INTRODUCCIÓN
Los hongos como Aspergillus spp., Fusarium spp., Penicillium spp., Alternaria spp. y Claviceps spp., que colonizan granos y frutas, producen metabolitos que son cancerígenos, inmunosupresores, neurotóxicos y alergénicos en los seres humanos (1).
Las micotoxinas son producidas por dos géneros de hongos filamentosos: Aspergillus y Penicillium. Las especies productoras de toxinas son: Aspergillus flavus, Aspergillus parasiticus, Penicillium puberalis y Aspergillus oryzae. En 1967, Nulik y Holiday también informaron de que las especies Aspergillus niger, Aspergillus gruber, Aspergillus wentii, Penicillium frecuentans, Penicillium variable y Penicillium citrinum constituyen especies toxigénicas (2). Estos hongos son contaminantes habituales de alimentos tales como los cereales y los cereales almacenados, y requieren una temperatura de 25 ºC y una humedad relativa del 95 % para lograr condiciones óptimas para la producción de micotoxinas. Las principales toxinas producidas por estos hongos son las aflatoxinas y las ocratoxinas (3,4).
Las aflatoxinas son micotoxinas cancerígenas, teratogénicas y mutagénicas con tropismo especial por órganos como el hígado, el cerebro y los riñones. Estas toxinas son producidas en condiciones óptimas de temperatura y humedad por los hongos A. flavus y A. parasiticus, y su síntesis está regulada por los genes AFLR y AFLS. Se han descrito dieciocho tipos de estas micotoxinas, destacando los tipos B1, B2, G1, G2, M1 y M2. El metabolito tóxico más importante de este grupo es la aflatoxina B1 (AFB1) (5,6), que es un contaminante habitual de los alimentos almacenados, como el maní, los pistachos, el maíz y el arroz en los climas tropicales y subtropicales. Se ha informado de que estas micotoxinas son potentes cancerígenos de la dieta y están implicadas en la etiología del carcinoma hepatocelular. También se han asociado con inmunosupresión y graves déficits nutricionales (7,8).
El mecanismo toxicológico de la AFB1 se basa en su epóxido radical, que interactúa con proteínas conjugadas para producir toxicidad e inhibición de la síntesis de proteínas. Además, puede producir genotoxicidad e inducir eventos cancerígenos debido a la mutación del gen P53, con la conversión de guanina a tiamina en el codón 249 (9,10).
La intoxicación con esta toxina se llama aflatoxicosis y puede presentarse en forma clínica aguda o crónica. La forma aguda se asocia con nefrotoxicidad, cardiotoxicidad y, principalmente, hepatotoxicidad, produciendo manifestaciones caracterizadas por ictericia, vómitos, dolor abdominal e insuficiencia hepática, que pueden conducir a la muerte (10). La forma crónica está relacionada con la desnutrición proteica, la carcinogénesis y la inmunosupresión. Dado que estas sustancias inducen la aplasia tímica, la exposición permanente a dosis subletales de esta micotoxina afecta al número y la función de los linfocitos, inhibe la fagocitosis, reduce la actividad del complemento y reduce la expresión de interleucina 2 (10).
En los portadores humanos del virus de la hepatitis B, la exposición a esta toxina se ha relacionado con un riesgo 60 veces mayor de presentar un carcinoma hepatocelular en comparación con la población general, ya que la AFB1 es 30 veces más potente en los pacientes con estos virus (11).
Algunos expertos han sugerido que las estrategias preventivas para evitar la exposición a estas toxinas son esenciales, especialmente en relación con la tecnificación del sector agrícola, con el fin de evitar así la contaminación de los cereales por hongos productores de toxinas (12). En la actualidad, algunos países desarrollados tienen una legislación clara con respecto a las concentraciones de AFB1 permitidas en los productos alimenticios, afirmando que los niveles no pueden ser superiores a 20 partes por billón (ppb). De hecho, la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) ha establecido este valor como el estándar para el nivel máximo de AFB1, teniendo en cuenta que esto ya se había establecido como límite permisible de las aflatoxinas totales en muchos países de América Latina y Estados Unidos (13).
Por lo tanto, el objetivo de este estudio fue cuantificar las aflatoxinas cancerígenas en los alimentos de consumo humano que se venden en los mercados de alimentos de 13 distritos de Lima, así como su implicación para la salud.
MATERIAL Y MÉTODOS
DISEÑO DEL ESTUDIO
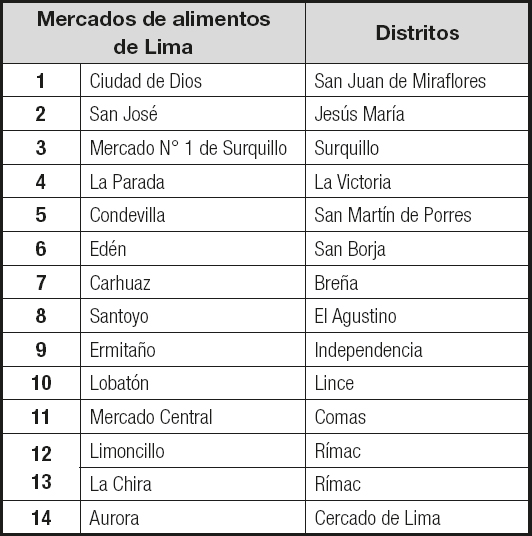
Realizamos un estudio descriptivo, transversal y prospectivo. El universo del estudio consistió en alimentos para consumo humano que se obtuvieron de 13 distritos, en diferentes mercados de alimentos de Lima, Perú, distribuidos entre diferentes sectores socioeconómicos y diferentes áreas geográficas al norte, sur y centro de Lima en los siguientes distritos: Breña, Cercado de Lima, El Agustino, Independencia, Jesús María, La Victoria, Lince, Rímac, San Borja, San Martín de Porres, Surquillo, San Juan de Miraflores y Comas.
Los alimentos evaluados en el estudio se clasificaron de la siguiente manera:
1.Capsicum baccatum: ají amarillo
2.Hordeum vulgare: cebada
3.Phaseolus vulgaris L. (variedad): frijol canario
4.Vigna unguiculata: frijol castilla
5.Vicia faba: haba
6.Lens culinaris: lenteja
7.Capsicum chinense (variedad): ají colorado
8.Arachis hypogaea: maní o cacahuete
9.Zea mays (v. saccharata): maíz dulce, mote
10.Solanum tuberosum: papa o patata
11.Vitis vinifera: uva pasa
12.Capsicum anuum L. (v. pimiento): pimentón
13.Capsicum pubescens: rocoto
14.Solanum lycopersicum: tomate
15.Triticum spp.: trigo
16.Daucus carota: zanahoria
17.Capsicum chinense: ají panca
18.Capsicum annuum: ají paprika
19.Pisum sativum (v. seca): guisante o arveja verde
20.Oryza sativa: arroz
Los alimentos del presente estudio se eligieron por el hecho de que son alimentos crudos susceptibles de contaminarse con micotoxinas y se consumen de forma masiva por la población de Lima (12).
TOMA DE MUESTRAS PARA EL ANÁLISIS DE AFLATOXINAS Y PREPARACIÓN
Se tomaron al azar 195 muestras, de 250 gramos cada una, de los diferentes mercados de alimentos de los 13 distritos de Lima. Se recolectaron en bolsas nuevas de tipo "Ziploc" con guantes nuevos. Luego se llevó a cabo el proceso de pulverización y/o homogeneización y las muestras se almacenaron en un lugar fresco, dentro de contenedores estériles para su transporte al laboratorio de microbiología.
Las muestras se recolectaron y procesaron de acuerdo con las instrucciones del método Veratox for Total Aflatoxin® (Lansing, Míchigan, EUA), que es un inmunoensayo enzimático competitivo para el análisis cuantitativo de aflatoxinas en cereales y alimentos para consumo animal. Se pesaron cinco gramos de la muestra y se mezclaron con 25 ml de metanol/agua destilada (70/30, v/v), agitándose después la solución durante 10 minutos a temperatura ambiente (20-25 ºC). Posteriormente, el extracto se filtró a través de un papel Whatman No. 1 y se diluyeron 250 μl del filtrado con 1,5 ml de agua destilada. Se usaron 50 μl del filtrado diluido en cada micropocillo durante la prueba. Finalmente se realizó un ensayo inmunoenzimático con el kit Veratox Total Aflatoxin® para el procedimiento de cuantificación de las aflatoxinas (14).
Los parámetros utilizados con el kit fueron: límite de detección de 0,1 ppb y rango de cuantificación de confianza entre 5 ppb y 200 ppb a una dilución de ¼ (14).
RESULTADOS
NIVELES MÁXIMOS DE AFLATOXINAS EN LOS ALIMENTOS DE LOS MERCADOS ESTUDIADOS
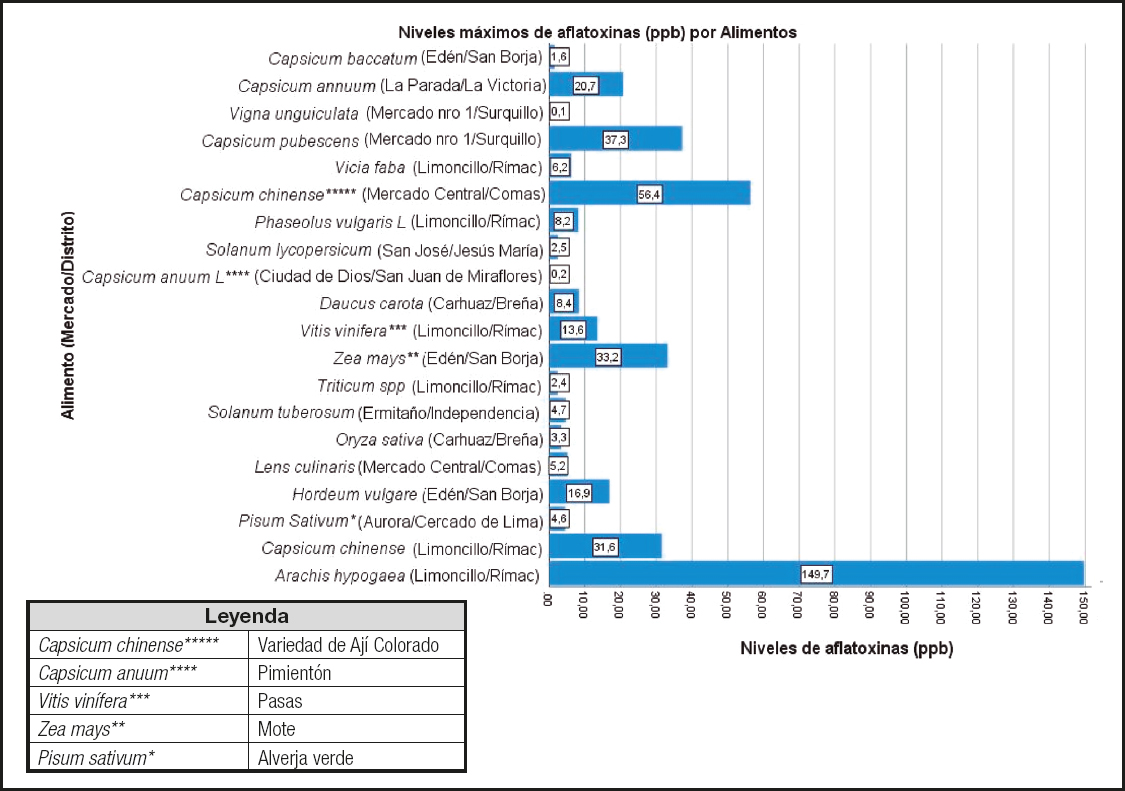
En cuanto a los niveles máximos de aflatoxinas por alimento en los mercados de alimentos estudiados, los alimentos que superaron el equivalente de 20 ppb a 20 μg/kg de aflatoxinas fueron: Arachis hypogaea (Mercado Limoncillo, Rímac), Capsicum chinense (**) (Mercado Central, Comas), Capsicum pubescens (Mercado Nº 1, Surquillo), Zea mays (Mercado Edén, San Borja), Capsicum chinense (La Chira, Rímac) y Capsicum annuum (La Parada, La Victoria), en orden decreciente respectivamente. Los alimentos restantes estudiados tenían niveles inferiores al máximo de 20 ppb (Fig. 1).
ANÁLISIS DE LAS VARIANZAS DE LOS ALIMENTOS ENTRE UNOS MERCADOS Y OTROS
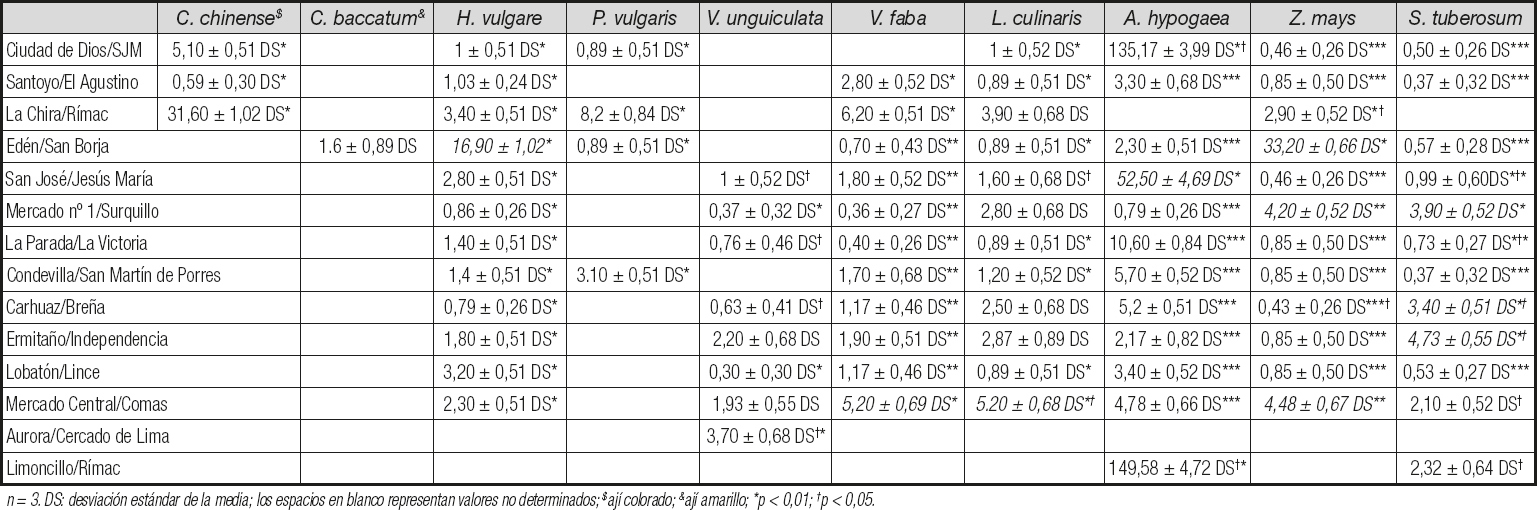
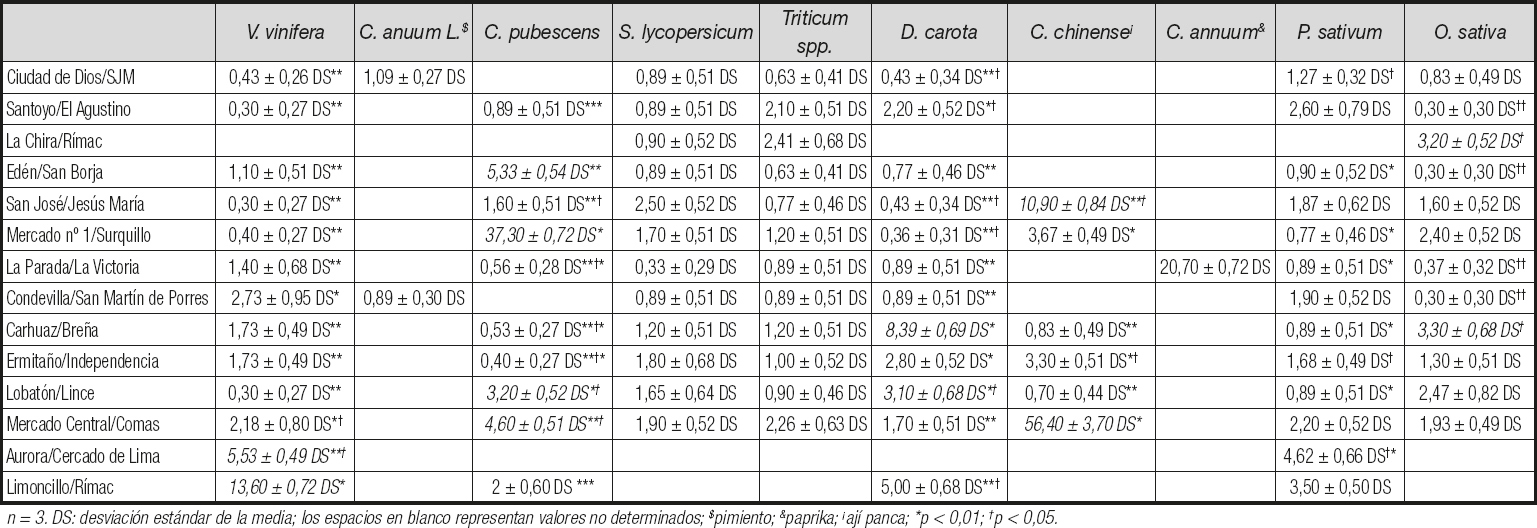
Entre los alimentos que sobrepasaron los 10 ppb de aflatoxinas totales, que pueden generar un riesgo para la salud pública, estuvieron: C. chinense (ají colorado) de La Chira, Rímac (31,60 ppb ± 1,02 DS); H. vulgari de Edén, San Borja (16,90 ppb ± 1,02 DS); A. hypogea de Ciudad de Dios, San Juan de Miraflores (135,17 ppb ± 3,99 DS), de San José, Jesús María (52,50 ppb ± 4,69 DS) y de Limoncillo, Rímac (149,58 ppb ± 4,72 DS); Z. mays (mote) de Mercado nº 1, Surquillo (33,20 ppb ± 0,66 DS); V. vinifera (pasas) de Limoncillo, Rímac (13,60 ppb ± 0,72 DS); C. pubescens de Mercado nº 1, Surquillo (37,30 ppb ± 0,72 DS); C. chinense de San José, Jesús María (10,90 ppb ± 0,84 DS) y de Mercado Central, Comas (56,40 ppb ± 3,70 DS), encontrándose diferencias significativas (p < 0,05) (Tablas II y III).
DISCUSIÓN
Encontramos 6 alimentos de consumo masivo en los mercados de alimentos que contenían cantidades de aflatoxinas mayores que el estándar internacional máximo de 20 ppb (13). Entre los alimentos que presentaron los valores más altos y estadísticamente significativos en comparación con los otros mercados estuvieron: Arachis hypogaea (maní) del mercado Limoncillo del distrito Rímac, del mercado Ciudad de Dios del distrito San Juan de Miraflores y del mercado San José del distrito de Jesús María, y Capsicum chinense (ají panca) del mercado central del distrito Comas, con niveles de aflatoxinas de hasta 149,7 ppb y 56,4 ppb, respectivamente. Estudios anteriores han reportado la contaminación por aflatoxinas de Arachis hypogaea (maní), y los altos valores encontrados en Arachis hypogaea y Capsicum chinense (ají panca) en el presente estudio son suficientes para producir un daño considerable en el hígado y los riñones en las personas que consumen alimentos contaminados (7,8,10). Las cantidades de aflatoxinas totales por encima de 20 ppb entre los otros alimentos estudiados, y con diferencias significativas, variaron con niveles que llegaron a 37,3 ppb y 33,2 ppb, respectivamente, y se encontraron en: Capsicum pubescens (rocoto) del Mercado nº 1 del distrito de Surquillo, y Zea mays (mote) del mercado de Edén en el distrito de San Borja, el último de los cuales se ha descrito previamente como susceptible a la contaminación por micotoxinas (6). El Capsicum chinense (ají colorado) del mercado de La Chira en el distrito de Rímac y el Capsicum annuum (pimentón) del mercado de La Parada en el distrito de La Victoria alcanzaron niveles de 31,6 ppb y 20,7 ppb, respectivamente. Es importante resaltar que los 6 alimentos que presentan valores superiores a los 20 ppb permitidos, con diferencias significativas (p < 0,05), pueden consumirse crudos o cocidos en ensaladas o cremas, respectivamente, y en ellos puede persistir la presencia de las aflatoxinas a pesar de la preparación, ya que estas moléculas son termoestables, pudiendo generar un daño acumulativo en el organismo. Curiosamente, se identificó que 4/6 (66,7 %) de los alimentos que exceden los límites permitidos pertenecen al género Capsicum spp., comúnmente llamados "ajís" o "chiles", y se consumen ampliamente en América Latina, incluido Perú (15). En muchos casos los ajís se consumen sin cocinar, y estudios previos han reportado un impacto severo en la salud por el consumo de alimentos crudos contaminados con aflatoxinas causantes principalmente de daño hepático (12). Debe considerarse que, además de la intoxicación aguda por las aflatoxinas contenidas en los alimentos, también es importante destacar la intoxicación crónica debido a su asociación con el riesgo de desarrollar cáncer de hígado. De hecho, el consumo de alimentos contaminados con niveles de aflatoxinas por debajo del límite máximo permitido también es motivo de preocupación, ya que el efecto del daño sobre el ADN es acumulativo en el genoma humano (6).
Para prevenir los efectos clínicos del envenenamiento por aflatoxinas se recomienda el consumo de una dieta rica en verduras, debido a la capacidad de la clorofila para unirse a las aflatoxinas y neutralizar sus efectos tóxicos (16).
Las aflatoxinas son muy estables al calor y no se descomponen al cocinar o freír los alimentos, lo que aumenta el riesgo de sufrir daño orgánico independientemente de la forma de consumo, ya se trate de comerlos crudos, cocidos o fritos (16). En Lima, los alimentos Capsicum annuum, C. chinense, Zea mays, C. pubescens, C. chinense (***) y Arachis hypogaea, en los que se halló una considerable contaminación por aflatoxinas (> 20 ppb), se consumen crudos, cocidos o, en algunos casos, fritos; estos alimentos se comportarían como una fuente de riesgo de desarrollar cáncer de hígado cuando están contaminados con aflatoxinas entre los residentes de los distritos de La Victoria, El Rímac, San Borja, Surquillo y Comas, como se demostró en nuestro estudio. Un hecho importante es que en El Rímac encontramos dos alimentos con la mayor contaminación detectada: A. hypogaea (149,7 ppb) y C. chinense (31,6 ppb), siendo la ingesta de estos alimentos un factor predisponente para el desarrollo de cáncer de hígado en la población de este distrito.
Entre 2010 y 2012, el cáncer de estómago se destacó entre los más prevalentes, ocupando el segundo y el tercer lugar, con frecuencias relativas del 21,2 % en hombres y del 13,8 % en mujeres, respectivamente, en la ciudad de Lima Metropolitana (17). Un estudio de 2015 realizado en Perú mostró que la tasa de mortalidad por cáncer de estómago y por cáncer de hígado y vías biliares ocupaba el segundo y cuarto lugar, respectivamente, y que Lima ocupaba la posición 13 entre los 25 con la tasa de mortalidad por cáncer más alta (18). Por lo tanto, conociendo la clara relación entre las aflatoxinas, el cáncer de hígado y el daño gastrointestinal, es necesario considerar los resultados presentados en este estudio como un factor de riesgo para el desarrollo de cáncer en Lima Metropolitana.
Entre las limitaciones del estudio estuvo que no se identificó el origen nativo de cada alimento, lo que hubiera sido útil para poder generar una línea de base en el tema de la prevención desde la producción del alimento.
CONCLUSIONES
Seis tipos de alimentos muestreados en los mercados de alimentos de 13 distritos de la ciudad de Lima, y que son de consumo masivo, excedieron los límites permisibles de la micotoxina cancerígena "aflatoxina". Se obtuvieron de mercados de diferentes niveles socioeconómicos (Rímac, San Juan de Miraflores, Comas, Surquillo, Jesús María y San Borja), lo que representa un riesgo para la salud pública. Los alimentos con los valores más altos de contaminación fueron el maní (Arachis hypogaea) del mercado Limoncillo del distrito de Rímac y el ají panca (Capsicum chinense) del mercado central del distrito de Comas. El alto riesgo acumulado de desarrollar enfermedades potencialmente mortales como el cáncer hace que sea necesario que el Servicio Nacional de Salud Agraria, el Ministerio de Salud y el Ministerio de Agricultura ayuden a desarrollar programas de capacitación sobre prevención, reducción y neutralización de aflatoxinas para las personas responsables de la cadena de los alimentos desde la producción y para los consumidores.