INTRODUCCIÓN
Tras el climaterio se produce un mayor riesgo de enfermedad cardiovascular que va asociado a la edad a la que se inicia la menopausia (1,2). Durante la menopausia, como consecuencia de la depleción hormonal, se producen alteraciones de la homeostasis energética que se acompañan de un incremento del peso corporal, con mayor tendencia a la obesidad y al depósito de grasa visceral, aumentando el riesgo cardiometabólico (3,4). En las situaciones de obesidad, y asociado al síndrome metabólico, se produce un cuadro de inflamación de bajo grado que, perpetuado en el tiempo, podría dar lugar a complicaciones cardiovasculares. En los adipocitos, debido a la acumulación de grasa intracelular y a la oxidación de los ácidos grasos, se desarrolla una reacción de lipotoxicidad con formación de radicales libres, lo que conlleva la síntesis de citoquinas proinflamatorias (TNF-α, IL-6 e IL-1), disminuyendo la secreción de adiponectina, como adipoquina antiinflamatoria. En consecuencia, se desencadena una reacción inflamatoria (5).
Los carotenoides son uno de los principales antioxidantes alimentarios y, en España, el 89 %, 68 % y 97,1 % del β-caroteno, la luteína + zeaxantina y el licopeno proceden del consumo de frutas y vegetales (6), aunque la ingesta varía en función de la época del año y del estatus socioeconómico y cultural (7). Los principales carotenoides son: α-caroteno, β-caroteno, β-criptoxantina, licopeno, zeaxantina y luteína. Estos constituyen el 70 % de los carotenoides circulantes en el plasma y acumulados en los tejidos humanos (7). Además de su función antioxidante, algunos carotenoides son precursores de la vitamina A y otros retinoides, que juegan un papel importante en el ciclo visual y en la regulación de los genes vinculados a muchos procesos fisiológicos y del desarrollo embrionario y fetal, la diferenciación celular y el control metabólico (8).
En el estudio CARDIA, en el que se estudió la relación entre los niveles plasmáticos de carotenoides y los marcadores de enfermedad cardiovascular en la población de Estados Unidos (hombres y mujeres) durante 15 años, se observó que los niveles de carotenoides plasmáticos estaban inversamente asociados a la incidencia de la hipertensión y que, en el caso de los fumadores, reducían el estrés oxidativo, la inflamación y la función endotelial, lo que indica su papel en la prevención del riesgo cardiovascular (9,10). Los resultados del proyecto Flamenco han descrito que una alta adherencia a la dieta mediterránea se asocia a un menor riesgo cardiometabólico en las mujeres peri y posmenopáusicas, al disminuir los niveles de colesterol plasmático, triglicéridos y proteína C-reactiva (PCR), reduciéndose también la frecuencia cardíaca en reposo, en comparación con las mujeres que presentaban una adherencia baja o media (11). Teniendo en cuenta la importancia que tienen los cambios del estilo de vida, incluida la dieta, para las mujeres en esta etapa de la vida (12), el objetivo del presente estudio ha sido estudiar el efecto de la suplementación de la dieta con alimentos ricos en carotenoides sobre los parámetros y biomarcadores relacionados con el riesgo cardiometabólico en mujeres peri y posmenopáusicas.
MATERIAL Y MÉTODOS
DISEÑO EXPERIMENTAL
En el presente estudio se ha realizado un estudio de intervención experimental en una población de mujeres peri y posmenopáusicas, sin antecedentes de enfermedad cardiovascular (ECV) y con algún factor de riesgo cardiometabólico. Los criterios de inclusión fueron: amenorrea de 6 o más meses, sobrepeso y obesidad, índice cintura-cadera > 0,85, porcentaje de grasa > 32 %, niveles de lípidos plasmáticos elevados, dislipemia aterogénica, hipertensión, fumadora, sin tratamiento con suplementos de vitaminas o minerales. Se reclutaron 12 voluntarias dentro de la comunidad de la Universidad de Murcia (España), con una edad comprendida entre 49 y 57 años y con un nivel socioeducativo similar. Las voluntarias fueron informadas individualmente del estudio de intervención y tras firmar el consentimiento informado, y durante 28 días, suplementaron su dieta semanal con alimentos comerciales proporcionados por los investigadores. Los productos seleccionados fueron alimentos ricos en los principales carotenoides dietéticos (luteína + zeaxantina, β-criptoxantina, α-caroteno, β-caroteno y licopeno) con las siguientes concentraciones de carotenoides totales: 257,11 mg/kg para las espinacas cocidas, 236,04 mg/kg para el zumo de naranja y zanahoria, y 226,83 mg/kg para el zumo de tomate (Tabla I). Las voluntarias ingirieron a la semana 400 g de espinacas, 750 ml de zumo de naranja-zanahoria y 600 ml de zumo de tomate, que proporcionaron 102,8, 177,03 y 136,09 mg de carotenoides, respectivamente, dando lugar a una ingesta semanal de 415 mg carotenoides totales (Tabla I). Al inicio (TI) y al final (TF) del periodo de intervención se registraron los datos antropométricos y se realizó una extracción de sangre de la vena antecubital en ayunas para el análisis de los diferentes parámetros, considerando para cada voluntaria la muestra inicial como control. Las muestras de sangre y suero se utilizaron para los análisis hematológicos y bioquímicos. Para la obtención del plasma, las muestras de sangre fueron centrifugadas a 3500 rpm a 4 °C durante 10 minutos. Posteriormente, las muestras de plasma se alicuotaron y congelaron a una temperatura de -80 °C, hasta la realización de los análisis posteriores. El protocolo experimental fue aprobado por la Comisión de Ética de la Investigación de la Universidad de Murcia (ID1476/2017 e ID2614/2019). El estudio se llevó a cabo en condiciones de respeto a los derechos fundamentales de la persona y a los postulados éticos, siguiéndose a estos efectos los contenidos de la Declaración de Helsinki. Los datos recogidos fueron tratados de forma leal y lícita con sujeción en todo momento a los principios y derechos recogidos en la Ley Orgánica de Protección de Datos Personales y garantía de los derechos digitales.
RECOGIDA DE DATOS ANTROPOMÉTRICOS
Se registraron los siguientes datos: peso, altura, índice de masa corporal (IMC), porcentaje de grasa e índice cintura-cadera (ICC). Para la toma de datos se utilizaron una báscula (TANITA® MC 780-P), un tallímetro y una cinta métrica flexible.
PARÁMETROS BIOQUÍMICOS
Entre los parámetros bioquímicos se analizaron los niveles de glucosa, ácido úrico, lipoproteína (a), colesterol total, triglicéridos (TG), lipoproteínas de alta densidad (HDL), lipoproteínas de muy baja densidad (VLDL), lipoproteínas de baja densidad (LDL) y el índice aterogénico (IA). El análisis bioquímico se realizó en un laboratorio de análisis clínicos.
BIOMARCADORES DE ESTRÉS OXIDATIVO
Para evaluar el estrés oxidativo se analizaron en el plasma la capacidad antioxidante y la concentración de malonaldehído (MDA). La capacidad antioxidante hidrofílica del plasma se determinó con la técnica ORAC (Oxygen Radical Absorbance Capacity) y se expresó en forma de mmol de equivalentes de Trolox (TE)/L. Para el análisis se siguió la metodología descrita por Prior y cols. (13), y se utilizó un lector de microplacas multimodal (Synergy HT BioTek, Winooski, VT, Estados Unidos).
La determinación de la concentración plasmática de MDA se realizó por HPLC de acuerdo con el método descrito por Mateos y cols. (14). Para la separación cromatográfica se utilizó una columna de fase reversa LiChroCART RP-18 (250 mm x 4 mm x 5 µm de tamaño de partícula), acoplada a una pre-columna del mismo material de 4 mm de longitud (Merck, Alemania). Inicialmente se realizó una hidrólisis alcalina combinando 250 µl de plasma con 50 µl NaOH 6 M e incubando la mezcla en un baño termostático a 60 °C durante 30 min. Finalizado el proceso, se adicionaron 125 µl de ácido perclórico al 35 % para conseguir la precipitación de las proteínas. Se agitó en un vórtex y se centrifugó a 14.000 rpm durante 10 min y a 4 °C. Una alícuota de 350 µl de sobrenadante se sometió a un proceso de derivatización con 25 µl de 2,4-dinitrofenilhidracina (Fluka, Suiza), incubándose a temperatura ambiente durante 30 min protegido de la luz. Finalmente se filtró la muestra con un filtro de 0.2 µm y se inyectaron 100 µl en el HPLC. La separación de los compuestos se realizó con un gradiente isocrático, utilizando como fase móvil una mezcla compuesta por agua con un 1 % de ácido acético (v/v) y acetonitrilo (62:38, v/v) con un flujo de 0,6 ml/min a 25 °C durante 30 minutos. La cuantificación del MDA se realizó a 310 nm. Los resultados se expresaron como nmol/ml de plasma.
BIOMARCADORES DE INFLAMACIÓN Y FUNCIÓN ENDOTELIAL
Como biomarcadores de inflamación y función endotelial se analizaron las concentraciones de adiponectina y de moléculas solubles de adhesión intercelular (sICAM-1) y vascular (sVCAM-1) con kits de ELISA-sandwich en microplacas (Elabscience, EE UU), utilizando un lector de microplacas multimodal (Synergy HT BioTek, Winooski, EE UU) y siguiendo en todo momento el protocolo de análisis descrito por el fabricante. También se determinó la concentración plasmática de la proteína C-reactiva ultrasensible, que fue analizada en el laboratorio de análisis clínicos que realizó las determinaciones bioquímicas.
ANÁLISIS DE CAROTENOIDES PLASMÁTICOS
La determinación y cuantificación de carotenoides se llevó a cabo de acuerdo con el procedimiento de extracción líquido-líquido con algunas modificaciones (15,16). En primer lugar se procedió a la desproteinización de las muestras, disolviendo 400 µl de plasma con 800 µl de etanol, que se agitaron en un vórtex durante 45 segundos. Una vez precipitadas las proteínas se procedió a la extracción de los carotenoides añadiendo 1 ml de hexano/BHT (100 mg/l) como agente antioxidante. Seguidamente, la mezcla se agitó durante 1 minuto y se centrifugó a 23.448 rpm durante 5 minutos a 4 °C. El sobrenadante se transfirió a un tubo de recolección, repitiéndose la extracción. Ambos sobrenadantes se combinaron y se evaporaron bajo una corriente de N2 hasta la sequedad. Por último, el residuo se reconstituyó en 300 µl de terc-butilmetil-éter/metanol (1/1, v/v), se homogenizó con un vórtex, se filtró con un filtro de jeringa de PTFE con poros de 0,2 µm de tamaño (VWR International, EE. UU)..
Las muestras se analizaron con un equipo de HPLC (Agilent 1200, Alemania) utilizando una columna C30 (250 mm x 4,6 mm y 5 µm de tamaño de partícula) (Trentec, Alemania), usando las condiciones descritas por Elvira-Torales y cols. (17) utilizando patrones puros de licopeno, luteína y zeaxantina, y β-caroteno para cuantificar el contenido de carotenoides.
ANÁLISIS ESTADÍSTICO
Para el tratamiento estadístico de los datos se utilizó el paquete estadístico para las ciencias sociales (SPSS) 24.0 para Windows (IBM, EE UU). Se llevó a cabo un análisis descriptivo, expresando los datos de los diferentes parámetros del estudio como valor medio y desviación estándar. Se determinó la normalidad de las muestras mediante el test de Kolmogorov-Smirnov y se realizó una comparación entre las medias de los datos iniciales y finales de un mismo parámetro dentro de cada grupo con la prueba de la “t” de Student (para muestras normales) y la de Wilcoxon (para muestras no normales), con un nivel de significación de p < 0,05, con el fin de detectar posibles cambios producidos a lo largo del periodo de intervención. Además, se realizó una correlación bivariada de Pearson para establecer la correlación entre los parámetros analizados.
RESULTADOS
La tabla II muestra los datos antropométricos al inicio y al final del estudio. Las doce voluntarias presentaron un peso medio inicial de 74 kg y una altura media de 158 cm, mostrando un IMC ligeramente superior a 29 kg/m2. El porcentaje de grasa fue del 39 % y el ICC fue superior a 0,85. No hubo cambios en los datos antropométricos entre el inicio y el final del estudio ya que las voluntarias siguieron su dieta habitual.
Tabla II. Datos antropométricos de las voluntarias al inicio (TI) y al final del periodo de intervención (TF)*
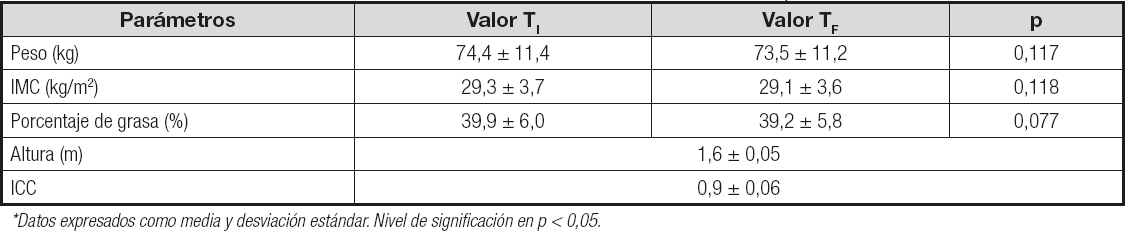
*Datos expresados como media y desviación estándar. Nivel de significación en p < 0,05.
La tabla III muestra los parámetros bioquímicos plasmáticos al inicio y al final del periodo de intervención. De los parámetros analizados, se observaron cambios estadísticamente significativos entre ambas mediciones en las proteínas y el perfil lipídico. Concretamente, el colesterol-LDL disminuyó significativamente (de 142,7 a 111,8 mg/dl; p < 0,001) mientras que las fracciones de colesterol VLDL y HDL, así como los TG plasmáticos, aumentaron significativamente. Los cambios del perfil lipídico se acompañaron de una disminución significativa (p < 0,001) del IA.
Tabla III. Datos bioquímicos de las voluntarias al inicio (TI) y al final del estudio de intervención (TF), y valores de referencia recomendados que indican bajo riesgo cardiometabólico1

1Datos expresados como media y desviación estándar. Nivel de significación en p < 0,05. *Valores de referencia proporcionados por Laboratorios Munuera S.L.U.
La tabla IV muestra las concentraciones plasmáticas de los carotenoides y los biomarcadores de estrés oxidativo, inflamación y daño endotelial. Tras el periodo de suplementación dietética se observó un incremento significativo (p < 0,05) de los niveles plasmáticos de todos los carotenoides individuales (Tabla IV), aumentando el contenido total de carotenoides plasmáticos de 0,56 µg/ml en TI hasta 1,22 µg/ml en TF (p < 0,05) (Fig. 1). Las variaciones de los distintos carotenoides entre TI y TF fueron de 0,05 a 0,07 µg/ml para la luteína, de 0,07 a 0,26 µg/ml para la β-criptoxantina, de niveles no detectados a 0,02 µg/ml para el α-caroteno, de 0,16 a 0,44 µg/ml para el β-caroteno y de 0,29 a 0,44 µg/ml para el licopeno (Tabla IV). Este incremento se acompañó de una modificación del perfil de carotenoides plasmáticos ya que, en el TI, el licopeno fue el carotenoide mayoritario, seguido del β-caroteno, mientras que en el TF, licopeno y β-caroteno representaron cada uno el 36 % y la β-criptoxantina el 21 % de los carotenoides totales (Fig. 2).
Tabla IV. Concentración plasmática de carotenoides y biomarcadores de estrés oxidativo, inflamación y daño endotelial al inicio (TI) y al final del periodo de intervención (TF)1

1Datos expresados como media y desviación estándar. Nivel de significación en p < 0,05. *Nd: no detectado.

Figura 1. Concentración plasmática de carotenoides totales (expresada en µg/ml) al inicio (TI) y al final del periodo de intervención (TF). *Indica diferencias significativas para p < 0,05.

Figura 2. Perfil de carotenoides plasmáticos al inicio (TI) y al final del periodo de intervención (TF), expresado como porcentaje del contenido total de carotenoides.
En relación a los biomarcadores de estrés oxidativo, se produjo una disminución significativa (p < 0,001) de la concentración plasmática de MDA, aunque la capacidad antioxidante hidrofílica del plasma se mantuvo sin cambios, mostrando valores medios de 13 mmoles de equivalentes Trolox/ml (Tabla IV). En cuanto a los biomarcadores de inflamación, hay que destacar un aumento estadísticamente significativo de las concentraciones de adiponectina (de 5,79 a 6,13 µg/ml; p < 0,011) y una disminución de la PCR (de 2,08 a < 0,05 mg/l; p = 0,021) (Tabla III). No se obtuvieron diferencias estadísticamente significativas para los biomarcadores de función endotelial sICAM-1 y sVCAM-1 (Tabla IV), pero en ocho de las 12 voluntarias se observó una disminución de ambos biomarcadores (diminución media de 15 ng/ml para sICAM-1 y de 28,514 ng/ml para sVCAM-1).
DISCUSIÓN
Los criterios de inclusión tenidos en cuenta a la hora de la selección de las voluntarias comprendían el riesgo cardiometabólico ya que estas presentaban sobrepeso y un alto porcentaje de grasa corporal, lo que nos indica un alto grado de adiposidad y un mayor depósito de grasa visceral (3,4), factores que pueden derivar en un síndrome metabólico. Hay que mencionar que no se observaron diferencias estadísticamente significativas entre estas variables al inicio y al final del periodo de intervención, pues el objetivo del estudio era suplementar la dieta con carotenoides pero no modificar el aporte energético de la misma. Por ello se indicó a las voluntarias que siguieran con su estilo de vida habitual (dieta y actividad física) durante el periodo de intervención, con el objetivo de evaluar los cambios asociados a la ingesta de carotenoides y no a la pérdida de peso. Se acepta que las mujeres posmenopáusicas son propensas a tener un mayor riesgo cardiometabólico. Concretamente, la acumulación de grasa en el tronco con baja cantidad de grasa en las piernas se relaciona con un riesgo tres veces mayor de padecer enfermedades cardiovasculares (18), por lo que en esta etapa de la vida es necesario realizar cambios en la dieta y el estilo de vida que reduzcan este riesgo (12).
Las concentraciones plasmáticas de glucosa y de ácido úrico se mantuvieron sin cambios entre el TI y el TF. Sin embargo, se observaron diferencias estadísticamente significativas en el colesterol unido a LDL, VLDL y HDL, los TG y el IA. Las concentraciones medias de colesterol-LDL disminuyeron en 31,02 mg/dl (lo que representa una disminución del 23 %) mientras que el colesterol-HDL se incrementó en 17 mg/dl (un incremento del 25 %). La reducción de los niveles de colesterol-LDL de riesgo medio (con concentraciones de 130-159 mg/dl) a valores por debajo del riesgo moderado (< 130 mg/dl) y el incremento del colesterol-HDL indicarían un efecto positivo de la suplementación dietética con carotenoides sobre la prevención cardiovascular, lo que condujo a una disminución significativa del IA, aunque los valores pre- y posintervención de este indicador permanecieron en niveles de bajo riesgo. Los efectos de los carotenoides sobre la mejora de la dislipemia aterogénica ya han sido descritos previamente por otros autores (19), pero este efecto no se había evaluado en un grupo de riesgo como el de las mujeres peri y posmenopáusicas. Además, se observó una correlación negativa y significativa (r = -0,6, p < 0,05) entre los valores de HDL y el porcentaje de grasa corporal, por lo que el consumo de carotenoides favorece el incremento de las HDL cuando la concentración de grasa corporal es elevada. Por el contrario, los valores de colesterol-VLDL y de TG aumentaron. La elevación de los TG se produce a expensas de las VLDL y depende de numerosos factores ambientales, entre los que destacan la dieta, el estilo de vida y la exposición a tóxicos o fármacos (20). A pesar de observarse un incremento de las VLDL y los TG, los valores medios permanecieron dentro de los valores considerados de referencia. En relación a la Lp(a) no se observaron diferencias estadísticamente significativas en los valores medios entre TI y TF debido a la gran variabilidad interindividual, ya que algunas voluntarias mostraron valores muy elevados, por encima de 30 mg/dl, lo que nos indica un riesgo cardiovascular 1,6 veces mayor que el correspondiente a los valores inferiores a esta concentración (21).
En relación a la concentración plasmática de carotenoides (Tabla III), el incremento observado tras la intervención muestra una clara mejora del perfil de antioxidantes lipofílicos plasmáticos. Los incrementos de los distintos carotenoides individuales estuvieron determinados por los alimentos elegidos para la intervención, destacando un incremento mayor para la β-criptoxantina, el β-caroteno y el licopeno, asociados al consumo de los zumos de naranja y zanahoria y de tomate. Estos zumos constituyen una fuente importante de carotenoides, que se presentan en forma más accesible como consecuencia del tratamiento térmico. Además, el consumo de zumo de naranja y zanahoria mostró un papel relevante en el incremento de los niveles de β-criptoxantina, por la naranja, y de α-caroteno y β-caroteno, por la zanahoria, pues son las principales fuentes dietéticas de estos carotenoides, proporcionando un beneficio adicional ya que estos tres carotenoides tienen actividad provitamina A y, por lo tanto, contribuyen a mejorar el estado nutricional de esta vitamina al ser convertidos en retinol (8,7). La suplementación dietética de carotenoides ha sido objeto de cierta controversia, pero hay que tener en cuenta que, en este caso, la suplementación se hizo de forma natural a partir de alimentos y no con suplementos o nutracéuticos. Además, las ingestas de carotenoides aportadas por los alimentos proporcionados se encontraban dentro de los valores que la Autoridad Europea de Seguridad Alimentaria considera seguros en relación con el licopeno, el β-caroteno, la luteína y la zeaxantina (22-24). Concretamente, el consumo de 75 mg/día de all-trans-licopeno y 20 mg de all-trans-luteína se considera seguro (24).
En un estudio realizado por Taylor Nuss y cols. (25) se ha observado que en las mujeres perimenopaúsicas existe una relación inversa entre la grasa corporal y los carotenoides plasmáticos debido a la acumulación de los carotenoides en el tejido graso: su naturaleza lipofílica hace que no se encuentren de forma circulante en el plasma. Por ello, es conveniente incrementar el consumo de estos antioxidantes en caso de sobrepeso y obesidad, con el objetivo de poder tener carotenoides circulantes disponibles para otros tejidos y órganos. En nuestro estudio se observó una correlación negativa entre el contenido de luteína plasmática y el porcentaje de grasa (r = -0,68, p < 0,05). Además, cabe destacar que la incorporación de alimentos ricos en estos antioxidantes condujo a una mejora del contenido de carotenoides en el plasma, lo que determina que estén disponibles para poder ejercer un efecto funcional y beneficioso como antioxidantes o antiinflamatorios en otros tejidos y órganos.
Tras la ingesta de carotenoides se observó una disminución estadísticamente significativa de los niveles plasmáticos de MDA, lo que nos indica una menor oxidación de los ácidos grasos poliinsaturados y, por tanto, una reducción del estrés oxidativo (26). Los carotenoides son antioxidantes plasmáticos y contribuyen de forma positiva a mejorar el balance oxidativo, actuando como captadores de radicales libres (oxígeno singlete y radicales peroxilos) y protegiendo a las lipoproteínas y los lípidos de membrana frente a la oxidación. Diferentes estudios han relacionado el consumo de carotenoides con una disminución del riesgo cardiovascular por su actividad antioxidante (27). Como se ha mencionado anteriormente, en las mujeres perimenopaúsicas el α-caroteno puede ser uno de los carotenoides liberados a la circulación sanguínea para actuar como antioxidante frente al estrés oxidativo inducido por la obesidad (25). Esto coincide con los resultados obtenidos en nuestro estudio ya que en el TF se produjo una reducción de los compuestos oxidados de los lípidos y un incremento del α-caroteno, asociado principalmente al consumo de zumo de naranja y zanahoria.
Se determinó la capacidad antioxidante plasmática de los componentes hidrofílicos, como la vitamina C y el α-tocoferol, sin observarse diferencias estadísticamente significativas. Sin embargo, no se pudo determinar la capacidad antioxidante lipofílica (carotenoides) del plasma por falta de muestra, por lo que el incremento de los carotenoides plasmáticos no se pudo correlacionar con la capacidad antioxidante plasmática total. No obstante, diferentes estudios (28,29) correlacionan la capacidad antioxidante total sérica con los niveles de ácido úrico y, en menor medida, con los de albúmina, ácido ascórbico, hierro y bilirrubina, pero no con las concentraciones del resto de antioxidantes de la dieta.
Con respecto a los biomarcadores de la inflamación, aumentaron significativamente (p < 0,05) los niveles de adiponectina, una adipoquina antiinflamatoria (Tabla III), que presentó un incremento de alrededor del 8 %. Recientemente, Wattanapol y cols. (30) han evaluado el nivel de adiponectina en mujeres peri y posmenopáusicas, con y sin síndrome metabólico, observando una variación significativa (6,0 ± 4,6 vs. 9,2 ± 5,2 µg/ml, p < 0,001, respectivamente). Estos autores han establecido que la adiponectina es un buen biomarcador para el síndrome metabólico en las mujeres y han recomendado un punto de corte de 7,15 µg/ml para los niveles de adiponectina como cribado del síndrome metabólico. Los valores obtenidos en este estudio para la concentración plasmática de adiponectina coinciden con los descritos por estos autores para las mujeres con síndrome metabólico; aunque mejoran tras la intervención dietética, no superan el valor de corte establecido para considerar la ausencia de síndrome metabólico (7,15 µg/ml) (30). El aumento de la adiponectina observado tras la intervención dietética es beneficioso, ya que es una citoquina antiinflamatoria que incrementa la sensibilidad a la insulina, estimula la captación de glucosa y favorece la oxidación de los ácidos grasos y la reducción de la síntesis de glucosa en el hígado. Además, suprime la diferenciación y activación de los macrófagos M1, disminuyendo la secreción de citoquinas proinflamatorias (TNF-α e IL-6), a la vez que promueve la proliferación de los macrófagos M2 y la expresión de otros biomarcadores antiinflamatorios (31). Estos resultados nos indicarían que la posible acumulación de los carotenoides en el tejido graso, como principal órgano de reserva de estos antioxidantes lipofílicos (25), disminuye la inflamación que tiene lugar en el tejido adiposo asociado a la obesidad, como consecuencia de la lipotoxicidad producida por la oxidación de los ácidos grasos, aumentando los niveles de adiponectina y disminuyendo la concentración plasmática de MDA. Aunque en este estudio no hemos analizado las concentraciones plasmáticas de IL-6 y TNF-α, otros estudios han descrito la disminución de los biomarcadores de la inflamación en mujeres obesas jóvenes tras la ingesta de tomate como fuente de licopeno (32). Además de los cambios observados en la adiponectina, la concentración plasmática de PCR disminuyó de forma estadísticamente significativa entre el inicio y el final del estudio, lo que indica también una disminución del estado de inflamación. La PCR es útil como biomarcador de la ECV ateroesclerótica y, a pesar de que tiene poca especificidad, sirve para evaluar la inflamación crónica de bajo grado relacionada con el riesgo cardiovascular (20), por lo que un descenso indicaría una mejora de dicho riesgo cardiovascular.
No se observaron diferencias significativas (p > 0,05) tras la ingesta de carotenoides en los niveles de sVCAM-1 y sICAM-1, moléculas que regulan la adhesión de los glóbulos blancos a las células endoteliales, así como la adhesión intercelular, debido a la alta variabilidad interindividual. A pesar de que en cuatro de las 12 voluntarias se observó un incremento, en las ocho voluntarias restantes ambos biomarcadores mostraron una disminución en torno al 15 % entre el TI y el TF, lo que sugiere una reducción del riesgo cardiovascular. El efecto de los carotenoides sobre sVCAM y sICAM se ha estudiado de forma individualizada según los distintos carotenoides. En un estudio realizado previamente en mujeres se observó que el consumo de licopeno, tras la ingesta de zumo de tomate, condujo a una disminución de los niveles circulantes de sVCAM de manera significativa (en un 42 %) con respecto al inicio (33). La dieta influye en la expresión y secreción de marcadores inflamatorios en los tejidos adiposo, hepático y endotelial vascular. El grado de obesidad y el tiempo de duración de la intervención nutricional, a su vez, también pueden influir en la respuesta hepática y del tejido adiposo a la dieta. En algunos estudios se ha observado que la expresión de ICAM-1 podría estar relacionada con las dietas ricas en hidratos de carbono en las personas con síndrome metabólico, así como con los ácidos grasos saturados y los ácidos grasos trans, con mayores concentraciones de VCAM-1 e ICAM-1 en los individuos con sobrepeso. Del mismo modo habría una asociación inversa de la ingesta de aceite de oliva y la dieta mediterránea con la expresión de VCAM (34). De este modo, tanto la calidad y la cantidad de los nutrientes ingeridos por las voluntarias durante el periodo de intervención, como la distribución de macronutrientes y la presencia de componentes bioactivos en la dieta, junto con el patrón dietético y el estilo de vida adoptado, podrían ser factores determinantes del estado inflamatorio.
Los estudios realizados en seres humanos con alimentos vegetales que incluyen carotenoides, suelen tener otros muchos componentes presentes en la matriz alimentaria, incluyendo fibra dietética, minerales y vitaminas, que podrían tener un efecto sinérgico, lo que dificulta predecir el efecto individual. En los estudios epidemiológicos se observan de forma indirecta los posibles beneficios, teniendo como principal limitación que no pueden demostrar la causalidad. Además, los efectos antioxidantes de los carotenoides in vivo son más difíciles de medir, al esperarse efectos pequeños y transitorios. Los estudios existentes son muy distintos entre sí, comprendiendo poblaciones, dosis de carotenoides, tiempos de suplementación y resultados distintos (35). La dosis total de carotenoides empleada en el presente estudio (415 mg/semana) es mayor que la utilizada en otros. Respecto al tiempo de suplementación, es similar al de otros estudios, aunque hay estudios que se extienden hasta 8 y 12 semanas. En un estudio realizado en hombres se demostró que la cantidad absoluta de licopeno absorbida no parecía variar mucho con la dosis y que las diferencias individuales tenían mayor impacto que la dosis en la cantidad de licopeno absorbida (36). También se ha observado que, a dosis altas, la concentración de β-caroteno en el suero parece ser independiente de la cantidad ingerida, sugiriéndose que el intestino humano tiene una capacidad finita para absorber carotenoides. Así mismo, se ha visto que las dosis pequeñas de carotenoides se pueden absorber más eficientemente. De este modo, los resultados no dependen solo de la cantidad ingerida, que puede afectar a la biodisponibilidad y, por tanto, a la bioactividad, sino que hay que tener en cuenta otros factores como la fuente de carotenoides, otros componentes de la dieta y factores relacionados con el individuo (7).
Los estudios de intervención humana con diseño aleatorio, doble ciego y controlado con placebo se consideran el gold standard o “patrón oro” de la nutrición para probar los efectos de la dieta en la salud (35). El presente estudio no tiene dichas características, si bien el efecto de la falta de un grupo con placebo podría verse minimizado al actuar las voluntarias como propio grupo control. No obstante, los resultados sí que podrían verse afectados por el número de participantes, por la pertenencia de todas las voluntarias a una misma área geográfica y por la falta de muestras plasmáticas. A pesar de estas limitaciones, los resultados muestran que la suplementación de la dieta con carotenoides es beneficiosa para las mujeres perimenopaúsicas con riesgo cardiometabólico. Esta información es de interés para el diseño de dietas para este grupo de población, ya que los carotenoides contribuyen a la mejora de la dislipemia aterogénica y de los biomarcadores de inflamación y estrés oxidativo.















