INTRODUCCIÓN
Los trastornos del espectro autista (TEA) son un conjunto de desórdenes biológicos complejos del neurodesarrollo caracterizados por comportamientos repetitivos, dificultades en la interacción social y alteraciones marcadas en la comunicación verbal y emocional (1). Los niños con esta condición tienen visitas médicas recurrentes, utilizan más medicamentos y presentan mayores problemas de salud que los niños neurotípicos (NT) (2), lo cual impacta negativamente en su calidad de vida (3,4). Según Holingue y cols., (5), entre el 30 % y 70 % de estos pacientes presentan uno o más trastornos gastrointestinales (TGI) que varían desde síntomas leves hasta severos como estreñimiento, dolor abdominal, diarrea y síndrome de intestino irritable (6). En los niños y adolescentes con TEA, los TGI se correlacionan positivamente con la severidad de las manifestaciones neurológicas (7), por lo cual es necesario conducir intervenciones enfocadas en la salud gastrointestinal (GI) de estos pacientes.
Algunos estudios han evidenciado que la microbiota intestinal de los sujetos con TEA es escasa y menos diversa pero con una mayor densidad de bacterias patógenas que la de los niños NT (8,9). Las alteraciones en la microbiota promueven respuestas inflamatorias localizadas que aumentan la permeabilidad intestinal y la entrada de metabolitos bacterianos o nutrientes parcialmente digeridos al torrente sanguíneo, acentuando los trastornos digestivos y neurológicos (10). El equilibrio en la microbiota colónica se ha propuesto como blanco terapéutico para la reducción de los TGI en los pacientes con TEA (11); incluso, durante la última década se ha sugerido el uso de tratamientos basados en alimentos funcionales como terapia para la reducción de los síntomas autísticos (12).
Por otra parte, se denomina alimento funcional a todo aquel alimento, producto alimenticio o ingrediente capaz de proveer beneficios a la salud humana superiores a los ofrecidos por los alimentos tradicionales y con efectos comprobados en la reducción del riesgo de desarrollo de enfermedades (13). Actualmente, los modelos dietéticos más empleados en la terapéutica de pacientes con TEA (con y sin TGI) incluyen las dietas libres de gluten y/o caseína (LGLC), útiles en la terapia funcional enfocada hacia la reducción de comorbilidades neurológicas, respuestas alérgicas y afecciones intestinales; este modelo dietético es el más empleado en la práctica clínica y su uso se ha extendido a diferentes países del mundo (14,15). La efectividad de las dietas LGLC se ha evaluado determinando sus efectos sobre la respuesta clínico-cognitiva, pero sus beneficios sobre los TGI son controvertidos y sus efectos en la microbiota se han explorado mínimamente (16). Además de las dietas LGLC, algunos investigadores recomiendan el uso de prebióticos/probióticos para regular la composición de la microbiota colónica, mejorar la función de barrera intestinal (que regula los mecanismos de selectividad y permeabilidad) y disminuir los síntomas asociados a los TGI (17,18); sin embargo, hasta la fecha no existen protocolos terapéuticos definidos en cuanto a cepas bacterianas, dosis y tiempos de tratamiento.
Por todo lo anterior, el objetivo de esta revisión es integrar, analizar y discutir la efectividad de las terapias de alimentación funcional basadas en intervenciones con dietas LGLC y suplementos de prebióticos/probióticos para aliviar los TGI en pacientes con TEA de entre 2 y 18 años.
METODOLOGÍA
Se realizó una revisión sistemática según las guías para la publicación de revisiones sistemáticas y metaanálisis (PRISMA). La búsqueda fue realizada por dos autores de manera independiente durante enero y julio de 2021 en las bases de datos PubMed, Scopus y EBSCOhost, con las siguientes cadenas de búsqueda: 1) (diet OR gluten OR casein) AND (gastrointestinal disorders) OR (gut OR microbiota) AND (autism OR autism spectrum disorders); 2) (probiotics OR prebiotics) AND (gastrointestinal disorders) OR (gut OR microbiota) AND (autism OR autism spectrum disorders).
Los criterios de inclusión de los artículos fueron: 1) ensayos clínicos (de etiqueta abierta, cuasiexperimentales, controlados y/o aleatorizados) con intervenciones mediante dietas LGLC o suplementos de prebióticos/probióticos; 2) efectuados en niños o adolescentes de entre 2 y 18 años con diagnóstico de TEA; 3) resultados de los efectos sobre los indicadores de salud gastrointestinal (síntomas digestivos, índices de severidad gastrointestinal, indicadores bioquímicos y/o microbiota intestinal); 4) publicados entre el 01-01-1990 y el 01-07-2021, y 5) escritos en idioma inglés o español. Algunos estudios incluidos en revisiones previas también se identificaron en el análisis bibliométrico. Se excluyeron los estudios de casos y aquellos que no reportaron información sobre los TGI. La información extraída de los manuscritos fue: características de los sujetos del estudio, tratamientos recibidos (tipo, dosis, frecuencia y duración), indicadores de salud gastrointestinal (antes mencionados) y seguridad de las intervenciones.
El riesgo de sesgo de los estudios se evaluó según los criterios del capítulo 8 del Manual Cochrane de Revisiones Sistemáticas de Intervenciones, Versión 5.1.0 (19). En breve: se analizaron siete ítems de evaluación de la calidad y rigurosidad metodológica de los estudios, que incluyeron: A) generación de la secuencia aleatoria, B) ciego de asignación, C) ciego de participantes y personal, D) ciego de evaluación de resultados, E) datos de resultados incompletos, F) informes selectivos y G) otros sesgos. Se clasificaron como: “riesgo bajo”, “riesgo incierto” o “riesgo alto”.
RESULTADOS Y DISCUSIÓN
ANÁLISIS DOCUMENTAL
La búsqueda inicial generó 436 documentos, de los cuales se eliminaron 160 artículos duplicados y 214 documentos no relevantes (133 artículos no relacionados, 56 revisiones, 16 estudios con animales, 5 estudios en modelo celular, 2 artículos de opinión, 1 libro y 1 capítulo de libro). De 62 artículos restantes, se descartaron 38 según el contenido de los resúmenes (19 revisiones, 10 estudios transversales, 3 estudios con animales, 3 artículos sin información sobre TGI, 2 estudios de caso y un estudio en modelo celular). Se revisaron en extenso 24 estudios de intervención para la verificación de los criterios de inclusión; de estos, 3 se descartaron debido al uso de terapias alternativas no nutricionales, 3 debido a la falta de seguimiento a los indicadores de salud gastrointestinal, un estudio descriptivo, uno que incluyó población adulta y un protocolo de investigación. Finalmente, 15 artículos se incluyeron para el análisis (Fig. 1).
HALLAZGOS
La evidencia encontrada acerca de la efectividad de los tratamientos alimenticios sobre los indicadores de salud GI de los pacientes con TEA se empezó a publicar a partir del año 2010. En los estudios incluidos participaron 707 sujetos con TEA y 89 pacientes NT (2-18 años); 568 formaron parte de los grupos experimentales (Tabla I). En diez ensayos, el diagnóstico de TEA fue confirmado por medio de instrumentos validados, como el DSM (Diagnostic and Statistical Manual of Mental Disorders), la ADI-R (Autism Diagnostic Interview-Revised) y/o la ADOS (Autism Diagnostic Observation) (20-29).
Tabla I. Características generales de los estudios, participantes y tratamientos, y principales resultados sobre los efectos de las intervenciones con probióticos, prebióticos y dietas LGLC sobre los TGI en niños y adolescentes con TEA

Tabla I (cont.). Características generales de los estudios, participantes y tratamientos, y principales resultados sobre los efectos de las intervenciones con probióticos, prebióticos y dietas LGLC sobre los TGI en niños y adolescentes con TEA
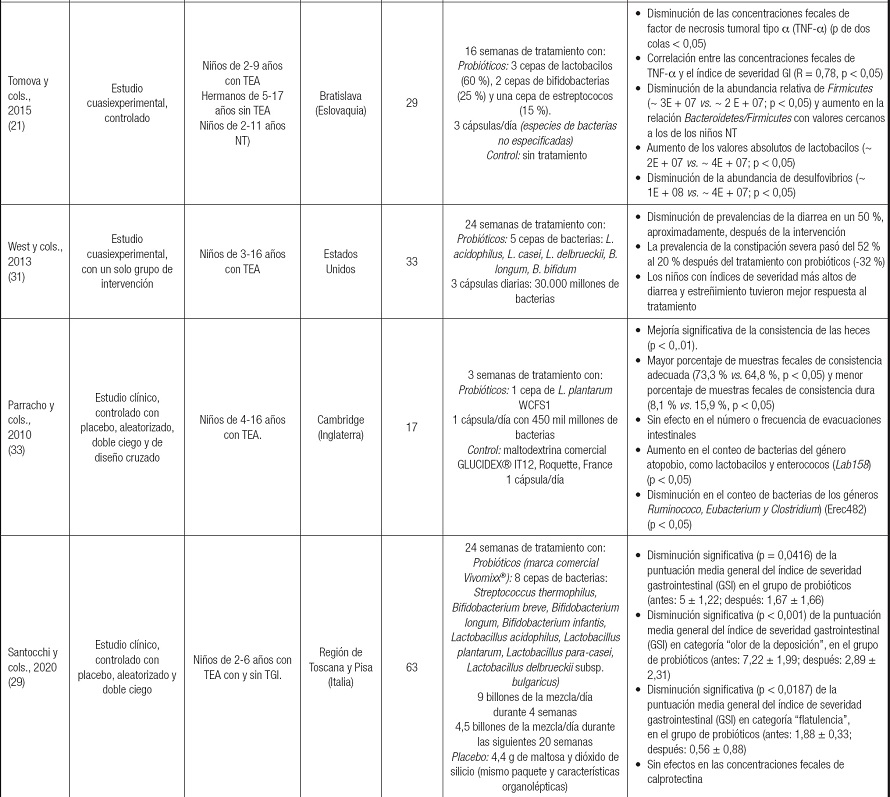
Tabla I (cont.). Características generales de los estudios, participantes y tratamientos, y principales resultados sobre los efectos de las intervenciones con probióticos, prebióticos y dietas LGLC sobre los TGI en niños y adolescentes con TEA

Tabla I (cont.). Características generales de los estudios, participantes y tratamientos, y principales resultados sobre los efectos de las intervenciones con probióticos, prebióticos y dietas LGLC sobre los TGI en niños y adolescentes con TEA

Tabla I (cont.). Características generales de los estudios, participantes y tratamientos, y principales resultados sobre los efectos de las intervenciones con probióticos, prebióticos y dietas LGLC sobre los TGI en niños y adolescentes con TEA

El estudio con menor número de participantes incluyó 8 pacientes (22) y el de mayor número, 130 (24). Los pacientes se seleccionaron de instituciones de educación especial, centros de atención terciaria y departamentos de psiquiatría, pediatría o gastroenterología. De acuerdo con el lugar de procedencia de los estudios, cinco se realizaron en Estados Unidos de América (22,23,28,30,31), dos en Inglaterra (32,33), dos en Italia (24,29), uno en Indonesia (26), uno en Egipto (34), uno en Eslovaquia (21), uno en Irán (25), uno en China (20) y uno en México (27) (Tabla I).
La duración de los tratamientos osciló entre 1 y 24 semanas. En siete estudios se utilizaron suplementos con probióticos (20,21,23,29,31,33,34); en otro se utilizaron galacto-oligosacáridos comerciales (B-GOS) como prebióticos (32) y en uno se diseñó un alimento en polvo, fuente de prebióticos naturales derivados de calostro bovino descaseinado, que se ofreció en ausencia o presencia de probióticos (suplementación mixta) (22). Los probióticos más empleados fueron los lactobacilos (21-23,29,33,34), seguidos de las bifidobacterias (21,23,29,34) y, en menor medida, los estreptococos (21,29). En otros cuatro estudios se usaron dietas LGLC (19,23,25,26) y en dos, la dieta LGLC se suplementó con gluten y caseína mediante la incorporación de alimentos fuente (26,28) (Tabla I).
Nueve trabajos fueron estudios clínicos aleatorizados; 8 controlados con placebo (23-26,28-30,32,33) y uno de diseño cruzado con dos intervenciones (22). Los métodos de aleatorización incluyeron: asignación 1:1 (23,29), sistema de números aleatorios (32,33) y por bloques (26-28,30).
Dos estudios no reportaron los métodos de aleatorización empleados (22,25). Los otros seis artículos fueron estudios cuasiexperimentales, cuatro de ellos con un solo grupo de intervención (24,27,31,34) y dos estudios controlados (20,21) (Tabla I).
Todos los estudios presentaron “riesgo de sesgo alto” en al menos uno de los ítems evaluados. Los estudios con mayores sesgos fueron los descritos por Tomova y cols. (21), Niu y cols. (20) y West y cols. (31) (“riesgo alto” en 7/7 ítems evaluados), mientras que el de Santochii y cols. (29) presentó menores riesgos (1/7 ítems), seguido del de Navarro y cols. (21) y el de Parracho y cols. (33) (4/7 ítems). Los sesgos más frecuentes fueron: Los informes selectivos de datos y resultados (ítem F; 10 de 15 artículos) (20,21,23,25-28,31,32,34), y “otros riesgos” (ítem G; 14 de 15 artículos) como: número reducido de participantes (21-23,28,30), intervenciones de corta duración (< 4 semanas) (20,26,30,33), uso de instrumentos no validados (20-21,24), poco tiempo de lavado en los ensayos de diseño cruzado (entre 2-3 semanas) (22-23,33) y omisión del número pacientes con mejoría clínica de los TGI (23,26,28,32,33) (Fig. 2). En el caso de los estudios cuasiexperimentales, la falta de control y aleatorización aumentó el riesgo de sesgo en cuatro de los siete ítems evaluados (A-D) y, según el mapa de riesgo, más de la mitad de los estudios presentaron riesgos de sesgo inciertos o altos en los diferentes ítems, integrando los de menor calidad metodológica (Fig. 2).

Figura 2. Evaluación del riesgo de sesgo de los artículos incluidos (formato de presentación adaptado por los autores). Se realizó de acuerdo con los criterios del capítulo 8 del Manual Cochrane de Revisiones Sistemáticas de Intervenciones (v.5.1.0). Las letras (A-G) corresponden a los ítems de evaluación. En colores los riesgos de sesgo: altos (rojo), inciertos (amarillo) y bajos (verde). La escala numérica (1 -14 ) corresponde a los ensayos clínicos y sus autores correspondientes (**)
EVIDENCIAS SOBRE LOS TGI EN PACIENTES CON TEA
Los instrumentos más utilizados para el diagnóstico y evaluación de los TGI en estos estudios fueron: la escala de valoración de heces de Bristol (22,28,31,32), el cuestionario sobre síntomas gastrointestinales pediátricos, versión Roma III (22-25,26), y el índice de severidad de los síntomas gastrointestinales (GIS; por sus siglas en inglés) y sus versiones modificadas (26-29,34). También se utilizó la escala del Módulo GI del Inventario de Calidad de Vida Pediátrico (Peds-QL; por sus siglas en inglés) (23), el Módulo Gastrointestinal de la Escala de Riesgos Genéticos y Medioambientales del Autismo Infantil (CHARGE; por sus siglas en inglés) (22), el Módulo Gastrointestinal de la Lista de Evaluación del Tratamiento del Autismo (ATEC; por sus siglas en inglés) (31), y cuatro estudios reportaron el uso de instrumentos no validados (20,21,24,33). Debido a estas variantes metodológicas, no fue posible determinar el número exacto de pacientes con TEA afectados por TGI. Sin embargo, de la información extraída de doce artículos (12/15) y considerando las prevalencias más altas de los síntomas evaluados, se estima que 387 pacientes (promedio del 58 %, rango del 27-83 %) cursaron con algún tipo de TGI en la línea base de los estudios (17-28).
Los TGI y síntomas más prevalentes fueron el estreñimiento (50-88,5 %) (20,22,24,27,31), la flatulencia (51-87,5 %) (22,24), la distensión abdominal (33-87,5 %) (22-24,27) y la diarrea (12,5-72,8 %) (22,24,27,31). Otros trastornos identificados incluyeron: síndrome de intestino irritable (SII), dolor al evacuar (22), proctalgia y malabsorción macroscópica (24). En algunos estudios, los TGI fueron más prevalentes y severos en los pacientes con TEA que en los voluntarios NT (20,21). Además, en el estudio de Alessandria y cols. (24) se encontró que más de un tercio de los pacientes cribados para la intervención (n = 56/151, 37 %) presentaban enteritis por infiltración linfocitaria (moderada o severa) según los análisis histológicos obtenidos a partir de biopsias intestinales.
Los TGI (y sus síntomas asociados) afectan la calidad de vida de los pacientes con TEA y sus familias, son motivo de consumo de fármacos y de consulta médica, aumentan la severidad de los síntomas autísticos, alteran la respuesta social y comprometen el estado de salud y nutrición (36,37). Por ello, el manejo nutricional de los TGI se ha postulado como un elemento importante para el manejo terapéutico, con beneficios en la respuesta clínico-cognitiva y GI de los pacientes (7). Y desde el año 2015 se dispone de las “Guías de manejo nutricional de los TGI en niños con trastornos del espectro autista”, dirigidas especialmente a los profesionales de salud implicados en la terapéutica nutricional de estos pacientes (38).
CARACTERÍSTICAS DE LA MICROBIOTA INTESTINAL EN LOS PACIENTES CON TEA
Siete de los estudios (7/15) revisados evaluaron biomarcadores asociados con la microbiota intestinal de los pacientes (20-23,32-34). Sin embargo, debido a las diferencias en las técnicas de extracción, cuantificación y clasificación del genoma bacteriano de las muestras fecales utilizadas en los estudios, estos resultados no son comparables (20-23,32-34) y la prevalencia de pacientes con disbiosis intestinal no pudo estimarse.
En el estudio de Manman y cols. (20) se encontró que la microbiota de los individuos NT era más uniforme y homogénea que la de los niños con TEA (p < 0,05) y que los pacientes con TEA y TGI presentaban menor diversidad bacteriana que los NT (p < 0,001) e incluso que los pacientes con TEA sin patologías digestivas (p < 0,01). Shaaban y cols. (34) encontraron que las concentraciones de bifidobacterias de los niños con TEA fueron más bajas que las de los niños sin TEA (p = 0,0001). Tomova y cols. (21) reportaron que, a diferencia de los voluntarios NT, los pacientes con TEA tuvieron una relación Bacteroidetes/Firmicutes más baja (~ 0,8 vs. ~ 0,4; p < 0,05) y mayores niveles de especies de lactobacilos (< 2E + 07 vs. ~ 4E + 07; p < 0,05). En este mismo estudio, los pacientes con TGI más severos (índice de severidad ≥ 5) presentaron menores relaciones Bacteroidetes/Firmicutes y mayor abundancia de bacterias de los géneros Clostridium (clúster 1) y Desulfovibrio que los pacientes con síntomas leves o moderados (Tabla I).
Actualmente no se han definido puntos de corte ni rangos de adecuación para las proporciones de especies bacterianas presentes en la microbiota intestinal, y su contribución a la patogénesis de los TGI en lospacientes con TEA está aún poco estudiada (39). Sin embargo, estudios recientes en ratones trasplantados con muestras fecales provenientes de niños con TEA y voluntarios NT han brindado información relevante para entender los efectos de la microbiota intestinal en el desarrollo de los comportamientos autísticos (40) a través del denominado eje microbiota-intestino-cerebro (MIC).
Las filas bacterianas más abundantes en la microbiota intestinal de los seres humanos son Firmicutes y Bacteroidetes, las cuales representan más del 90 % del total de especies bacterianas presentes en el intestino (41). En los pacientes con TEA, bajas relaciones Bacteroidetes/Firmicutes son indicativas de microbiotas poco abundantes y reflejan disminuciones en las concentraciones de bacterias constitutivas de la microbiota comensal, lo cual se asocia con un mayor riesgo de infecciones por bacterias oportunistas, causantes de enfermedad (42). En particular, niveles elevados de bacterias de los géneros Clostridium y Desulfovibrio en pacientes con TEA se han asociado con daño intestinal severo debido a mecanismos implicados en la liberación de toxinas proinflamatorias (43) y mayor producción de sulfuro de hidrógeno (S2H) en el lumen intestinal, respectivamente, capaces de alterar también la respuesta neurológica (44). Algunas especies bacterianas pertenecientes al género Clostridium son difíciles de erradicar debido a su resistencia al uso de múltiples antibióticos (43).
EFECTIVIDAD DE LOS TRATAMIENTOS DE ALIMENTACIÓN FUNCIONAL SOBRE LOS TGI EN PACIENTES CON TEA
No fue posible identificar el número de pacientes en que mejoraron los TGI con los tratamientos, dado que en los estudios de Arnold y cols. (23), Tomova y cols. (21), Parracho y cols. (33), Grimaldi y cols. (32), Hyman y cols. (28), Santocchi y cols. (29) y Pusponegoro y cols. (26) no se reportaron cambios en las prevalencias de los TGI, ni la frecuencia de los pacientes en que disminuyó el grado de severidad de dichos trastornos después de recibir las intervenciones correspondientes (Tabla I).
Según resultados disponibles de nueve estudios (9/15), al menos 127 pacientes (24 %) presentaron mejorías de los TGI después de recibir los tratamientos; de ellos, 68 recibieron dietas modificadas en gluten y/o caseína (24,25,27,30) y 59 recibieron suplementos de prebióticos/probióticos (20-22,34). En dos estudios, 27 participantes disminuyeron el índice de severidad general de los TGI (20,22) y, en el de West y cols. (31), 12 y 13 pacientes disminuyeron la severidad de la diarrea y el estreñimiento, respectivamente. Teniendo en cuenta los cambios de las prevalencias de los TGI después de los tratamientos, 41 pacientes resolvieron la malabsorción macroscópica (24), otros 34 el estreñimiento (25-27,34) y uno el dolor intermitente con mejoría en la consistencia de las heces (30).
Efectos de las dietas LGLC
Seis de siete (6/7) estudios reportaron mejoras en ciertos indicadores de salud GI. Se encontraron menores prevalencias de estreñimiento (24-25,27), diarrea (24), dolor abdominal (24,25), flatulencia (27), malabsorción macroscópica, proctalgia (24) y susceptibilidad de permeabilidad intestinal (27) después de la implementación de las dietas. En el estudio de Navarro y cols. (30), solo en uno de seis pacientes disminuyó el dolor abdominal intermitente y mejoró la consistencia de las heces después del tratamiento con una dieta LGLC. Pusponegoro y cols. (26) encontraron que la incorporación de gluten y caseína durante una semana en pacientes con TEA que consumían dietas LGLC aumentó significativamente (p = 0,027) la puntuación del índice de severidad general de los TGI. Pero Hyman y cols. (28) no encontraron alteraciones en la frecuencia o las características de las heces tras incorporar durante 12 semanas gluten y/o caseína a la dieta LGLC que llevaban previamente los pacientes (Tabla I). Los riesgos de sesgo introducidos en las investigaciones (Fig. 2) no permiten comprobar los efectos de estas dietas sobre los TGI y, debido a los riesgos de deficiencias nutricionales, su prescripción debe estar clínicamente justificada.
Los mecanismos de acción de las dietas LGLC sobre la salud GI no están completamente estudiados. Algunos autores señalan que los sujetos con TEA presentan alteraciones en la digestión y absorción de algunos nutrientes (45,46). La digestión deficiente de caseína y gluten parece aumentar la formación y transferencia de exorfinas (p. ej., gliadinomorfinas y casomorfinas) hacia el torrente sanguíneo, acentuando los síntomas neurológicos (47). En el colon, estos péptidos pueden ser reconocidos por células presentadoras de antígenos de la mucosa (p. ej., macrófagos y células dendríticas) capaces de desencadenar respuestas inmunológicas locales debido a la liberación de reactantes inflamatorios, como citoquinas y anticuerpos, con efectos potencialmente nocivos para el intestino (48). Por ello, las dietas LGLC se utilizan cada vez con más frecuencia dentro del abordaje clínico de los pacientes con TEA (16) pero, hasta la fecha, sus aplicaciones terapéuticas para la corrección o disminución de los TGI en pacientes con TEA son poco concluyentes debido a la falta de estudios longitudinales que permitan determinar con precisión sus riesgos o beneficios en el corto, medio y largo plazo.
Las desventajas de las dietas LGLC incluyen, principalmente, inadecuados métodos de sustitución de los alimentos restringidos por parte de los padres o cuidadores y prácticas inapropiadas en la lectura, revisión e interpretación de las etiquetas nutricionales de los productos comestibles procesados y ultraprocesados, muchos de ellos elaborados con alimentos o ingredientes contenedores de gluten o caseína, que podrían afectar a la respuesta al tratamiento, a lo cual se suman los costos económicos relacionados con los precios elevados de dichos alimentos, con impactos importantes en la economía familiar (49), especialmente en las familias que viven bajo condiciones económicas desfavorables.
Adicionalmente, desde el punto de vista clínico, la implementación de dietas LGLC en niños con TEA podría reducir potencialmente la ingesta de nutrientes críticos como calcio, vitamina D y aminoácidos esenciales, desencadenantes de alteraciones en el crecimiento lineal y la densidad mineral ósea (50) y, por lo tanto, su prescripción debe realizarla cuidadosamente un profesional en dietética y nutrición quien, además de reducir los riesgos nutricionales asociados, deberá determinar la necesidad de emplear suplementos para corregir las deficiencias de micronutrientes específicos.
Efectos de los suplementos de prebióticos y/o probióticos
La efectividad de los prebióticos/probióticos en la disminución de los TGI en pacientes con TEA ha sido tema de interés científico en la última década (51). En seis de ocho (6/8) estudios en los que se utilizaron este tipo de suplementos (20-22,29,31,33,34) se reportaron disminuciones en las prevalencias del estreñimiento, la diarrea, el dolor abdominal, el dolor al evacuar y la flatulencia, en algunos casos con mejoras en la consistencia de las heces (22-33,34). De acuerdo con los hallazgos obtenidos por Sanctuary y cols. (22), Shaaban y cols. (34) y Niu y cols. (20), la suplementación con probióticos o con prebióticos/probióticos disminuyó el índice de severidad de los TGI de los pacientes con TEA entre 1 y 4 puntos (p < 0,05), datos similares a los publicados recientemente por Santocchi y cols. (29), aunque Arnold y cols. (23) y Grimaldi y cols. (32) no encontraron efectos terapéuticos asociados a sus respectivas intervenciones (Tabla I).
Los probióticos aumentan la producción de ácidos grasos de cadena corta (AGCC), estimulan la producción de moco colónico, mejoran la tolerancia inmunológica a los alimentos y limitan la capacidad infectiva de las bacterias patógenas (52). Su uso (c/s prebióticos) se ha masificado para la prevención y el tratamiento de patologías intestinales (53). Sin embargo, la evidencia acerca de la efectividad de estos suplementos en la salud intestinal de los pacientes con TEA es limitada debido a los sesgos metodológicos de los estudios (Fig. 2). Y dado que aún no se han definido cepas, dosis y tiempos de tratamiento, los efectos terapéuticos encontrados en las investigaciones no son concluyentes. Las brechas existentes en este campo del conocimiento invitan a los investigadores a conducir nuevos y mejores estudios para determinar los beneficios terapéuticos de los suplementos probióticos (c/s prebióticos) para aliviar los TGI en los niños con TEA.
EFECTOS DE LAS INTERVENCIONES SOBRE LA MICROBIOTA INTESTINAL
De los quince estudios revisados, solo cinco (5/15) en los que se utilizaron suplementos de prebióticos/probióticos reportaron resultados acerca de los efectos sobre la microbiota intestinal (21,22,32-34) (Tabla I); en ninguno de los estudios con dietas modificadas en gluten y caseína se evaluó la microbiota intestinal como variable de respuesta al tratamiento. En estos estudios con probióticos se emplearon diferentes técnicas para la extracción de ADN fecal y la evaluación de la microbiota, y los formatos de presentación de resultados no fueron comparables entre sí. No fue posible calcular el número de sujetos que modificaron la composición de la microbiota después de los tratamientos y esta información no se encontró en los documentos.
En el estudio de Shaaban y cols. (34), la suplementación durante 12 semanas con Lactobacillus acidophilus, Lactobacillus rhamnosus y Bifidobacteria longum aumentó significativamente (p = 0,001) el conteo de unidades formadoras de colonias (UFC) de bacterias benéficas en las muestras fecales de los niños con TEA: lactobacilos (1,98 × 107 vs. 2,53 × 107 UFC) y bifidobacterias (0,73 × 107 vs. 1,62 × 107 UFC). El aumento en las poblaciones de lactobacilos (y otras bacterias benéficas) también se encontró en otras investigaciones (33) (Tabla I). Acorde con los resultados de uno de los estudios (21), la suplementación conjugada (lactobacilos, bifidobacterias y estreptococos) durante 16 semanas redujo la abundancia fecal de bacterias patógenas causantes de inflamación (p. ej., Firmicutes [~ 3E + 10 vs. < 2E + 10] y Desulfovibrio [~ 9E + 08 vs. ~ 4E + 07]) y aumentó la relación fecal Bacteroidetes/Firmicutes hasta valores similares a los de los controles NT (Tabla I). Sin embargo, en los estudios con prebióticos no se encontraron cambios en la microbiota intestinal asociados a dichos tratamientos (22,32) (Tabla I).
Las terapias de manipulación de la microbiota intestinal se han propuesto como opciones terapéuticas para la disminución de los TGI y la erradicación de infecciones ocasionadas por bacterias resistentes con potencial ofensivo intestinal, como Clostridium difficile (54), e incluyen el uso de probióticos/prebióticos y el trasplante de bacterias fecales, este último con beneficios demostrados en la disminución de los TGI de los pacientes con TEA a corto y largo plazo (55). Pero dadas las diferencias metodológicas y los riesgos de sesgo presentes en estos estudios (Fig. 2), los efectos terapéuticos de los suplementos de probióticos no se han demostrado completamente.
SEGURIDAD, TOLERANCIA Y ADHERENCIA A LOS TRATAMIENTOS
Ninguno de los participantes en los estudios presentó complicaciones médicas graves asociadas a los tratamientos. Aunque los probióticos fueron bien tolerados por la mayoría de los participantes, varios investigadores reportaron la aparición o exacerbación de síntomas, principalmente GI, ninguno de ellos con repercusiones clínicas relevantes. En el estudio de Niu y cols. (20), dos de 65 pacientes (5 %) desarrollaron diarrea, la cual desapareció a partir de la tercera semana de tratamiento. Shaaban y cols. (34) también reportaron efectos adversos transitorios en cinco de treinta pacientes (17 %): uno por diarrea, dos por calambres abdominales y dos por distensión abdominal. En los trabajos de Arnold y cols. (23) y de Sanctuary y cols. (22), cinco de 18 pacientes (27 %) presentaron dolor abdominal, diarrea o aumento en la frecuencia de gases. En el estudio de Santocchi y cols. (29), tres de 32 pacientes pertenecientes al grupo del placebo (9 %) y dos de 31 del grupo de intervención (6 %) abandonaron el estudio, los últimos debido al aumento de síntomas GI (uno por dolor abdominal y otro por diarrea). En el estudio de Parracho y cols. (33), los participantes que manifestaron síntomas clínicos graves durante el tratamiento (p. ej., erupciones cutáneas, diarrea severa y pérdida de peso) fueron retirados. Erróneamente, Grimaldi y cols. (32) y Tomova y cols. (21) no informaron sobre la seguridad de los suplementos utilizados. De manera semejante, en los estudios con dietas LGLC, pocos investigadores evaluaron la seguridad, tolerancia y adherencia a los tratamientos. Únicamente Hyman y cols. (28) reportaron la aparición de efectos adversos consistentes en diarrea, dolor abdominal e irritabilidad, pero estos no estuvieron asociados a deficiencias nutricionales por los cambios en la dieta. Alessandria y cols. (24) encontraron que el 32 % de los pacientes fueron incapaces de adherirse completamente a la dieta LGLC, pero todos concluyeron el estudio.
CONCLUSIONES
Hasta la fecha han sido pocos los estudios publicados sobre la efectividad de la estrategia de alimentación funcional mediante dietas LGLC y suplementos de probióticos/prebióticos para aliviar los TGI en los TEA. Esta revisión integra y analiza los resultados de 15 estudios publicados desde el año 2010 acerca de la efectividad de las dietas LGLC y los suplementos de prebióticos/probióticos sobre los indicadores de salud gastrointestinal en pacientes con TEA.
En estos estudios, la falta de consenso en el uso de instrumentos para la evaluación de TGI de los pacientes impide establecer comparaciones respecto a la proporción de niños afectados por estos trastornos. Sin embargo, según datos emitidos por los investigadores, más de la mitad de los pacientes con TEA (58 %) presentaron algún TGI previo a la intervención, principalmente estreñimiento, diarrea y dolor abdominal, según los métodos diagnósticos utilizados. Estos datos son compatibles con resultados derivados de estudios epidemiológicos que reportan prevalencias de entre el 21 y el 77 % (56). Según los resultados de los estudios incluidos en esta revisión, al menos 127 pacientes (24 %) presentaron mejorías de los TGI después de los tratamientos recibidos.
Algunos de los investigadores reportaron diferencias en la composición de la microbiota intestinal de los pacientes con TEA, principalmente en aquellos con TGI, con menores relaciones Bacteroidetes/Firmicutes y mayores concentraciones fecales de bacterias patógenas (p. ej., Clostridium y Desulfovibrio). Aunque se desconocen los efectos de los disbalances en la composición de la microbiota intestinal en los niños con TEA, se cree que esta es un contribuyente importante en la patogénesis de los TGI y los síntomas autísticos de estos pacientes. Sin embargo, las diferencias técnicas empleadas en su evaluación impiden establecer comparaciones entre los resultados.
Las terapias de sustitución de la microbiota intestinal por medio de suplementos de probióticos/prebióticos y dietas restrictivas se han postulado como estrategias útiles en la reducción de los TGI en pacientes con TEA; sin embargo, en los estudios de intervención con dietas LGLC no se han evaluado sus efectos. De igual forma, el uso de suplementos de probióticos (c/s prebióticos) ha generado resultados contradictorios en la regulación de la microbiota de los pacientes y sus beneficios terapéuticos no se han corroborado. Si bien, los tratamientos aquí mencionados son seguros y en general bien tolerados por los pacientes con TEA, hasta el 27 % de los pacientes pueden presentar exacerbación de síntomas GI como diarrea, distensión o dolor abdominal, principalmente durante la fase inicial del consumo de los probióticos (c/s prebióticos).
Todos los estudios aquí analizados presentaron riesgos de sesgo importantes, entre ellos, la falta de controles experimentales y de aleatorización de los tratamientos, el bajo número de participantes, las características heterogéneas de las intervenciones y los tratamientos de corta duración. Además, las diferencias en las técnicas de análisis de la microbiota intestinal y los instrumentos de evaluación diagnóstica no permiten determinar los efectos de las intervenciones sobre la disminución de los TGI, ya que los resultados no son comparables. Debido a lo anterior, se justifica la necesidad de conducir investigaciones controladas para comprender los efectos de estos tratamientos en el manejo terapéutico de los TGI en pacientes con TEA.















