INTRODUCCIÓN
Existen numerosas patologías cuyo manejo se realiza de forma habitual en la atención especializada (AE) y que están estrechamente relacionadas con los TCA. Dicha relación puede ser bien porque la patología en sí misma supone un factor de riesgo en la aparición de un TCA (por ejemplo, la diabetes mellitus tipo 1, DM1) o bien porque el motivo de consulta en la AE sea un síntoma secundario a un TCA no detectado. En este último caso, la AE es a menudo el primer (y a veces único) contacto con el profesional sanitario del paciente con TCA (por ejemplo, una paciente con TCA que consulte por amenorrea o infertilidad en Ginecología). En general, los pacientes con TCA con un índice de masa corporal (IMC) fuera del rango de la normalidad tienen más probabilidades de ser identificados en la AE. Por el contrario, en aquellos con normopeso, el TCA puede pasar inadvertido si no se tiene un alto índice de sospecha del mismo. Es por ello que la formación en TCA de los profesionales sanitarios de la AE es fundamental.
Teniendo en cuenta que el Ministerio de Sanidad contempla la prevención de la enfermedad dentro de las competencias de la AE (1), nos planteamos la búsqueda de evidencia en cuanto a la prevención de los TCA en la AE. Desde el punto de vista preventivo, en la AE encontramos: prevención selectiva, prevención indicada y prevención secundaria.
A continuación se desarrollan aquellas situaciones clínicas y patologías susceptibles de ser atendidas en la AE en las que existe una posible asociación con los TCA, intentando recoger la evidencia en cuanto a su papel en el desarrollo o el mantenimiento de los TCA, así como los aspectos preventivos.
DIABETES MELLITUS
La DM1 es una enfermedad autoinmune, ocasionada por la destrucción de las células beta del páncreas, que conduce a una deficiencia de insulina (2), siendo el tratamiento de elección el aporte de insulina exógeno (3). El tratamiento nutricional tiene un papel fundamental en el manejo de la diabetes, de tal forma que la American Diabetes Association (ADA) recomienda la contabilización de raciones de carbohidratos (e incluso en algunos casos considerar el contenido de grasas y proteínas de los alimentos) para determinar la dosis de insulina en las comidas y así alcanzar un mejor control glucémico (4).
La DM1 como factor de riesgo de TCA está ampliamente documentada en la literatura, estimándose que los pacientes con DM1 tienen 2,4 veces más riesgo de TCA que la población no diabética (5). La prevalencia es variable, encontrando cifras del 8 (6), 10 (5) y 32,4 % (7). En un trabajo en adolescentes con DM1, la mitad presentaban preocupación por el peso y la silueta corporal (6). La relación entre la DM1 y los TCA está tan consolidada que ha dado lugar a la aparición del término “diabulimia”, que hace referencia a aquellas personas con DM1 que realizan la restricción u omisión deliberada de insulina para controlar el peso (8), y que constituye el TCA más frecuente en la DM1 (9).
La coexistencia de un TCA y la DM1 puede tener graves consecuencias ya que se asocia a un peor control metabólico de la diabetes (5), siendo la restricción/omisión deliberada de insulina un factor de riesgo de complicaciones microvasculares y de mortalidad (10).
Según un estudio reciente, la aparición del TCA ocurre habitualmente después del diagnóstico de la diabetes en los pacientes con DM1 (11). Esto puede deberse a que en la DM1 hay determinadas conductas relacionadas con la propia enfermedad que potencian de manera directa la aparición de trastornos alimentarios. Por un lado, encontramos la excesiva preocupación en torno a la ingesta de carbohidratos, que ocurre como consecuencia de la necesidad de su contabilización en cada ingesta con el fin de poder ajustar adecuadamente la dosis de insulina prandial (12). Por otro lado, las posibles fluctuaciones del peso asociadas al uso de insulina o la excesiva ingesta calórica secundaria a la hipoglucemia pueden conducir a aumento de peso y posterior insatisfacción corporal (12).
Respecto a los estudios de prevención de los TCA en la DM1 cabe destacar los siguientes trabajos:
− El estudio piloto de Wilksch y cols. (13) evaluó la efectividad de un programa para mejorar los factores protectores de los TCA en niñas con DM1. Para ello, 20 niñas (10 a 12 años) sin antecedentes de TCA y con DM1 recibieron 2 sesiones grupales, de 4 horas cada una, donde se abordaban el perfeccionismo, los medios de comunicación, la imagen corporal y la autoestima. En la evaluación realizada al mes de la intervención se objetivó una mejoría significativa de la autoestima, la internalización de la delgadez y el perfeccionismo. No hubo mejoría del control metabólico medido según la hemoglobina A1c (si bien el escaso tiempo transcurrido limita su interpretación) pero sí en las escalas de medición del autocuidado de la diabetes.
− Olmsted y cols. (14) evaluaron un programa de psicoeducación (PE) sobre los TCA y el control metabólico en adolescentes con DM1. Para ello seleccionaron primero a aquellas pacientes que o bien presentaban riesgo de TCA según diversas escalas (9 o más puntos en la subescala Drive for Thinness del Eating Disorder Inventory (EDI); 5 puntos o más en la subescala Bulimia del EDI; 15 o más puntos en la subescala Body Dissatisfaction del EDI), o bien tenían antecedentes actuales o pasados de atracones, abuso de laxantes o diuréticos, u omisión de insulina para perder peso. Seguidamente se aleatorizó a esas 130 mujeres (12 a 20 años) con DM1 y que cumplían los citados criterios, a recibir PE o “tratamiento habitual” en proporción de 2:1. El programa de PE constaba de 6 sesiones de 90 minutos semanales cada una sobre la relación entre los TCA y la DM1, los efectos perjudiciales de la omisión de la insulina y las conductas alimentarias desordenadas en el control glucémico y su impacto. Los resultados de la PE se midieron a los 6 meses de la intervención, objetivándose reducciones significativas en las subescalas de restricción y preocupación sobre la alimentación de la Eating Disorder Examination (EDE) y en la subescala Drive for Thinness del EDI. No se evidenció mejoría en la omisión de insulina como conducta purgativa ni en los niveles de hemoglobina A1c.
− Alloway y cols. (15) quisieron averiguar si un programa de PE grupal mejoraba el control metabólico, la adherencia al tratamiento de la diabetes, los síntomas de TCA y la psicopatología general en mujeres DM1 con TCA subclínico. Se reclutaron a través de distintos anuncios a pacientes con DM1 y con interés en el campo de la conducta alimentaria. De las 91 mujeres reclutadas, 14 cumplieron los criterios de un TCA subclínico, definido como uno de los siguientes: 40 puntos o más en el EDI; 7 puntos o más en la subescala Drive for Thinness del EDI; 2 puntos o más en la subescala Bulimia del EDI; 15 puntos o más en la subescala Body Dissatisfaction del EDI; Eating Attitudes Test (EAT) con 17 o más puntos. Se asignaron 8 mujeres al grupo de PE y 6 al grupo de control. El programa de PE, a través de 6-7 sesiones semanales, incluyó información sobre los TCA, la alimentación saludable, el manejo del estrés, la mejora de la autoestima, las expectativas de delgadez a través de los medios de comunicación y la mejoría de la imagen corporal. En el análisis realizado al mes de la intervención, ambos grupos presentaron mejoría psicopatológica general sin diferencias significativas entre ambos grupos. Tampoco hubo diferencias en el control metabólico, la adherencia al tratamiento diabetológico o los síntomas TCA. Cabe destacar, como limitaciones del estudio: la escasa muestra, la estrategia de reclutamiento (que podría haber seleccionado aquellas mujeres “más interesadas” y predispuestas al cambio y que podría explicar la mejoría en ambos grupos) y posiblemente la mayor edad de las pacientes respecto a otros trabajos (32,9 años de media).
Las distintas sociedades científicas relacionadas con la diabetes tienen muy presente el impacto de los TCA en la diabetes y se posicionan al respecto. La ADA recomienda realizar un cribado de los TCA en la DM1 con hiperglucemia y pérdida de peso no explicadas (9), y aconseja que la evaluación nutricional de estos pacientes incluya de rutina la presencia de conductas alimentarias anómalas (9). La International Society for Pediatric and Adolescent Diabetes (ISPAD) recomienda que los jóvenes con DM1 sean evaluados por profesionales de salud mental en cuanto a problemas psicosociales y trastornos alimentarios (16). Desde un punto de vista práctico, hay herramientas diseñadas y validadas para identificar a aquellos pacientes con DM1 en riesgo de desarrollar un trastorno alimentario, como por ejemplo la Eating Problem Survey-Revised (DEPS-R) (17) o la Screen for Early Eating Disorder Signs (SEEDS) (18).
La diabetes mellitus tipo 2 (DM2) y su relación con los TCA, aunque menos extensamente que en la DM1, también se ha estudiado (19), encontrándose prevalencias variables que oscilan entre un 14 (20) y un 40 % (21). En el caso de la DM2, el TCA más frecuente es el trastorno por atracón (9), y cabe señalar que la aparición del TCA ocurre habitualmente antes del diagnóstico de la DM2 (11), a diferencia de lo que ocurre en la DM1. Los TCA en la DM2 también tienen un impacto negativo sobre el control metabólico (20).
CELIAQUÍA
La enfermedad celiaca (EC) es una enfermedad autoinmune que ocurre en pacientes genéticamente susceptibles y que está desencadenada por la ingesta de gluten, que da lugar a una enfermedad inflamatoria del tubo digestivo. El tratamiento consiste en evitar los alimentos que contienen gluten de forma permanente.
La relación entre la EC y los TCA es conocida. Existe una asociación positiva entre ambas enfermedades tanto antes como después del diagnóstico de la EC, aunque un trabajo demostró que más del 85 % de los TCA se diagnosticaron después de la aparición de la EC (22). En un estudio, la prevalencia de los TCA en pacientes con EC fue del 3,9 % (22) y en otro, el HR para el desarrollo de AN en pacientes celiacos fue de 1,46 (IC 95 %, 1,08-1,98) (23). Por otro lado, la asociación entre EC y DM1 es frecuente y, cuando esto ocurre, la probabilidad de desarrollar un TCA es 3 veces mayor que en ambas entidades por separado (24), siendo dicho riesgo mayor en las mujeres y los pacientes con sobrepeso (25).
Los factores que se han relacionado con los TCA en la EC son (22,24-27):
− La necesidad de llevar una alimentación exenta de gluten.
− El estrés por tener que llevar a cabo la restricción alimentaria sin gluten de por vida.
− La necesidad de tener un elevado conocimiento sobre los alimentos.
− La preocupación por la contaminación cruzada con alimentos que contengan gluten.
− El retraso del crecimiento y la pubertad retrasada.
− El aumento de peso durante el tratamiento.
− La presencia de alteraciones psicopatológicas en relación con la enfermedad crónica.
− La coexistencia de otras comorbilidades médicas (DM1) o psiquiátricas.
La coexistencia entre EC y TCA dificulta el manejo de estos pacientes. Por un lado, el tratamiento de la EC a través de la eliminación del gluten de la dieta induce per sé una restricción alimentaria que puede dificultar el tratamiento de los pacientes con AN. Por otro lado, no se puede descartar que algunos pacientes con TCA consuman a sabiendas productos que contienen gluten para perder peso.
No se han encontrado estudios específicos de prevención de los TCA en pacientes con EC.
ENFERMEDAD INFLAMATORIA INTESTINAL
La enfermedad inflamatoria intestinal (EII) se refiere a un grupo de patologías cuyo sustrato común es la inflamación crónica del intestino. Las más frecuentes son la enfermedad de Crohn y la colitis ulcerosa. El tratamiento se basa en el empleo de distintos fármacos (aminosalicilatos, glucocorticoides, inmunosupresores y agentes biológicos) con el objetivo de minimizar los síntomas, mejorar la calidad de vida e inducir y mantener la remisión de la enfermedad (o en su defecto, minimizar la progresión y la aparición de complicaciones) (28).
Desde el punto de vista nutricional, la relación entre la EII y la alimentación es compleja. Existen múltiples dietas que se han ensayado en pacientes con EII, cuya evidencia científica es limitada (29,30), y a las cuales los pacientes tienen acceso a través de internet (con resultados que no siempre se ajustan a la evidencia científica). A este respecto, la European Society for Clinical Nutrition and Metabolism (ESPEN) sostiene que no solo no hay ninguna “dieta específica” para la EII que pueda promover la remisión de la EII activa sino que las dietas de exclusión no pueden recomendarse para inducir la remisión (31). Las recientes guías sobre la enfermedad de Crohn y la colitis ulcerosa del American College of Gastroenterology tampoco recomiendan ninguna dieta específica de forma sistemática para su manejo (32,33). Esto no significa que los pacientes con EII no se beneficien del consejo dietético individualizado por parte de personal cualificado; de hecho, se recomienda que todos los pacientes con EII reciban consejo dietético por parte de un dietista como parte del manejo multidisciplinar para mejorar el estado nutricional y evitar la desnutrición (31).
El carácter crónico de la enfermedad y las posibles complicaciones derivadas de la misma (estenosis intestinales) o de sus tratamientos (ostomías, síndrome de intestino corto) pueden derivar en la necesidad de adaptar la alimentación y justificar, desde un punto de vista terapéutico, algunas restricciones (por ejemplo, en la estenosis sintomática puede ser necesario adaptar la consistencia de la dieta o restringir el consumo de lactosa en los brotes) (31).
Se sabe que más del 80 % de los pacientes con EII modifican su alimentación (cualitativa y cuantitativamente) tras el diagnóstico de la enfermedad (34), siendo frecuente que los pacientes con EII crean que algunos alimentos son útiles para controlar o modificar el curso de su enfermedad (35); incluso el 37 % piensan que la dieta es más importante que los fármacos en el tratamiento de aquella (34). Larussa y cols. reportan que el 70 % de los pacientes con EII restringen alimentos por su cuenta (34), siendo esto más frecuente en los individuos jóvenes y con mayor nivel educativo (34). La autorrestricción alimentaria indiscriminada puede afectar negativamente a la ingesta de nutrientes (35), la salud del paciente (por ejemplo, menor mineralización ósea (34)) y la esfera social (34). Respecto a este último punto, cabe destacar que el 29 % de los pacientes con EII no comparten la misma alimentación que el resto de su familia, llevando a cabo una alimentación diferente, y que más del 20 % de los pacientes no salen a comer fuera de casa por miedo a que ello desencadene un brote (34).
Se ha sugerido que existe una relación entre la EII y los TCA basada en el reporte de casos y series (36), siendo la asociación más frecuente la encontrada entre AN y enfermedad de Crohn (36). El estudio de Wardle y cols. sobre conducta alimentaria en la enfermedad de Crohn (37) evidencia una mayor prevalencia de comportamientos alimentarios patológicos en los pacientes con enfermedad de Crohn que en los controles, con mayores puntuaciones en la Binge Eating Scale (BES), mayor proporción (29 % vs. 3,3 %) de pacientes con 17 o más puntos en la escala BES, menor puntuación en el Control of Eating Questionnaire (CoEQ) y mayor en el Dutch Eating Behavior Questionnaire (DEBQ). Satherly y cols. reportan que el 20 % de los pacientes con EII (n = 116) presentaron 20 puntos o más en el EAT-26 (38).
Quick y cols. proponen los siguientes potenciales factores de riesgo de desarrollar un TCA en pacientes con EII (25):
− El retraso del crecimiento y la pubertad retrasada.
− La preocupación por la alimentación con frecuentes restricciones de la alimentación en relación a la clínica digestiva o a la propia enfermedad (adaptación de la dieta tras la cirugía).
− El miedo a la ingesta, secundario al dolor abdominal.
− La preocupación por la silueta y el peso corporal en relación a la ganancia de peso de los glucocorticoides.
− La coexistencia de otras comorbilidades psiquiátricas.
− La severidad de la enfermedad y las limitaciones físicas y psicosociales que genera.
Cabe destacar la especial dificultad que entrañan el diagnóstico diferencial y el manejo de un TCA y una EII desde un punto de vista clínico. En pacientes afectos de EII, el diagnóstico de un TCA puede ser difícil, ya que varios de los síntomas más notables (diarrea, vómitos, pérdida de peso y anorexia) pueden estar presentes en ambas afecciones (36), lo cual puede retrasar el diagnóstico de un eventual TCA y, por tanto, su tratamiento. Aunque hay un cuestionario validado de calidad de vida en relación con la alimentación de pacientes con EII (39), no se trata de una herramienta de screening de TCA como tal, y el hecho de que las herramientas de cribado de TCA habituales no sean específicas ni estén validadas en pacientes con EII dificulta aún más su despistaje (25). Otros obstáculos son la no aceptación del diagnóstico de TCA por los pacientes con EII o sus padres (40), con la consiguiente falta de cooperación en el tratamiento y una posible menor adherencia o el rechazo del tratamiento corticoideo por miedo a ganar peso (36).
No se han encontrado estudios específicos de prevención de TCA en pacientes con EII.
FIBROSIS QUÍSTICA
La fibrosis quística (FQ) es una enfermedad de herencia autosómica recesiva, caracterizada por la disfunción de las glándulas exocrinas, que conduce al organismo a producir secreciones de moco espesas, produciendo su acumulación a nivel pulmonar, pancreático y de otros órganos.
Desde el punto de vista nutricional, los pacientes con FQ presentan riesgo de desnutrición secundario principalmente a la malabsorción de nutrientes y a mayores requerimientos de energía (41). El adecuado estado nutricional en este colectivo está estrechamente relacionado con una mejor función pulmonar y supervivencia, por lo que el soporte nutricional de estos pacientes se considera un pilar fundamental del tratamiento (41,42).
Los estudios que analizan la prevalencia de los TCA en la FQ muestran resultados dispares. Pumariega y cols. objetivaron un 12 % de TCA en adolescentes con FQ (n = 108) durante el seguimiento en un período de 3 años (43). En cambio, otros autores arrojan tasas similares de TCA en presencia o ausencia de FQ (44-46). Sin embargo, hay que tener en cuenta la limitación de estos trabajos en cuanto al pequeño tamaño muestral y el empleo de distintas herramientas y criterios para el diagnóstico de los TCA. La presencia de un TCA en pacientes con FQ tiene el potencial de empeorar la situación respiratoria como consecuencia de la desnutrición (47).
Otros estudios evidencian una mayor tasa de conductas alimentarias patológicas que, sin llegar a cumplir criterios de un TCA, sí pueden suponer un riesgo para su aparición en el tiempo. Así, por ejemplo, en el estudio de Shearer y Bryon (44), donde solo un paciente de 55 cumplió los criterios del TCA no especificado, objetivó, por otro lado, que el 24 % de los pacientes tenían algún tipo de conducta alimentaria inapropiada, siendo la más común la restricción. Además, un paciente realizó un uso inadecuado de la terapia con enzimas pancreáticas para perder peso y el 15 % presentaron miedo al aumento ponderal (a pesar de que ninguno de los participantes presentaba sobrepeso u obesidad). Los autores ponen de manifiesto que la autoevaluación de sus pacientes estuvo influenciada por la forma y el peso corporal en un 36 y 53 %, respectivamente (44). En el estudio de Bryon y cols. (46), el 11 % de la muestra refirió miedo a ganar peso (a pesar de encontrarse en normopeso) y el 12 % de los pacientes con FQ con normopeso y el 8 % de los pacientes con IMC < 17,5 kg/m2 presentaron deseo de perder peso.
Son varios los potenciales factores de riesgo de aparición de un TCA reportados en la FQ (25):
− El retraso en el crecimiento y la pubertad retrasada.
− El bajo peso.
− La gravedad de la enfermedad.
− La preocupación por el manejo nutricional de la FQ (elevados requerimientos, necesidad de tratamiento con enzimas pancreáticas).
− La presión por mantener o conseguir un peso adecuado y ejercicio regular para mantener la función pulmonar.
− La presión de los padres durante las comidas.
− La alteración de la imagen corporal.
− La coexistencia de otros trastornos como la diabetes o la depresión.
No se han encontrado estudios relacionados específicamente con la prevención de los TCA en pacientes con FQ. Sin embargo, en las guías sobre manejo de la FQ de la European Cystic Fibrosis Society (ECFS) se especifica que el tratamiento nutricional debe tener en cuenta las actitudes del paciente hacia la alimentación para poder identificar precozmente un TCA (42).
ALTERACIONES MENSTRUALES
Las alteraciones menstruales, especialmente en mujeres jóvenes, son un motivo de consulta frecuente en la AE en el que se debe contemplar la posibilidad de un TCA subyacente. La amenorrea ha sido clásicamente un criterio diagnóstico de la AN y, aunque actualmente ya no se trata de una condición necesaria para establecer el diagnóstico (48), es un síntoma clínico casi constante en la AN. En la BN, hasta el 45 % de las pacientes presentan irregularidades menstruales a pesar de un IMC normal (49).
Se conoce desde hace tiempo que es necesario un nivel mínimo de grasa corporal para el adecuado funcionamiento del eje hipotálamo-hipófisis-ovario (50), siendo la desnutrición en sí misma una causa de amenorrea. Más aun, parece ser el déficit de energía (que puede ocurrir independientemente del peso corporal) el factor más relevante para la aparición de la amenorrea hipotalámica, tanto en la pérdida de peso como en el ejercicio (49,51). Además, existe una fuerte relación entre la presencia de vómitos frecuentes y la aparición de irregularidades menstruales en las adolescentes (52).
Las guías clínicas de manejo de la amenorrea hipotalámica recomiendan realizar una historia clínica detallada y dirigida a descartar un TCA como origen de la amenorrea (53): alimentación, conducta alimentaria, ejercicio, rasgos de personalidad como el perfeccionismo, necesidad de aprobación social, fluctuaciones de peso, estado anímico y antecedentes familiares generales y específicos de TCA.
No se han encontrado estudios relacionados específicamente con la prevención de los TCA en pacientes con alteraciones menstruales.
INFERTILIDAD
Conocida la elevada frecuencia de los TCA durante la edad reproductiva, no es raro que la infertilidad sea un motivo de consulta (54), más aun teniendo en cuenta la elevada prevalencia de la amenorrea en este colectivo. Además, la propia situación de infertilidad o su tratamiento pueden generar una serie de circunstancias (depresión, sentimientos de culpa, menor autoestima, ansiedad, ganancia de peso, etc.) que faciliten en las mujeres predispuestas el desarrollo de un TCA (55,56).
La prevalencia de los TCA en las mujeres con problemas de fertilidad es variable según las series, encontrándose cifras del 16,7 (57), 17 (58) y 20 % (59). Entre las mujeres no fértiles con amenorrea, el 58 % presentaban un TCA según un estudio (57). Es probable que muchas de estas pacientes pasen inadvertidas para el especialista que las lleva, habiéndose reportado que solo el 26 % de las pacientes comunican el antecedente de TCA a su médico (60). Cuando se les pregunta a las pacientes los motivos de no comunicar en la consulta prenatal la presencia de un TCA, los principales motivos se relacionan con el miedo a sentirse juzgadas por el profesional; la falta de oportunidad (porque no se pregunte activamente o porque no se tenga el mismo médico o matrona en todas las visitas y ello dificulte crear un vínculo y confianza); la preferencia por manejarse ellas mismas el trastorno; la ausencia de conciencia de enfermedad; y la minimización de los síntomas y su gravedad (60). Otra barrera importante en la identificación del TCA en este contexto viene dada por la escasa conciencia y conocimiento de esta entidad por parte de los profesionales (60-62). Abraham reporta que solo el 50 % de los obstetras interrogan de forma activa sobre la conducta alimentaria y las conductas de control del peso corporal (63). Es posible que la escasa referencia a los TCA en las distintas guías de práctica clínica sobre fertilidad haya contribuido a este hecho. Así, en las guías NICE de fertilidad actualizadas en 2017 no se mencionan los TCA (64). Únicamente aconsejan a aquellas mujeres con infertilidad por anovulación y con IMC > 30 kg/m2 que bajen de peso para mejorar la respuesta al tratamiento y tener un impacto positivo durante el embarazo; y a aquellas con IMC menor de 19 kg/m2 con irregularidades menstruales o amenorrea, que se les informe de que la ganancia de peso mejora las posibilidades de concepción (64). Las guías NICE de TCA, en relación a la fertilidad/concepción, recomiendan brindar asesoramiento a las mujeres con un TCA que planean concebir (esto incluye información sobre la importancia de mantener una buena salud mental, asegurar una ingesta adecuada de nutrientes y un peso corporal saludable, y no realizar conductas compensatorias) (65). Tampoco la Sociedad Española de Fertilidad hace referencia específica a los TCA en sus guías de estudio de la disfunción reproductiva (66).
Aunque aún no se refleja en los consensos, es creciente el número de publicaciones donde se recomienda el screening sistemático de los TCA en las mujeres que consultan por problemas de fertilidad (58,67-69). Paslakis y Zwaan recomiendan realizar screening de TCA a todas las mujeres que consulten por infertilidad con el EAT-8 y remitir a un profesional especialista en psiquiatría a aquellas con cribado positivo (sugieren un punto de corte de 3 puntos) y también a las que presenten un IMC menor de 18,5 kg/m2 (independientemente del cribado) (67). Otros autores recomiendan el SCOFF (del acrónimo inglés de sick, control, one fat food) como herramienta de cribado en general para las consultas de ginecología-obstetricia (68,69), aunque no se ha validado en esta población y podría no detectar los TCA subclínicos (69).
No se han encontrado estudios relacionados específicamente con la prevención de TCA en pacientes con infertilidad.
EMBARAZO
Alrededor del 7,5 % de las embarazadas presentan un TCA (70). La presencia de TCA en las gestantes se ha asociado a una mayor morbilidad tanto para la madre como para el feto (71) y tras el parto. Se ha descrito un mayor riesgo de hemorragia anteparto (72), hiperemesis gravídica (73), aborto (74), cesárea (75) y depresión posparto (75). Además, hay evidencia de un mayor riesgo de retraso del crecimiento intrauterino (72), tamaño pequeño para la edad gestacional (73,76) o grande para la edad gestacional (en pacientes con trastorno por atracón) (76), microcefalia (73), parto prematuro (76), hipertensión (en pacientes con trastorno por atracón) (76) y mortalidad perinatal (76).
Si bien es cierto que muchos trabajos reflejan que en la mayoría de mujeres el embarazo conlleva una mejoría de la gravedad del TCA (77,78), también está descrito el embarazo como factor “desencadenante” del inicio o empeoramiento de un trastorno alimentario (77). Tras el parto, la mejoría del TCA experimentada por algunas mujeres durante la gestación tiende a desaparecer para volver a la situación previa al embarazo (77).
En las mujeres embarazadas con TCA, las guías NICE de TCA recomiendan ofrecer tratamiento del TCA y asesoramiento sobre la alimentación saludable, y considerar una atención obstétrica más intensiva (65). Al igual que ocurría en las consultas de fertilidad, existe tendencia por parte de los expertos a recomendar un screening sistemático de los TCA en las gestantes, tanto en la consulta prenatal como a lo largo del embarazo y en el posparto (67-69). Paslakis y Zwaan recomiendan remitir a la paciente al especialista en psiquiatría tras un screening positivo con el EAT-8 y en caso de bajo peso o insuficiente ganancia ponderal a lo largo de la gestación (67). Otros expertos recomiendan realizar a las pacientes preguntas directas sobre el peso o las conductas para su control y el empleo de laxantes o vómitos (69), así como remitir a un especialista en TCA a todas aquellas mujeres con IMC < 18 kg/m2 (69). A lo largo de la gestación, el especialista debe estar atento a los posibles signos de alarma que sugieran un TCA, como: hiperemesis gravídica, falta de aumento de peso durante dos visitas prenatales consecutivas en el segundo trimestre, alteraciones electrolíticas sugestivas de abuso de laxantes/diuréticos, etc. (69).
No se han encontrado estudios relacionados específicamente con la prevención de los TCA durante la gestación o tras el parto.
ANÁLISIS DE DEBILIDADES, AMENAZAS, FORTALEZAS Y OPORTUNIDADES (DAFO)
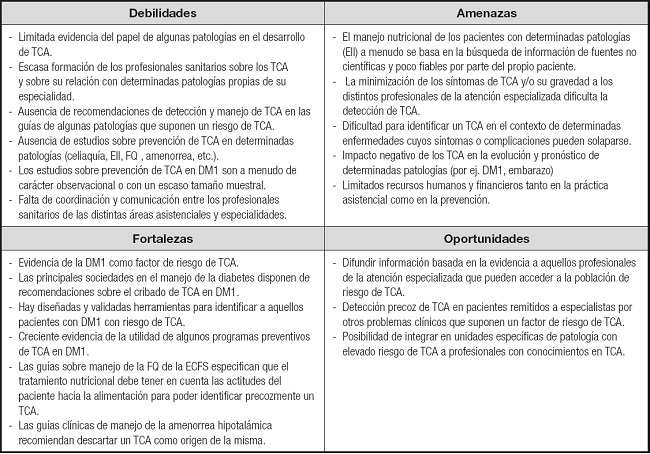
El análisis DAFO sobre la prevención de los TCA en la atención sanitaria especializada se muestra en la tabla I.
CONCLUSIÓN
Los principales factores de riesgo de TCA en relación a las patologías y situaciones clínicas descritas en este trabajo son a menudo complejos y de carácter multifactorial (Tabla II). Aunque la evidencia objetivada en relación a la prevención en este contexto es variable y a menudo escasa o inexistente según la entidad clínica estudiada, es importante conocer el riesgo de TCA que comportan las distintas enfermedades para así poder establecer estrategias de prevención y detección precoz de los TCA, y contribuir a un mejor pronóstico de estos pacientes.
Tabla II. Mensajes clave con respecto a los factores de riesgo de aparición de TCA en patologías atendidas en atención especializada y recomendaciones prácticas.
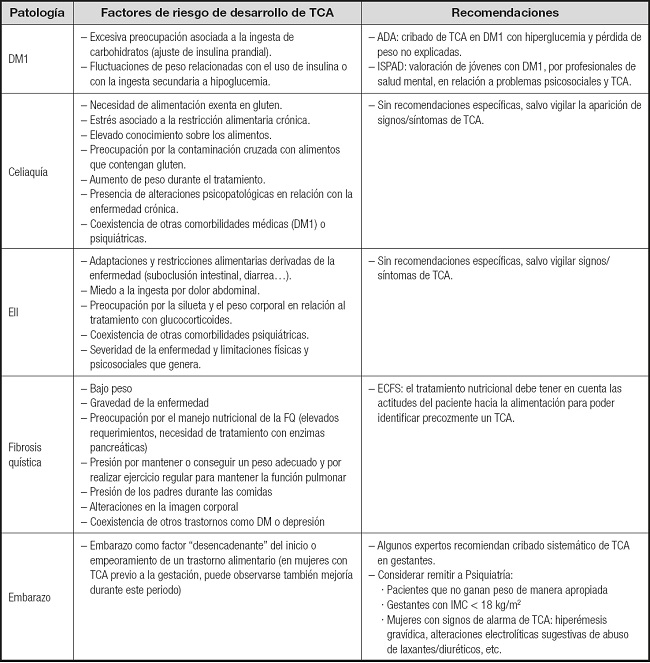
ADA: American Diabetes Association; ECFS: European Cystic Fibrosis Society; IMC: índice de masa corporal; ISPAD: International Society for Pediatric and Adolescent Diabetes; DM1: diabetes mellitus tipo 1; EII: enfermedad inflamatoria intestinal; TCA: trastornos de la conducta alimentaria.