INTRODUCCIÓN
La leucemia linfoide aguda (LLA) constituye el 25 % de los tumores y el 75-80 % de las leucemias en la edad pediátrica, con un pico de incidencia máximo entre los 1 y 4 años de edad (1). La evidencia actual describe un ligero predominio en los varones, sobre todo en la edad puberal, y en cuanto a la raza, la incidencia de la LLA es mayor en los individuos de raza blanca. Existen diferencias geográficas: en los países industrializados, la LLA de estirpe B es con diferencia la más frecuente de las hemopatías malignas, lo que se ha relacionado con la mayor exposición en estos países a determinados agentes medioambientales leucemógenos (principalmente, radiaciones ionizantes [1]). Gracias a la mejora de los tratamientos de la leucemia, la supervivencia de estos pacientes se ha incrementado notablemente en las últimas décadas, pasando de una supervivencia de menos del 10 % en los años sesenta a una supervivencia libre de enfermedad a 3 años que con los tratamientos actuales se aproxima, e incluso supera, el 90 % en los países más desarrollados (2).
El sobrepeso y la obesidad son condiciones frecuentes en los supervivientes de cáncer infantil, lo que está relacionado tanto con los tratamientos del cáncer como con la adquisición de factores de riesgo cardiovascular a lo largo de los años de supervivencia, al igual que los adquiere la población general (3,4). En los supervivientes de LLA infantil se asocian diferentes factores a dicho riesgo cardiovascular. Factores bioquímicos, como leptina, adiponectina y la existencia de resistencia periférica a la insulina (RI), se han analizado en estos pacientes, aunque sin encontrar asociaciones definitivas (5-8). Asimismo, la existencia de un aumento del grosor miointimal carotídeo (cIMT), que se considera un importante marcador estructural de riesgo cardiovascular, también se ha estudiado en esta población, sin encontrarse una relación significativa (9,10). Por otro lado, el desarrollo de un mayor número de eventos cardiovasculares es la consecuencia a largo plazo más frecuente en los supervivientes de LLA. A los 35 años, esta población tiene 10,9 veces más riesgo de presentar un evento cardiovascular que aquellos que no han padecido cáncer en la infancia (11). El objetivo de nuestro estudio es conocer los factores de riesgo cardiovascular, tanto bioquímicos como funcionales y estructurales, presentes en los supervivientes de la leucemia infantil, así como establecer las posibles relaciones entre estos y el tratamiento recibido.
MATERIAL Y MÉTODOS
La muestra se obtuvo a partir del registro de pacientes con enfermedades hematológicas del Servicio de Hematología del Hospital Universitario Central de Asturias. Se seleccionaron aquellos con diagnóstico de leucemia aguda entre los 6 y los 16 años de edad, desde 1998 a 2018, que habían superado la enfermedad y finalizado el tratamiento al menos en los dos años anteriores. Como criterios de exclusión se establecieron: 1) negación del consentimiento informado; 2) presentación de eventos cardiovasculares (fallo cardiaco, necesidad de oxigenación por membrana extracorpórea o transplante, etc.) durante el tratamiento de la enfermedad; 3) presencia de cualquier enfermedad previa al diagnóstico de leucemia aguda que afectase a los sistemas cardiovascular, renal y hepático.
A cada paciente se le realizó una evaluación somatométrica, una extracción analítica, una medición del cIMT mediante ecografía y estudio de composición corporal mediante bioimpedancia eléctrica. Se revisó en su historial el tipo de tratamiento recibido, incidiendo en la recepción de radioterapia y corticoterapia.
EVALUACIÓN SOMATOMÉTRICA
Se midieron el peso y la talla, con el paciente descalzo y vistiendo ropa ligera, mediante una báscula marca TANITA con precisión de 0,1 kg, y un estadiómetro de pared marca SECA, modelo 264, con precisión de 0,1 cm. Se calcularon los valores de la puntuación z para cada caso individual según los estándares de referencia nacionales. A partir de las mediciones obtenidas se calculó el índice de masa corporal (IMC), el cual se estandarizó también según las referencias poblacionales de España en 2010. Nos servimos de estos datos para la definición de sobrepeso y obesidad, según se muestra en la tabla I. Se midieron los perímetros de cintura y cadera con el paciente de pie, con los pies juntos y los miembros superiores al costado del tronco, con el abdomen desnudo y relajado, en bipedestación y durante la espiración, con una cinta métrica flexible a nivel de la porción media existente entre la última costilla y la cresta ilíaca, así como a nivel de los trocánteres mayores de la cabeza del fémur, respectivamente. A partir de estas mediciones se calcularon los índices cintura/altura (ICA) y cintura/cadera (ICC), los cuales son indicativos de riesgo cardiovascular en caso de valores superiores a 0,5 para ICA, y valores superiorres o iguales a 0,9 en hombres, y 0,85 en mujeres para ICC.
NIVELES SANGUÍNEOS DE LEPTINA Y ADIPONECTINA
Se realizó una extracción sanguínea por vía periférica tras 12 horas de ayuno, y un análisis por técnicas de ELISA a partir de las muestras de suero. A posteriori se calculó el cociente leptina/adinonectina.
RESISTENCIA INSULÍNICA
Definida en nuestra población por un índice Homeostasis Model Assesment (HOMA) > 3, calculado a partir de la fórmula: RI = (glucemia basal en ayunas x insulina) / 405, donde la glucemia se expresa en mg/dL y la insulina en mU/L.
EVALUACIÓN ECOGRÁFICA
Realizada con un ecógrafo Philips modelo EPIQ 7 con sondas lineales para la evaluación del cIMT. Con el paciente en decúbito supino y la cabeza en ligera extensón, se tomaron tres mediciones de ambas carótidas comunes, a 1 cm de la bifurcación carotídea, reflejándose como valor del estudio la media de los valores obtenidos.
ESTUDIO DE COMPOSICIÓN CORPORAL
Se realizó mediante análisis de bioimpedancia eléctrica (BIA) con un monitor modelo AKERN 101 (Akern, Monachiello, Pisa). El estudio se efectuó en una camilla con el participante en decúbito supino, con los brazos separados del tronco aproximadamente 30° y las piernas separadas 45°. Se colocaron 4 electrodos (Biatrodes, Akern) en las extremidades, dos en la mano derecha y otros dos en el pie derecho, con una separación entre ambos de 4-5 centímetros. Estos adhesivos, conectados por cables al aparato, proporcionan los datos de resistencia (Rz) y reactancia (Xc). Estos, junto con peso, talla, edad, género, etnia y actividad física del paciente, se introdujeronn en el programa informático del dispositivo (Bodygram plus), registrándose los valores de masa grasa y masa magra obtenidos.
ANÁLISIS ESTADÍSTICO
A partir de los datos obtenidos se realizó un análisis descriptivo, proporcionando distribuciones de frecuencias relativas y absolutas para las variables cualitativas, y medidas de posición y dispersión para las cuantitativas. Las diferencias de variables cuantitativas entre dos grupos se estudiaron con el test de la t de Student o el de Wilcoxon para muestras independientes, en función del cumplimiento de la hipótesis de normalidad. Si los grupos eran 3 o más, se aplicó el test ANOVA previa verificación de la normalidad y homocedasticidad. El estudio de correlación entre dos variables cuantitativas se valoró con el coeficiente y test de correlación de Pearson o de Spearman, en función de que las variables se ajustasen o no a una distribución normal. Se contruyeron de forma univariante y multivariante modelos lineales para identificar los factores asociados a leptina, adiponectina, cIMT y homocisteína. El nivel de significación empleado fue de 0,05. El análisis estadístico se efectuó mediante el programa R (R Development Core Team), versión 3.6.3.
RESULTADOS
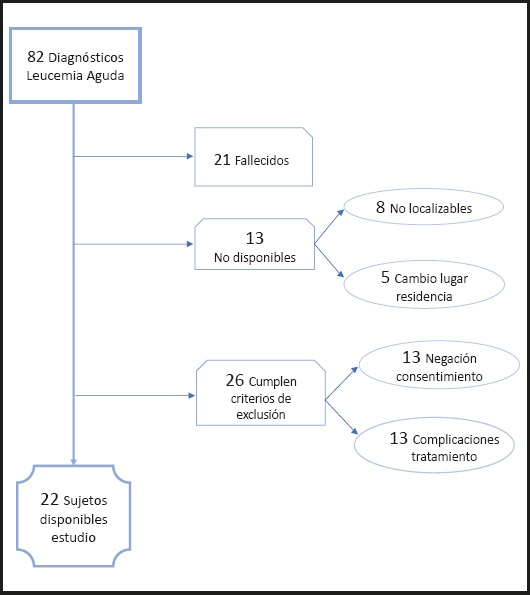
En los últimos 20 años, en el Hospital Universitario Central de Asturias se registraron 82 niños con diagnóstico de leucemia aguda a una edad entre los 6 y 16 años. De esta muestra, únicamente 22 pacientes pudieron ser evaluados, distribuyéndose los 60 pacientes restantes según se reproduce en el siguiente diagrama de flujo (Fig. 1).
Los sujetos de nuestro estudio tenían, en el momento de la evaluación, una edad media de 19 años y 5 meses (rango: 12,5 a 30 años). La edad media a la que los pacientes finalizaron el tratamiento fue de 9 años y dos meses (DE: 4 años) y el tiempo medio que había pasado desde entonces hasta el momento del estudio fue de 7,05 años (DE: 4,65 años). Distribuídos por sexos, nuestro estudio está conformado por 14 hombres y 8 mujeres.
Con respecto al diagnóstico de la enfermedad, prácticamente todos los casos fueron diagnosticados de LLA. Únicamente un paciente había padecido leucemia mieloide aguda (LMA) y tres pertenecían al grupo de las leucemias promielocíticas (LPM). Cabe destacar un caso de LLA con cromosoma Philadelphia positivo. El 45 % de los casos se incluyeron en protocolos de riesgo intermedio y el 18 % en protocolos de alto riesgo, correspondiendo el resto a un bajo riesgo.
Tras su evaluación somatométrica, el 16 % de los sujetos que conforman la muestra se etiquetaron de sobrepeso y otro 16 % alcanzaban criterios de obesidad; dos tercios de los sujetos estudiados presentaban normopeso.
Se encontraron ocho individuos (el 36 % de la muestra) con RI, de los cuales solamente dos eran mujeres, y todos menos uno eran menores de 18 años al momento de la evaluación. En nuestra muestra, el valor de HOMA-IR en el p75 fue de 3,76. Más de la mitad (5/8) tenían normopeso. Aquellos supervivientes con RI presentaban una ratio leptina/adiponectina significativamente más alta que la de aquellos sin RI (2,52 vs. 0,45; p = 0,037), situándose el p75 en 1,43.
Con respecto a los niveles de leptina, se ha analizado si su comportamiento difiere en función de otras variables, encontrándose diferencias significativas según el sexo, de forma que las mujeres presentan valores significativamente más altos (Tabla II). También con la presencia de obesidad y sobrepeso. Aunque se encuentran valores de leptina marcadamente superiores en los sujetos con RI, esta relación no alcanza la significación estadística. No se han encontrado tampoco diferencias estadísticamente significativas con respecto al tratamiento recibido con radioterapia craneal o corticoterapia. Se construyeron modelos lineales con el fin de identificar variables asociadas a la leptina. Se aplica un método de selección paso a paso, resultando en el modelo final que, a mayor IMC, aumenta el valor de leptina (Tabla III).
Tabla II. Variables somatométricas y clínico-analíticas.
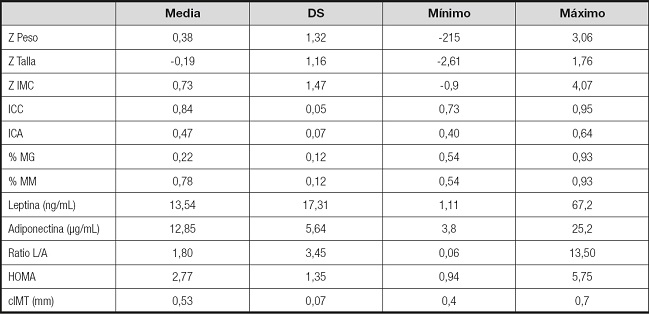
Estadísticos descriptivos. Z Peso: puntuación estandarizada segun sexo y edad para la variable peso; Z Talla: puntuación estandarizada segun sexo y edad para la variable talla; Z IMC: puntuación estandarizada segun sexo y edad para la variable índice de masa corporal; % MG: masa grasa corporal en porcentaje; % MM: masa magra corporal en porcentaje; Ratio L/A: ratio leptina/adiponectina; HOMA: índice Homeostasis Model Assesment; cIMT: espesor mediointimal carotídeo..
En relación a los niveles de adiponectina, no se han encontrado diferencias estadísticamente significativas con respecto a la RI, el haber recibido tratamiento con radioterapia craneal o la corticoterapia. A diferencia de la leptina, tampoco se han encontrado diferencias con respecto al sexo y la presencia de obesidad. Solo el IMC parece asociarse de forma significativa a la adiponectina (Tabla III), aunque dicha significación desaparece al ajustar por el resto de variables en el modelo multivariante (Tabla IV).
Tabla III. Análisis del comportamiento de adipokinas y cIMT entre los distintos grupos de una misma variable para HOMA, sexo, tratamiento corticoideo, presencia de radioterapia y peso. Se detallan para los grupos definidos por variables cualitativas la media (desviación típica) en la aplicación de test paramétricos y la mediana (recorrido intercuartílico) en el supuesto no paramétrico.
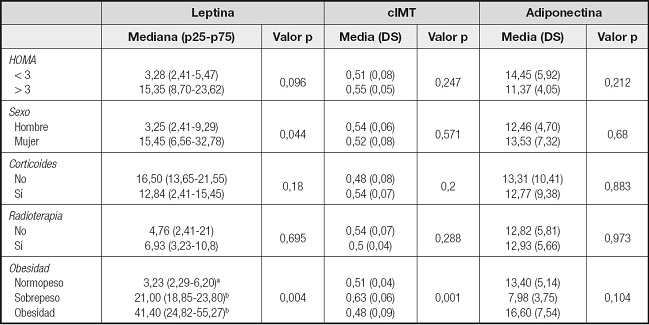
cIMT: grosor mediointimal carotideo.
a-bDiferente letra indica diferencia significativa (p < 0,05).
Tabla IV. Modelos de regresión, univariantes y multivariante, tanto para leptina como para grosor mediointimal carotídeo y adinopectina.
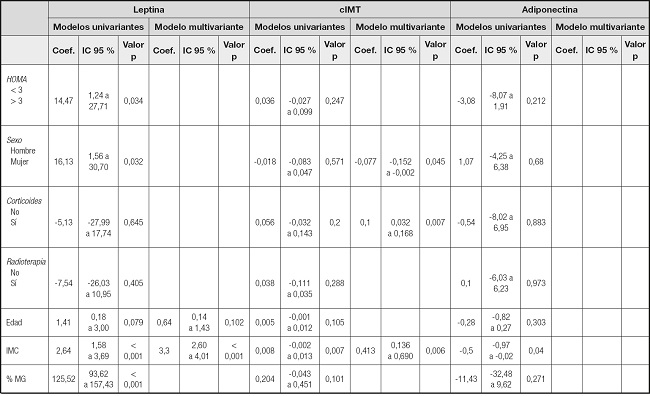
Coef.: coeficiente; cIMT: grosor mediointimal carotídeo; IMC: índice de masa corporal; % MG: masa grasa en porcentaje.
Aplicado el mismo estudio con el cIMT, únicamente se han encontrado diferencias significativas con respecto a la presencia de obesidad (Tabla III). Se ha analizado si su comportamiento difiere en función de otras variables, encontrándose diferencias significativas según la presencia de obesidad y sobrepeso. Se construyeron modelos lineales con el fin de identificar variables asociadas al cIMT. Se aplica un método de selección paso a paso, resultando en el modelo final que al aumentar la proporción de masa grasa corporal aumenta el valor de cIMT, al igual que ocurre con la toma de corticoides, mientras que ser mujer se asocia con una disminución de dicho índice. Se incluyen otras variables en el modelo final sin alcanzar significación estadística (Tabla IV).
DISCUSIÓN
Nuestro estudio aporta nuevas evidencias de las alteraciones del metabolismo hidrocarbonado, así como de la disfunción secretora del tejido adiposo y las células endoteliales en individuos supervivientes de leucemia en edad pediátrica. Su interés radica en ser una fuente de datos de una población escasamente estudiada, como es la edad infantojuvenil, sin claros valores de referencia establecidos en cuanto a adipokinas, RI o cIMT. Todo esto ayuda a entender el elevado riesgo cardiovascular de este tipo de pacientes y pretende enfatizar el mantenimiento de estrategias de control y vigilancia de la salud que ayuden a contener la evolución de dicho riesgo en accidentes cardíacos y cerebrovasculares.
Sobrepeso y obesidad son ya condiciones habituales en nuestro entorno pediátrico (12) y se han asumido por parte de la ciudadanía como normales, a pesar del alto riesgo que entrañan. Sin embargo, no está tan asumido que los niños con normopeso puedan tener factores de riesgo cardiovascular ya presentes a edades muy tempranas y capaces de deteminar un futuro adverso (13,14). Esto se acentúa en el caso de determinadas patologías, como en el caso que nos ocupa: los supervivientes de leucemia aguda infantil. Factores como la exposición a corticoides, la radioterapia, la predisposición genética o el sexo femenino favorecen la acumulación en exceso de grasa corporal (15).
Otros factores relacionados con la obesidad en estos pacientes son el descenso de los niveles de somatotropina y el aumento de la resistencia a la leptina (16). En nuestra muestra, un tercio de los evaluados se etiquetaron de sobrepeso/obesidad y un 36 % presentaban resistencia insulínica. Entre los individuos con RI, más de la mitad tenían normopeso y no se encontraron diferencias entre sexos.
Entre los supervivientes de LA infantil, la evidencia disponible revela datos de RI en parte independientes del índice de masa corporal (6), encontrándose un índice HOMA elevado en pacientes sin sobrepeso ni obesidad. Hay estudios que demuestran una correlación positiva entre el índice HOMA y la ratio leptina/adiponectina (L/A) (19-21), y algunos autores defienden que obtienen valores más elevados en aquellos pacientes que habían sido expuestos a radioterapia craneal (6,21,22). Los resultados de nuestro estudio están alineados con los mostrados por la publicación de Tonorezos y cols. (6), de forma que podemos decir que también observamos datos de RI en parte independientes del IMC, sugiriendo en estos pacientes sin sobrepeso ni obesidad la implicación de otros mecanismos en la generación de la misma. Además, encontramos una correlación positiva entre la ratio L/A y la elevación del índice HOMA, aunque en nuestro estudio no conseguimos alcanzar la significación estadística, quizás por lo limitado de la muestra. En esta relación no encontramos diferencias en función de la historia de radioterapia craneal y tampoco entre los sexos.
La adiponectina es una adipokina implicada en la regulación del metabolismo de los hidratos de carbono de forma independiente del grado de adiposidad (14). Su deficiencia genética se asocia al desarrollo de RI, mientras que su administración a modelos experimentales aumenta la sensibilidad a la acción de la insulina. Cifras inferiores a 7 ng/mL se relacionan con la presencia de síndrome metabólico (23). Cuando hay un diagnóstico de leucemia se observa que los niveles de adiponectina son bajos, y son numerosos los estudios que han planteado el rol que esto puede tener en el desarrollo de la misma (24,25). Entre los supervivientes, los niveles de adiponectina se encuentran generalmente descendidos, lo cual se relaciona más con la presencia de resistencia insulínica y obesidad que con las secuelas de la propia enfermedad. En nuestro estudio no hemos logrado encontrar asociación significativa alguna en relación a la sensibilidad a la insulina, el sexo, la composición corporal o el tratamiento recibido. La relación entre niveles de adiponectina a largo plazo y el tratamiento con radioterapia craneal (CRT) es controvertida; mientras unos estudios muestran niveles bajos de adiponectina en relación con la CRT (6), otros los descartan (5).
La leptina es una adipokina proinflamatoria sintetizada y secretada casi de forma exclusiva por el tejido adiposo. Presenta secreción pulsátil y acción sobre el hipotálamo, determina nuestro comportamiento alimentario, regula el gasto energético y la termogénesis, y tiene un papel importante en la homeostasis del metabolismo de la glucosa y los lípidos (17). Sus niveles (ajustado el IMC) son mayores en mujeres que en hombres y se elevan exponencialmente en los estados de obesidad (26). En la población adulta española, los valores medios de leptina en el año 2010, en el p75, fueron de 14,3 ng/ml en los varones y 37 ng/ml en las mujeres (27). Según la bibliografía consultada, cifras superiores a 14 ng/mL se relacionan con la presencia de síndrome metabólico (23). En relación a la leucemia, se ha observado que las mujeres supervivientes a esta patología presentan leptinemias más elevadas, incluso a largo plazo, tras finalizar el tratamiento; en esta población, el sexo femenino es factor de riesgo para la elevación de los niveles de leptina (8,29). Este hallazgo se ha atribuido en mayor medida a la elevación del IMC y al sexo femenino más que al tratamiento recibido (28). Resultados acordes encontramos en nuestro estudio, en el cual las mujeres presentan, con respecto a los varones, mayores valores de leptina; lo mismo ocurre en presencia de obesidad y sobrepeso con respecto a los individuos con normopeso. Se ha prestado especial atención a la radioterapia intracraneal, la cual se ha postulado como factor para la resistencia a la leptina debido al daño hipotalámico producido por la radiación (6,29,30). Sin embargo, otros estudios sugieren niveles elevados de leptina, incluso más de un año después del tratamiento, tanto en hombres como en mujeres, y tanto en aquellos que han recibido radioterapia intracraneal como en aquellos que no la han recibido (31). En nuestro estudio no hemos encontrado diferencias estadísticamente significativas con respecto a la presencia o no de resistencia insulínica, o a haber recibido tratamiento con radioterapia craneal, al contrario que lo descrito en los estudios de Karaman (29) o Jahnukainen (30). Nuestro modelo lineal predice un aumento de la leptina a mayor IMC, y un descenso de valores de la misma según aumenta el gasto energético en reposo. En el modelo univariante se aprecia relación entre la masa grasa corporal y los niveles de esta adipoquina, relación que se pierde al ajustar el resto de variables; esto estaría también en consonancia con la bibliografía consultada (21). Lo que parece estar claro es que, de alguna manera, la propia leucemia o su tratamiento parecen generar una resistencia central a la leptina, de forma que estos sujetos almacenan energía de forma inapropiada, ayudando a explicar los cambios de composición corporal y de RI que sufren a largo plazo los supervivientes de leucemia (6).
El cIMT, establecido en los últimos años como marcador de riesgo cardiovascular, evalúa la aterosclerosis subclínica de forma precoz y no invasiva. Estudios recientes no han encontrado diferencias en cuanto al cIMT entre pacientes jóvenes supervivientes de LLA y controles sanos (10,32). Esto se explica porque el cIMT demuestra alteraciones morfológicas mientras que la disfunción endotelial, que es uno de los primeros componentes de la aterosclerosis, precisa de un daño mantenido en el tiempo para que se materialice en alteraciones de la pared de los vasos. Los incrementos del cIMT en los primeros años de la edad adulta deben interpretarse con cautela, ya que se ha descrito un remodelado arterial en respuesta al aumento de la masa magra y la presión arterial correspondientes a la adolescencia y el crecimiento en adultos jóvenes. Además, la exposición continuada a dislipemias, inflamación y otros factores de riesgo cardiovascular podría ser crítica en el desarrollo de daño arterial en la edad adulta posterior (34,35). En nuestro estudio, únicamente hemos encontrado diferencias significativas con respecto a la presencia de obesidad y sobrepeso. Ni el sexo ni la presencia de RI se han podido relacionar de forma significativa con valores aumentados de cIMT, lo que puede en parte explicarse por el limitado tamaño de la muestra. Con respecto al uso de radioterapia, esta no parece ser un factor influyente en el aumento del cIMT. En esta línea, nuestro estudio es uno más para intentar resolver la controversia existente en este momento (9,28,32).
Como fortaleza de este estudio destaca la amplia evaluación multifactorial de sus integrantes, la cual abarca aspectos bioquímicos, estructurales y de composición corporal que, integrados en conjunto en una misma muestra, no se han investigado hasta la fecha en esta población. La principal limitación es el tamaño muestral, así como la complejidad de su análisis debido a la diversidad de la muestra, lo cual puede disminuir su potencia por la presencia de pacientes en distintos tramos etarios y con particularidades propias. Cabe mencionar además las dificultades de interpretación por falta de estudios previos con datos de referencia en la población infantojuvenil y la escasa bibliografía disponible.