INTRODUCCIÓN
Según el último informe de Global Cancer Statistics (1), el cáncer es una de las enfermedades más prevalentes en todo el mundo y su incidencia continúa aumentando rápidamente. Se ha estimado que en el año 2020 se diagnosticaron aproximadamente 19,3 millones nuevos casos de cáncer, lo que supone que aproximadamente 125.000 personas son diagnosticadas de cáncer cada día (8,7 personas cada minuto). Estudios previos han sugerido que la diabetes es una comorbilidad frecuente entre los pacientes con cáncer (2), lo que puede deberse a varias razones. Por ejemplo, el cáncer y la diabetes comparten factores de riesgo comunes, como la edad avanzada, el tabaquismo, la obesidad, hábitos dietéticos poco saludables, la inactividad física y un mayor consumo de alcohol (3). Los pacientes con diabetes tienen un mayor riesgo de ciertos tipos de cáncer, como el cáncer de mama y el cáncer colorrectal, y se ha objetivado el doble de incidencia de cáncer de hígado, páncreas y endometrio (4).
En la enfermedad oncológica, la presencia de caquexia tumoral representa un factor de mal pronóstico. Aproximadamente entre el 50 y el 80 % de los pacientes con cáncer tienen diversos grados de caquexia, y la proporción es aún mayor entre los pacientes con estadios avanzados (5). Los pacientes con caquexia por cáncer tienen un mayor riesgo de muerte, especialmente aquellos con caquexia refractaria, que es responsable de más de una quinta parte de todas las muertes por cáncer (6). La caquexia tumoral se desarrolla como una enfermedad secundaria que causa una disfunción progresiva, caracterizada por una respuesta inflamatoria sistémica, balance proteico-energético negativo y pérdida involuntaria de masa corporal magra, con o sin disminución del tejido adiposo (7). Clínicamente, la caquexia se manifiesta como una reducción significativa del peso corporal, acompañado de cambios en la composición corporal y alteraciones en el equilibrio del sistema biológico. Los criterios diagnósticos de caquexia incluyen una pérdida de más del 5 % del peso corporal en los 6 meses previos, o entre el 2-5 % con IMC < 20 kg/m2, o reducción de la masa muscular. La disminución de la masa muscular esquelética es el síntoma más evidente de la caquexia tumoral, y se acompaña de la disminución de la grasa y del músculo cardíaco. El síndrome caquéctico se clasifica en tres estadios (Fig. 1): precaquexia, caquexia y caquexia refractaria, según el grado de reducción de las reservas de energía y proteínas corporales o el índice de masa corporal, junto con el porcentaje de pérdida de peso (8). Los estadios de la caquexia y la cantidad de pérdida de peso están directamente relacionados con la supervivencia de pacientes con cáncer (6). No todos los pacientes progresan a través de los 3 estadios.
Los pacientes con cáncer tienen un riesgo particularmente alto de desnutrición porque tanto la enfermedad como sus tratamientos pueden impactar negativamente en su estado nutricional (9). Los problemas nutricionales de los pacientes con cáncer deben considerarse como un continuo, desde los primeros signos y síntomas de anorexia hasta la precaquexia, caquexia y caquexia refractaria. Se sabe que la eficacia y el impacto de cualquier intervención nutricional están relacionados con el momento del soporte, obteniéndose los mejores resultados con una intervención temprana (10). El estadio del tumor, su localización, el tipo de terapia y las comorbilidades van a influir en las necesidades nutricionales del paciente, por lo que se pueden adaptar las intervenciones nutricionales de acuerdo con el riesgo existente de cada paciente. Por este motivo, es esencial la creación de protocolos multidisciplinares en los que se aborde desde el cribado nutricional hasta el manejo terapéutico de los pacientes oncológicos con desnutrición o riesgo de desarrollarla (11). En caso de diabetes concomitante, el manejo debe incluir un control glucémico adecuado, ya que la glucemia no controlada durante el tratamiento del cáncer es un factor que contribuye a peores resultados oncológicos (12,13) y peor calidad de vida (14).
A continuación, se presentan los resultados del consenso de expertos y las respuestas de los panelistas sobre el manejo nutricional en la práctica clínica habitual de los pacientes con diabetes/hiperglucemia hospitalizados en planta (no críticos) con caquexia tumoral.
RESULTADOS
FACTORES DE RIESGO Y CRIBADO DE LA DESNUTRICIÓN
Casi la totalidad de los panelistas (97,8 %) indicaron que, según su experiencia, es frecuente que el paciente con diabetes/hiperglucemia y caquexia tumoral presente desnutrición o riesgo de desnutrición. En la tabla I se muestran las recomendaciones consensuadas por el comité de expertos sobre los factores de riesgo relacionados con la caquexia tumoral en pacientes con diabetes/hiperglucemia y el cribado de la desnutrición, y las respuestas de los panelistas a cada afirmación. Los expertos consensuaron la idoneidad de establecer la gravedad de la caquexia en base a la pérdida de peso, incluyendo precaquexia y caquexia refractaria. Para ello, se tendrá en cuenta la localización del tumor y el estadio tumoral, el estado funcional según la escala ECOG (del inglés, Eastern Cooperative Oncology Group) (15) y las posibilidades terapéuticas de intervención. El 89 % de los panelistas manifestó que establecía la gravedad de la caquexia en base a la pérdida de peso en este tipo de pacientes. Tanto los expertos como la gran mayoría de los panelistas reconocieron que la obesidad/sobrepeso puede enmascarar la pérdida de peso en pacientes que inician una precaquexia/caquexia tumoral. En general, tanto la presencia de hiperglucemia como la variabilidad de la glucosa durante la hospitalización fueron consideradas como factor pronóstico adverso.
REQUERIMIENTOS DE ENERGÍA Y NUTRIENTES
Los expertos recomendaron calcular el aporte energético inicial del paciente con diabetes/hiperglucemia y caquexia tumoral teniendo en cuenta el riesgo de síndrome de realimentación; los panelistas así lo hacían en el 72,2 % de los casos (Tabla II). Los requerimientos calóricos y proteicos, según la práctica clínica de los panelistas, coincidieron en general con los recomendados por los expertos, aunque en el caso de insuficiencia renal, los panelistas mostraron cierta variabilidad en la elección de los requerimientos proteicos.
Tabla II. Comparativa de la atención óptima según las recomendaciones de los expertos y la práctica clínica habitual de los panelistas en relación con los requerimientos energéticos y nutricionales.
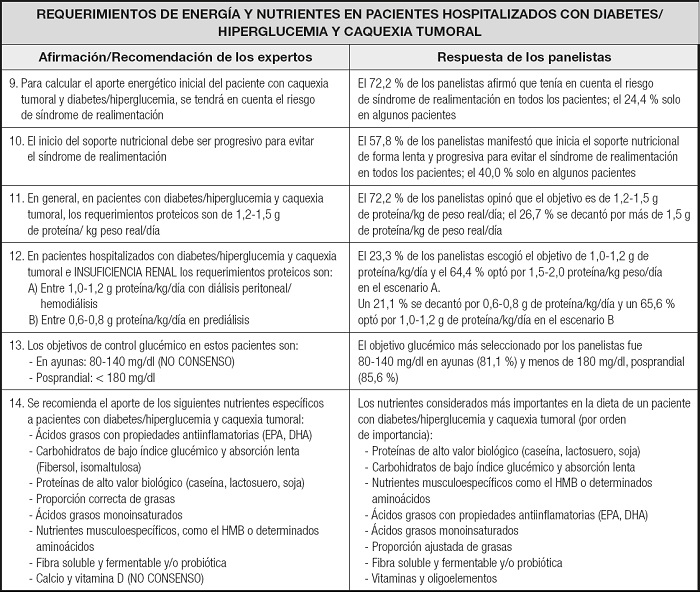
DHA: ácido docosahexaenoico; EPA: ácido eicosapentaenoico; HMB: hidroximetilbutirato.
No hubo consenso entre los expertos en el objetivo glucémico en ayunas, aunque sí consensuaron el objetivo de glucemia posprandial en < 180 mg/dl; la opinión predominante entre los panelistas fue coincidente con la recomendación. En general, los expertos y los panelistas coincidieron en los nutrientes más importantes que hay aportar en la dieta de los pacientes desnutridos con diabetes/hiperglucemia y caquexia tumoral (carbohidratos de absorción lenta, nutrientes musculoespecíficos como el hidroximetilbutirato).
PLAN DE CUIDADO NUTRICIONAL (ORAL Y POR SONDA)
Los expertos recomendaron establecer una dieta adaptada desde el ingreso del paciente, con buena saborización y de fácil ingesta, y adaptada en temperatura en presencia de mucositis (Tabla III). El 77 % de los panelistas informó de que siempre aplicaba esta medida, dándole la mayor importancia al enriquecimiento proteico. Hubo coincidencia entre los expertos y los panelistas sobre la idoneidad de la suplementación nutricional oral específica para diabetes en estos pacientes, recomendando las fórmulas poliméricas, hipercalóricas e hiperproteicas ESPECÍFICAS PARA DIABETES, para obtener el mejor control glucémico. La nutrición enteral por sonda estaría indicada cuando no se cubre el 60 % de los requerimientos nutricionales mediante la dieta oral suplementada.
DISCUSIÓN
La caquexia tumoral es una de las principales causas de mal pronóstico en pacientes con cáncer, por lo que, para reducir la morbimortalidad asociada y mejorar la calidad de vida, es imperativo identificar posibles marcadores pronósticos que puedan estratificar a los pacientes (16). Generalmente, la caquexia tumoral se diagnostica en etapas avanzadas de la enfermedad, pero puede surgir en cualquier fase de la progresión del cáncer. Menos del 5 % de pérdida de peso involuntaria, junto con anorexia e intolerancia a la glucosa se conoce como etapa precaquexia.
Sin embargo, la caquexia consiste en una pérdida de peso involuntaria > 5 % en seis meses, que no puede revertirse por completo con soporte nutricional convencional. Finalmente, en la caquexia refractaria, debido a un mayor catabolismo activo, el manejo de la pérdida de peso es difícil. Por lo tanto, se debe monitorizar de forma regular la pérdida de peso para la detección temprana de los síntomas de caquexia, lo que permitiría tomar decisiones de tratamiento oportunas. En pacientes obesos, la evaluación de la masa muscular magra frente a la pérdida de peso corporal es esencial para el diagnóstico adecuado de la caquexia. La pérdida de peso en pacientes con sobrepeso/obesidad puede pasarse por alto porque los pacientes pueden parecer bien nutridos; sin embargo, podría existir una sarcopenia grave inadvertida como consecuencia de la caquexia tumoral (17).
Actualmente, la detección y el seguimiento de la degradación muscular requiere pruebas validadas de análisis de composición corporal. La bioimpedanciometría, especialmente como análisis vectorial, o la ecografía muscular (sobre todo del recto anterior del muslo) son herramientas en auge para medir la masa magra (18,19), y se ha objetivado que la primera de ellas puede ser indicador pronóstico en el cáncer de mama, colorrectal y pancreático avanzado (20-22). Por otro lado, se ha propuesto la utilización de la prueba de fuerza de agarre como una herramienta sencilla para la evaluación de la función del paciente, de manera que podría ayudar en la detección temprana de la caquexia, asociada incluso con la supervivencia (23).
Otros factores de mal pronóstico en pacientes desnutridos con caquexia tumoral, tal y como indicaron los expertos y los panelistas, son la hiperglucemia (mantenida) y la variabilidad glucémica durante la hospitalización. Existen dudas en torno a la hiperglucemia en el momento del ingreso, ya que puede ser más un indicador de morbilidad aguda que de control glucémico (24). Debido a la insulinorresistencia asociada a la caquexia (25), que se puede sumar a la inherente por la diabetes, mantener o alcanzar los objetivos glucémicos puede ser difícil durante la hospitalización. Además, la diabetes recibe menos atención de la habitual durante el tratamiento activo del cáncer porque los pacientes y los profesionales sanitarios pueden priorizar la enfermedad oncológica sobre otras enfermedades crónicas, lo que repercute negativamente en los resultados (26,27). Un adecuado plan de cuidado nutricional es, por tanto, fundamental, con el establecimiento de una dieta adaptada a cada paciente según sus comorbilidades, localización del tumor y síntomas que puedan influir en la ingesta, y siempre teniendo en cuenta el riesgo de síndrome de realimentación (28).
El asesoramiento dietético y un soporte nutricional específico tienen el potencial de mantener la masa muscular o incluso revertir la pérdida de peso en pacientes con cáncer (29,30). Por ejemplo, se ha visto que los suplementos nutricionales pueden mejorar el peso, la capacidad de ejercicio y la masa corporal magra en estos pacientes (31,32). Los ácidos grasos omega-3, ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA) tienen potencial para revertir la caquexia del cáncer (33), y también se ha comunicado que mejoran la sensibilidad a la insulina, en estudios con animales y humanos, mediante la modulación del metabolismo de los lípidos, la estimulación de biogénesis mitocondrial y la alteración del patrón de adipocinas secretadas (34). Una revisión sistemática con metaanálisis de 11 ensayos controlados y aleatorizados (n = 1 350) demostró que el consumo de SNO con alto contenido de proteínas y enriquecido con ácidos grasos omega-3 se asoció con un aumento del peso corporal, una menor pérdida de masa magra y una mejora en la calidad de vida de pacientes que recibían quimioterapia (35). Las fórmulas de SNO que incluyen el aminoácido β-hidroxi- β-metilbutirato han demostrado también mejorar la masa muscular en pacientes desnutridos (36).
El ejercicio aeróbico moderado se ha propuesto como una opción de tratamiento no farmacológico para la caquexia tumoral que puede prevenir la pérdida de masa muscular (37); sin embargo, el cumplimiento en pacientes frágiles puede ser problemático. En pacientes obesos/diabéticos tipo 2, se ha demostrado que el ejercicio aeróbico moderado reduce la inflamación de bajo grado (38). La terapia multimodal es la combinación de dos o más intervenciones diseñadas para mejorar resultados específicos. A pesar de la falta de guías para tratar la caquexia, la evidencia indica que una terapia multimodal que incluya asesoramiento nutricional y SNO para promover el equilibrio de proteínas y energía, con aporte de EPA y medicamentos antiinflamatorios no esteroideos para reducir la inflamación y ejercicio de resistencia moderado para aumentar el anabolismo, podría mejorar los resultados (9,39,40). Este tipo de intervención multimodal es factible, segura y está asociada con mejoras en el peso y el estado nutricional, el rendimiento físico y la gravedad de los síntomas, y puede ser beneficiosa para los pacientes con caquexia y cánceres avanzados (41,42). En el caso de pacientes con diabetes/hiperglucemia, la administración de fórmulas específicas para la diabetes puede ayudar a mantener los objetivos glucémicos (43). Tanto los expertos como los panelistas indicaron que las fórmulas debían ser, en general, hiperproteicas e hipercalóricas en este contexto.
En conclusión, debido a las implicaciones pronósticas de la desnutrición y la caquexia en la tolerancia al tratamiento, la calidad de vida y la supervivencia, se debe realizar un cribado y evaluación nutricional tempranos en todos los pacientes con cáncer que necesiten hospitalización, pero especialmente en aquellos afectados por tumores que impidan la ingesta o la digestión adecuadas. Un abordaje centrado en el paciente puede mejorar el estado nutricional, la calidad de vida y los resultados oncológicos de los pacientes con diabetes/hiperglucemia que experimentan caquexia tumoral.

















