INTRODUCCIÓN
La anemia se define como una afección en la que la concentración de hemoglobina (Hb) y/o el número de glóbulos rojos (RBC) son inferiores a lo normal e insuficientes para satisfacer las necesidades fisiológicas de un individuo (1). Una de las causas de la anemia nutricional es que la cantidad de hierro absorbida es insuficiente para satisfacer las necesidades del organismo. Esta insuficiencia puede deberse a una ingesta inadecuada de hierro procedente de los alimentos y a una baja biodisponibilidad (2).
Los esfuerzos mundiales para reducir la carga de anemia se han dirigido en gran medida a aumentar la ingesta de hierro mediante la suplementación, el enriquecimiento de los alimentos y la diversificación de la dieta (3), especialmente en los entornos de escasos recursos, donde el acceso a los servicios de prevención, detección y tratamiento de la anemia es bajo, incluso, en los que presentan acceso deficiente a la tecnología de enriquecimiento de alimentos y/o suplementos de hierro (4).
De hecho, la deficiencia de hierro actualmente es uno de los principales contribuyentes a la carga mundial de morbilidad y afecta especialmente a los niños, las mujeres pre-menopáusicas y las personas en general de países de ingresos bajos y medios (5).
La deficiencia de hierro es el tipo más común de deficiencia de micronutrientes en todo el mundo y figura como una de las diez principales enfermedades objetivo de la Organización Mundial de la Salud (OMS) para su cura y prevención (6).
En ese sentido, la suplementación con hierro es considerada un método eficaz para tratar la deficiencia y se utilizan generalmente suplementos tradicionales, como el sulfato ferroso, el gluconato ferroso y el fumarato ferroso (7,8).
Los suplementos de hierro a menudo se administran por vía oral, intravenosa o intramuscular (9). Sin embargo, la primera suele ser problemática debido a las preparaciones que contienen hierro en forma de jarabes o gotas y tienen un sabor desagradable, pueden manchar los dientes y causar trastornos gastrointestinales, todo lo cual disminuye el cumplimiento de la intervención y, por lo tanto, limita su eficacia (10).
En general, los alimentos también pueden fortificarse con sangre seca como fuente de hemoglobina, pero debido a riesgos relacionados con la inocuidad de los alimentos y creencias culturales y religiosas, así como por los profundos cambios de color y sabor de los alimentos fortificados (se necesita agregar sabores fuertes para superar el sabor), esta práctica no ha sido ampliamente aceptada en todos los países y comunidades (11), por lo que constantemente se buscan nuevos productos que presenten una mayor palatabilidad y un mejor perfil de efectos secundarios (12).
En ese contexto, en regiones geográficas altoandinas crecen productos autóctonos como la quinua (Chenopodium quinoa), la achita (Amaranthus caudatus L.) y la cañihua (Chenopodium pallidicaule Aellen) (13). Estos alimentos presentan grandes propiedades benéficas y múltiples usos, por lo que pueden incluirse en la dieta para diversificarla y combatir la anemia.
En consecuencia, las estrategias dietéticas para combatir la anemia incluyen la suplementación con hierro, la modificación y diversificación de la dieta y la fortificación de los alimentos (14), por lo que recientes avances en el estudio del hierro han estimulado un nuevo interés por investigar la deficiencia del hierro y, consecuentemente, las condiciones de la anemia en el mundo (15).
En ese sentido, basados en que la primera línea de tratamiento dentro de la suplementación en las dietas debe ser la terapia oral, este estudio presupone que la administración de hierro microencapsulado (origen mineral) y hemínico (hierro animal), enmascarado en galletas de harina de quinua y cañihua y otros ingredientes como el yogurt podría incrementar la hemoglobina en ratas Wistar alimentadas con nutrientes normales sin hierro.
Por lo tanto, el objetivo de este estudio fue determinar los efectos de la suplementación de hierro microencapsulado y hemínico para incrementar los niveles de hemoglobina y el peso corporal en ratas alimentadas sin hierro.
MÉTODOS
DISEÑO DEL ESTUDIO
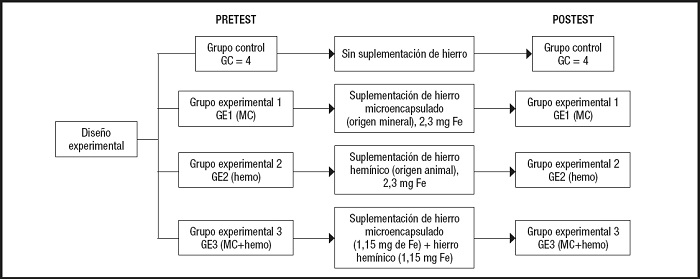
Se diseñó un estudio experimental aleatorizado en 20 ratas albinas Wistar (diez machos y diez hembras) con un rango de edad de 28 a 35 días de vida (26,0 ± 2,3 días). El peso aproximado de los animales fue de 115,9 ± 5,7 g, con una longitud de cuerpo de 16,0 ± 0,3 cm. Los animales se alojaron en jaulas de acero inoxidable (dos animales por jaula) en un ambiente controlado (20-22 °C, 30-50 % de humedad relativa y ciclos de luz de 12 horas) y con alimentación patrón (Labina, Purina) y agua ad libitum. El lecho de aserrín se renovó cada tres días, totalizando cinco cambios durante el experimento.
Todos los animales se adaptaron a estas nuevas condiciones de vida por un periodo de cinco días. Luego se constituyeron cuatro grupos de estudio y se administró una dieta general para los cuatro grupos caracterizada por déficits en hierro. Se utilizó una dieta seca en polvo que contenía todos los nutrientes normales, excepto el hierro, y que estuvo compuesta de sacarosa, caseína, una mezcla de sal y vitaminas solubles en agua y grasas (16). Todos los grupos consumieron estos alimentos durante 15 días, tres veces al día (en la mañana de 7 a 8 a.m., al medio día de 13 a 14 horas y por la noche de 18 a 19 horas), totalizando 60 g por jaula (20 g por cada comida en un día), y el agua fue ad libitum. Los suplementos para los cuatro grupos quedaron conformados de la siguiente manera:
− GC: sin suplementación de hierro.
− GE1: suplementación de hierro microencapsulado (origen mineral), 2,3 mg Fe.
− GE2: suplementación de hierro hemínico en polvo (origen animal), 2,3 mg de Fe.
− GE3: suplementación de hierro microencapsulado (1,15 mg de Fe) + hierro hemínico (1,15 mg de Fe).
La figura 1 muestra el flujograma del diseño experimental desarrollado.
ELABORACIÓN DE SUPLEMENTOS
Ambos hierros (microencapsulado y hemo) se adquirieron en polvo (previamente certificado) de una empresa china. Para la elaboración de los alimentos en ambos formatos, se utilizaron leche en polvo y cereal molido (a base de quinua y cañihua), luego se añadió 1 ml de yogurt para juntar todo y, finalmente, se formaron pequeñas bolas de 1 cm, resultando pequeñas galletas.
Para formar el cereal molido (quinua, cañihua) durante el proceso de extrusión se añadieron arroz y maíz para ayudar a la aglutinación del producto (previamente, se lavaron y se secaron los cereales).
MEDICIONES DEL PRETEST Y POSTEST
Para la evaluación del peso corporal (g) de las ratas se utilizó una balanza analítica de marca Scaltec modelo SAC-62, con una precisión de 1 g, y para la longitud total se utilizó un paquímetro de aluminio graduado en milímetros (mm) (Harpenden, Inglaterra), midiendo desde el hocico hasta la punta de la cola según las recomendaciones de Cossio-Bolaños y cols. (17). La superficie corporal (SC) fue calculada por medio de la ecuación propuesta por Cano-Rabano y cols. (18), donde SC = 0,1*PV*0,685 (SC = superficie corporal; PV = peso vivo).
La concentración de hemoglobina se midió en la sangre utilizando un analizador portátil Hemo Control (EKF Diagnostics, Inglaterra). Se extrajo la sangre de la cola por gota en ayunas, aproximadamente 1-2 ml. El tiempo de lectura del resultado es de aproximadamente 25 segundos para cada muestra.
Todas las evaluaciones efectuadas tanto en el pretest como en el postest y la dieta se efectuaron de acuerdo a la guía de ética de Estados unidos para animales de experimentación (19) y de acuerdo al Comité de Ética de la Universidad Católica Santa Maria, Arequipa, 320-2021.
ESTADÍSTICA
La distribución normal de los datos se verificó por el test de Shapiro-Wilk. Los resultados se analizaron a través de la estadística descriptiva de la media (X) y desviación estándar (DE). La diferencia estadística entre los grupos se verificó por medio del análisis de varianza (ANOVA, de dos vías) y la prueba de especificidad de Tukey. Todo el análisis estadístico se efectuó en SPSS 16,0 para Windows, adoptando un nivel de significación del 5 %.
RESULTADOS
Los valores iniciales de peso, longitud y SC de las ratas investigadas se observan en la tabla I. No hubo diferencias en la edad, peso, longitud, SC y Hb entre los cuatro grupos (p < 0,334 a 0,980) (Tabla I).
Tabla I. Variables somáticas iniciales de la muestra estudiada.
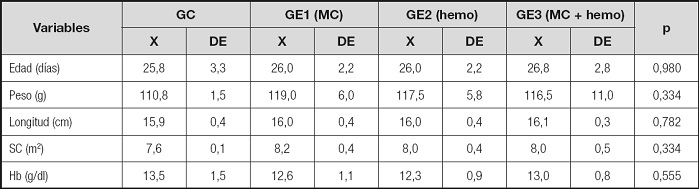
GC: grupo control; GE: grupo experimental; MC: microencapsulado; hemo: hierro hemínico; X: promedio; DE: desviación estándar; p: diferencia significativa (p < 0,05).
Las comparaciones de los niveles de Hb entre el pretest y el postest de los cuatro grupos de estudio se observan en la tabla II. En el GC no hubo diferencias significativas (p = 0,225) entre el pretest y el postest, a pesar de disminuir los niveles de Hb en un -9,6 %; sin embargo, en el GE1 (MC), en el GE2 (hemo) y en el GE3 (MC+hemo) sí hubo diferencias significativas (p < 0,05) en la Hb entre el pretest y el postest. Los tres GE incrementaron los niveles de hemoglobina en 14,3-14,5 % (Tabla II).
Tabla II. Efecto de la administración de suplementos de hierro sobre la hemoglobina en ratas alimentadas sin hierro.
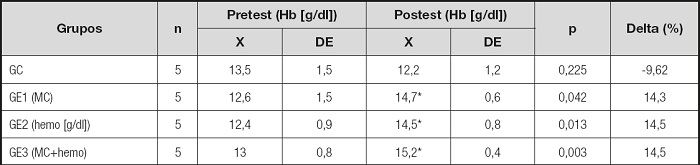
X: promedio; DE: desviación estándar; GC: grupo control; GE1 (MC): grupo experimental suplementado con hierro microencapsulado; GE2 (hemo): grupo experimental suplementado con hierro hemínico; GE3 (MC+hemo): grupo experimental suplementado con hierro microencapsulado + hemínico.
*Diferencia significativa en relación al GC.
En la figura 2 se observan las comparaciones del postest en los cuatro grupos. El GE1 (MC), el GE2 (hemo) y el GE3 (MC+hemo) reflejan diferencias significativas en relación al GC (p < 0,05).
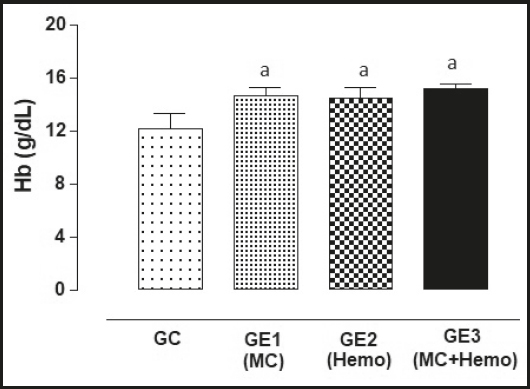
Figura 2. Comparación de los valores medios y ± DE de hemoglobina de los cuatro grupos durante el postest. aDiferencia significativa en relación al grupo control. GC: grupo control; GE: grupo experimental.
Los valores del peso y la longitud de las ratas se observan en la tabla III. Los cuatro grupos aumentaron significativamente el peso en el postest (p < 0,001). El GC aumentó en un 12,2 %; el GE1 (MC), en un 21,6 %; el GE2 (hemo), en un 44,5 %; y el GE3 (MC+hemo), en un 30,2 %. Por el contrario, en la longitud no hubo diferencias significativas (p > 0,5-0,1) en ninguno de los cuatro grupos.
Tabla III. Efecto de la administración de suplementos de hierro sobre el peso y la longitud en ratas alimentadas sin hierro.
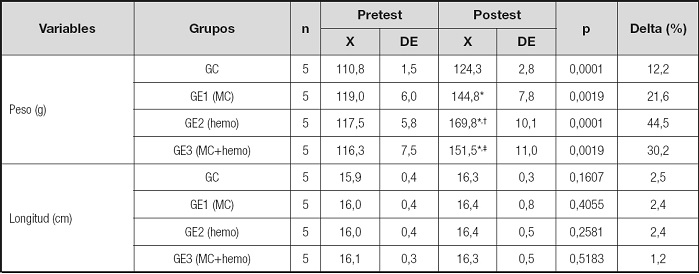
X: promedio; DE: desviación estándar; GC: grupo control; GE1 (MC): grupo experimental suplementado con hierro microencapsulado; GE2 (hemo): grupo experimental suplementado con hierro hemínico; GE3 (MC+hemo): grupo experimental suplementado con hierro microencapsulado + hemínico.
*Diferencia significativa en relación al GC.
†Diferencia significativa en relación al GE1 (MC).
‡Diferencia significativa en relación al GE2 (hemo).
DISCUSIÓN
Los resultados del estudio han demostrado que la suplementación de hierro microencapsulado y hemínico de forma individual han incrementado significativamente los niveles de hemoglobina (14,3 % y 14,5 %) y peso corporal (21,6 % y 44,4 %) en ratas Wistar; sin embargo, cuando se combinó la suplementación (hierro microencapsulado + hemínico), los resultados no superaron los valores de hemoglobina y peso corporal de los grupos microencapsulado y hemínico, reflejando similares valores.
De hecho, los resultados obtenidos en este estudio mostraron que las suplementaciones con hierro microencapsulado y hemínico son las mejores alternativas para aumentar los niveles de hemoglobina en ratas alimentadas sin hierro, aunque un hecho que llamó la atención es que el aumento del peso corporal fue mayor en el grupo suplementado con hierro hemínico, observándose un incremento significativo del 44,5 % (~52,3 g), en relación al grupo suplementado con hierro microencapsulado 21,6 % (~25,8 g).
Estos hallazgos son relevantes, dado que el hierro hemo se absorbe más eficientemente que el hierro inorgánico en el intestino humano (20) y, además, no provoca efectos secundarios ni irritación gástrica (21). Por lo tanto, es considerado como una fuente importante de hierro corporal, lo que contribuye al aumento de los niveles de hemoglobina y, consecuentemente, al crecimiento del peso corporal.
En general, el mecanismo por el cual el enterocito capta el hemo y lo cataboliza para utilizar el hierro es materia de discusión y actualmente se necesita mayor investigación para comprender completamente la absorción de este micronutriente crítico (22).
De hecho, la proteína más abundante en la sangre es la hemoglobina, que representa el 12-18 % de la composición total de la sangre y puede purificarse y procesarse fácilmente para producir varios productos o suplementos de hierro hemo en el organismo (23).
Por el contrario, los compuestos de hierro microencapsulados se utilizan principalmente para enriquecer las fórmulas infantiles y los cereales, pero también se añaden a otros alimentos (24) con el objetivo de aumentar los niveles de hemoglobina, por lo que es considerado un medio efectivo y eficaz de reposición en poblaciones deficientes de hierro (25). Sin embargo, los costos del proceso de encapsulación pueden ser altos y pueden limitar las aplicaciones (24). Además, algunos estudios destacan que la adherencia al tratamiento por microcápsulas puede reflejar miedo a los efectos secundarios, particularmente a los síntomas gastrointestinales (náuseas, vómitos, estreñimiento, sabor metálico [26,27]), e incluso puede dañar el revestimiento mucoso del tracto gastrointestinal, ocasionando estreñimiento (28) debido a la toxicidad oxidativa del hierro ferroso (29).
En ese sentido, el hierro, en general, es crucial para numerosos procesos celulares y la deficiencia de hierro provoca diversas consecuencias para la salud (5), por lo que, según los resultados alcanzados en este estudio, la suplementación de hierro hemínico junto a los granos altoandinos (quinua y cañihua) podría ser una alternativa para mejorar el aumento de la hemoglobina en situaciones en que las dietas alimenticias sean deficientes en hierro. Asimismo, el hierro hemínico podría ser incluso una alternativa cuando se quiere producir una recuperación del peso corporal durante el crecimiento y desarrollo de los niños. De hecho, estos resultados son consistentes con estudios anteriores, donde se han reportado incrementos significativos del peso corporal (30,31).
En consecuencia, estos hallazgos corroboran la importancia de suplementar con hierro hemínico acompañado de harina de quinua y cañihua en ratas en proceso de crecimiento, ya que no solo permite mejorar su desarrollo somático, sino que también podría coadyuvar al crecimiento sináptico del cerebro (32), respectivamente.
También se resalta que el consumo de ambos granos altoandinos considerados como seudocereales en los últimos años se ha incrementado debido principalmente a su valor nutritivo, así como a su ausencia de gluten (33). Por ejemplo, la quinua es una rica fuente de minerales y tiene mucho más zinc (2,73-5,01 mg/100 g), hierro (4,82-7,19 mg/100 g) y calcio (77,10-211,90 mg/100 g) que otros cereales (34). Además, por otro lado, la cañihua es rica en proteínas (14-17 %), grasas (4,1-7,8 %), carbohidratos (56-66 %) y minerales (35), respectivamente.
La unión de ambos granos aumenta la biodisponibilidad mineral y puede mejorar la calidad nutricional, especialmente si se añade hierro hemínico, con lo cual se garantizan aumentos significativos en los niveles de hemoglobina y de peso corporal.
Hasta donde sabemos, el presente estudio es uno de los primeros en informar sobre la utilidad del hierro hemínico y microencapsulado como suplemento alimenticio en ratas anémicas, sin embargo, estudios futuros deben investigar en modelos humanos y probar los efectos de dichos suplementos.
Este estudio presentó algunas limitaciones que deben ser reconocidas. Por ejemplo, los cuatro grupos presentaron un pequeño tamaño de muestra, lo que podría afectar el poder estadístico; además, no fue posible evaluar el hierro sérico y tisular (hígado, bazo, riñón y corazón), lo que habría proporcionado mayor información al estudio. Sin perjuicio de lo anterior, esta investigación proporciona resultados favorables para ser replicados en otros estudios, dado el control de fuentes de invalidación interna como la selección aleatoria de los animales a cada condición de experimento, el control del crecimiento somático y la administración de las pruebas del pretest y postest. Futuras investigaciones deben ampliar el tiempo de suplementación del hierro y probar otros tipos de suplementos y dietas en ratas.
En conclusión, la suplementación de hierro microencapsulado y hemínico en conjunto con harina de quinua y cañihua por separado incrementó los niveles de hemoglobina y peso corporal significativamente en ratas alimentadas sin hierro en un periodo de 15 días, aunque el grupo suplementado con hierro hemínico mostró mayores incrementos de peso corporal en relación con los demás grupos (44,5 %). Estos resultados sugieren que el hierro hemo, junto a la harina de quinua y cañihua, podrían explotarse como un nuevo suplemento de hierro seguro y eficiente en comparación con el hierro microencapsulado, dada su mayor biodisponibilidad de hierro y su capacidad de incrementar el peso y producir menos efectos secundarios.