INTRODUCCIÓN
Suplementar la nutrición humana con los AG Ω3 EPA/DHA es cada vez más frecuente, debido a la evidencia de su utilidad en el manejo de enfermedades cardiovasculares, metabólicas y hepáticas, así como en patologías neurológicas, músculo-esqueléticas, inflamatorias e infecciosas (1-3). En el ámbito hospitalario, esta suplementación ha demostrado efectividad en el tratamiento de distintas situaciones médicas y quirúrgicas, al aplicarse con el fin terapéutico de mejorar el pronóstico de recuperación, el tiempo de estancia hospitalaria y la supervivencia (4-8), efectos que son considerados potencialmente benéficos para trasladar su uso a pacientes críticos, especialmente con sepsis grave (9).
En los últimos años se ha generado interés para evidenciar los mecanismos celulares reguladores que ejercen los AG Ω3 EPA/DHA en el estado proinflamatorio que caracteriza al paciente en condición crítica, destacando en ellos la modificación de la estructura de las membranas celulares, la señalización de la respuesta inmunitaria e inflamatoria y los mecanismos de transcripción génica que involucran la síntesis del factor de necrosis tumoral (FNT-α) mediante la atenuación del factor nuclear kappa-beta (FN-kB), la síntesis de eicosanoides e interleucinas (IL) proinflamatorias y de proteínas de fase reactante como la proteína C-reactiva (PCR) (10-14).
Así también se ha obtenido evidencia en ensayos clínicos sobre la reducción de la incidencia de infecciones, del tiempo de ventilación mecánica asistida y de los días de estancia hospitalaria; Sin embargo, en los últimos metaanálisis se señala que los resultados son contradictorios y no concluyentes sobre la reducción de la tasa de mortalidad (15-18).
La mortalidad de los pacientes con estado crítico es atribuible de un 7 a un 17 % a la instauración del síndrome de respuesta inflamatoria sistémica (SRIS), siendo la tasa general en las unidades de cuidados intensivos (UCI) de un 25,8 %, elevándose esta a un 35 % cuando los pacientes presentan sepsis y alcanzando hasta un 50 % si se presenta SRIS con fallo del sistema compensador antinflamatorio; sin embargo, si en la intervención clínica se logra instaurar de manera efectiva la compensación antiinflamatoria, la mortalidad se reduce a menos del 5 % (19-21). Debido a ello, las intervenciones terapéuticas en el paciente crítico se dirigen a modular la respuesta inflamatoria descontrolada para limitar el daño y mejorar la supervivencia. Por lo tanto, es necesario que estas intervenciones sean valoradas por medio de herramientas que determinen el pronóstico, en relación directa con la condición clínica, permitiendo evaluar la evolución, el riesgo de complicaciones y la mortalidad (22-32).
El objetivo de este ensayo clínico fue analizar el efecto de la suplementación con AG Ω3 EPA/DHA, vía nutrición parenteral, sobre los marcadores de pronóstico clínico, médicos, nutricionales y bioquímicos, en pacientes con estado crítico, en relación con el desenlace.
MATERIAL Y MÉTODOS
POBLACIÓN DEL ESTUDIO
Se trató de un ensayo clínico controlado, aleatorizado y unicéntrico efectuado de julio de 2020 a marzo de 2022 en pacientes adultos ≥ 18 años con estado crítico de patología médica o quirúrgica y con requerimiento de soporte nutricional con NPT en un lapso no menor a 5 días. El ensayo clínico fue aprobado por el Comité de Investigación del Hospital General de Puebla “Dr. Eduardo Vázquez Navarro”, en acuerdo a la declaración de Helsinki; número de registro 99/ENS/INV/REV/2020.
El tamaño de la muestra se calculó de manera probabilística con un margen de error del 5 %, un nivel de confianza del 95 % y una heterogeneidad del 50 % con respecto a un tamaño de población de 72 pacientes en condiciones críticas que son atendidos por el Servicio de Nutrición Clínica Parenteral de la unidad hospitalaria en un periodo de 6 meses; sin embargo, debido a la reconversión de la unidad hospitalaria a unidad COVID, el tiempo destinado para alcanzar la muestra se extendió a 20 meses.
La muestra total se integró con 64 pacientes en condición crítica que cumplieron los criterios de selección; 47 se aleatorizaron para integrar los grupos de suplementación con AG Ω3 EPA/DHA. El soporte nutricional con NPT para todos los casos contenía una emulsión de lípidos a concentración del 20 %, la cual se compone de un 50 % de AG de cadena larga, provenientes del aceite de soja, y un 50 % de AG de cadena media, procedentes del aceite de coco (LTC/MTC). Para la suplementación de AG Ω3 EPA/DHA se utilizó una emulsión al 10 % de aceite de pescado altamente refinado con un contenido promedio de 1,25 a 2,82 g de EPA y 1,44 a 3,09 g de DHA.
Las dosis de suplementación empleadas fueron de 0,1 g/kg/día de AG Ω3 EPA/DHA (n = 23) y de 0,2 g/kg/día (n = 24); los resultados se compararon con un grupo de control histórico que cumplió con los criterios de selección y que recibió NPT sin suplementación (n = 17) en el periodo comprendido de febrero de 2018 a junio de 2020.
Los pacientes incluidos en los grupos de suplementación con AG Ω3 EPA/DHA recibieron la explicación referente al ensayo clínico y su objetivo, obteniéndose de ellos el consentimiento informado, por voluntad propia o mediante la aceptación de su familiar responsable.
CRITERIOS DE SELECCIÓN
Los criterios de inclusión para la totalidad de los grupos fueron: pacientes en condición crítica, hemodinámicamente estables, con patología médica aguda o posquirúrgica, que requirieran cuidados de paciente crítico dentro o fuera de la unidad de cuidados intensivos, con necesidad de soporte nutricional endovenoso; criterios de exclusión: pacientes oncológicos, alergia conocida al huevo o al pescado y trombocitopenia menor de 80 x 103/µL; criterios de eliminación: trombocitopenia aguda severa con evidencia de sangrado.
PROCEDIMIENTO
Se realizó el registro de fecha de ingreso a la unidad hospitalaria, fecha de solicitud de interconsulta al Servicio de Nutrición Clínica Parenteral, días previos de estancia antes del inicio del tratamiento con NPT, fecha de egreso y supervivencia a los 60 días o defunción.
Todas las variables fueron determinadas de manera basal y al final del tratamiento, las variables edad en años, sexo, diagnóstico, peso habitual en kg se registraron directamente del expediente clínico; la estatura en cm y peso en kg se estimaron por antropometría por medio de la medición de longitud rodilla-talón utilizando un antropómetro largo (Gráculus Antropometría® MEX) y la circunferencia media del brazo utilizando una cinta antropométrica metálica estándar.
Las variables hemodinámicas temperatura en grados centígrados (Tº), frecuencia cardiaca en latidos/min (FC), frecuencia respiratoria en respiraciones/min (FR), presión arterial diastólica en mmHg (PAD), presión arterial sistólica en mmHg (PAS) y presión arterial media en mmHg (PAM), así como la escala de Glasgow, el uso de vasopresores en mcg/kg/min y el uso de apoyo mecánico ventilatorio (AMV) se determinaron diariamente a lo largo del tratamiento; sin embargo, para fines del estudio se emplearon los registros basales y finales. La presión parcial de oxígeno (PaO2), la fracción inspirada de oxígeno (FiO2), la saturación de oxígeno (SatO2) y el pH se determinaron por medio de la gasometría arterial.
La creatinina sérica e mg/dL (CRS), la albúmina sérica en g/dL (Alb), la bilirrubina total en mg/dL (BT), el colesterol total en mg/dL (CT), el sodio sérico en mmol/L (Na) y el potasio sérico en mmol/L (K) se determinaron por medio de análisis de química sanguínea; para el hematocrito en % (Hct), los linfocitos totales en 103/µL (RTL), los leucocitos totales en 103/µL (LT) y el número de plaquetas en 103/µL (PLT) se utilizó el análisis de citometría hemática.
Para la determinación de la excreción de nitrógeno urinario en g (NUU/24 h) y la creatinina total urinaria en mg/dL (CRU) se realizó una recolección de orina de 24 h de manera basal y con determinaciones posteriores cada siete días hasta el término del tratamiento; para fines del estudio se emplearon el valor basal y el final.
Los marcadores de pronóstico clínico médicos fueron: evaluación secuencial de falla orgánica (SOFA), evaluación de fisiología aguda y salud crónica II (APACHE II) y puntuación de fisiología agu- da simplificada III (SAPS 3) (22-25); los marcadores de pronóstico nutricional fueron: riesgo nutricional en el enfermo crítico (NUTRIC), índice de riesgo nutricional Buzby (IRN), recuento total de linfocitos (RTL), excreción de nitrógeno (N2) e índice creatinina/talla (ICT) (26-29,33); ambos fueron calculados y estratificados de manera basal y al final de la administración del tratamiento. Los marcadores bioquímicos CRS, CT y ALB fueron valorados y estratificados como índices del pronóstico de riesgo (30-32).
INTERVENCIÓN NUTRICIONAL
Para todos los grupos de estudio, el gasto metabólico basal se determinó utilizando la fórmula de Harris y Benedict (34), resultado al que se le aplicó el factor de Long de 1,6, correspondiente al paciente crítico (35), determinando así la necesidad energética total, valor final que corresponde a la meta de cobertura total del requerimiento energético al 100 % (GMT). La carga calórica de la NPT se incrementó cada tercer día hasta alcanzar la meta del GMT si las condiciones metabólicas lo permitían; para fines del estudio, se registró la cobertura final de GMT por NPT, kcals/kg/día alcanzadas y días totales de soporte nutricional con NPT.
El tratamiento fue administrado vía NPT a las dosis designadas previamente de manera aleatoria; la dosis se mantuvo sin variación a lo largo de los días totales del tratamiento. La carga proteica se cubrió manteniendo una relación de kcals no proteicas: nitrógeno, en un rango de 80 a 100:1 (kcals NP: N2) y de acuerdo con el NUU/24 h, tratando de mantener balances nitrogenados positivos a lo largo del tratamiento.
ANÁLISIS ESTADÍSTICO
El análisis estadístico se realizó con el paquete SPSS versión 24.0 (IBM SPSS, Armonk, NY, EUA), estableciéndose un nivel de confianza del 95 % con margen de error del 5 %, con significancia estadística en p < 0,05.
Se efectuó una estadística descriptiva para conocer el supuesto de la distribución normal de cada variable del estudio utilizando la prueba de Kolmogorov-Smirnov y la prueba de Shapiro-Wilk para los marcadores de pronóstico clínico. Los datos cuantitativos se presentan como medias con desviación estándar (± DE) y los datos cualitativos se presentan en frecuencia y porcentaje.
Para el análisis de las variables clínicas, así como para los marcadores de pronóstico clínico, se estableció un nivel de confianza del 95 % con margen de error del 5 %, con significancia estadística en p < 0,05, empleándose la t de Student para muestras relacionadas en los datos con distribución normal y la prueba de Wilcoxon de muestras relacionadas para los datos no paramétricos.
El análisis de la supervivencia se estimó por el método de Kaplan-Meier, con prueba estadística de Log Rank, y para determinar la probabilidad de supervivencia se empleó el método actuarial con rango de 60 días e intervalos de 10 días.
RESULTADOS
Se incluyó un total de 64 pacientes con una media de edad general de 40,19 ± 15,65 años; la distribución entre hombres y mujeres fue equitativa con el 50 % para ambos sexos; 47 pacientes consecutivos integraron aleatoriamente los grupos de suplementación de AG Ω3 EPA/DHA: 23 pacientes con dosis de 0,1 g/kg/día (48,9 %) y 24 pacientes con 0,2 g/kg/día (51,1 %); ninguno de los pacientes presentó trombocitopenia severa, por lo que el total de los pacientes concluyeron el ensayo clínico. El grupo de control histórico se integró por 17 pacientes de la misma unidad hospitalaria, los cuales recibieron NPT con emulsión de lípidos al 20 % LTC/MTC, sin suplementación, en el periodo inmediato anterior al inicio del ensayo clínico.
Los días de soporte nutricional con NPT para todos los grupos se estimaron en 16,02 ± 10,73, con una media de cobertura calórica del 85,94 % ± 14,67 y una moda del 100 % de la meta del GMT; la carga calórica final media fue de 34,28 ± 8,13 kcals/kg/día, la pérdida de peso expresada en porcentaje se estimó en un -2,85 ± 7,35 %. Por otro lado, el tiempo del ingreso previo a la solicitud de tratamiento con soporte nutricional fue de 6,43 ± 6,97 días. Los datos descriptivos de los tres grupos de estudio y las características del soporte nutricional con NPT se presentan en la tabla I.
Tabla I. Variables demográficas y característica del soporte nutricional.
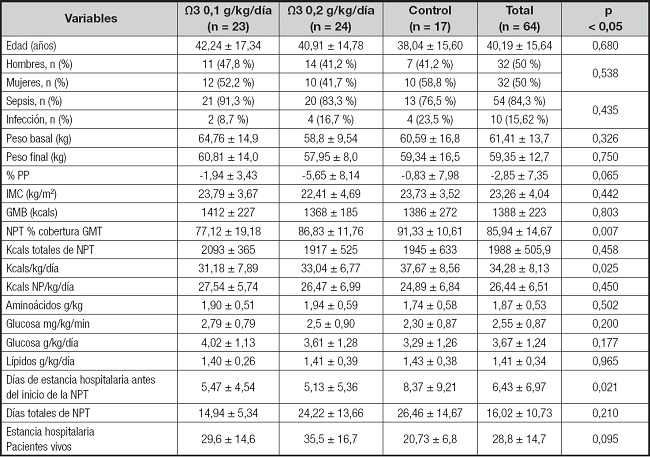
Las variables cuantitativas se expresan en medias ± desviación estándar (DE); las variables cualitativas se presentan en frecuencia y porcentaje; NPT: nutrición parenteral total; %PP: porcentaje de pérdida de peso; IMC: índice de masa corporal; GMB: gasto metabólico basal; GMT: gasto metabólico total; Kcals NP: kilocalorías no proteicas.
El servicio con el mayor número de interconsultas para instaurar soporte nutricional con NPT fue Cirugía General con un 67,18 %, seguido de la unidad de cuidados intensivos (UCI) con un 31,25 %. Los diagnósticos más frecuentes fueron: “sepsis de origen abdominal” con el 28,12 %, seguido por “fístulas enterocutáneas” con un 21,87 % y un 18,75 % para “lesión de la vía biliar”; el 84,38 % del total de los pacientes presentaron estado séptico al valorarse para inicio del tratamiento; el restante 15,62 % presentó algún grado de infección.
VARIABLES CLÍNICAS Y MARCADORES BIOQUÍMICOS DE PRONÓSTICO CLÍNICO
La estadística descriptiva y comparativa de las variables clínicas y los marcadores bioquímicos se presenta como medias ± DE en la tabla II; para la determinación de la significancia estadística en los datos de distribución normal se emplearon la prueba de la t de Student y la prueba de Wilconxon para datos no paramétricos. Las variables clínicas FC, FR, PAS y FiO2, así como la variable bioquímica PLT, presentaron diferencias significativas entre la determinación basal y la final con la dosis de suplementación de Ω3 de 0,1 g/kg/día (p < 0,005), (p < 0,034), (p < 0,001), (p < 0,045) y (p < 0,038), respectivamente. La variable pH (p < 0,038) muestra una diferencia significativa exclusivamente para la suplementación con dosis de Ω3 de 0,2 g/kg/día; la PaO2 presentó una disminución significativa (p < 0,044) en el grupo de control; el resto de las variables clínicas no muestran diferencias significativas entre con o sin suplementación de AG Ω3 EPA/DHA.
Tabla II. Comparación de variables clínicas y bioquímicas, basales y al final de la intervención, para los grupos de suplementación con AG Ω3 y el grupo de control.
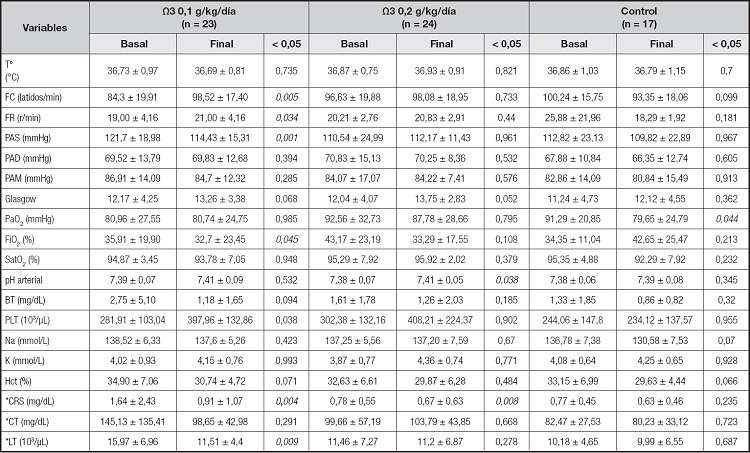
Las variables se expresan en medias ± desviación estándar (DE); To: temperatura; FC: frecuencia cardiaca en latidos/min; FR: frecuencia respiratoria en respiraciones/min; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PAM: presión arterial media; AMV: apoyo mecánico ventilatorio; PaO2: presión parcial de oxígeno; FiO2: fracción inspirada de oxígeno; SatO2: saturación de oxígeno; BT: bilirrubina total; PLT: plaquetas; Na: sodio sérico; K: potasio sérico; Hct: hematocrito.
*Marcadores de pronóstico clínico bioquímicos: CRS: creatinina sérica; CT: colesterol total; LT: leucocitos totales.
En lo referente a los marcadores de pronóstico clínico bioquímicos, los niveles de CT no mostraron diferencia significativa para ninguno de los grupos del estudio; en cuanto a LT, se presenta diferencia entre el número basal y el final con la dosis de Ω3 de 0,1 g/kg/día (p < 0,009), con medias de 15,97 ± 6,96 y 11,51 ± 4,40, respectivamente.
Por último, los niveles de CRS muestran diferencia estadísticamente significativa con las dosis de suplementación de AG Ω3 EPA/DHA, con media basal de 1,64 ± 2,43 y final de 0,91 ± 1,07 para la suplementación con Ω3 a razón de 0,1 g/kg/día (p < 0,004), siendo las medias para la suplementación con Ω3 en dosis de 0,2 g/kg/día (p < 0,008) de 0,78 ± 0,55 y 0,67 ± 0,63 basal y final, respectivamente; el grupo de control no presenta diferencias significativas.
MARCADORES DE PRONÓSTICO CLÍNICO MÉDICOS
La tabla III muestra la estadística descriptiva y comparativa con medias ± DE de los marcadores de pronóstico clínico médicos: SOFA, APACHE II y SAPS 3; se utilizó la prueba de Wilcoxon con una p < 0,05 para la significancia estadística. El total de los marcadores de pronóstico clínico médicos muestran diferencias significativas consistentes para los grupos de intervención con suplementación de AG Ω3 EPA/DHA. El marcador SOFA muestra una media de determinación basal de 5,39 ± 4,15 y una final de 3,61 ± 3,79 para la suplementación con Ω3 en dosis de 0,1 g/kg/día (p < 0,002), siendo las medias para la suplementación de Ω3 en dosis de 0,2 g/kg/día (p < 0,013) de 5,71 ± 4,77 y 2,96 ± 2,95, basal y final, respectivamente; en contraste, el grupo control no presenta diferencia significativa en las determinaciones basales 6,24 ± 4,49 y finales 5,06 ± 4,68 (p < 0,319).
Tabla III. Efecto de la suplementación de AG Ω3 EPA/DHA en marcadores de pronóstico clínico médicos.
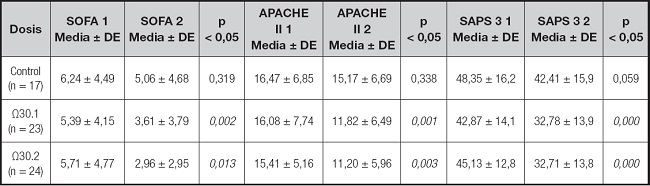
Las variables se expresan en medias ± desviación estándar (DE). Significancia estadística (< 0,05) por Wilcoxon; SOFA: evaluación secuencial de falla orgánica; APACHE II: evaluación de fisiología aguda y salud crónica II; SAPS: puntuación de fisiología aguda simplificada III.
Para el marcador APACHE II, la media de la determinación basal fue de 16,08 ± 7,74, con una final de 11,82 ± 6,49 para la suplementación de Ω3 en dosis de 0,1 g/kg/día (p < 0,001), siendo la media basal de 15,41 ± 5,16 y la final de 11,20 ± 5,96 para la suplementación de Ω3 en dosis de 0,2 g/kg/día (p < 0,003); APACHE II y SOFA no presentan diferencia significativa en las determinaciones del grupo de control: valor basal de 16,47 ± 6,85 y final de 15,17 ± 6,69 (p < 0,338).
Los resultados estadísticos de SAPS 3 muestran resultados significativos para ambas dosis de suplementación, con medias de determinación basal de 42,87 ± 14,12 y final de 32,78 ± 13,98 para la suplementación con Ω3 en dosis de 0,1 g/kg/día (p < 0,000); para la suplementación con Ω3 en dosis de 0,2 g/kg/día (p < 0,000), las medias fueron de 45,13 ± 12,8 y 32,71 ± 13,87, basal y final, respectivamente; el grupo de control no presenta diferencias significativas (p < 0,059) en las determinaciones.
MARCADORES DE PRONÓSTICO CLÍNICO NUTRICIONALES
Los resultados en los marcadores de pronóstico clínico nutricionales se presentan en las tablas IV y V, con estadística descriptiva mostrando medias ± DE, utilizando la prueba de Wilcoxon con una p < 0,05 para la significancia estadística. Al igual que lo descrito para los marcadores médicos, los marcadores nutricionales NUTRIC y RTL muestran significancia estadística para ambos grupos de suplementación con AG Ω3 EPA/DHA.
Tabla IV. Efecto de la suplementación de AG Ω3 EPA/DHA en marcadores de pronóstico clínico nutricionales.
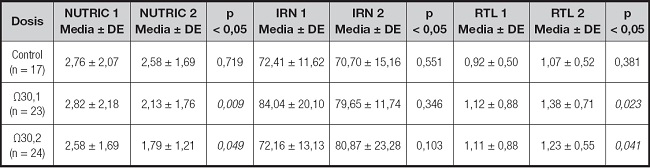
Las variables se expresan en medias ± desviación estándar (DE). Significancia estadística (< 0,05) por Wilcoxon; NUTRIC: riesgo nutricional en el enfermo crítico; IRN: índice de riesgo nutricional Buzby; RTL: recuento total de linfocitos.
Tabla V. Efecto de la suplementación de AG Ω3 EPA/DHA en marcadores de pronóstico clínico nutricionales (bis).
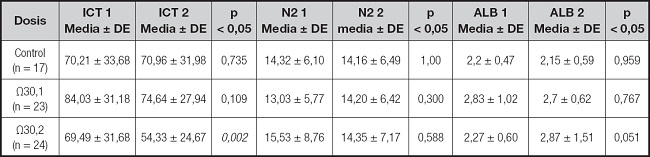
Las variables se expresan en medias ± desviación estándar (DE). Significancia estadística (< 0,05) por Wilcoxon; ICT: índice creatinina-talla; N2: nitrógeno ureico urinario de 24 h; ALB: albúmina sérica.
El marcador clínico NUTRIC presento una media basal de 2,82 ± 2,18 y una final de 2,13 ± 1,76 (p < 0,009) con la dosis de Ω3 de 0,1 g/kg/día, siendo para la dosis de Ω3 de 0,2 g/kg/día de 2,58 ± 1,69 y 1,79 ± 1,21, respectivamente, con significancia en p < 0,049; el grupo de control no presenta significancia estadística en la media de las determinaciones (p < 0,719). Los resultados de RTL fueron: basal de 1,12 ± 0,88 y final de 1,38 ± 0,71 con la dosis de Ω3 de 0,1 g/kg/día; con la dosis de Ω3 de 0,2 g/kg/día, se obtuvieron resultados basal y final de 1,11 ± 0,88 y 1,23 ± 0,55, respectivamente, mostrando significancia estadística (p < 0,041); igual que en NUTRIC, el marcador RTL en el grupo de control no presentó diferencia estadística entre las medias de las determinaciones (p < 0,381). En contraste, el marcador ICT mostró diferencia significativa exclusivamente con la dosis de Ω3 de 0,1 g/kg/día (p < 0,002); por su parte, el marcador ALB presentó diferencia en la misma dosis de suplementación, pero esta no fue estadísticamente significativa (p < 0,051). Los marcadores clásicos IRN y N2 no mostraron diferencia significativa para ninguno de los grupos del estudio.
MORTALIDAD Y SUPERVIVENCIA
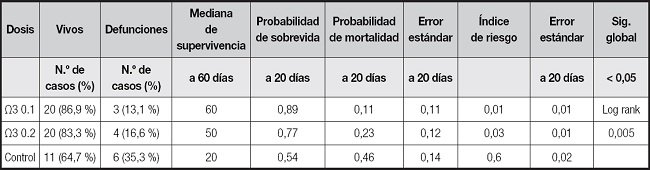
Los resultados de número de casos de sobrevida y defunciones, mediana de supervivencia y probabilidad de sobrevida y mortalidad se muestran en la tabla VI. Se realizaron un análisis de Kaplan-Meier y una prueba estadística Log Rank para determinar el riesgo de mortalidad y la probabilidad de supervivencia, estableciéndose un rango de sobrevida de 60 días.
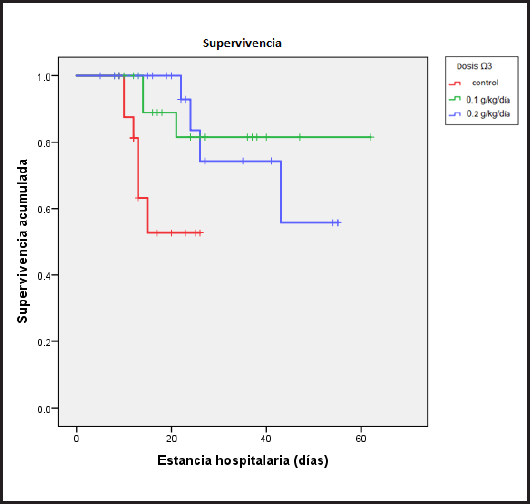
La mediana de supervivencia es de 60 días para el grupo con suplementación de Ω3 en dosis de 0,1 g/kg/día, de 50 días para la dosis de Ω3 de 0,2 g/kg/día y de 20 días para el grupo de control; la probabilidad de sobrevida a 20 días es del 89 %, 77 % y 54 % en la suplementación con dosis de Ω3 de 0,1 g/kg/día y con dosis de Ω3 de 0,2 g/kg/día, y en el grupo de control, respectivamente. La comparación global en la prueba de igualdad de distribución de la supervivencia para el grupo de control y en los distintos niveles de dosis de AG Ω3 EPA/DHA muestran significancia estadística con un Chi cuadrado de 10,68 (p < 0,005). La figura 1 presenta el gráfico de la función de supervivencia a 60 días.
ESTANCIA HOSPITALARIA
Los resultados de la estancia hospitalaria presentan una media de 29,6 ± 14,59 días para el grupo con dosis de suplementación de Ω3 de 0,1 g/kg/día (n = 11), media de 32,55 ± 16,7 días para la dosis de Ω3 de 0,2 g/kg/día (n = 20) y de 20,73 ± 6,81 días en el grupo de control; la diferencia entre los días de estancia hospitalaria no es significativa (p < 0,095), siendo la media general de 28,8 ± 14,71 días.
DISCUSIÓN
En 2019, la Sociedad Europea de Nutrición Enteral y Parenteral (ESPEN) enunció que no hay evidencia sustancial para recomendar el uso rutinario de los AG Ω3 EPA/DHA en la NPT, argumentando que los estudios muestran un alto sesgo y un bajo nivel de evidencia (36); sin embargo, apoya el uso de ellos, tanto para pacientes quirúrgicos como no quirúrgicos, pero considera que es necesario realizar más investigaciones para contar con evidencia sólida. En acuerdo a lo enunciado por la ESPEN, en 2021, la Asociación Americana de Nutrición Enteral y Parenteral (ASPEN) establece una postura juiciosa sobre el empleo de los AG Ω3 EPA/DHA en pacientes críticos, debido a que la evidencia es contradictoria para el tiempo de estancia hospitalaria, los días de ventilación mecánica y la incidencia de infecciones y mortalidad (37).
Ante la disyuntiva de las recomendaciones internacionales y frente a la imperante necesidad de realizar intervenciones clínicas eficaces, este estudio pretende contribuir con evidencia existente y creciente que refuerce la decisión de suplementar la NPT con AG Ω3 EPA/DHA en el tratamiento de los pacientes en condición crítica por medio del enfoque sobre la valoración de los marcadores de pronóstico clínico de empleo cotidiano en las unidades hospitalarias, con el fin de que dicha suplementación pueda considerarse como coadyuvante terapéutico útil frente a la respuesta inflamatoria descontrolada que presentan los pacientes en estado crítico, sin olvidar que la suplementación de cualquier nutracéutico debe soportarse con una base nutricional suficiente y adecuada.
Los resultados de la investigación muestran que la adición de AG Ω3 EPA/DHA en ambas dosis, 0,1 y 0,2 g/kg/día, aun en una intervención nutricional tardía, con una media de inicio de 6,43 ± 6,97 días posteriores al ingreso hospitalario, fue capaz de mejorar significativamente el pronóstico de recuperación evidenciado en distintos marcadores clínicos estudiados, así como de mejorar la probabilidad de supervivencia (p < 0,005). Sin embargo, no hubo diferencia significativa en el tiempo de estancia hospitalaria (p < 0,095), en contraste con lo reportado en las más recientes revisiones sistemáticas, metaanálisis y guías de práctica clínica de pacientes en cuidados críticos (36,38,39), probablemente debido a lo tardío de la instauración del soporte nutricional.
Con la finalidad de aportar, una base calórica suficiente y adecuada en la condición crítica, el requerimiento calórico se otorgó de manera individual, calculado por la fórmula de Harris y Benedict, lo que permitió conocer el porcentaje de cobertura del requerimiento energético basal y el progreso paulatino de acuerdo con las condiciones metabólicas particulares de cada paciente. La carga calórica media fue de 34,28 ± 8,13 kcals/kg/día, cubriendo el GMT en un 85,94 ± 14,67 %, con una moda del 100 %. En este punto cabe resaltar que la media calórica general fue de 1988,0 ± 505,9 kcals/día, con un valor mínimo de 702 kcals y un máximo de 3119 kcals/día, cubriendo el requerimiento considerado óptimo (70 al 100 % del GMT) de acuerdo a la recomendación para pacientes críticos (8,36). La heterogeneidad de la carga calórica deriva de la diferencia del peso corporal de cada paciente en nuestra población de estudio, que presentó una media de peso general de 61,26 ± 13,3 kg con un valor mínimo de 20,7 kg y máximo 98 kg.
La suplementación parenteral con AG Ω3 EPA/DHA en este estudio demostró una mejoría de la condición clínica evidenciada a través de los resultados en las variables clínicas como en la generalidad de los marcadores de pronóstico utilizados, así como en la disminución significativa de la probabilidad de mortalidad, elevando así la esperanza de sobrevida para ambas dosis estudiadas.
El comportamiento de los marcadores de pronóstico clínico SOFA, APACHE II, SAPS 3, NUTRIC, RTL y CRS fue consistente al mostrar una mejoría significativa del pronóstico en ambas dosis de suplementación, y fueron invariables con los resultados obtenidos para el grupo de control, al no presentar diferencia significativa en las determinaciones basal y final, infiriéndose así la efectividad de la suplementación de la NPT con AG Ω3 EPA/DHA de origen marino. Este resultado concuerda con lo obtenido en 2019 por Donoghue y cols. para el marcador SOFA; sin embargo, los resultados obtenidos por nuestro grupo de trabajo difieren para el APACHE II al igual que con los resultados obtenidos en el mismo año por Meng y cols., ya que no obtienen diferencias significativas en sus determinaciones de este marcador (17,40). Por otro lado, los resultados referentes a SAPS 3 coinciden con lo obtenido en 2006 por Heller y cols., debido a que ellos obtienen resultados favorables en la reducción de la mortalidad predicha por SAPS II (41), marcador antecesor al utilizado en este trabajo. Los resultados obtenidos en los marcadores de pronóstico clínico SOFA, APACHE II, SAPS 3, NUTRIC, RTL y CRS muestran que se trata de herramientas potencialmente útiles para valorar la suplementación con los AG Ω3 EPA/DHA.
Los resultados obtenidos para la probabilidad de sobrevida y mortalidad, con determinación de significancia estadística con Chi cuadrado de 10,68 (p < 0,005), reflejan lo predicho en los resultados de los marcadores clínicos, al mejorar el pronóstico basal posterior a la administración de ambas dosis de suplementación de AG Ω3 EPA/DHA. Finalmente, es importante subrayar que, independientemente de lo demostrado para ambas dosis de suplementación con AG Ω3, la dosis de 0,1 g/kg/día presentó mejores resultados para el tiempo de sobrevida y la disminución de la mortalidad, así como en los parámetros clínicos FR, PAS, FiO2 y el parámetro de resolución del estado infeccioso LT.
Las limitaciones del estudio estuvieron marcadas por las condiciones y el tiempo frente a la situación mundial de la pandemia de COVID-19, ya que este evento no permitió la aleatorización del grupo de control, por lo que se utilizó un grupo de control histórico menor que los grupos de intervención; por otro lado, el tiempo destinado al estudio se extendió tres veces lo previsto; aunado a lo dicho anteriormente, la instauración del soporte nutricional fue tardía.
Las perspectivas futuras con respecto a este estudio son: la necesidad de un número mayor de sujetos de estudio para definir las dosis óptimas y seguras, así como los tiempos mínimo y máximo seguros de suplementación; finalmente, es imprescindible realizar la determinación de la sensibilidad y especificidad de los marcadores de pronóstico clínico frente a la suplementación de AG Ω3 EPA/DHA.
CONCLUSIÓN
A manera de conclusión, podemos decir que la suplementación de la nutrición parenteral con los AG Ω3 EPA/DHA a dosis de 0,1 g/kg/día y 0,2 g/kg/día mejora el pronóstico de recuperación y la probabilidad de sobrevida de los pacientes críticos e influye positivamente en los parámetros clínicos de la función inmunológica, respiratoria, renal y de resolución del estado de infección.