INTRODUCCIÓN
El tratamiento médico nutricional consiste en el aporte de los nutrientes necesarios para mantener las funciones vitales cuando no es posible la alimentación convencional, así sea mediante nutrición enteral (NE), nutrición parenteral (NP) o la combinación de ambas (21). Su objetivo es múltiple: conseguir un correcto estado nutricional, evitar la desnutrición, influir terapéuticamente en el curso de la enfermedad mediante la combinación de diferentes nutrientes y reducir la morbimortalidad.
En los pacientes críticos el aporte de nutrientes por vía enteral es el preferible (22,23-26), quedando como alternativa la NP para aquellos casos en los que no es posible o suficiente la de tipo enteral.
NUTRICIÓN PARENTERAL
La NP puede administrarse por vía venosa periférica (VVP) o por vía central (VVC), que es la opción más habitual en UCI, optándose por una u otra dependiendo de factores tales como la osmolaridad, la duración del tratamiento, el aporte energético y los requerimientos nutricionales necesarios (27).
En cuanto a la colocación de dispositivos, la VVP es un catéter que se inserta con técnica aséptica mientras que la VVC al ser un catéter más invasivo, se realiza con técnica estéril siguiendo el protocolo BZ (bacteriemia cero).
En lo que respecta al procedimiento de administración de la NP, se deben tener en cuenta algunas consideraciones básicas: en caso de ser NP de Farmacia, se retirará del frigorífico 30-60 minutos antes de su administración y se seguirá el siguiente protocolo: revisar la bolsa de nutrición, observar las características de la solución y su caducidad; realizar higiene de manos y ponerse guantes, conectar el sistema de infusión y filtro a la bolsa de NP y purgarlo; aplicar antiséptico en conector del catéter; comprobar la permeabilidad del catéter y conectar el sistema; administrar NP, siempre que sea posible, como única perfusión de la luz; programar la velocidad de infusión; registrar procedimiento (27).
Los cuidados básicos de Enfermería en la NP se resumen, básicamente, en tres aspectos: a) punto de punción: curar, vigilar signos de infección, reducir la manipulación de la vía y utilizar técnica aséptica; b) sistemas y filtros: cambiar cada 24 h y evitar tanto llaves de tres pasos como tapones antirreflujo; y c) NP: cambiar cada 24 h desechando lo que sobre y no utilizar soluciones con partículas o si los lípidos se han separado en capa diferenciada (27).
Las complicaciones que pueden surgir con la NP pueden ser, fundamentalmente, mecánicas (malposición del catéter, obstrucción del mismo, punción), metabólicas (hiper-hipoglucemias, hiperosmolaridad, hipertrigliceridemia, etc.) y/o sépticas (contaminación del contenido de la NP, de las vías de administración y de las conexiones) (27).
NUTRICIÓN ENTERAL
La NE se administra a través de una sonda, pudiendo precisarse o no técnica quirúrgica. Las sondas sin técnica quirúrgica son las más utilizadas, y pueden ser de tres tipos: nasogástricas –SNG– (las más empleadas) (24), nasoduodenales y nasoyeyunales –SNY– (21,28). Dentro de las sondas que precisan técnica quirúrgica están la gastrostomía (quirúrgica, endoscópica, radiológica) y la yeyunostomía (quirúrgica, endoscópica o radiológica).
Para colocar una sonda sin técnica quirúrgica se precisan, entre otros materiales: SNG/SNY, bolsa colectora, jeringa, lubricante, guantes, fonendo, batea y esparadrapo.
En nuestro caso, el procedimiento que habitualmente seguimos en UCI para insertar la SNG se asienta en una serie de pasos y medidas básicas: informar al paciente; higiene de manos y uso de guantes; colocar al paciente en posición Fowler; medición de la longitud a introducir (distancia entre la punta de la nariz hasta el lóbulo de la oreja y, desde ahí, hasta el apéndice xifoides); cubrir el pecho con un empapador y batea (por posible vómito); lubricar la punta de la sonda con lubricante hidrosoluble o agua, e introducirla suavemente con movimiento rotatorio hasta la distancia marcada; fijar la sonda y conectarla a la bolsa colectora; anotar en la hoja de registro de cuidados de enfermería la fecha, tipo de sonda y longitud de colocación (29).
En cuanto al procedimiento que se sigue para colocar la SNY, destacar tan solo algunas consideraciones importantes: se realizará una radiografía toracoabdominal para comprobar la correcta colocación de los dos extremos (gástrico en cámara gástrica y yeyunal más allá del ángulo de Treitz); iniciar NE por extremo yeyunal y siempre mediante infusión continua; realizar lavados de la sonda con 20-50 cc de agua c/6 h para evitar su obstrucción; conectar el extremo gástrico a una bolsa de descompresión; la medicación se administrará por la luz gástrica y se pinzará la sonda 20 minutos; solo administrar por la luz yeyunal los inmunosupresores en los pacientes con trasplante hepático.
Actualmente existen muchos métodos para hacer la comprobación de las sondas sin técnica quirúrgica. El método tradicional se basa en introducir aire con una jeringa por la sonda y auscultar en el área epigástrica con un estetoscopio. También (siendo la técnica menos frecuente) se puede medir el pH aspirado (gástrico 0,8- 5; intestinal 6,5; respiratorio ≥ 7). Con todo, el método gold standard de comprobación de estas sondas es a través de radiografía con contraste (20 ml de contraste radiológico y validación por el médico intensivista) (29).
Los cuidados de Enfermería en NE se van a centrar, fundamentalmente, en evitar la broncoaspiración por regurgitación de la dieta, evitar la formación de úlceras por decúbito en nariz y mucosa gástrica, evitar la obstrucción de la sonda enteral y otras posibles complicaciones (Tabla III).
Tabla III. Cuidados básicos de Enfermería en pacientes críticos con nutrición enteral.

SNG: sonda nasogástrica; SNY: sonda nasoyeyunal.
En cuanto a los dispositivos con técnica quirúrgica, la gastrostomía es una técnica quirúrgica que se hace por endoscopia percutánea (PEG), manteniendo todas las medidas de asepsia propias de un quirófano. Tras la realización de la técnica, se deben anotar las marcas de referencia de la fijación de la sonda con respecto a la pared abdominal. La dieta puede iniciarse a las 6 horas del procedimiento. Como cuidados básicos a implementar, se deben comprobar diariamente las marcas de referencia de la sonda, la zona de piel alrededor de la sonda debe mantenerse limpia y seca, y la sonda debe girarse con facilidad y moverse hacia fuera y hacia dentro.
La yeyunostomía es una técnica que se hace en el quirófano. Al ingreso del paciente se anotará la posición de la sonda con respecto a la pared abdominal. La dieta se iniciará tras orden médica. Se realizarán lavados cada 6 horas para evitar obstrucción. En ningún caso se conectará la vía yeyunal a bolsa de drenaje. Principalmente se aconseja realizar dos cuidados básicos: diariamente hay que comprobar la marca de referencia (no se puede movilizar) y se debe mantener la piel de alrededor limpia y seca.
La higiene de manos es indispensable y no debe olvidarse nunca, puesto que reduce el riesgo de contaminación de cualquier elemento que se esté manipulando para la NE o la NP.
INICIO DE LA NUTRICIÓN
Una vez decidido el tipo de nutrición a llevar a cabo, y cuando se opta por empezar con NE, se deben asumir una serie de condiciones:
- La administración de la NE se hará en régimen continuo en todos los casos, salvo indicación en contra (21).
- Las dietas se administrarán durante 23 horas, con una hora de descanso (21).
- Los sistemas utilizados para la administración de la NE serán cambiados una vez al día, coincidiendo con el nuevo periodo de dieta tras el descanso.
- En los pacientes que tengan perfusión de insulina, esta se suspenderá durante el descanso y se reiniciará cuando se inicie la dieta.
- El paciente mantendrá una posición semisentada durante la administración de la NE (25).
Para comenzar con la NE (inicio de tolerancia), en nuestro centro se sigue un algoritmo que parte de la medición de residuo gástrico; si este se sitúa por encima de 300 ml, no se inicia la nutrición, mientras que si está por debajo se iniciará la dieta por SNG (con fórmula hipercalórica-hiperproteica) a 20 ml/h (30). Se vuelve a realizar la medición del residuo gástrico a las 6 h (Fig. 3).
El primer día (tolerancia) se administra fórmula hipercalórica-hiperproteica en función de la tolerancia y con descansos cada 6 h, a un ritmo de infusión de 20-30-40 ml/h. Ya en el segundo día, el volumen/24 h de fórmula hipercalórica-hiperproteica es de 1 200 ml, con descansos cada 12 h, y a un ritmo de 52 ml/h. En el tercer día se administra la nutrición prescrita, a dosis plena y con el volumen requerido por paciente, a un ritmo indicado de forma individualizada (24).
Actualmente se cuenta con diferentes tipos de dietas para administrar por vía enteral y deben elegirse en función de la fase en la que se encuentre el paciente, las necesidades individuales, la tolerancia a la NE y la existencia o no de patología digestiva. Los protocolos de nutrición y el personal bien entrenado ayudan a garantizar un aporte nutricional correcto al paciente crítico (21,31).
FACTORES CONDICIONANTES DEL APORTE NUTRICIONAL
La prescripción inadecuada, los problemas en la administración de la dieta y las complicaciones asociadas a la NE son los principales factores que pueden interferir en el aporte nutricional correcto en el paciente crítico.
La eficacia en el aporte de nutrientes se determina mediante la relación entre el volumen de nutrientes recibidos por los pacientes y el volumen que ha sido prescrito de acuerdo con los cálculos realizados. En condiciones ideales, el balance debe ser > 75 %; en un balance < 60 %, estaría indicada la NP complementaria (21,24,31,32).
Los problemas asociados con la administración de la dieta pueden deberse, fundamentalmente, a tres factores: a) sistemas inadecuados (sistemas de gravedad, no recomendables, bombas sin lavado periódico de la SNY, conexiones no adecuadas); b) problemas mecánicos (obstrucciones de la sonda, erosiones de la mucosa, auto retirada de la sonda); y c) retraso en el inicio de la NE (22,31).
Las complicaciones de la NE constituyen el principal factor condicionante del descenso en la eficacia nutricional del paciente crítico. Se sabe que las complicaciones gastrointestinales son las más frecuentes (50-70 % de los pacientes) y requieren más atención por las medidas que se deben instaurar. Dentro de estas complicaciones gastrointestinales, las más relevantes son el aumento del residuo gástrico (ARG), la diarrea asociada a la NE, la distensión abdominal, los vómitos y la regurgitación, y el estreñimiento (25,28,30-32).
El ARG se caracteriza por la presencia de volumen de drenado aspirado superior a 500 ml, siendo la complicación más frecuente (21,24,25,28,33). En su origen pueden estar implicados factores relacionados con la ingesta o con la dieta, neuroendocrinos, farmacológicos y/o alteraciones patológicas (gastropatías). Como principal consecuencia, se eleva el riesgo de reflujo gastroesofágico que puede dar lugar a broncoaspiración. Ante un ARG, hay que conocer qué velocidad de infusión de NE tiene el paciente, qué aporte calórico recibe y si se necesita suplemento de NP (Fig. 4).

Figura 4. Algoritmo de actuación frente al aumento del residuo gástrico (ARG: aumento del residuo gástrico; SNG: sonda nasogástrica; SNY: sonda nasoyeyunal).
La diarrea asociada a la NE se establece cuando hay presencia de un número ≥ 5 deposiciones diarreicas o más de 2 deposiciones de un volumen igual o superior a 1 000 ml, pudiendo causar malestar del paciente y malabsorción de la dieta/desnutrición. Puede estar provocada por factores relacionados con la dieta, con la técnica de administración, con factores infecciosos y/o con factores vinculados a la medicación concomitante. La actuación frente a este trastorno depende de si la diarrea es inicial o tardía (Fig. 5).
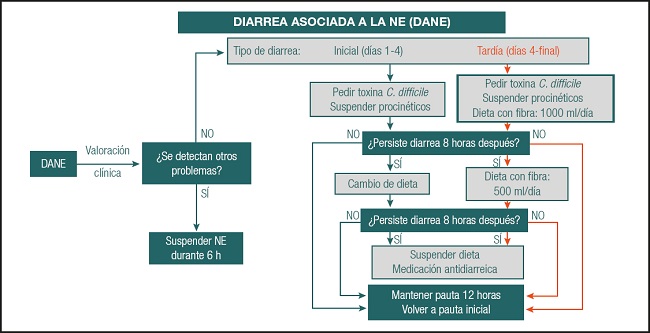
Fuente: cita 34.
Figura 5. Algoritmo de actuación frente a la diarrea asociada a la NE (DANE: diarrea asociada a la nutrición enteral; NE: nutrición enteral).
La distensión abdominal alude a cambios en la exploración abdominal, generalmente con aumento del diámetro de la cavidad abdominal, con respecto a la que el paciente presentaba antes del inicio de la NE. En estos casos es útil valorar el perímetro abdominal para detectar tendencia al aumento de este y valorar la presión intraabdominal (PIA) (recomendable suspender la NE cuando sea > 25 mmHg) (24,30). Puede estar provocada por un desequilibrio entre oferta de nutrientes y capacidad funcional del tubo digestivo, o por patología digestiva local. Entre sus consecuencias destacan la aparición de diarrea, malestar del paciente y malabsorción de la dieta. Para valorar este problema, se detiene la NE durante 6 horas, procediendo seguidamente a una valoración clínica (Fig. 6).
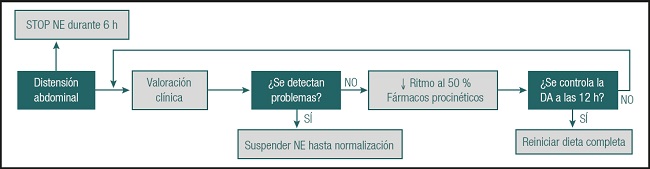
Fuente: cita 34.
Figura 6. Algoritmo de actuación frente a la distensión abdominal (NE: nutrición enteral; DA: distensión abdominal).
Los vómitos y la regurgitación pueden deberse a un origen central (raras ocasiones), a problemas mecánicos relacionados con la sonda (acodamientos, localización incorrecta…), posiciones horizontales del paciente y/o alteraciones de la motilidad gástrica. El manejo clínico de ambos desórdenes es idéntico y también parte de la decisión de detener la NE durante 6 horas (Fig. 7).

Fuente: cita 34.
Figura 7. Algoritmo de manejo de los vómitos y la regurgitación (NE: nutrición enteral; SNG: sonda nasogástrica).
El estreñimiento (considerado como una ausencia de deposiciones tras 4 días de NE) puede estar provocado, principalmente, por una dieta pobre en residuos, alteraciones de la motilidad intestinal (propias o por fármacos) y/o por patología digestiva local. Provoca malestar en el paciente e impactación fecal. En nuestro medio ponemos especialmente el acento en la prevención de este trastorno, activando un protocolo de actuación cuando se va a iniciar la NE en un paciente para evitar que aparezca (Fig. 8).

Fuente: cita 34
Figura 8. Algoritmo para la prevención del estreñimiento en pacientes que van a iniciar una NE (NE: nutrición enteral).1En cualquier momento de su estancia en la Unidad de Cuidados Intensivos.2A las 48 h si no deposición, reintroducir Macrogol® 3.350, 1 sobre c/8 h, hasta obtener deposición, luego suspender laxante de nuevo.3Valorar factores de riesgo: inmovilidad, benzodiacepinas, opiáceos, pentotal, relajantes musculares, soporte nutricional no adecuado.4Valorar obstrucción intestinal:– Síntomas: distensión abdominal, dolor cólico, vómitos (fecaloideos).– Signos: ruidos. aumentados; metálicos/silencio abdominal.– Pruebas: valorar Rx abdominal.
En ocasiones se suspende la NE y esto puede hacerse de forma justificada e indicada o sin contar con motivos aparentes. En general, esta suspensión puede estar indicada cuando hay sospecha de patología abdominal, en el proceso de extubación o traqueotomía, cuando hay vómitos (una vez descartada la causa), en endoscopia digestiva/ecocardiografía transesofágica o para el manejo protocolizado de complicaciones gastrointestinales de la NE (21,30). Se considera innecesario e inadecuado suspender la NE en casos tales como la preparación para cirugía, la fibrobroncoscopia, la realización de pruebas diagnósticas (tomografía axial computarizada, resonancia magnética), por cambios posturales, en el paciente sometido a ventilación mecánica no invasiva, ante alteraciones analíticas (hiper-hipoglucemia, hiper-hiponatremia…), por agitación del paciente, en ausencia de ruidos peristálticos y, en general, cuando no haya una razón clínica documentada (22,23).
DOS MENSAJES FINALES
Para concluir, destacar dos ideas:
- En el proceso de nutrición de los pacientes críticos siempre es necesario medir el residuo gástrico, aunque es un parámetro que está sujeto a cierta controversia, ya que se empieza a cuestionar su relevancia debido a que la medición de volumen de residuo gástrico (VRG) no es una técnica estandarizada ni validada (25).
- El aporte nutricional correcto en el paciente crítico requiere un alto grado de seguimiento por parte de los profesionales sanitarios, siendo el personal de Enfermería el que está en contacto directo constante con el paciente.















