INTRODUCCIÓN
Los gasotransmisores son moléculas gaseosas producidas de forma endógena, capaces de atravesar mediante difusión las membranas celulares y regular cascadas de señalización. Dentro de los gasotransmisores conocidos se encuentran el óxido nítrico (NO), el monóxido de carbono (CO) y el sulfuro de hidrógeno (H2S). Particularmente, el H2S actúa como modulador del sistema nervioso, el sistema cardiovascular y el sistema intestinal. Además, posee efectos cardioprotectores y regula procesos inflamatorios, mitocondriales y del metabolismo energético. La producción endógena de H2S puede favorecerse al asegurar una ingesta adecuada de los aminoácidos precursores para su síntesis, como la cisteína y la metionina. Adicionalmente, el consumo adecuado de alimentos ricos en donadores naturales de H2S, tales como el ajo, la cebolla y el brócoli, puede aumentar la concentración de H2S y sus efectos benéficos.
En la presente revisión se recapitularán los efectos benéficos del H2S sobre el metabolismo energético, la obesidad y las enfermedades relacionadas. Además, se aportarán sugerencias para incrementar la ingesta dietética de donadores de H2S y sustratos que favorezcan su síntesis endógena.
VÍAS DE SÍNTESIS DEL SULFURO DE HIDRÓGENO
El H2S, también conocido como ácido sulfhídrico, ácido hidrosulfúrico o gas de alcantarilla, es un gas inflamable, incoloro y con un característico olor a huevo podrido que fue descrito en el siglo XVIII por Ramazzini como gas tóxico ambiental (1). En 1996, Abe y Kimura propusieron que el H2S tiene efectos como neuromodulador por su capacidad de señalización a nivel cerebral (2). Posteriormente, fue incluido en la familia de los gasotransmisores junto al NO y al CO (3).
El H2S se produce en las células de los mamíferos por dos vías: la enzimática y la no enzimática. Por la vía enzimática, su síntesis puede comenzar a partir de los aminoácidos metionina (Met) o L-cisteína a través de las vías de transmetilación y transulfuración. La vía de la transmetilación se lleva a cabo por acción de la metionina-adenosiltransferasa (MAT), que condensa una Met proveniente de la dieta con una adenosina proveniente del ATP para formar S-adenosilmetionina (SAM); luego, una metiltransferasa (MT) cataliza la formación de la S-adenosilhomocisteína (SAH) al transferir el grupo metilo proveniente de SAM a un aceptor (R), para finalmente ser hidrolizada por la SAH-hidrolasa (SAHH) y obtener homocisteína (Hcy), que podrá ser remetilada hacia Met o entrar a la vía de la transulfuración (4) (Fig. 1).
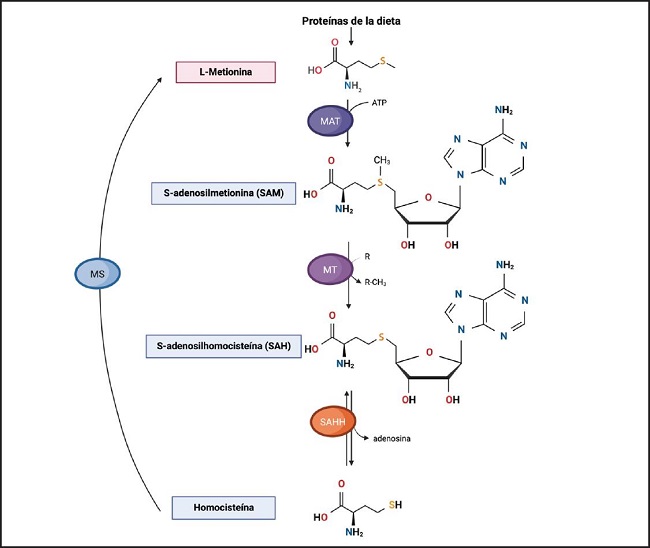
Figura 1. Vía de transmetilación. A partir de las proteínas provenientes de la dieta se obtiene al aminoácido esencial L-metionina (L-Met). La L-Met es condensada por la MAT utilizando ATP, formando a SAM. Posteriormente, la SAM, catalizada por MT, dona grupos metilo, formando productos metilados y la SAH. Luego, la SAH es hidrolizada por la SAHH en homocisteína (Hcy) y adenosina. La Hcy entra a la vía de transulfuración y también puede ser remetilada hacia Met por acción de la MS. Cuando la vía de transmetilación se acopla a la de transulfuración, la metionina derivada de la dieta puede convertirse mediante una serie de reacciones reversibles en homocisteína o continuar hasta formar de manera irreversible L-cisteína, contribuyendo a la síntesis de H2S (MAT: metionina-adenosiltransferasa; SAM: S-adenosilmetionina; MT: metiltransferasas; SAH: S-adenosilhomocisteína; SAHH: SAH-hidrolasa; MS: metionina-sintasa [44]).
La Hcy derivada de la vía de transmetilación pasa por una serie de reacciones enzimáticas que componen la vía de la transulfuración para generar L-cisteína. En el citosol, el H2S es sintetizado por dos enzimas dependientes de piridoxal fosfato (PLP): la cistationina-γ-liasa (CSE) y la cistationina-β-sintasa (CBS). Además, tanto en el citosol como a nivel mitocondrial, el H2S es producido por la enzima 3-mercaptopiruvato sulfuro-transferasa (3-MST) en conjunto con la cisteína-aminotransferasa (CAT) (5) (Fig. 2).

Figura 2. Vía de transulfuración, síntesis enzimática del H2S. La homocisteína, proveniente de la vía de la transulfuración, pasa por una reacción de condensación con L-serina llevada a cabo por la CBS, formando cistationina. Posteriormente, la cistationina sufre una hidrólisis por acción de la CSE, generando L-cisteína. Luego, en el citosol, la L-cisteína puede ser catabolizada tanto por la CSE como por la CBS; o en la mitocondria, por acción de la CAT y la 3-MST para la síntesis de H2S (CBS: cistationina-β-sintasa; CSE: cistationina-γ-liasa; CAT: cisteína-aminotransferasa; 3-MST: 3-mercaptopiruvato sulfuro-transferasa [5]).
La CBS genera cistationina mientras convierte la cisteína en serina y lantionina para posteriormente producir H2S. Por otro lado, la enzima 3-MST cataliza la conversión de 3-mercaptopiruvato a piruvato mediante la degradación de la cisteína. En estas reacciones, la cisteína es convertida por la cisteína-aminotransferasa (CAT) a 3-mercaptopiruvato mediante la incorporación de α-cetoglutarato a la reacción. En el siguiente paso, la 3-MST forma un persulfuro al transferirse un azufre desde el 3-mercaptopiruvato, lo cual, bajo la presencia de un reductor como la tiorredoxina, produce piruvato y H2S (6) (Fig. 2).
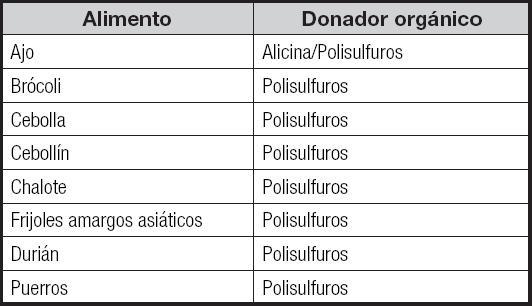
La producción no enzimática de H2S se lleva a cabo a partir de la glucosa, el glutatión, los polisulfatos orgánicos (que se encuentran presentes en el ajo) y el azufre elemental (7). Podemos encontrar compuestos que funcionan como donadores de grupos sulfuro. Este grupo incluye: 1) donadores inorgánicos como el sulfhidrato de sodio (NaHS) y el sulfuro de sodio (Na2S); 2) donadores sintéticos como el GYY4137; y 3) donadores orgánicos de origen natural que se encuentran presentes en algunos vegetales como el ajo, la cebolla y el brócoli.
IMPORTANCIA BIOLÓGICA DEL SULFURO DE HIDRÓGENO EN LA SALUD HUMANA
El H2S es una molécula involucrada en vías de señalización en múltiples aparatos y sistemas, tales como el sistema nervioso y el cardiovascular (8). Además, participa en una gran variedad de funciones como la relajación del músculo liso y la protección de las neuronas y el músculo cardíaco contra el estrés oxidativo, y ayuda a mantener la secreción de insulina, disminuye la presión arterial al relajar los vasos sanguíneos y tiene efectos antiapoptóticos y antiinflamatorios (9).
PARTICIPACIÓN DEL SULFURO DE HIDRÓGENO EN LAS ENFERMEDADES CRÓNICO-METABÓLICAS
Se ha observado que el H2S puede estar relacionado con padecimientos como la obesidad y la diabetes mellitus de tipo 2 (DM2) que, por su naturaleza, guardan un estrecho vínculo con el estado nutricional de quien las padece.
La obesidad es un padecimiento de gran relevancia en la investigación científica y clínica debido a su creciente prevalencia y al gran número de enfermedades asociadas, siendo uno de los focos de interés principales el estudio del tejido adiposo (10). El H2S ejerce una gran variedad de efectos sobre el adipocito que incluyen la adipogénesis, el metabolismo lipídico, la sensibilidad a la insulina y la secreción de adipocinas (11). Estudios recientes han mostrado que el H2S incrementa la actividad del receptor activado por proliferadores de peroxisomas γ (PPARγ), además de ser capaz de aumentar la captura de glucosa y el almacenamiento lipídico (12).
Asimismo, se ha estudiado el H2S como mediador antiinflamatorio en la obesidad. En este padecimiento existe una disminución de la disponibilidad de H2S en los macrófagos de tejido adiposo. En este sentido, en un estudio en el que se evaluó un donador de H2S (GYY4137) en cultivos de células 3T3-L1, se logró disminuir el efecto generado por la inflamación durante el proceso de adipogénesis (13). Además, se ha observado que en explantes de tejido adiposo humano, el H2S exógeno o la activación de su síntesis endógena incrementaron la adipogénesis, la sensibilidad a la insulina y la actividad de la enzima deacetilasa dependiente de NAD sirtuina 1 (SIRT1), así como la actividad transcripcional de PPARγ, mientras que al inhibir la producción de H2S se alteró la diferenciación del adipocito, produciéndose senescencia celular, y hubo un incremento de los procesos inflamatorios (14).
Por otro lado, existe controversia respecto a los efectos del H2S en la DM2. En modelos animales de esta patología se ha observado que los niveles de H2S se encuentran disminuidos, así como la expresión de las enzimas involucradas en su síntesis, tanto en los islotes pancreáticos como en el hígado. Además, el H2S es capaz de inhibir la secreción de insulina estimulada por glucosa en los islotes pancreáticos (15). En contraste, Takahashi y colaboradores recientemente demostraron que el H2S puede estimular la secreción de insulina mediante la regulación de la metiltiolación del tRNA en la síntesis de proinsulina (16).
SUSTRATOS O PRECURSORES DEL SULFURO DE HIDRÓGENO EN LA DIETA
Aunque resulta difícil realizar una estimación real de la cantidad de H2S formada por cantidad de alimento, quizá debido a las propiedades naturales y al metabolismo de la molécula, como su volatilidad y reactividad (17), y a factores involucrados en la asimilación de alimentos por el cuerpo humano (edad, sexo, estado de nutrición, dieta habitual etc), existe evidencia científica que valida la capacidad de ciertos alimentos o nutrimentos para modificar la formación de este gasotransmisor. Esto dependería de la cantidad de aminoácidos sulfurados y/o moléculas donadoras que contengan. Por ejemplo, se ha reportado que cuando se suplementa con S-adenosil metionina, se produce un incremento de aproximadamente el 50 % en la actividad de CBS que promueve la producción de H2S en hígado y riñón, mientras que la adición de amino-oxiacetato (un inhibidor de la CBS) bloquea la producción de H2S (18). Así mismo, investigaciones en células y modelos animales han mostrado que el consumo de alimentos ricos en sustratos y donadores orgánicos de H2S incrementa la producción del mismo. En un estudio en células, al adicionar dos dientes de ajo diluidos (entre 5 y 6 gramos diluidos en 5 L, aprox.) a glóbulos rojos humanos hubo un incremento de 8 µM de H2S (19). El aceite esencial de frijoles amargos asiáticos aumentó la producción de H2S al administrar 2 g/mL a células MCF-7 (20). En un ensayo clínico donde participaron 130 voluntarios que consumieron 400 g de brócoli durante 12 semanas, los autores encontraron que hubo una reducción de LDL en el plasma (21). Así, aunque no es factible la cuantificación por alimento, la producción de H2S sí está relacionada con el aporte dietético de sus precursores orgánicos.
DIETAS MODIFICADAS EN CISTEÍNA Y METIONINA
Cisteína
En mamíferos, la cisteína (Cys) es un aminoácido no esencial que contiene azufre y se produce endógenamente por el metabolismo de su precursor, el aminoácido esencial metionina (22).
La cisteína participa tanto en la estructura como en la función de las proteínas y actúa de manera directa e indirecta para controlar el estrés oxidativo, incrementa la biodisponibilidad del NO y tiene un papel importante en el metabolismo de la insulina y la glucosa, además de mantener bajos los niveles de aldehídos reactivos y ayudar en la regulación de la presión arterial (22). Incluso se ha propuesto al H2S como probable responsable de la reducción de la presión arterial y los infartos que se ha observado con el consumo de una dieta rica en proteínas (23).
Por otro lado, los niveles plasmáticos de cisteína total correlacionan consistentemente con el índice de masa corporal (IMC), la cantidad de masa grasa y el índice de cintura/cadera en algunos estudios en humanos (24). En el 2012, Elshorbagy y colaboradores compararon en un modelo murino el efecto de una dieta baja en cisteína (LC) y el de una dieta alta en cisteína (HC), observando que los ratones con HC presentaban una ganancia mayor de peso, un incremento en el porcentaje de grasa visceral y un aumento de los niveles de triglicéridos hepáticos cuando se comparaban con los ratones con LC, pudiendo esto orientar a que una dieta alta en cisteína puede ser capaz de promover un incremento en la adiposidad, indicando una causalidad en la asociación de la Cys plasmática total y la obesidad en los seres humanos (25).
Por otro lado, los esquemas frecuentemente utilizados para aumentar el aporte de cisteína de manera experimental en modelos animales son: Altromin 1314, dieta enriquecida con 4 g de L-cisteína/kg, mientras que la dieta estándar contenía 3.244 g de cisteína/kg (26); o la administración del fármaco N-acetil cisteína (NAC) como tratamiento para dar un mayor aporte de cisteína, con diferentes esquemas como pueden ser 150 mg/kg de peso, de forma oral por 1 semana (27). Entre los alimentos con alto contenido de cisteína se encuentran: pollo, huevo, carne de res y granos enteros (23) (Tabla I).
Tabla I. Contenido de cisteína y metionina por porción de 100 g de algunos alimentos (45).
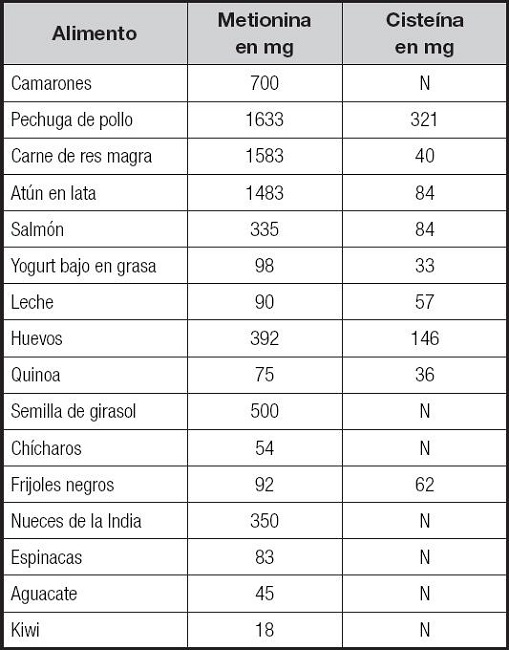
N: no se conoce, contiene trazas o no contiene.
Metionina
Por su parte, la metionina es un aminoácido esencial que contiene azufre y tiene un papel clave como sustrato en la síntesis de proteínas; funciona como donante de grupos metilo para DNA, RNA y otros aceptores, y como precursor de la cisteína en la ruta de transulfuración (28,29). Es un aminoácido vital para el crecimiento y mantenimiento de la masa magra corporal en los humanos, por lo que se le ha propuesto para usarse como suplemento con este fin; sin embargo, debido a que la metionina también es el precursor de la homocisteína, su ingesta excesiva puede provocar hiperhomocisteinemia, que es un factor de riesgo de enfermedad cardiovascular (30). De igual manera, el incremento del consumo de metionina también se ha asociado con un IMC elevado y una mayor prevalencia de la DM2 (31). Los artículos publicados acerca de la ingesta dietética de aminoácidos, en especial la metionina, mencionan que su restricción puede tener efectos benéficos para la salud en un contexto de obesidad (32). En modelos de ratones con obesidad inducida por una dieta alta en grasa, esta restricción mejoró el perfil lipídico y la hepatoesteatosis. Además, se encontró en este mismo modelo que esta restricción contribuyó al equilibrio del estrés oxidativo en el hígado mediante la regulación positiva de las vías de transulfuración de la metionina, aumentando los niveles plasmáticos de H2S (33).
Esto es interesante porque el H2S demostró mejorar el metabolismo de los lípidos, aumentando la producción de glucosa y la disminución del estrés oxidativo en un estado fisiológico en el mismo modelo de obesidad inducido por la dieta rica en grasas. Así que la restricción de metionina alivia el estrés oxidativo a través de la producción endógena de H2S, mejorando el metabolismo hepático y el estado inflamatorio en estos ratones (34).
La ingesta diaria recomendada de metionina es de 14 mg/kg de peso/día, aunque existen otras recomendaciones de 13-16 o incluso hasta 19 mg/kg de peso/día. Como referencia, podemos trasladar estos valores a un hombre adulto de 70 kg, que debería consumir entre 910 y 1330 mg/día. Esta cantidad se puede obtener al consumir 70-100 g de proteína al día (35), por lo que se recomienda únicamente cumplir con el requerimiento diario recomendado (32).
DIETAS RICAS EN DONADORES ORGÁNICOS DE H2S
Es de nuestro conocimiento que el consumo de ajo y cebolla es benéfico para la prevención o tratamiento de las enfermedades cardiovasculares, la trombosis, la hipertensión y la diabetes. En estos casos es el efecto de la alicina, el más común de los tiosulfatos, que se descompone en dialildisulfatos (DADS), dialilsulfato (DAS) y dialiltrisulfatos (DATS) (36). El ajo fresco contiene varios compuestos orgánicos ricos en sulfuro, oligoelementos y compuestos fenólicos y esteroides, junto con carbohidratos, proteínas y fibra. Por un lado, podemos encontrar compuestos liposolubles como dialildisulfuros DADS y DATS. Por otra parte, tiene compuestos solubles en agua como gamma-glutamil-s-alilcisteína (SAC) y s-alil-mercaptano-cisteína (SAMC); todos los compuestos mencionados se conocen como aliinas. Cuando el bulbo (cabeza) del ajo se pica o exprime, la aliina se metaboliza en alicina mediante la acción de la alinasa. La alicina es autorreactiva y se convierte rápidamente en compuestos más estables, como polisulfuros (37).
Algunas investigaciones han informado que los compuestos como los DATS, que son abundantes en los aceites de ajo, pueden participar en tiol-intercambio de disulfuro o reacciones de transferencia de azufre impulsadas por enzimas. Estos procesos, además de producir H2S, pueden generar otras especies de azufre reactivas tales como dihidropersulfuros (H2S2), dihidropolisulfuros (H2Sn), hidropersulfuros (RH2S) e hidropolisulfuros (RSnH); estos compuestos se han detectado en los cerebros de algunos animales, donde funcionan como importantes moléculas de señalización y citoprotectores contra el estrés oxidativo (38). Una investigación realizada sobre estos compuestos arrojó que los eritrocitos convierten a los DADS, DAS y DATS en H2S en presencia de tioles libres (19). Recientemente, en un estudio en el que se administró alicina a ratones con obesidad inducida por una dieta rica en grasas, se pudo observar una restricción de la ganancia de peso asociada a lipólisis y termogénesis (39).
Actualmente se ha investigado la capacidad de liberación de H2S a partir de aceites esenciales de una amplia gama de plantas dietéticas, incluidas los frijoles amargos asiáticos (Parkia speciosa), el durián (Durio zibethinus), que es un fruto exótico del sudeste asiático, la cebolla amarilla (Allium cepa), los puerros (Allium porrum) y el ajo (Allium sativum). En células de mamíferos cultivadas expuestas a estos aceites se ha detectado un aumento de la producción de H2S, lo que sugiere que, con la incorporación de estas plantas a la dieta, los polisulfuros que aportan aumentarían la producción de H2S en las células de los mamíferos (19).
Al parecer, el tiempo de cocción de estos aceites demostró tener un efecto en la composición de los polisulfuros del ajo y las subsecuentes tasas de producción de H2S. Hervir ajo machacado durante períodos breves no reduce los niveles de polisulfuro en los tejidos vegetales en contraste con el calentamiento prolongado, que sí reduce sus niveles (40,41), aunque aún se necesita más evidencia al respecto.
Entre los alimentos ricos en donadores de sulfuro se encuentran: ajo, brócoli y cebolla amarilla, entre otros.
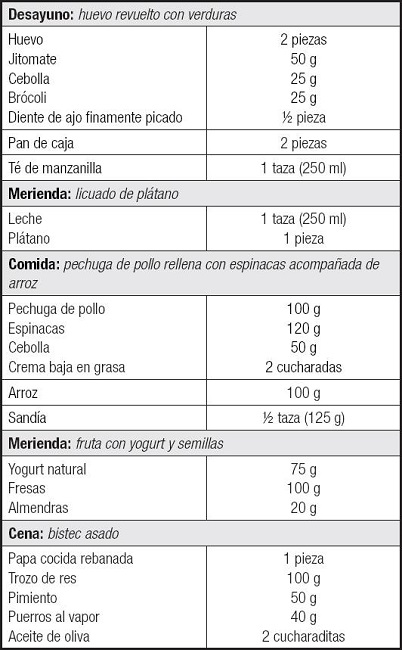
No obstante, se puede fortalecer o incrementar su aporte consumiendo de manera habitual los alimentos ricos en donadores orgánicos y sustratos. Como sugerencia, podría tomarse el siguiente menú de la tabla III.
CONTROVERSIAS SOBRE EL CONSUMO DIETÉTICO DE DONADORES ORGÁNICOS, PRECURSORES DE H2S Y SUS BENEFICIOS EN LA SALUD
Aunque en los últimos años se han realizado investigaciones con respecto al consumo dietético tanto de donadores orgánicos como de precursores (metionina y cisteína) del H2S y sus beneficios, los resultados de estos estudios no han sido concluyentes. Es por eso que existen controversias como, por ejemplo: ante la suplementación de aminoácidos de cadena ramificada (AACR), como la metionina, en una investigación en pacientes con prediabetes y diabetes que consumieron un suplemento con 20 g/día por 4 meses de AACR, se encontró que mejoró el metabolismo de la glucosa; sin embargo, en otros estudios se ha asociado positivamente la suplementación de AACR con el riesgo de padecer DM2 (32).
En un ensayo doble ciego aleatorio en seres humanos, donde participaron 26 pacientes adultos obesos, asignándoseles ya fueran 2 mg/kg/día o 35 mg/kg/día de metionina por 16 semanas, no se encontró ninguna diferencia con respecto al peso corporal, la resistencia a la insulina o la masa magra entre los dos grupos de tratamiento. Además, existen otros aminoácidos que se han estudiado como potenciales tratamientos de la obesidad como, por ejemplo, el triptófano, su restricción moderada promueve la longevidad y aumenta la termogénesis y la ingesta de alimentos; pero cuando la restricción es severa, aumenta el peso corporal y la masa grasa (32).
EFICACIA, SEGURIDAD Y TOXICIDAD DE CISTEÍNA Y METIONINA COMO FUENTE DE H2S
En relación a la seguridad y eficacia de la suplementación con cisteína, metionina o donadores de H2S, existen estudios clínicos y experimentales que sustentan su utilidad como soporte en el tratamiento de varias patologías. Podemos encontrar estudios nutricionales y metabólicos que se llevaron a cabo con suplementación de metionina, donde la ingesta más alta fue de 3 veces el requerimiento estimado (0,910 y 1,330 g/día aproximadamente, en un hombre adulto con normopeso de 70 kg) y no se reportaron efectos adversos. Una pregunta que surge para proponer el uso de estos agentes es la seguridad o toxicidad de su ingesta. En un estudio clínico, a pacientes con poliartritis reumatoide se los trató con metionina (5 o 10 g/día) y no se reportaron efectos adversos serios, aunque la presencia de náuseas, vómitos y halitosis fue frecuente (42).
Se ha demostrado que una dosis única de 100 mg/kg de peso en un día es segura, teniendo en cuenta que esta dosis es 7 veces el requerimiento diario para aminoácidos sulfurados totales (metionina + cisteina). El consumo continuo de esta dosis durante 1 semana incrementó los niveles de homocisteína. Este mismo estudio demostró que dosis diarias de 250 mg de metionina resultaron ser seguras (42).
Por otra parte, una revisión sistemática que incluyó 60.885 estudios clínicos en seres humanos resalta los beneficios del uso de L-cisteína en padecimientos como: diabetes mellitus de tipo 2, cuidado del cabello, inflamación crónica, prevención del cáncer de tracto digestivo superior y de mama, enfermedades cardiovasculares, síndrome de intestino irritable y esteatosis hepática no alcohólica, entre otros. En esto estudios se concluyó que los beneficios derivados del tratamiento con estos aminoácidos están asociados con la disminución del estrés oxidativo, del estado proinflamatorio y de la apoptosis, así como con el aumento de los niveles de GSH, el aumento de la producción de H2S y la sensibilidad a la insulina (18,43). En una revisión sistemática de ensayos clínicos con metanálisis donde se incluyeron 12 ensayos con un total de 553 participantes hipertensos, se concluyó que la suplementación con ajo redujo la presión arterial en 5,5 ± 1,9 mmHg, de manera similar a los medicamentos antihipertensivos estándar. Esta reducción de la presión arterial se asoció con una reducción del 16-40 % del riesgo de sufrir eventos cardiovasculares (44).
PROYECCIONES FUTURAS SOBRE EL USO DEL H2S COMO INTERVENCIÓN DIETÉTICA
El H2S tiene al parecer efectos terapéuticos en diversas patologías relacionadas con la malnutrición, como la obesidad y la DM2; sin embargo, no hay investigaciones con resultados concluyentes al respecto y es por eso que resulta importante demostrar los posibles efectos benéficos de consumir alimentos ricos en donadores orgánicos y sustratos, sin pretender dar una recomendación de consumo terapéutico. También existe la posibilidad de que el consumo de alimentos ricos en donadores orgánicos y sustratos, con la administración conjunta de fármacos donadores de H2S, pudiera generar un sinergismo que guarde relación con los efectos protectores de este gasotransmisor, aunque falta más información al respecto. Es importante mencionar que fortalecer su aporte dietético no puede considerarse como cura o tratamiento principal de ninguna enfermedad; sin embargo, existen estudios que apuntan a que el H2S puede ser un potencial tratamiento coadyuvante para algunas enfermedades como, por ejemplo, la hipertensión arterial.