INTRODUCCIÓN
La enfermedad renal crónica (ERC) es un grave problema de salud pública debido a su elevada prevalencia y sus múltiples complicaciones, entre ellas, los trastornos óseos-metabólicos propios del hiperparatiroidismo secundario (HPT2) (1). Estos últimos aparecen con mayor frecuencia en la ERC avanzada y están presentes en cerca de 56 % de los pacientes que requieren hemodiálisis, según datos de Chile (2). El HPT2 cursa con un exceso de paratohormona (PTH), niveles que están regulados por el calcio iónico circulante, mediante un mecanismo de retroalimentación negativa a través del receptor sensor de calcio (CaSR) en la glándula paratiroides (3). El descenso mantenido del calcio iónico aumenta la producción de PTH, estimulando la resorción ósea y la liberación de calcio y fosforo a la circulación. A nivel renal, incrementa la producción de vitamina D activa, que favorece la absorción intestinal de calcio y fosforo. Además, la PTH genera estimulación de la reabsorción tubular y reducción de la excreción renal de calcio junto a una acción fosfatúrica. En conjunto, estas acciones están destinadas a mantener concentraciones adecuadas de calcio. Por otro lado, la concentración de fosforo está regulada predominantemente por el factor de crecimiento de fibroblastos 23 (FGF23), que reduce su reabsorción renal. La función paratiroidea es inhibida por niveles altos de calcio, vitamina D y FGF23. Las alteraciones en los niveles de estos elementos constituyen potentes estímulos para la aparición y progresión del HPT2 (4).
Existen diversas terapias farmacológicas para el HPT2, entre las que se encuentra el uso de calcimiméticos tales como cinacalcet y etelcalcetide. Cinacalcet es un agonista alostérico del CaSR, que aumenta su sensibilidad al calcio extracelular. A nivel de la paratiroides, dicha sensibilización reduce la liberación de PTH, con la subsecuente disminución del calcio sérico (5). Desde su aprobación por la FDA en el año 2004, el uso de este calcimimético se ha incrementado progresivamente, siendo utilizado desde comienzos de la década de 2010 en Chile. Sin embargo, su alto costo (~120 USD mensuales) es la principal limitación para un uso más masivo.
Si bien la indicación principal de cinacalcet se enmarca en el contexto del HPT2, la expresión del CaSR no es exclusiva de las glándulas paratiroides. El receptor funcional ha sido descrito en múltiples tejidos tales como cerebro, páncreas, hígado, pulmones, esófago, estómago, corazón, piel, hipófisis, ovario, mama, testículos y próstata, por lo que el efecto de cinacalcet podría ser más amplio que el descrito originalmente. La expresión del CaSR también ha sido reportada en el tejido adiposo humano (6). Estudios in vitro realizados en un modelo de células adiposas humanas y en explantes de tejido adiposo han asociado a cinacalcet con un efecto deletéreo (7-10). En ambos modelos, la activación del CaSR por cinacalcet ha mostrado una exacerbación del estado inflamatorio, aumento en la proliferación de preadipocitos, aumento de la diferenciación de preadipocitos a adipocitos viscerales y desregulación del metabolismo lipídico, con un posible impacto a nivel hepático (10). Dichos efectos promoverían una disfunción del tejido y enfermedades asociadas a la obesidad (11). Así, se ha propuesto que el uso de cinacalcet estaría involucrado con una disfunción del tejido adiposo con las conocidas consecuencias a nivel cardiometabólico.
Una parte importante de los pacientes con ERC presenta un elevado riesgo cardiovascular (CV) y se estima que entre el 40 y el 70 % de los enfermos renales que inician diálisis ya tienen manifestaciones clínicas de ello (12). En este sentido, el tratamiento con estatinas reduce los niveles de lípidos y la mortalidad CV (13); sin embargo, se ha observado que cinacalcet no disminuye la mortalidad CV al compararse con terapias convencionales (14). Estos pacientes tampoco mostraron mejorías del perfil lipídico (15) o el estado inflamatorio (16). Esta situación podría ser secundaria a la alteración de la función adiposa inducida por el uso de cinacalcet, pero existe escasa información referente a este efecto en la salud CV y ninguna evidencia (hasta donde sabemos) que considere el efecto en tejido adiposo.
Por tanto, se torna relevante estudiar si nuestro modelo in vitro aplica a nivel sistémico. Nuestra hipótesis apunta a que el uso de cinacalcet se asocia con un aumento en marcadores inflamatorios, un aumento de grasa corporal y un deterioro en el perfil lipídico. Planteamos analizar el efecto de la terapia con cinacalcet sobre parámetros antropométricos, inflamatorios y lipídicos en pacientes renales con HPT2 que permita explicar los mecanismos que relacionen la disfunción adiposa y la incapacidad del tratamiento cinacalcet para mejorar la sobrevida de la población con ERC en diálisis.
MÉTODOS
DISEÑO
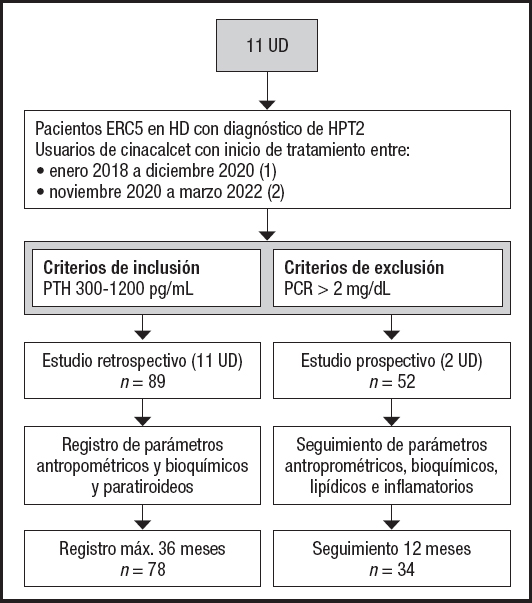
Se trata de un estudio observacional con una aproximación retrospectiva y otra prospectiva en dos grupos independientes de pacientes.
Estudio retrospectivo
Consistió en el análisis de registros antropométricos y bioquímicos de pacientes pertenecientes a once unidades de diálisis renal de la región Metropolitana y región de Los Ríos, Chile. Se incluyó a pacientes ERC en hemodiálisis que hubiesen comenzado tratamiento con cinacalcet durante el periodo de recolección de datos (i.e., de enero de 2018 a diciembre de 2020) con una duración máxima de seguimiento de tres años. Se consideró la fecha de inicio de cinacalcet como el momento basal (mes 0) y los seguimientos clínicos se registraron cada seis meses. Los pacientes contaban con datos antropométricos disponibles de peso (kg), talla (m), circunferencia de cintura (CC, cm) y pliegue tricipital (PT, mm). También tenían disponibles exámenes de sangre con niveles séricos de calcio (mg/dl), fósforo (mg/dl), potasio (meq/l), nitrógeno ureico (mg/dl), creatinina (mg/dl), albumina (g/dl), hemoglobina (g/dl), fosfatasa alcalina (U/l) y paratohormona intacta (PTH) (pg/ml). También se recogieron las características clínicas, comorbilidades y tratamiento farmacológico (hipolipemiante, hipoglicemiante), así como dosis diarias de cinacalcet (30, 60, 90 mg) y eventuales interrupciones del tratamiento durante el periodo de seguimiento. Los antecedentes se obtuvieron desde la ficha en papel y/o electrónica de cada paciente.
Estudio prospectivo
Consistió en el análisis de la evolución antropométrica y de parámetros bioquímicos de pacientes pertenecientes a dos unidades de diálisis de la región Metropolitana, incluidos en el estudio retrospectivo. Se incluyó a pacientes ERC en hemodiálisis que hubiesen comenzado tratamiento con cinacalcet durante el periodo de recolección de datos (i.e., de noviembre de 2020 a marzo de 2022) con una duración total de seguimiento de un año. Se consideró el inicio de cinacalcet como el momento basal (mes 0) y el seguimiento se realizó a los tres, seis y 12 meses de tratamiento. El estudio incluyó la evolución antropométrica de peso y talla, PTH, colesterol total (mg/dl), colesterol HDL (mg/dl), colesterol LDL (mg/dl), colesterol VLDL (mg/dl), triglicéridos (mg/dl) y proteína C reactiva ultrasensible (PCR, mg/dl) durante el año de seguimiento. Se recogieron características mórbidas y tratamiento farmacológico (hipolipemiante, hipoglicemiante) (Fig. 1).
POBLACIÓN (AMBOS ESTUDIOS)
Se incluyó a pacientes de ambos sexos con ERC en etapa 5 en hemodiálisis con diagnóstico de HPT2 y que hubieran iniciado tratamiento con cinacalcet con valores de PTH sérica entre 300 y 1.200 pg/ml. Se excluyó a los pacientes con daño hepático y patología inflamatoria con valores de PCR > 2 mg/dl, sin embargo, dada la alta prevalencia de diabetes tipo 2 y dislipidemia, no se consideró la exclusión por patologías crónicas.
CONSIDERACIONES ÉTICAS (AMBOS ESTUDIOS)
La investigación se realizó conforme a la Declaración de Helsinki (2000). El protocolo fue aprobado por los comités de ética de los servicios de salud Metropolitano Oriente, Metropolitano Central y de Valdivia (solo para el estudio retrospectivo), además del Comité del Instituto de Nutrición y Tecnología de los Alimentos (INTA), de la Universidad de Chile. Antes de iniciar el estudio, se requirió que los pacientes firmaran un consentimiento informado.
EVALUACIÓN ANTROPOMÉTRICA (AMBOS ESTUDIOS)
Se realizó la evaluación antropométrica siguiendo técnicas descritas previamente por Lohanm y Roche (1988). Brevemente, el peso corporal se midió con una báscula electrónica (Detecto) de 0,05 kg de precisión y la estatura, con un antropómetro (GPM) de 0,1 cm de precisión. Se calculó el índice de masa corporal (IMC) a través de la fórmula peso (kg)/talla (m2), el cual permitió clasificar el estado nutricional (17). La CC se midió en el punto medio entre la parte inferior de las costillas y la parte superior de la cresta iliaca, mediante una cinta métrica no elástica de marca Seca milimetrada y con una precisión de 0,1 cm. El valor de la CC fue categorizado para evaluar el riesgo CV (18). La medida del PT se obtuvo en duplicado, teniendo en cuenta el promedio de dos mediciones, y se utilizaron los valores de referencia publicados por Frisancho (2008) y los puntos de corte propuestos por el mismo.
ESTUDIO METABÓLICO
Estudio retrospectivo
Se obtuvo una muestra de 10 ml de sangre sin ayuno previo al inicio de la sesión de diálisis de cada paciente. Las determinaciones bioquímicas fueron calcio, fósforo, potasio, nitrógeno ureico, creatinina, albúmina, hemoglobina, fosfatasa alcalina y PTH mediante el sistema de química clínica ADVIA® (Siemens Healthcare Diagnostics Inc.). Todos los analitos fueron procesados en el mismo laboratorio y forman parte de los exámenes de control mensual de cada centro de diálisis.
Estudio prospectivo
Se obtuvo una muestra de 4 ml de sangre con 12 horas de ayuno previo al inicio de la sesión de diálisis. Todas las determinaciones incluidas en el perfil lipídico fueron analizadas en suero mediante el sistema de química clínica ADVIA® 1800, de acuerdo a las metodologías correspondientes para colesterol total (enzimático), colesterol LDL (colesterol oxidasa), colesterol HDL (eliminación/catalasa) y triglicéridos (enzimático LPL-GK). La PCRu fue analizada en suero mediante inmunoturbidimetría potenciada con látex (Roche Diagnostics GMBH®). Los procedimientos clínicos de ambos estudios fueron realizados por el personal de enfermería de cada unidad según los protocolos establecidos. Las muestras fueron refrigeradas y despachadas al laboratorio en una unidad refrigerante antes de dos horas posterior a la extracción. Todos los analitos fueron procesados en el mismo laboratorio.
DURACIÓN DEL TRATAMIENTO CON CINACALCET
La duración del tratamiento (en meses) se calculó como el tiempo transcurrido entre el inicio y el término del tratamiento con cinacalcet. La fecha de término puede corresponder al fin del tratamiento farmacológico (e.g., resolución quirúrgica, fallecimiento), interrupción del tratamiento (normalización de la PTH, causas médicas, mala adherencia) o traslado del paciente a otro centro de diálisis.
ANÁLISIS ESTADÍSTICO
La distribución de las variables continuas se estudió a través del test de Kolmogorov-Smirnov e histogramas. Las variables continuas se describieron utilizando medias ± DE y mediana e intervalo entre percentiles 25 y 75 (P25, P75). Para analizar los cambios en los valores basales y las evaluaciones finales de acuerdo al tiempo y dosis de tratamiento se comparó la mediana de la diferencia (Δ) porcentual entre el valor basal vs. el valor final. Para analizar los cambios en los valores basales y las evaluaciones posteriores de acuerdo al tiempo de tratamiento, se comparó el promedio de los valores porcentuales relativos a la línea base. Se utilizaron pruebas de Mann-Whitney y Kruskal-Wallis para muestras independientes y pruebas de Wilcoxon o Friedman para muestras dependientes, según distribución de los datos. El análisis estadístico se realizó con el paquete SPSS V26. Se consideró estadísticamente significativo un nivel de confianza del 95 %, con un valor de p < 0,05.
RESULTADOS
DESCRIPCIÓN DE LA MUESTRA
Estudio retrospectivo
De un total de 89 pacientes en tratamiento con cinacalcet, un 55 % eran hombres y un 24 % eran adultos mayores, con una media de edad de 54 años. El promedio del IMC fue de 27 kg/m2; el 1% de la muestra tenía un estado nutricional enflaquecido; el 37 %, eutrófico; el 30 % tenía sobrepeso; y 32 %, obesidad. El 65 % de los pacientes tenía un riesgo CV elevado según los criterios de circunferencia de cintura. Se encontró un 83 % de hipertensión arterial (HTA) y un 30 % de diabéticos. Un 34 % de los enfermos estaba en tratamiento farmacológico con hipolipemiantes y el 18 %, con hipoglicemiantes. La tabla I muestra las características de los pacientes al comienzo del seguimiento, que tuvo una duración promedio de 19,4 meses; el 35,4 % de los pacientes fueron tratados durante un tiempo menor a 12 meses. Antes del año de tratamiento, un 22 % de los pacientes tuvo resolución quirúrgica (paratiroidectomía) y un 11 % tuvo una normalización de la PTH, por lo que interrumpió el tratamiento farmacológico con cinacalcet. Se utilizaron diferentes dosis de cinacalcet: el 53 % usó 30 mg/día, el 38 % usó dosis de 60 mg/día y el 9 % consumió dosis de 90 mg/día.
Estudio prospectivo
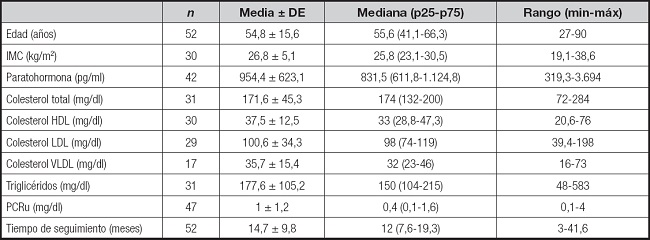
De un total de 52 pacientes en tratamiento con cinacalcet, un 57,7 % eran hombres y un 25 % eran adultos mayores, con una media de edad de 55 años. El promedio de IMC fue de 26,8 kg/m2 y el 40 % de la muestra tenía un estado nutricional eutrófico, el 33 % tenía sobrepeso y el 27 % era obeso. Se encontró un 88 % de HTA y un 35 % de diabéticos, así como un 50 % de pacientes con PCR (como parámetro de inflamación) alterado > 0,5 mg/dl al inicio del seguimiento/tratamiento. Del grupo de enfermos inflamados, el promedio de PCR fue de 1,9 mg/dl. Entre las dislipidemias, un 17 % de los pacientes tenía hipercolesterolemia aislada; un 51 %, hipertrigliceridemia aislada; un 13 %, hiperlipidemia mixta; y un 53 %, colesterol HDL bajo aislado. Un 55 % de los enfermos estaba en tratamiento farmacológico con hipolipemiantes y el 37 %, con hipoglicemiantes. La tabla II muestra las características de los pacientes al comienzo del seguimiento, que tuvo una duración promedio de 14,7 meses; el 65,1 % de los pacientes fueron tratados durante un tiempo menor a 12 meses. De estos enfermos, un 15 % reportó un término precoz del tratamiento, el 2 % por resolución quirúrgica, el 7 % por causas médicas, un 3 % por fallecimiento y un 3 % por traslado del paciente a otro centro de diálisis. Se utilizaron diferentes dosis de cinacalcet: el 84 % usó 30 mg/día, el 11 % usó dosis de 60 mg/día y el 5 % consumió dosis de 90 mg/día.
EFECTIVIDAD DE CINACALCET EN EL CONTROL DEL HIPERPARATIROIDISMO SECUNDARIO
Estudio retrospectivo
Los valores promedio de seguimiento para los indicadores plasmáticos relevantes en el manejo de la ERC no tuvieron cambios entre el inicio y el final del tratamiento (cuando se considera el total de la muestra), a excepción del calcio sérico, que mostró una disminución del 3,4 % (basal: 8,9 ± 0,8 mg/dl, final: 8,6 ± 1 mg/dl). Los valores durante el seguimiento se pueden ver en la figura 1. Respecto de los niveles basales de PTH, disminuyeron en promedio en un 12 % luego de seis meses de tratamiento (1.001 ± 626 pg/ml vs. 881 ± 610 pg/ml). Sin embargo, los valores de PTH al final del seguimiento retornaron a los niveles iniciales (1.005 ± 685 pg/ml en relación a los niveles a los seis meses). Los niveles de fósforo no presentaron diferencias significativas entre el valor basal (5,7 ± 1,8 mg/dl), los seis meses de seguimiento (5,9 ± 4,4 mg/dl) y el final del tratamiento (5,5 ± 1,9 mg/dl). Los valores de fosfatasa alcalina se mantuvieron estables durante el tratamiento (basal: 282,5 ± 288,3 U/l vs. seis meses: 251,2 ± 284,8 U/l y vs. final: 243,8 ± 278,2 U/l).
Estudio prospectivo
Los niveles basales de PTH disminuyeron en promedio en un 8,4 % luego de seis meses de tratamiento (954,4 ± 623,1 vs. 874,3 ± 642,4 pg/ml). Sin embargo, al final del seguimiento, la PTH retornó a niveles iniciales. Los valores durante el seguimiento se pueden observar en la tabla III.
CAMBIOS DE VARIABLES ANTROPOMÉTRICAS, LIPÍDICAS E INFLAMATORIAS
Estudio retrospectivo
En el total de la muestra, las variables antropométricas no presentaron cambios entre el inicio y el final del tratamiento/seguimiento. El IMC promedio fue de 27,3 ± 5,5 kg/m2 al inicio y 27,3 ± 5,7 kg/m2 al final del tratamiento. La CC promedio fue de 103 ± 15 cm al inicio y 101 ± 14 cm al final del tratamiento. El PT promedio fue de 16 ± 5,6 mm al inicio del tratamiento y 16 ± 6,1 mm al final del mismo. Tampoco se identificaron cambios en variables antropométricas cuando se categorizan los pacientes por la duración del tratamiento/seguimiento, según lo muestra la tabla IV. Asimismo, no se identificaron cambios en estas variables al clasificar a los pacientes según las dosis de cinacalcet utilizadas (Tabla IV).
Tabla IV. Cambios de parámetros antropométricos en pacientes con insuficiencia renal crónica según duración y dosis del tratamiento con cinacalcet.

Los valores corresponden a la mediana de Δ% (inicial-final).
PTH: paratohormona; IMC: índice de masa corporal; CC: circunferencia de cintura; PT: pliegue tricipital.
Prueba de Kruskal-Wallis para variable duración del tratamiento/seguimiento.
Prueba de Mann-Whitney para variable dosis de tratamiento.
En la figura 2 se observan los valores de PTH a través del tiempo de tratamiento con cinacalcet, relativos a los valores del inicio del tratamiento; los valores relativos de PTH a los seis meses y a los 18 meses de tratamiento/seguimiento fueron menores que al inicio del mismo. Finalmente, la PTH tuvo una variación máxima de -28,3 % a los 30 meses, comparado con la observación inicial (Fig. 2). Por otro lado, los valores relativos de IMC para cada periodo no fueron diferentes que los valores de base.

Figura 2. Cambios en niveles plasmáticos de PTH, fosfatasa alcalina, calcio y fósforo. A. Cambios séricos a través del tiempo para PTH y fosfatasa alcalina. La barra con líneas corresponde a los promedios basales (n = 80/78), la barra con puntos corresponde a los valores a los seis meses de tratamiento (n = 78/77) y la barra con color liso corresponde a los valores al final del seguimiento (n = 73/77). La barra de error corresponde a DE. Prueba de Wilcoxon. B. Cambios séricos a través del tiempo para calcio y fósforo. La barra con líneas corresponde a los valores basales (n = 85/83), la barra con puntos corresponde a los valores a los seis meses de tratamiento (n = 81/80) y la barra con color liso corresponde a los valores al final del seguimiento (n = 80/78). Prueba de Wilcoxon. *Significancia en el nivel 0,05 (bilateral).
Estudio prospectivo
En el total de la muestra, la PTH, el IMC, las variables del perfil lipídico y la PCR no presentaron cambios entre el inicio y el final del tratamiento/seguimiento. Los valores durante el seguimiento se pueden ver en la tabla III. La PCR promedio fue de 1,02 ± 1,17 mg/dl al inicio y 1,08 ± 1,16 mg/dl al final del tratamiento. El colesterol total, el colesterol LDL y los triglicéridos disminuyeron en un 6,8 %, 12,5 % y 5,5 %, respectivamente, al inicio del tratamiento vs. al final, mientras que el colesterol HDL aumentó en un 1,6 %. No se identifican cambios entre el inicio y el final del tratamiento cuando se categorizan los pacientes por la duración del tratamiento/seguimiento, según muestra la tabla V. Tampoco se observaron diferencias al analizar al subgrupo de pacientes que disminuyeron en más de un 20 % la PTH.
Tabla V. Cambios de parámetros lipídicos y PCRu en pacientes con insuficiencia renal crónica según duración con cinacalcet.
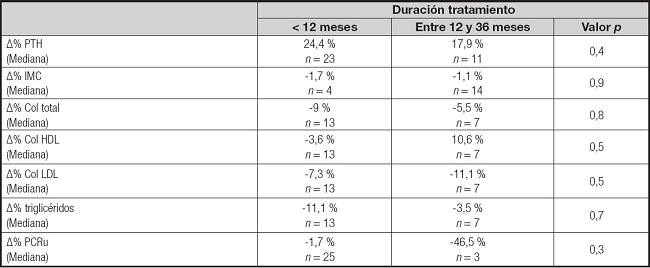
Los valores corresponden a la mediana de Δ% (inicial-final).
PTH: paratohormona; IMC: índice de masa corporal; PCRu: proteína C reactiva ultrasensible.
Prueba de Mann-Whitney para variable duración del tratamiento/seguimiento.
DISCUSIÓN
Nuestros resultados muestran que, de acuerdo a lo esperado, el tratamiento con cinacalcet redujo los niveles séricos de PTH en un 12 % luego de seis meses de tratamiento y un 17,8 % a los 36 meses, al igual que la mayor parte de los estudios clínicos, que muestran mejoría de los valores de PTH entre un 28 % y un 45 % (16,19). Adicionalmente, investigaciones previas muestran reducciones en los valores de calcio sérico tras el tratamiento con cinacalcet. Segura y cols. (19) observaron una variación negativa de un 6 %, en línea con nuestro reporte, con una reducción de un 3,4 %. Otro estudio mostró un descenso en los niveles de calcio del 8,7 %, mientras que los valores de fósforo se incrementaron en un 5,4 % (20), al igual que en nuestro estudio. Sin embargo, otros autores han descrito reducciones en los niveles de fósforo del 13,2 % luego del tratamiento con cinacalcet (19).
Poco se ha debatido sobre los factores que influyen en el grado de respuesta a cinacalcet. Se sabe que los niveles previos de PTH podrían determinar la respuesta, donde valores superiores a 800 pg/ml logran alcanzar el objetivo de las guías K/DOQUI en un 50 %, mientras que con PTH inferior a 800 pg/ml se logra en un 70-73 % (21). Entre los factores que podrían determinar una adecuada efectividad de cinacalcet, la adherencia farmacológica es un determinante que se ha asociado a un aumento de síntomas gastrointestinales adversos, incluidos náuseas y vómitos (22). Es interesante destacar que los antecedentes genéticos de los pacientes pueden también jugar un rol a considerar, por la existencia de polimorfismos del CaSR que aminoran la respuesta a cinacalcet, argumento a respaldar en futuros estudios (23).
En términos de estado nutricional, nuestro estudio constató una prevalencia del 62 % de exceso de peso, incluyendo un 32 % de obesos, con cifras similares a la población general en Chile (31,2 %) (Encuesta Nacional de Salud [ENS] 2016-2017). Además, se observó que un 65 % de los enfermos tenían una CC sobre los parámetros normales, dando cuenta de una masa grasa aumentada y un riesgo CV elevado. Un reciente estudio en pacientes tratados con cinacalcet expuso un IMC de 25 ± 5 kg/m2 (24), valor inferior al reportado en nuestra investigación (27,3 ± 5,5 kg/m2), pero consistente con el análisis de una cohorte europea que observó un IMC de 27 kg/m2 (25). En la población general, un IMC más alto se asocia con un riesgo incrementado de mortalidad y, por el contrario, en pacientes en hemodiálisis, un IMC más alto se asocia paradójicamente a una ventaja en la sobrevida (26); los mecanismos subyacentes siguen siendo poco conocidos y son materia de debate. Un IMC más alto se ha asociado a una mortalidad más baja en todos los grupos etarios (27). Esta hipótesis se relaciona con una mayor masa libre de grasa como predictor de mayor sobrevivencia, a diferencia de la masa grasa, que se asocia con inflamación y efectos perjudiciales (28).
Por otra parte, el análisis de pacientes tratados con cinacalcet mostró que en tres años de seguimiento no hubo diferencias en la incidencia de eventos CV (29). En este sentido, el ensayo clínico multicéntrico EVOLVE destacó que cinacalcet no redujo el riesgo de muerte o de sucesos CV mayores en pacientes con HPT2, exponiendo además lo complejo del seguimiento en este tipo de estudios (30). Por tanto, nuestra hipótesis de un incremento del riesgo CV por cinacalcet no debería descartarse como posible mecanismo que explica estos resultados.
Estudios in vitro muestran que cinacalcet aumentaría la adipogénesis visceral, sin embargo, nuestros resultados no lograron establecer variaciones en el IMC o CC por efecto del tratamiento. En acuerdo con nuestra hipótesis, un reporte de caso observó que cinacalcet produjo un aumento de 4 kg de peso corporal acompañado de una respuesta compensatoria en los parámetros metabólicos en un paciente con HPT2 (31). No obstante, este estudio no evaluó ingesta de alimentos ni composición corporal, por lo que no hay certeza sobre si hubo aumento de tejido adiposo, ni de si el aumento de grasa fue visceral o subcutáneo, lo cual tiene implicancias fisiopatológicas diferentes. Entre los marcadores clínicos de adiposidad, el índice de adiposidad visceral (VAI) (32) y el fenotipo hipertrigliceridemia-cintura abdominal (HTGW) (33) han demostrado ser buenos predictores de riesgo de ECV. Ambos indicadores no han sido evaluados en este estudio, pero sería relevante contar con estas evaluaciones en investigaciones futuras.

Figura 3. Análisis del cambio para PTH a través del tiempo de seguimiento. Cambios séricos a través del tiempo para PTH (valores PTH relativos a PTH inicial). Prueba de Wilcoxon para muestras pareadas ente 0 m (tiempo 0) y cada uno de los periodos de tiempo.
Es interesante señalar que, en hemodiálisis, el papel protector de un IMC elevado se anula frente a las consecuencias negativas de la inflamación crónica (34). La evidencia reciente demuestra que la inflamación crónica puede causar desnutrición y ECV aterosclerótica progresiva, donde el marcador de inflamación PCR permite estudiar el estado inflamatorio. Al respecto, nuestro estudio mostró una mediana inicial de PCRu de 0,4 mg/dl, muy cercana a los valores esperados de normalidad (35), y tras el seguimiento no logramos establecer un efecto del tratamiento con cinacalcet. Esto es consistente con un estudio que reportó que el tratamiento con cinacalcet no modificó los niveles de PCR (15).
La alteración del perfil lipídico es una patología que históricamente se ha relacionado en pacientes con HPT2. En este sentido, nuestros datos mostraron valores iniciales de colesterol total, colesterol HDL, colesterol LDL y triglicéridos dentro de los valores normales (18). Al respecto, un estudio en pacientes en hemodiálisis observó que un alto IMC y PCR, junto a niveles bajos de colesterol HDL, se asociaron con una mayor endotoxinemia, lo que podría contribuir al aumento de la inflamación y la mortalidad en pacientes en hemodiálisis (36). Al evaluar el efecto del tiempo de tratamiento con cinacalcet sobre la variación de parámetros lipídicos no se encontraron hechos significativos, consistente con un estudio en el que 20 semanas de tratamiento no modificaron los niveles de colesterol total, lipoproteínas LDL y HDL (15). Sin embargo, debemos considerar la escasa información existente, las reducidas muestras de pacientes y el corto intervalo de tiempo estudiado, que justifican el estudio de estos parámetros a largo plazo.
El desarrollo de esta investigación desveló limitaciones en la dificultad en estudiar pacientes con HPT2, por la heterogeneidad del fenotipo y las diferentes respuestas al tratamiento. Las principales limitaciones metodológicas tuvieron relación con la perdida de pacientes por una suspensión del tratamiento farmacológico, fallecimiento o traslado del paciente a otro centro de diálisis. Por otro lado, es relevante destacar que este reporte representa una aproximación traslacional que intentó probar si el modelo planteado a nivel celular es relevante a nivel sistémico. Nuestros hallazgos sugieren que pacientes con HPT2 a la ERC pueden ser tratados eficazmente con cinacalcet, el cual es capaz de reducir los niveles de PTH sin provocar cambios en parámetros antropométricos, lipídicos e inflamatorios. Dados los resultados, creemos necesario generar estudios clínicos-metabólicos en profundidad que permitan explicar por qué cinacalcet, actuando sobre la PTH en forma efectiva, no ha sido capaz de disminuir la mortalidad CV.