INTRODUCCIÓN
Anteriormente se propuso que la grasa oral se detectaba a través de los sentidos del olfato y tacto. En años recientes, se ha propuesto que la grasa podría tener receptores específicos por lo que puede ser considerada un sabor básico (1). Se han identificado algunos receptores que se expresan en las células de las papilas gustativas y pueden activar los canales o vías de señalización en respuesta a su unión con moléculas derivadas de los ácidos grasos; entre estos receptores se encuentran algunos acoplados a proteínas G como GPR40, GPR113, GPR120, así como el receptor CD36, el canal de potasio rectificador tardío (Kdr) y el canal receptor de potencial transitorio, subfamilia M, miembro 5 (TRPM5) (2).
CD36 está implicado en varios procesos fisiológicos como receptor de microorganismos, reconocimiento de eritrocitos infectados de malaria, células apoptóticas y proteínas dañadas, así como en la captación y señalización de ácidos grasos de cadena larga (AGCL) (3) por lo cual ha sido vinculado al proceso de percepción oral de las grasas (4).
El gen que codifica este receptor es CD36 y es altamente polimórfico; estudios evidencian que algunos polimorfismos de un solo nucleótido (SNP) en este gen pueden estar asociados con enfermedades metabólicas como obesidad, diabetes mellitus tipo 2 (DM2) y síndrome metabólico (5-7), así como enfermedades cardiovasculares y aterosclerosis, sin embargo, el papel de las variantes genéticas en CD36 en el proceso de percepción del sabor graso ha sido explorado en menor medida. Por lo anterior, el objetivo de esta revisión fue analizar el papel emergente de CD36 en la percepción oral de la grasa y la relación de algunos SNP de CD36 con la aceptación y preferencias por alimentos con grasa, así como umbrales de percepción a ácidos grasos.
MATERIALES Y MÉTODOS
Se realizó la búsqueda de literatura en la base de datos PubMed combinando las palabras clave: CD36; CD36 SNP; CD36 POLYMORPHISM; CD36 GENETIC VARIANTS, con el operador booleano AND y los siguientes términos por separado CVD; FATTY TASTE; DIABETES; OBESITY; METABOLIC SYNDROME y FAT FOOD PREFERENCES, la búsqueda se filtró considerando solo los artículos publicados entre 2000-2022 y en idioma inglés (n = 2551). La selección final de los artículos fue manual y se incluyeron los que asociaran algún SNP de CD36 con al menos una enfermedad metabólica y/o que incluyera algún análisis sensorial, así como estudios donde se considerara a las interacciones entre CD36 con hormonas y otros factores (n = 39). Se consultaron las listas de referencias de los artículos y se hizo énfasis en investigaciones realizadas en seres humanos sobre modelos murinos. Para la realización de las tablas se presentan los datos del autor, año, zona geográfica, población de estudio, SNP, valor de significancia y odds ratio (OR), en la tabla 1 se incluyeron solamente artículos con n > 100, sin embargo, para la tabla 2 no se consideró este parámetro ya que la información disponible es más limitada.
PERCEPCIÓN ORAL DE LA GRASA: PAPEL DE CD36
La grasa de los alimentos está conformada principalmente por triglicéridos y fosfolípidos en una amplia gama de formas físicas, ya sea líquida, sólida o semisólida. Esta contribuye a proporcionar características deseables al alimento como textura viscosa, suave, cremosa y crujiente, lo que favorece la generación de sensaciones sensoriales agradables (8). Desde hace años, se ha propuesto que la grasa es un sabor básico, sin embargo, el año 2015 Running y cols. proporcionaron evidencias que apoyaban esta afirmación y propusieron que a este sabor graso se le denominara Oleogustus (1).
La detección de lípidos en los alimentos requiere la presencia de sensores específicos ubicados en lugares estratégicos (cavidad oral, intestino delgado e hipotálamo) (9). El modelo hipotético más aceptado para la detección de moléculas de grasa por las células receptoras del sabor es a través de los receptores acoplados a proteínas G y de la proteína CD36 (10).
CD36 es un receptor de AGCL, mientras que GPR41 y GPR43 podrían estar involucrados en la percepción de los ácidos grasos de cadena corta, GPR120 estimula la transducción de señales desde las células de las papilas gustativas al sistema nervioso central a través de los nervios aferentes (11), además parece participar en los efectos posprandiales de la ingesta (12). Los canales TRPM5 y Kdr podrían estar involucrados también en la recepción del sabor graso, ya que contribuyen a la despolarización de las células de las papilas gustativas, induciendo la liberación de adenosín trifosfato (ATP) a través de los canales moduladores 1 de la homeostasis del calcio (CALHM1) (13).
La transducción gustativa empieza cuando las células del gusto son expuestas a los ácidos grasos libres de los alimentos; la sustancia química que se percibe como grasa debe ser soluble en saliva; dado que los triglicéridos generalmente son insolubles se ha sugerido que los ácidos grasos se liberan a partir del glicerol por acción de la lipasa lingual (14). CD36 se encuentra en el lado apical de las papilas gustativas circunvaladas, foliadas y fungiformes y podría transducir las señales desencadenadas por la unión de ligandos lipídicos; dicha transducción es mediada por las quinasas asociadas que interactúan con el extremo carboxilo terminal de la proteína. La señalización por CD36 induce a una mayor concentración de calcio intracelular en las papilas gustativas y esto se asocia con la liberación de neurotransmisores, la activación de neuronas gustativas en el cerebro y un aumento rápido y sostenido del flujo y contenido de secreciones pancreatobiliares (3). Algunas variantes genéticas de CD36 se han asociado con una disminución de la sensibilidad oral a los ácidos grasos y a una ingesta mayor de comidas ricas en ácidos grasos (15).
ESTRUCTURA, EXPRESIÓN Y FUNCIONES GENERALES DE CD36
CD36 es una proteína integral de membrana de 80 kD y se encuentra en diversas células y tejidos, incluyendo plaquetas, fagocitos, adipocitos, hepatocitos, miocitos, el endotelio microvascular, células dendríticas y epitelios especializados de mama y riñón, entre otros. Está constituida por una cadena peptídica de 472 aminoácidos que se ancla en la membrana con una topología tipo horquilla; con dos dominios transmembrana y con ambos extremos, N- y C-terminal, en el citoplasma. El dominio extracelular glucosilado de CD36 incluye tres puentes disulfuro en la mitad carboxilo-terminal, la mitad amino-terminal contiene dominios de unión para la hexarelina, ácidos grasos, lipoproteínas de baja densidad oxidadas (LDL-ox), trombospondina 1 (TSP1) y eritrocitos infectados con Plasmodium falciparum (16).
En los enterocitos, CD36 contribuye a la absorción de AGCL y colesterol, así como a procesos que optimizan la formación de quilomicrones. También forma parte del complejo de vesículas de transporte de pre-quilomicrón y es importante para la salida de las mismas del aparato de Golgi, donde se agregan apoproteínas y lípidos adicionales (17).
CD36 también participa en la utilización de los lípidos musculares y el almacenamiento de energía adiposa por lo que existe evidencia de que esta molécula está involucrada en la patogénesis de trastornos metabólicos como DM2, obesidad, enfermedades aterotrombóticas y cardiovasculares (3), además también está implicada en la percepción del sabor graso, la aceptación y preferencias por alimentos con alto contenido de grasa (14).
CD36 se puede encontrar en el plasma y compartimentos celulares en forma soluble (CD36s) (18) como respuesta a un estado inflamatorio de bajo grado en la resistencia a la insulina o durante la apoptosis celular que ocurre en las células espumosas, por lo cual, CD36s se ha propuesto también como marcador de enfermedad coronaria temprana.
CD36s también se ha estudiado en relación con la sensibilidad gustativa al ácido oleico (AO), la adiposidad y el IMC en población adulta joven del occidente de México (n = 72). Se reportó que existe una correlación positiva entre el IMC y el umbral de sensibilidad gustativa a los ácidos grasos orales, así como la existencia de una relación negativa entre el IMC y los niveles séricos de CD36s, mientras que la adiposidad solo se relacionó negativamente con los niveles de CD36s en mujeres (18).
GEN CD36 Y PRINCIPALES POLIMORFISMOS GENÉTICOS
CD36 está codificada por el gen CD36 que se encuentra en el cromosoma 7q21.11 y consta de 15 exones (19). El sitio de inicio de la transcripción de CD36 se encuentra a 289 nucleótidos río arriba del codón de inicio de la traducción (Fig. 1), y se ha identificado que su expresión génica puede ser regulada por los receptores activados por proliferadores de peroxisomas (PPARs, especialmente por el PPARγ) y el receptor retinoide X (RXR) (19). Se ha descrito que los derivados de las ox-LDL, como los ácidos 13-hidroxioctadecanoico (13-HODE) y el 15-hidroxieicosatetraenoico (15-HETE), activan los PPARγ que a la vez aumentan la transcripción de CD36 (20).
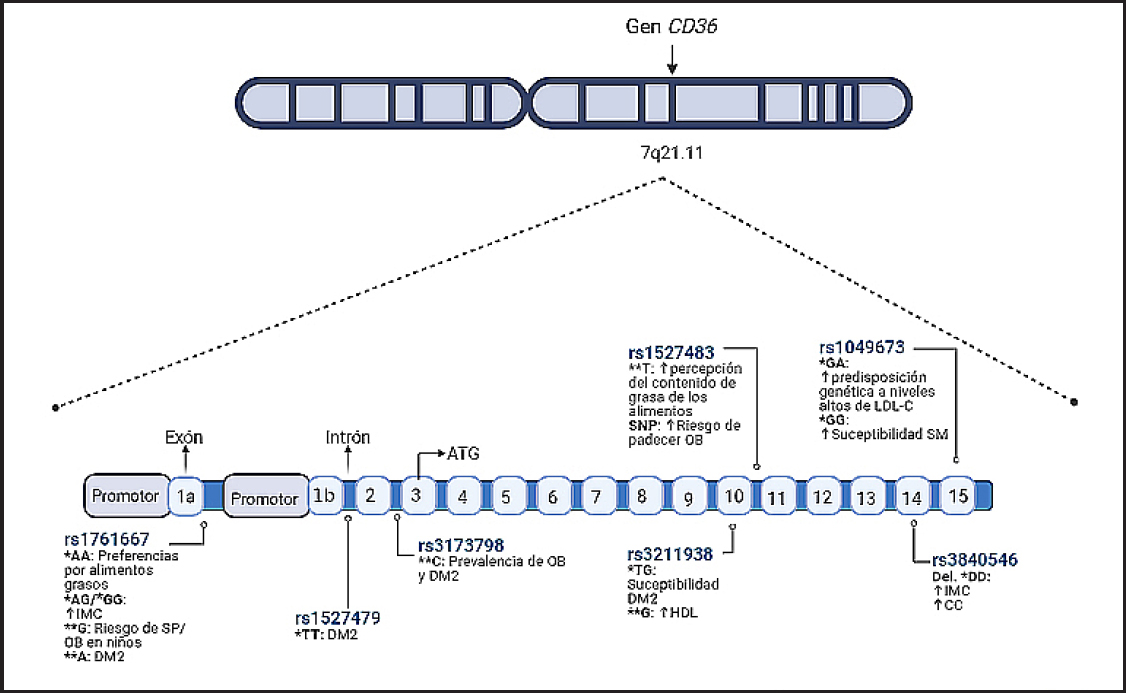
Figura 1. En esta figura se observa la localización del gen CD36 y algunas de sus variantes genéticas (*Genotipo; **Alelo; IMC: índice de masa corporal; SM: síndrome metabólico; DM2: diabetes mellitus tipo 2; SP: sobrepeso; OB: obesidad; HDL: colesterol de alta densidad; SNP: polimorfismo de un solo nucleótido; LDL-C: lipoproteínas de baja densidad; Del: deleción; CC: circunferencia de cintura).
Este gen es altamente polimórfico (21) y algunos de sus polimorfismos se han asociado con diversas enfermedades como DM2 (22): rs3173798 (23), rs3211938 y rs1527479; el SNP rs1761667 se ha asociado con enfermedad cardiovascular (6, 14) y aterosclerosis (16, 24) y otros con IMC elevado (rs1761667, rs3840546) (4,5) (Tabla I).
Tabla I. Variantes genéticas de CD36 asociadas con enfermedades metabólicas y cardiovasculares.

p: valor de significancia; OR: odds ratio; IC: intervalo de confianza; SM: síndrome metabólico.
La presencia de algunos polimorfismos de nucleótido simple en individuos con obesidad se asocia con una mayor preferencia por la grasa y por lo tanto mayor consumo de esta, así como con umbrales de detección para diferentes ácidos grasos (rs1761667 y rs1527483) (4) (Tabla II).
Tabla II. Variantes genéticas de CD36 asociadas con percepción de la grasa y preferencia alimentaria.
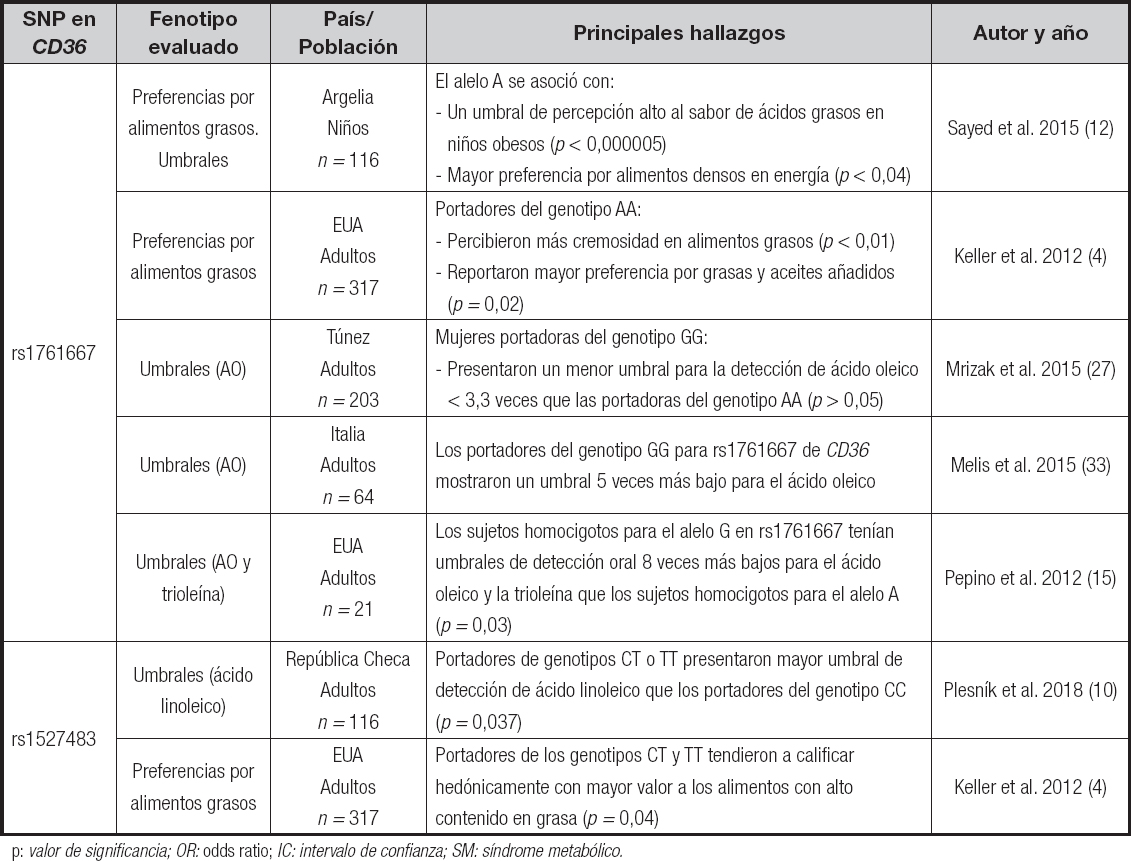
p: valor de significancia; OR: odds ratio; IC: intervalo de confianza; SM: síndrome metabólico.
Algunos de estos polimorfismos, incluidos el rs3173798, rs1527479, rs3173798 y rs1527483 se encuentran en un intrón por lo que pueden afectar la estructura, función y estabilidad del ARNm y, por ende, alterar la traducción de proteína. Si el polimorfismo se encuentra en un exón (por ejemplo, el SNP rs3211938) este puede afectar el corte y empalme y generar isoformas de la proteína. Los SNP del tipo INDEL (como la deleción rs3840546) pueden influir en la unión de factores de transcripción en la región promotora o en el inicio de la traducción del complejo de exploración de ribosomas en la región 5' no traducida (UTR) (25).
POLIMORFISMOS DE CD36 ASOCIADOS CON LA ACEPTACIÓN, PREFERENCIAS Y UMBRALES DE PERCEPCIÓN DE ALIMENTOS GRASOS
Derivado de las investigaciones que señalaron un papel de CD36 en la percepción de la grasa, se han realizado estudios para evaluar si las variantes genéticas en CD36 se asocian con diferencias en la percepción de la grasa, aceptación e ingesta de la misma. Cabe destacar que se ha demostrado que en humanos este receptor se expresa en las papilas circunvaladas y fungiformes (26).
En un estudio realizado adultas afroamericanas se reportó que portadores del genotipo AA para el SNP rs1761667 (-31118 G/A) en CD36 percibieron más “cremosidad” y reportaron una mayor aceptación por grasas y aceites añadidos en la dieta que las personas portadoras del genotipo GG y GA. Por lo anterior, se sugirió que los portadores del genotipo AA para este polimorfismo tienen menor expresión de CD36 lo que conlleva a un cambio en el umbral de detección de los ácidos grasos y una mayor aceptación de alimentos con contenido graso. En este estudio, también se reportó que los portadores de los genotipos CT y TT para rs1527483 en CD36 percibieron un mayor contenido de grasa en aderezos independientemente de la concentración de esta en ellos; se concluye que las diferencias en las calificaciones de cremosidad percibida entre los genotipos se debían posiblemente a diferencias en la capacidad de detectar pequeñas cantidades de ácidos grasos libres en las muestras y como resultado, los atributos de textura como la cremosidad se volvieron más acentuados. También se concluyó que la presencia del genotipo AA en rs1761667 puede reducir la expresión de CD36, por lo que puede haber beneficios posingestivos sobre el metabolismo de los lípidos. Sin embargo, no se midió la expresión del receptor a nivel de ARNm o proteína para corroborar el efecto del SNP (4).
Pepino y cols. (2012) realizaron un estudio con personas con obesidad, agrupados de acuerdo al genotipo de rs1761667 en CD36 (AA, n = 6; AG, n = 7; GG, n = 8). Se evaluaron umbrales para detección de ácido oleico y trioleína, y se demostró que los portadores homocigotos G para el SNP rs1761667 de CD36 tenían umbrales de detección más bajos para estos que los portadores homocigotos para el alelo A, el cual se asocia con una menor expresión de CD36. El IMC podría afectar los umbrales de detección orosensoriales de grasa, sin embargo, en este estudio no hubo diferencias significativas entre grupos en el consumo de alimentos, las preferencias de grasas y antojos por alimentos, pero se considera tomar con precaución las conclusiones en este artículo dado el número reducido de participantes (15).
Se ha sugerido que las personas con obesidad muestran una sensibilidad más baja a los ácidos grasos; Sayed y cols. (2015) reportaron una correlación positiva entre el tamaño de la cintura y el aumento del umbral de detección oral al ácido oleico. En niños obesos portadores del alelo A para el SNP rs1761667 de CD36 el umbral de detección de ácido oleico fue mayor que en niños portadores del alelo G. También encontraron que el alelo A en rs1761667 de CD36 predispuso significativamente a los niños a preferir productos alimenticios con alto porcentaje de grasa tales como pasta, papas fritas, chocolates y pan. Es posible que una dieta rica en grasas en niños obesos pueda dar lugar a un aumento en los umbrales (12). Cabe señalar que la categorización de los patrones alimentarios en este estudio es ambigua, por lo que se sugiere considerar en este tipo de estudios encuesta de frecuencias de consumo de alimentos más amplias y validadas para la población.
Considerando la relación sugerida entre el consumo de grasa y la sensibilidad a ella, con la obesidad y el SNP rs1761667 de CD36, Mrizak y cols. (2015) realizaron un estudio en mujeres tunecinas con obesidad. Demostraron que las portadoras del genotipo AA para rs1761667 poseen umbrales más altos para la detección de ácido oleico, mientras que las portadoras del alelo G fueron más sensibles a la detección del ácido oleico. Los autores concluyeron que no se puede distinguir si la disminución de la sensibilidad a la grasa en mujeres con obesidad es una causa o la consecuencia de la obesidad (27).
También se ha planteado que ser portador homocigoto G para rs1761667 en CD36 se asocia con una función de CD36 disminuida. Esta afirmación se hace basándose en que la disminución de la expresión de CD36 en la lengua debería conducir a una disminución de la sensibilidad del gusto a la grasa y, por lo tanto, a un aumento en la ingesta de grasa y mayores niveles de ácidos grasos libres y triglicéridos en plasma (28,29), sin embargo, también se ha propuesto que CD36 parece ser un sensor de lípidos en las papilas gustativas circunvaladas. En un estudio con ratones se ha demostrado que a expresión de CD36 en las papilas circunvaladas está regulada a la baja por lípidos durante la ingesta de alimentos (30).
Cabe destacar que no todos los estudios son concordantes, probablemente se deba a la cantidad de participantes en los estudios, zona geográfica, pool genético y a las diferencias en la actividad del promotor de CD36 que es diferente dependiendo el tipo de tejido, además existen pocos estudios que evalúen la expresión de CD36 como proteína receptora del sabor y su expresión a nivel ARNm.
Otro estudio realizado en el 2017 reportó que la variante rs1527483 influye en la percepción de la grasa a nivel de la cavidad oral. Este evaluó la asociación entre las calificaciones de “oleosidad” percibida, contenido de grasa y cremosidad de alimentos, percepción oral de la grasa y obesidad con dos SNP de CD36 (rs1761667 y rs1527483). Se reportó que las mujeres calificaron la percepción del contenido de grasa y la “untuosidad” de productos lácteos más alto que los hombres, además los participantes portadores del genotipo TT en rs1527483 de CD36 percibieron significativamente una mayor cremosidad en un producto alimenticio. Se concluye que el polimorfismo rs1527483 de CD36 juega un papel más dominante en percepción de la grasa a nivel cavidad oral, y que el género es un factor que influye en la percepción del contenido de la grasa, probablemente debido a los niveles hormonales dentro de los ciclos menstruales (aunque no se evaluó en el estudio), pero existen diversos estudios contradictorios. Los dos SNP en CD36 no se asociaron con el origen étnico, la obesidad, la adiposidad central y la adiposidad general. Además de las diferencias tanto demográficas como genéticas de la población en la cual fue realizado el estudio, está descrito que otros SNP en CD36 tienen un desequilibrio de ligamento con rs1761667 y rs1527483 por lo que también podrían estar asociados con la percepción oral de la grasa y la obesidad (31).
Enciso-Ramírez y cols. (2020) realizaron una investigación en México con población infantil con la finalidad de asociar al polimorfismo rs1761667 en CD36 con sobrepeso, obesidad y las preferencias por tres tipos de aceite con diferente composición de ácidos grasos. Solo se asoció el alelo G con sobrepeso/obesidad (OR 2,43 [CI 1,02-5,99]; p = 0,02) y no se encontró alguna relación entre este polimorfismo con las preferencias de los participantes por los distintos tipos de aceites (32). Estos resultados pueden discrepar de otros, posiblemente debido al tamaño de la muestra, la zona geográfica donde se desarrolló la investigación y a otros factores biológicos determinantes, como el hecho que en los niños las papilas gustativas son de menor tamaño que las de los adultos (32), además de factores ambientales y sociales, como la edad, el aprendizaje, la exposición repetida y el consumo de dichos aceites que no es tan común en la región.
OTROS FACTORES IMPLICADOS EN LA PERCEPCIÓN ORAL DE LAS GRASAS
Interacciones genéticas entre el sabor amargo y el sabor graso
Khan y cols. (2019) demostraron que la utilización de ácidos grasos, como el oleico (AO) y el linoleico (AL), en estudios experimentales influye en la percepción de los compuestos amargos, mientras que la modalidad del sabor amargo puede interferir con la percepción del sabor de los lípidos (2).
Melis y cols. analizaron la relación entre la percepción orosensorial del AO, las variantes de CD36 rs1761667 y rs1527483 y la degustación de PROP. Cabe destacar que los individuos que son súpercatadores de PROP presentan una mayor sensibilidad a una amplia gama de estímulos orales de todas las cualidades gustativas. Los participantes con genotipo GG para rs1761667 de CD36 mostraron un umbral 5 veces más bajo para el ácido oleico. Los participantes no catadores de PROP con el genotipo GG de rs1761667 mostraron un umbral para ácido oleico 9 veces más bajo y los súper catadores de PROP con genotipo CC para rs1527483 de CD36 mostraron un umbral 4 veces más bajo que los no catadores de PROP con el mismo genotipo para este locus de CD36. Se concluyó que la percepción orosensorial de los ácidos grasos está directamente asociada con la capacidad de respuesta al PROP y con el polimorfismo rs1761667 de CD36 principalmente en personas que no son catadores de PROP (33).
En población árabe se demostró que los umbrales de detección de sabor graso y amargo se asocian con el IMC, dado que existió una correlación positiva entre los umbrales detección de ácido linoleico y PROP en participantes obesos. La sensibilidad al ácido linoleico también está asociada con el IMC elevado. Se concluyó que los umbrales de detección altos para sabores grasos y amargos podrían ser un factor que contribuye a la obesidad (34), por lo anterior también se sugiere que puede haber una relación entre el sabor graso, el sabor amargo y la obesidad.
Hormonas
Se ha reportado que los umbrales de detección a ácido oleico han sido más altos en personas con obesidad demostrando así una correlación positiva entre los umbrales de detección e IMC. También se ha demostrado que existe mayor frecuencia de genotipo AA de rs1761667 en participantes con obesidad, además los genotipos AA y AG tenían umbrales de detección al AO más altos. La baja sensibilidad para detectar el sabor de la grasa puede jugar un papel importante en el desarrollo de la obesidad. Además, el aspecto hormonal puede influir en el estado nutricio ya que en la obesidad existen cambios en las adipocitocinas, como adiponectina y leptina. En esta condición, la leptina se encuentra en niveles altos y se cree que influye en la disminución de la capacidad gustativa y olfativa. Por lo que se sugiere que las complicaciones metabólicas de la obesidad pueden alterar la percepción del gusto (35).
Un estudio experimental en ratones demostró que CD36 se coexpresa junto con la leptina y el receptor de leptina (Ob-Rb) en las papilas circunvaladas. También se reportó que la leptina a nivel de la lengua ejerce una acción inhibitoria sobre la detección orosensorial de un ácido graso dietético al interferir con la señalización de Ca2+ y el potencial de membrana en las papilas gustativas de los ratones (36).
El péptido YY también podría estar implicado en la percepción del sabor graso mediado por CD36. Karthi y cols. (2020) analizaron la interrelación entre rs1761667 en CD36, la percepción de grasa oral, el péptido salival YY y la adiposidad. El grupo con obesidad (OB) exhibió un umbral de detección 3 veces mayor para AL mientras que los participantes con sobrepeso mostraron un umbral de detección más bajo. Los portadores de los genotipos AA y AG para rs1761667 tenían un umbral de detección de AL mayor que los portadores del genotipo GG; los portadores de genotipos AA y AG tenían un IMC, circunferencia de la cintura, circunferencia de cadera, relación cintura-cadera y relación cintura-estatura mayores en comparación con portadores del genotipo GG. El grupo OB tenía un nivel bajo de péptido salival YY, por lo que esta hormona tiene un papel fisiopatológico en el desarrollo de la obesidad y CD36 podría regular la síntesis o liberación del péptido YY en papilas (37).
Karmous y cols. (2022) demostraron que existe una asociación positiva entre el indicador de la dieta saludable y los umbrales de detección a los ácidos grasos, así como una asociación negativa entre la adherencia a la dieta mediterránea y la detección oral de la grasa en participantes con obesidad. De acuerdo con estos autores, la transición nutricional de la población es uno de los factores que contribuye a la obesidad y esto a su vez a la mala detección orosensorial de la grasa (38).
Cambios epigenéticos
Algunos cambios epigenéticos en los genes responsables de la percepción oral de los ácidos grasos pueden contribuir a la baja percepción de los mismos y por lo tanto ser factor de riesgo para la obesidad.
Los niños con obesidad tienen una menor capacidad de detección al ácido oleico y al PROP, y una mayor preferencia por los alimentos palatables y ricos en grasa como papas fritas, queso y chocolate. En este mismo estudio también se reportó una correlación positiva entre la metilación de los genes GPR120 y CD36 con la ingesta de calorías procedentes de alimentos palatables (39). Sin embargo, no hay mucha información sobre la metilación de estos genes asociados con la percepción oral de las grasas por lo que se considera como una perspectiva.
CONCLUSIONES
CD36 participa en la fisiopatología de algunas enfermedades cardiovasculares y metabólicas, así como en la percepción oral de los lípidos. Algunas variantes genéticas de CD36 pueden asociarse con menor expresión, que en conjunto con la dieta también podrían modificar la percepción oral de los lípidos. CD36 podría no ser el único gen involucrado en la percepción oral de las grasas, por lo tanto, es importante tener en cuenta que puede existir una interacción entre este gen con otros que codifiquen para receptores de sabor.
El nivel de evidencia del papel de CD36 en la percepción oral de las grasas es intermedio, dado que la heterogeneidad en los hallazgos puede deberse a las diferencias técnicas y metodológicas de los estudios y a las diferentes poblaciones estudiadas, se dificulta su integración. También es importante considerar que la expresión de los genes depende de otros factores como el ambiente y factores biológicos, esto podría afectar la expresión de otros genes que codifiquen receptores de sabor y por lo tanto influir en las preferencias alimentarias y los umbrales de detección a ácidos grasos. Considerando esto, son necesarias más investigaciones que incluyan distintas poblaciones con un gran número de participantes, así como la posible investigación de la interacción entre distintas hormonas y la expresión de CD36.














