INTRODUCCIÓN
El fósforo es un elemento ampliamente distribuido en el cuerpo humano y representa el 1 % del peso corporal total. El 85 % se encuentra en el hueso, donde junto con el calcio forma cristales de hidroxiapatita que ayudan a la mineralización de la matriz ósea aportando resistencia y rigidez esquelética. El resto (aproximadamente un 15 %) se encuentra en forma de fosfatos a nivel intracelular y es el anión más abundante que interviene en funciones esenciales en el metabolismo energético (1,2).
Los niveles de fósforo son regulados fundamentalmente por el factor de crecimiento de fibroblastos (FGF-23), la hormona paratiroidea (PTH) y el sistema hormonal de la vitamina D. La concentración sérica normal oscila entre 2,5-4,5 mg/dl y puede variar según factores como la edad, el sexo del paciente, la hora del día en que se toma la muestra y el laboratorio donde se procesa (1-3).
La prevalencia de hipofosfatemia dependerá de la población estudiada; por ejemplo, se ha descrito que un 5 % de pacientes hospitalizados presentan esta alteración iónica (3) y sus manifestaciones clínicas dependerán del tiempo de instauración y sus niveles séricos. La mayoría de las veces es leve, y cuando esta condición es grave y de instauración aguda (especialmente con valores inferiores a 1 mg/dl), puede poner en riesgo la salud y la vida del paciente (1-3).
CASO CLÍNICO
Presentamos el caso de una mujer de 57 años con antecedentes de diabetes mellitus tipo 2, cirrosis hepática etílica abstinente, hipertensión portal y anemia ferropénica crónica de causa multifactorial, que ha requerido transfusión de hematíes y tratamiento intravenoso con carboximaltosa férrica (Ferinjet®) con una periodicidad mensual desde hace casi dos años. Por su enfermedad de base, realizaba tratamiento crónico diurético con espironolactona y furosemida. La paciente consultó por clínica de dolor y debilidad en miembros inferiores de predominio distal en aumento, de un año de evolución, con dificultad para deambular hasta requerir apoyo con bastón e incluso el uso de silla de ruedas. Fue derivada al Servicio de Neurología y, con la sospecha clínica de posible polineuropatía sensitiva de causa metabólica asociada a la diabetes mellitus, fue referida para valoración en consulta de Endocrinología.
En la exploración física llama la atención ligero tinte ictérico y, al explorar la marcha, esta se encuentra enlentecida y se aprecia debilidad muscular de predominio distal con dificultad para caminar de puntas y talones.
EXÁMENES COMPLEMENTARIOS
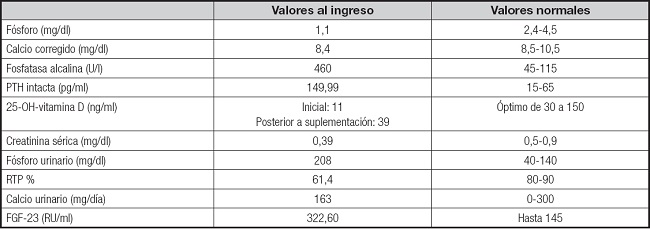
La tabla I muestra los resultados de los análisis de laboratorio. Los resultados de la electromiografía (EMG) fueron compatibles con polineuropatía sensitiva, axonal y desmielinizante moderada.
DISCUSIÓN
En el caso que presentamos, inicialmente se consideró como posible causa de la hipofosfatemia el uso de diuréticos de asa que la paciente tomaba por su patología de base, pero tras suplementación de fosfato, vitamina D y retirada de diuréticos, la hipofosfatemia persistía. Por este motivo se decidió ingreso hospitalario para repleción endovenosa y complementar estudio.
Ante el hallazgo de hipofosfatemia junto con normocalcemia, niveles de vitamina D corregidos y aumento de excreción renal de fósforo (retención tubular de fósforo [RTP] baja), ligado con el antecedente de administración de carboximaltosa férrica endovenosa, se llegó a la sospecha diagnóstica de hipofosfatemia crónica por aumento de la excreción renal de fósforo secundaria al uso de carboximaltosa férrica.
La carboximaltosa férrica es una preparación intravenosa que ayuda a la corrección rápida de la anemia con menor riesgo de reacciones adversas que otras preparaciones de hierro intravenoso. Sin embargo, se ha visto que puede causar efectos sobre el metabolismo fosfocálcico (4), como se ha reportado en ficha técnica de la Agencia Española de Medicamentos y Productos Sanitarios (CIMA), donde se menciona el uso de la CF como causa de hipofosfatemia y la posibilidad de desarrollo de osteomalacia hipofosfatémica (10).
El ensayo clínico PHOSPHARE-IDA comparó a 245 pacientes con anemia ferropénica que recibieron carboximaltosa férrica o hierro derisomaltosa y concluyó que la administración de carboximaltosa férrica fue el factor de riesgo más fuerte para desarrollar hipofosfatemia severa y persistente, 75 % versus 7,9 %, respectivamente, con una OR de 38,37 (IC 95 %: 16,62-88,56; p < 0,001) (5). Además, junto con el uso de este medicamento, se observó el comportamiento de los marcadores del metabolismo óseo y mineral con resultados asociados a niveles más bajos de fósforo y aumento del FGF-23, la PTH y la fosfatasa alcalina de forma significativa (p < 0,05) (5,6). En cuanto al tiempo de aparición de la hipofosfatemia, Sánchez y cols. realizaron un estudio retrospectivo en el cual incluyeron a pacientes con anemia ferropénica que fueron tratados con carboximaltosa férrica y posteriormente tuvieron determinaciones seriadas de fosfato sérico. En su estudio hallaron que el 58 % desarrolló hipofosfatemia, la media de tiempo de inicio fue a los 18 días y el tiempo que tardó en corregirse fue en los siguientes 78 días (4). Datos similares podemos encontrar en el estudio FIRM (IDA-304), un ensayo clínico aleatorizado doble ciego que comparó los efectos de la carboximaltosa férrica versus el ferumoxitol. Dicho estudio reporta mayor incidencia de hipofosfatemia en los pacientes que recibieron carboximaltosa férrica en comparación con el ferumoxitol (< 2,0 mg/dl, 50,8 % vs. 0,9 %; < 1,3 mg/dl, 10,0 % vs. 0,0 %; p < 0,001). Además, se realizó seguimiento de los niveles de fosfato sérico; en el caso de los pacientes que recibieron ferumoxitol, el fosfato sérico permaneció sin variaciones extremas; sin embargo, en los pacientes que recibieron carboximaltosa férrica, se pudo comprobar que fue disminuyendo progresivamente desde la primera semana de su administración hasta llegar a su nadir a las dos semanas tras la administración (IC 95 %: 1,45-1,57, p < 0,001) (9). La evidencia existente demuestra una incidencia mayor de hipofosfatemia con carboximaltosa férrica, frente a otros preparados de hierro intravenoso como la derisomaltosa férrica y el ferumoxitol (12).
En cuanto a los factores que aumentan el riesgo de desarrollo de hipofosfatemia, se ha visto que influye la exposición a dosis repetidas del fármaco. Benedikt S y cols. realizaron una búsqueda bibliográfica de casos reportados con hipofosfatemia tras la administración de CF y encontraron 77, la mayoría con varias administraciones (58 %). Además, en 44 pacientes se describió sintomatología específica como debilidad generalizada, fatiga y dolor óseo y muscular, así como osteomalacia con fracturas. Otros factores son los antecedentes de trastornos gastrointestinales que conllevan un déficit de absorción de vitaminas liposolubles, como por ejemplo el déficit de vitamina D con desnutrición. En otros estudios se ha relacionado el uso concomitante de medicamentos que afecten la función tubular renal con un déficit de hierro más grave asociado a pacientes con pérdida sanguínea gastrointestinal y ginecológica (11,12).
Desde un punto de vista fisiopatológico, se ha visto que el déficit de hierro estimula la producción de FGF-23, que en circunstancias normales se dividiría en fragmentos inactivos, sin embargo, la carboximaltosa férrica evita esa escisión manteniendo sus concentraciones elevadas (3-8). El FGF-23 incrementa la excreción urinaria de fosfato, ya que disminuye las proteínas transportadoras de fosfato dependientes de sodio, que regulan la absorción de fosfato a nivel renal (NPT2a y NPT2c), y también actúa inactivando a la 25-hidroxivitamina D (25[OH]D), que es el principal estimulante en el intestino del transportador NPT2b, reduciendo así la absorción de calcio y fósforo. Esto genera a su vez un hiperparatiroidismo secundario, lo que refuerza la fosfaturia. En el caso de nuestra paciente, las pruebas de laboratorio mostraron un FGF-23 elevado y una 25(OH)D baja, lo que ayudó a confirmar el diagnóstico (1,2,7).
No existe un consenso actual sobre el cribado que debemos realizar en los pacientes que están utilizando de forma crónica carboximaltosa férrica. No obstante, a nuestro criterio, existe bibliografía con evidencia suficiente para recomendar realizar un control de niveles de fósforo dentro de las primeras tres semanas después del inicio de su administración, principalmente en pacientes con factores de riesgo que predisponen al desarrollo de esta entidad (6).
Finalmente, en el caso que presentamos, tras suspender la carboximaltosa férrica, en el control realizado en consulta externa al mes del alta, la paciente presenta mejoría evidente del estado general, sin necesidad de uso de silla de ruedas, y valores normales de fósforo y calcio en analítica.