Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.19 no.6 jun. 2002
NOTA CLÍNICA
Linfoma cardiaco primario: diagnóstico citológico y tratamiento con
respuesta a poliquimioterapia y a autotrasplante de precursores
hematopoyéticos. Presentación de un caso y revisión de la literatura
C. Porcar Ramells, C. Clemente González, D. García Parés, R. Guardia Sánchez*,
Mª J. Pérez Ayuso**, F. García-Bragado Dalmau
Servicio Medicina Interna, *Servicio Hematología, **Servicio Cardiología. Hospital Universitari de Girona.
Dr. Josep Trueta. Girona
RESUMEN
El linfoma cardíaco primario (LCP) es un tumor extraordinariamente infrecuente en pacientes inmunocompetentes, de diagnóstico dificil y a menudo tardío, que comporta un pronóstico muy grave y escasas posibilidades terapeúticas.
Presentamos un caso de linfoma no Hodgkin cardíaco primario en un paciente de 46 años, inmunocompetente, que debutó con insuficiencia cardíaca y flutter auricular. Se practicaron estudios con ecocardiografía transesofágica (TEE), tomografía computarizada (TC) y resonancia magnética (MR) que detectaron una tumoración intracardíaca localizada a nivel del septo interauricular. El diagnostico se fundamentó en el examen citológico del liquido pleural. Se instauró tratamiento quimioterápico y se sometió al paciente a un autotrasplante de precursores hematopoyéticos. El paciente permanece en remisión 36 meses después del diagnóstico y 29 meses del autotrasplante.
Nuestra experiencia indica que un diagnóstico precoz y preciso conjuntamente con un tratamiento antilinfomatoso apropiado y agresivo puede ayudarnos a obtener una supervivencia prolongada en pacientes con LCP.
PALABRAS CLAVE: Linfoma cardíaco primario. Diagnóstico. Pronóstico. Tratamiento.
Primary cardiac lymphoma: antemortem cytologic diagnosis and treatment with a response to polychemotherapy and the autologous peripheral blood stem cells transplantation. Presentation of one case report and review of the literature
ABSTRACT
The primary cardiac lymphoma (PCL) is an extremely infrequent tumor suffered by immunocompetents patients with a difficult diagnosis and slow progress leading to a serious prognosis and few therapeutically possibilities.
It's a primary-cardiac non-Hodgkin's lymphoma (NHL) in a patient of 46-year-old, immunocompetent, who started with a congestive heart failure and atrial flutter. Some examinations were carried out such as a transesophageal echocardiography (TEE), a computed tomography (TC) and a magnetic resonance imaging (MRI) and an intracardiac tumor placed in the interauricular septum was detected. The diagnosis was based on a pleural fluid cytological examination. It was decided to follow a chemotherapy treatment and the autologous peripheral blood stem cells transplantation was carried out. The patient remains in full remission thirty-six months after diagnosis and twenty-nine months after the autotransplant.
Our clinical experience indicated that an early and accurate diagnosis combined with the appropriate and aggressive antilymphoma therapy can thus help in obtaining a long survival in patients with PCL.
KEY WORDS: Primary cardiac lymphoma. Diagnosis. Prognosis. Treatment.
Trabajo aceptado: 13 de diciembre de 2000
Correspondencia: Carles Clemente i Gonzalez. Servicio de Medicina Interna. Hospital Universitari de Girona. Dr. Josep Trueta. C/ Av. de França, s/n. 17007 - Girona. Tel. 972 20 27 00. Fax 972 21 27 54.
INTRODUCCIÓN
Los linfomas cardíacos primarios (LCP) son excepcionales y representan el 1,3% de los linfomas extraganglionares (1). El LCP se define como el linfoma no Hodgkin (LNH) con afectación exclusiva del corazón y pericardio o como el LNH con una gran masa tumoral localizada en el corazón (2,3). La presentación clínica inespecífica y su evolución tórpida dificultan el diagnóstico antes de la muerte. Un diagnóstico y tratamiento precoz mejoraría el pronóstico de esta entidad (4,5).
Presentamos un caso de LCP que se diagnosticó a partir del estudio citológico del líquido pleural con respuesta a la poliquimioterapia y al trasplante autógeno de precursores hematopoyéticos. El paciente permanece en remisión completa 36 meses después del diagnóstico y 29 meses después del autotrasplante.
CASO APORTADO
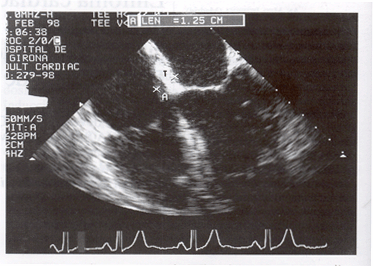
Presentamos un paciente de 46 años sin antecedentes patológicos de interés que ingresó por presentar insuficiencia cardíaca congestiva y flutter auricular. La clínica comenzó dos meses antes del ingreso en forma de astenia, disnea progresiva hasta hacerse de mínimos esfuerzos, ortopnea, edemas en extremidades inferiores y escroto, sudación nocturna y prurito generalizado. Las constantes a su ingreso fueron presión arterial de 140/85 mmHg, frecuencia cardíaca 120/minuto, frecuencia respiratoria 30/minuto y temperatura axilar 36 ºC. En la exploración física había palidez cutánea, edemas en escroto y extremidades inferiores y signos clínicos de presión venosa aumentada. La auscultación cardiopulmonar puso de manifiesto un ritmo cardíaco irregular, un primer ruido reforzado, un soplo diastólico II/VI en borde paraesternal izquierdo y una disminución del murmullo vesicular en la base derecha. No se palpaban adenopatías ni visceromegalias. En las pruebas de laboratorio practicadas destacaron: hemoglobina de 134 g/l; 13 x 109 leucocitos/l (75% S, 8% L, 14% M); 245 x 109 plaquetas/l; lacticodeshidrogenasa (LDH) 1.091 U/l, ácido úrico 13,2 mg/dl y beta-2 microglobulina 0,36 mg/dl. La serología para el virus de la inmunodefiencia humana (VIH) fue negativa. El electrocardiograma (ECG) mostraba flutter auricular y la radiografía de tórax, pequeño derrame pleural derecho, con infiltrado intersticial bilateral y silueta cardíaca aumentada de tamaño sugerentes de edema de pulmón. En un ecocardiograma transtorácico realizado el día del ingreso se apreciaba la cavidad auricular derecha ocupada por una masa que dificultaba el flujo a través de la válvula tricúspide. Un ecocardiograma transesofágico (ETE) objetivó una gran masa tumoral intracardíaca, de densidad heterogénea, que infiltraba el septo interauricular y protuía en ambas aurículas, con predominio en aurícula derecha, invadiendo la desembocadura de las venas cavas y que prolapsaba a través de la válvula tricúspide provocando una obstrucción al flujo con gradiente medio de 6 mm Hg. Así mismo había una hipertrofia concéntrica del ventrículo izquierdo con fracción de eyección del 64%, y una dilatación ligera a moderada de aurícula izquierda (Fig. 1). La tomografía computarizada (TC) torácica visualizó una masa intracardíaca a nivel del septo interauricular, un derrame pleural bilateral de predominio derecho y adenopatías significativas a nivel retrocavo y paracardíacas (Fig. 2). La TC abdominal y pélvica fueron normales. La resonancia magnética (RM) sincronizada con el ECG demostró con mayor precisión las características de la masa auricular y detectó la presencia de un mínimo derrame pericárdico. Se consideró la posibilidad de practicar una biopsia endocavitaria por via endovenosa, que fue finalmente rechazada ante la situación clínica inicial del paciente y el riesgo en la práctica de la biopsia de la masa tumoral intracardíaca. Se realizó una toracocentesis que fue diagnóstica, ya que la citología del líquido pleural confirmó la presencia de células malignas de estirpe linfoide compatibles con linfoma de células B grandes. El estudio de extensión se completó con una biopsia ósea y hepática que no mostraron infiltración por linfoma. A la vista de estos resultados se instauró tratamiento quimioterápico según protocolo CHOP (ciclofosfamida 1.400 mg, doxorubicina 100 mg, vincristina 2 mg, 6-metil-prednisolona 120 mg) durante cuatro ciclos. Un nuevo ETE, realizado a los 10 días del inicio del tratamiento, demostró una importante reducción de la tumoración intracardíaca, que adquirió aspecto multiloculado, con gran movilidad en el interior de la cavidad auricular derecha, sin obstrucción del flujo a través de la válvula tricúspide y de las venas cavas. A los 10 días de la segunda tanda ingresó por aplasia medular secundaria a la quimioterapia y neumonía bilateral con insuficiencia respiratoria severa con buena respuesta al tratamiento con piperacilina-tazobactam, amikacina y anfotericina-B. Durante el ingreso presentó paresia del VI par craneal derecho. Con la sospecha de infiltración del sistema nervioso central se practicaron una TC craneal y una punción lumbar que fueron normales. Se administraron dos tandas de quimioterapia intratecal con citarabina (30 mg), metotrexate (12 mg) e hidrocortisona (20 mg) y fue dado de alta. Tras la tercera tanda de poliquimioterapia sistémica reingresó por otro episodio de aplasia medular con mucositis gastrointestinal e infección urinaria que evolucionó satisfactoriamente. Se instauró quimioterapia de intensificación según protocolo ESHAP (etopósido 70 mg, citarabina 3,6 g, cisplatino 45 mg, 6-metil-prednisolona 900 mg) durante dos ciclos y cuatro tandas más de quimioterapia intratecal con citarabina (30 mg), metotrexate (12 mg) e hidrocortisona (20 mg). Tras la reevaluación postratamiento se decidió someter al paciente a un trasplante autógeno de progenitores hemopoyéticos de sangre periférica y fue trasladado a otro centro hospitalario. Previamente al acondicionamiento, presentó un cuadro de uveitis anterior infiltrativa del ojo izquierdo que mejoró con metotrexato intratecal. El acondicionamiento consistió en el régimen BEAM (BCNU 650 mg/1 dosis, etopósido 425 mg/ 4 dosis, ARA-C 210 mg/8 dosis, melfalan 300 mg/1 dosis). Recibió la celularidad criopreservada (CD34+ 2,3 x 106/kg, obtenida en seis aféresis; 18,1 CFU-GM x 104/kg). En la revisión realizada a los cuatro meses del trasplante el enfermo se mantenía asintomático. El ETE demostraba únicamente un engrosamiento del septum interauricular. El paciente permanece en remisión completa 36 meses tras el diagnóstico y después de 29 meses del autotrasplante presentando de forma ocasional crisis de flutter auricular.
Fig. 1. Ecocardiograma transesofágico en 4 cámaras donde se objetiva masa ecodensa que infiltra el septo interauricular y protuye en ambas aurículas, con predominio en aurícula derecha, ocupando gran parte de la cavidad y provocando obstrucción a nivel de la válvula tricúspide.
Fig. 2. Tomografía computarizada (TC) torácica: Masa intracardíaca a nivel del septo interauricular. Derrame pleural bilateral de predominio derecho. Adenopatias a nivel retrocavo y paracardíacas.
DISCUSIÓN
La mayoría de los tumores cardiacos son de origen metastásico. Las más frecuentes son las procedentes de carcinomas de pulmón y mama, seguidas por las neoplasias hematológicas y melanomas (6-8).
Los tumores primarios del corazón son infrecuentes, y presentan una prevalencia que oscila entre el 0,0017 y 0,28% según diferentes series de autopsias en pacientes no seleccionados (1,2). Son benignos en tres cuartas partes de los casos y entre ellos el mixoma es el más frecuente. La mayoría de tumores malignos son sarcomas, de los que el angiosarcoma es el más frecuente, seguido por el sarcoma indiferenciado, osteosarcoma, histiocitoma fibroso maligno, leiomiosarcoma, mixosarcoma, el sarcoma sinovial y el neurofibrosarcoma (9).
Los linfomas cardiacos son extraordinariamente raros y representan el 1,3% de los tumores primarios del corazón (1). Los linfomas cardiacos pueden ser primarios o bien tratarse de una infiltración a partir de un linfoma generalizado. Éstos últimos son más frecuentes ya que entre el 9 y el 28%, según diversas series, pueden implantarse secundariamente en el corazón (10). Los LCP son una rareza; hay unos 60 casos descritos en la literatura de los que más del 80% son linfomas no Hodgkin (LNH) (11).
En 1978 McAllister y Fenoglio (2) definen al LCP como aquel linfoma extraganglionar que afecta sólo al miocardio o pericardio. Posteriormente Cairns y cols. (3) definen esta entidad como aquel LNH con una gran masa tumoral localizada en el corazón.
Desde un punto de vista anatomopatológico, la mayoría corresponden a linfomas de células grandes B, difusos, de alto grado de malignidad y rápido crecimiento (11,12). Son más habituales en pacientes inmunodeprimidos, como los infectados por el VIH (13) o los pacientes sometidos a trasplantes de corazón (14) o riñón (15).
Un dato importante en el diagnóstico diferencial de las masas intracavitarias es su localización. Los linfomas diseminados se implantan más frecuentemente a nivel del pericardio visceral con afectación del tejido adiposo subepicárdico (6). Los linfomas primarios son, en general, tumores no localizados que aparecen como nódulos múltiples o masas polipoides que infiltran el miocardio, con mayor frecuencia a nivel de la aurícula derecha (1,11). En nuestro caso la masa tumoral afectaba el septo interauricular.
No existen signos ni síntomas cardiacos específicos que hagan sospechar un LCP (12). La forma de presentación y las manifestaciones clínicas vienen determinadas fundamentalmente por la localización de la implantación y la extensión del tumor (16). En la revisión de los casos publicados las formas de presentación más frecuentes fueron insuficiencia cardíaca congestiva (16), dolor torácico (17), arritmias (18,19) y derrame pericárdico con o sin taponamiento (18,20,21). Otras manifestaciones fueron disnea (22), derrame pleural masivo (23,24), pericarditis constrictiva (25), síndrome de la vena cava superior (20), alteraciones electrocardiográficas (ondas Q y T negativas, alteraciones segmento ST, bloqueos AV) (17,21,25-27) y más raramente se han presentado, como infarto de miocardio (15) o muerte súbita (28). El caso que aportamos la presentación clínica correspondía a insuficiencia cardiaca congestiva y flutter auricular.
Las alteraciones analíticas son comunes a otros linfomas, pero destacaríamos el aumento de la velocidad de sedimentación globular (VSG), ácido úrico y LDH (11).
En el diagnóstico de linfoma cardiaco son de gran importancia las técnicas de imagen. La ecocardiografía bidemensional y, en especial, la ecocardiografía transesofágica, son elementos fundamentales en el diagnóstico del tumor, ya que proporcionan imágenes muy sensibles con respecto al lugar de implantación del tumor o su tamaño (29). El inconveniente que presentan es la falta de información respecto a la extensión extracardíaca del tumor (30). Por su parte, la TC y la RM son técnicas de indudable valor al proporcionarnos cortes seccionales del corazón, mediastino, pulmón y tórax sin superposición de imágenes y sin las limitaciones anatómicas de la ecocardiografía (31). La gammagrafía es otra técnica de imagen de gran ayuda en el descubrimiento y manejo de los linfomas (16,32). Es característico una intensa captación de citrato de galio, dándose casos de confusiones con procesos inflamatorios o metastásicos cardíacos.
El diagnóstico de certeza se obtiene mediante el estudio histológico. Actualmente la prueba diagnóstica más rentable es la biopsia por vía intravenosa (33,34), que, sin embargo, sólo consigue el diagnóstico en la mitad de los casos (11,33). En nuestro caso se desaconsejó por el riesgo de ruptura auricular. También se han mostrado útiles la toracotomía exploradora con biopsia y el estudio citológico del líquido pericárdico (17,18), o pleural (23,24). El diagnóstico de neoplasia linfoide requiere en ocasiones, además de criterios morfológicos, la utilización de métodos inmunohistoquímicos o la técnica de reacción en cadena de la polimerasa (PCR) (35) para diferenciar los distintos tipos tumorales.
El tratamiento y la evolución de los casos publicados de LCP han sido muy heterogéneos. La cirugía de resección, combinada o no a quimioterapia y/o radioterapia ha obtenido resultados variables, con supervivencias que oscilan entre el mes y los trece meses (32,36-39). Yuh y cols. (40) describen el primer caso de LCP en que se practicó un trasplante cardiaco ortotópico con una supervivencia de tres meses.
Siguiendo la clasificación de La Working Formulation (41) y más recientemente la plasmada en la Revised European-American Classification of Lymphoid Neoplams o clasificación REAL (42) podemos incluir a los LCP dentro del grupo de linfomas agresivos. El tratamiento inicial de los LNH agresivos, en la actualidad, se basa en la poliquimioterapia. Los regímenes terapéuticos empleados deben tener en cuenta el tipo histológico del LNH, la edad, la extensión de la enfermedad y los factores pronósticos o de riesgo (43). Varios ensayos comparativos multicéntricos en los que se compara CHOP con otras combinaciones de segunda (F-MACHOP, ProMACE-MOPP) o tercera (MACOP-B, ProMACE-CytaBOM) generación no obtienen diferencias significativas en cuanto a la tasa de remisiones completas ni a la supervivencia (44-49), por lo que podemos considerar el régimen CHOP, por su fácil manejo y su baja toxicidad, la terapia estándar de los LNH agresivos y así pues, el régimen terapéutico que podemos emplear en el LCP. En la revisión de los casos publicados la mayor parte de los autores utilizaron este régimen terapéutico, al igual que nuestro caso. Los pacientes tratados con poliquimioterapia, mediante CHOP o régimen similar, aplicada en fases avanzadas de la enfermedad tienen una supervivencia media de 7 meses (intervalo: 0-48) (11). La supervivencia media aumenta a 11,5 meses (intervalo: 4-36) cuando la combinamos con radioterapia11. Recientemente se ha descrito el caso de un paciente en progresión después de la respuesta inicial a ProMACE-CytaBOM (ciclofosfamida, adriamicina, VP-16, arabinósido de citosina, bleomicina, vincristina, metotrexato y prednisona) con la intención de realizar posteriormente un autotrasplante, sin embargo, no ha sido comunicado que se realizara (11).
El trasplante de progenitores hemopoyéticos (TPH) tiene en la actualidad un importante papel en el tratamiento de las hemopatías malignas (50). Las indicaciones más frecuentes que motivan la realización de un TPH en adultos son los linfomas, leucemias y tumores sólidos (51).
El autotrasplante de progenitores hemopoyéticos de sangre periférica es una modalidad terapéutica asociada a la quimioterapia mieloablativa cuya finalidad es la aceleración del proceso de recuperación mielopoyética. Se utilizó, en un principio, como terapia de rescate en los pacientes con resistencia primaria o recaída, pero poco a poco se ha ido utilizando también como terapia de primera línea en los pacientes con LNH que presentan criterios de mal pronóstico (carga tumoral elevada, afectación de la médula ósea y LDH elevadas). En nuestro caso presentó una recaída con progresión al sistema nervioso por lo que se practicó el autotrasplante.
Los resultados obtenidos con tratamientos mieloablativos seguidos de trasplante de células hemopoyéticas de sangre periférica han indicado que con esta modalidad terapéutica se pueden obtener tasas de remisión completa y de supervivencia superiores a la quimioterapia convencional, en especial para los enfermos de alto riesgo (50) o aquellos que permanecen sensibles a la quimioterapia (52,53). Aunque los resultados parecen prometedores, no existen estudios aleatorizados que lo confirmen (54,55). En nuestro caso permanece en remisión completa 29 meses después del autotrasplante de células hemopoyéticas periféricas.
En conclusión, los LCP son extraordinariamente infrecuentes y no existen estudios de seguimiento a largo plazo. El diagnóstico se lleva a cabo mayoritariamente en la autopsia y se han referido unos pocos casos tratados y con corta supervivencia. En nuestro caso el diagnóstico se realizó a partir de la citologia del líquido pleural y las técnicas de imagen nos sirvieron para valorar la regresión del tumor tras la quimioterapia. Creemos que es el segundo caso (56) descrito en la literatura en el que se ha podido practicar un autotrasplante de progenitores hematopoyéticos de sangre periférica después de la poliquimioterapia y el que presenta una mayor supervivencia.
Bibliografía
1. Burke A, Virmani R. Tumors of the heart great vessels. Atlas of tumor pathology. 3rd series, Fascicle 16. Washington, D.C.: Armed Forces Institute of Pathology, 1996; 171-9. [ Links ]
2. McAllister HA, Fenoglio JJ. Tumors of the cardiovascular system. Atlas of tumor pathology. 2nd series. Fascicle 15. Washington, D.C.: Armed Forces Institute of Pathology 1978: 73-109. [ Links ]
3. Cairns P, Butany J, Fulop J, Rakowski H, Hassaram S. Cardiac presentation of non-Hodgkin's lymphoma. Arch Pathol Lab Med 1987; 111: 80-3. [ Links ]
4. Nand S, Mullen GM, Lonchyna VA, Moncada R. Primary lymphoma of the heart. Prolonged survival with early systemic therapy in a patient. Cancer 1991; 68: 2289-92. [ Links ]
5. Chao TY, Han SC, Nieh S, Lan GY, Lee SH. Diagnosis of primary cardiac lymphoma. Report of a case with cytologic examination of pericardial fluid and imprints of transvenously biopsied intracardiac tissue. Acta Cytol 1995; 39: 955-9. [ Links ]
6. Roberts WC, Glancy DL, DeVita VT. Heart in malignant lymphoma (Hodgkin's disease, lymphosarcoma, reticulum cell sarcoma and mycosis fungoides). A study of 196 autopsy cases. Am J. Cardiol 1968; 22: 85-107. [ Links ]
7. McDonnell PJ, Mann RB, Bulkley BH. Involvement of the heart by malignant lymphoma: a clinicopathologic study. Cancer 1982; 49: 944-51. [ Links ]
8. Klatt EC, Heitz DR. Cardiac metastases. Cancer 1990; 65: 1456-9. [ Links ]
9. Burke AP, Cowan D, Virmani R. Primary sarcomas of the heart. Cancer 1992; 69: 387-95. [ Links ]
10. Pavlidis NA, Elisaf M, Bai M, Tolis Ch, Papadimitriou C. Primary lymphoma of the pericardium: report on a "cured" case and review of the literature. Med Pediatr Oncol 1994; 22: 287-91. [ Links ]
11. Ceresoli GL, Ferreri AJM, Bucci E, Ripa C, Ponzoni M, Villa E. Primary cardiac lymphoma in immunocompetent patients. Diagnostic and therapeutic management. Cancer 1997; 80: 1497-506. [ Links ]
12. Curtsinger CR, Wilson MJ, Yoneda K. Primary cardiac lymphoma. Cancer 1989; 64: 521-5. [ Links ]
13. Holladay AO, Siegel RJ, Schwartz DA. Cardiac malignant lymphoma in acquired immune deficiency syndrome. Cancer 1992; 70: 2203-7. [ Links ]
14. Weintraub J, Warnke RA. Lymphoma in cardiac allotransplant recipients: clinical and histological features and immunological phenotype. Transplantation 1982; 33: 347-51. [ Links ]
15. Rodenburg CJ, Kluin P, Maes A, Paul LC. Malignant lymphoma confined to the heart, 13 years after a cadaver kidney transplant. N Engl J Med 1985; 313: 122 [ Links ]
16. Chou ST, Arkles B, Gill GD, Pinkus N, Parkin A, Hicks JD. Primary lymphoma of the heart. A case report. Cancer 1983, 52: 744-7. [ Links ]
17. Castelli MJ, Mihalov ML, Posniak HV, Gattuso P. Primary cardiac lymphoma initially diagnosed by routine cytology. Case report and literature review. Acta Cytol 1989; 33: 355-8. [ Links ]
18. Pozniak AL, Thomas RD, Hobbs CB, Lever JV. Primary malignant lymphoma of the heart. Antemortem cytologic diagnosis. Acta Cytol 1986; 30: 662-4. [ Links ]
19. Bolis S, Bregani ER, Rossini F, Schiavina R, Pogliani EM. Atrial flutter followed by sick sinus syndrome as presenting symptoms of B-cell malignant non-Hodgkin lymphoma involving the heart. Haematologica 1993; 78: 332-4. [ Links ]
20. Hwang MH, Brown A, Piao ZE, Scanlon PJ. Cardiac lymphoma associated with superior vena caval syndrome and cardiac tamponade: case history. Angiology 1990; 41: 328-32. [ Links ]
21. Nakayama Y, Uchimoto S, Tsumura K, Morii H. Primary cardiac lymphoma with infiltration of the atrioventricular node: remission with reversal of the atrioventricular block induced by chemotherapy. Cardiology 1997; 88: 613-6. [ Links ]
22. Johnston IDA, Popple AW. Right ventricular outflow tract obstruction secondary to small intestinal lymphoma. Br Heart J 1980; 43: 593-6. [ Links ]
23. Scully RE, Mark EJ, McNeely WF, McNeely BU. Case records of the Massachusetts General Hospital: Case 22-1987. N Engl J Med 1987; 316: 1394-404. [ Links ]
24. Ito M, Nakagawa A, Tsuzuki T, Yokoi T, Yamashita Y, Asai J. Primary cardiac lymphoma. No evidence for an etiologic association with Epstein-Barr virus. Arch Pathol Lab Med 1996; 120: 555-9. [ Links ]
25. Scully RE, Mark EJ, McNeely BU. Case records of the Massachusetts General Hospital: Case 29-1983. N Engl J Med 1983; 309: 169-78. [ Links ]
26. O'Dea D, Kay R, Blake J, Rubin D, Pucillo A, Davidian M, et al. Electrocardiographic pseudo-myocardial infarct pattern in malignant cardiac disease. Cancer 1989; 63: 958-62. [ Links ]
27. Nagano M, Uike N, Suzumiya J, Muta K, Goto T, Suehiro Y, et al. Successful treatment of a patient with cardiac lymphoma who presented with a complete atrioventricular block. Am J Hematol 1998; 59: 171- 4. [ Links ]
28. Roh LS, Paparo GP. Primary malignant lymphoma of the heart in sudden unexpected death. J Forensic Sci 1982; 27: 718-22. [ Links ]
29. Mügge A, Daniel WG, Haverich A, Lichtlen PR. Diagnosis of noninfective cardiac mass lesions by two-dimensional echocardiography. Comparison of the transthoracic and transesophageal approaches. Circulation 1991; 83: 70-8. [ Links ]
30. Menegus MA, Greenberg MA, Spindola-Franco H, Fayemi A. Magnetic resonance imaging of suspected atrial tumors. Am Heart J 1992; 123: 1260-8. [ Links ]
31. Tesoro-Tess JD, Biasi S, Balzarini L, Ceglia E, Matarazzo C, Piotti P, et al. Heart involvement in lymphomas. The value of magnetic resonance imaging and two-dimensional echocardiography at disease presentation. Cancer 1993; 72: 2484-490. [ Links ]
32. Hamada S, Nishimura T, Hayashida K, Uehara T. Intracardiac malignant lymphoma detected by Gallium-67 citrate ad Thallium-201 chloride. J Nucl Med 1988; 29: 1868-70. [ Links ]
33. Flipse TR, Tazelaar HD, Holmes DR Jr. Diagnosis of malignant cardiac disease by endomyocardial biopsy. Mayo Clin Proc 1990; 65: 1415-22. [ Links ]
34. Daus H, Bay W, Harig S, Schneider G, Feiden W, Schieffer H. Primary lymphoma of the heart: report of a case with histological diagnosis of the transvenously biopsied intracardiac tumor. Ann Hematol 1998; 77: 139-41. [ Links ]
35. Kasai K, Kuwao S, Sato Y, Murayama M, Harano Y, Kameya T. Case report of primary cardiac lymphoma. The applications of PCR to the diagnosis of primary cardiac lymphoma. Acta Pathol Jpn 1992; 42: 667-71. [ Links ]
36. Takagi M, Kugimiya T, Fujii T, Yamauchi H, Shibata R, Narimatsu M, et al. Extensive surgery for primary malignant lymphoma of the heart. J Cardiovasc Surg 1992; 33: 570-2. [ Links ]
37. Albat B, Messner-Pellenc P, Thevenet A. Surgical treatment for primary lymphoma of the heart simulating prosthetic mitral valve thrombosis. J Thorac Cardiovasc Surg 1994; 108: 188-9. [ Links ]
38. Sommers KE, Edmundowicz D, Katz WE, Hattler BG. Primary cardiac lymphoma: echocardiographic characterization and successful resection. Ann Thorac Surg 1996; 61: 1001-3. [ Links ]
39. Kimura T, Yoshizu H, Hatori N, Shimizu M, Segawa D, Tanaka S. Surgical treatment for primary cardiac malignant lymphoma. Nippon Kyobu Geka Gakkai Zasshi 1997; 45: 607-10. [ Links ]
40. Yuh DD, Kubo SH, Francis GS, Bank A, McDonald KM, Jessurun J, et al. Primary cardiac lymphoma treated with orthotopic heart transplantation: a case report. J. Heart Lung Transplant 1994; 13: 538-42. [ Links ]
41. National Cancer Institut. Sponsored study of classification of nom-Hodgkin's Lymphoma: summary and description of a working formulation of clinical usage. Cancer 1982; 49: 2212-35. [ Links ]
42. Harris NL, Jaffe ES, Stein H, Banks PM, Chan JKC, Cleary ML, et al. Revised European-American Classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994; 84: 1361-92. [ Links ]
43. Martelli M, De Sanctis V, Avvisati G, Mandelli F. Current guidelines for the management of aggressive non-Hodgkin's lymphoma. Drugs 1997; 53: 957-72. [ Links ]
44. Gordon LI, Harrington D, Andersen J, Colgan J, Glick J, Neiman R, et al. Comparison of a second-generation combination chemotherapeutic regimen (m-BACOD) with standard regimen (CHOP) for advanced diffuse non-Hodgkin's lymphoma. N Engl J Med 1992; 327: 1342-9. [ Links ]
45. Fisher RI, Gaynor ER, Dahlberg S, Oken MM, Grogan TM, Mize EM, et al. Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma. N Engl J Med 1993; 328: 1002-6. [ Links ]
46. Cooper IA, Wolf MM, Robertson TI, Fox RM, Matthews JP, Stone JM, et al. Randomized comparison of MACOP-B with CHOP in patients with intermediate-grade non-Hodgkin's lymphoma. J Clin Oncol 1994; 12: 769-78. [ Links ]
47. Sertoli MR, Santini G, Chisesi T, Congiu AM, Rubagotti A, Contu A, et al. MACOP-B versus ProMACE-MOPP in the treatment of advanced diffuse non-Hodgkin's lymphoma: results of a prospective randomized trial by the Non-Hodgkin's Lymphoma Cooperative Study Group. J Clin Oncol 1994; 12: 1366-74. [ Links ]
48. Silingardi V, Federico M, Cavanna L, Avanzini P, Gobbi PG, Lombardo M, et al. ProMACE-CytaBOM vs MACOP-B in advanced aggressive non-Hodgkin's lymphoma: long-term results of a multicenter study of the Italian Lymphoma Study Group (GISL). Leuk Lymph 1995; 17: 313-20. [ Links ]
49. Montserrat E, García-Conde J, Viñolas N, López-Guillermo A, Hernández-Nieto L, Zubizarreta A, et al. CHOP vs ProMACE-CytaBOM in the treatment of aggressive non-Hodgkin's lymphomas: long-term results of a multicenter randomized trial. Eur J Haematol 1996; 57: 377-83. [ Links ]
50. Peterson BA . The role of transplantation in non-Hodgkin lymphoma. J Clin Oncol 1994; 12: 2524-6. [ Links ]
51. Gratwohl A, Hermans J, Baldomero H. Hematopietic precursor cell trasplants in Europe: activity in 1994. Report from the European Group for Blood ad Marrow Transplantation (EBMT). Bone Marrow Transplant 1996; 17: 137-48. [ Links ]
52. Gribben JG, Goldstone AH, Linch DC, Taghipour AK, McMillan AK, Souhami RL, et al. Effectiveness of high-dose combination chemotherapy ad autologous bone marrow transplantation for patients with non-Hodgkin's lymphomas who are still responsive to conventional-dose therapy. J Clin Oncol 1989; 11: 1621-9. [ Links ]
53. Philip T, Guglielmi C, Hagenbeek A, Somers R, Van Der Lelie H, Bron D, et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin's lymphoma. N Engl J Med 1995; 333: 1540-5. [ Links ]
54. Haioun C, Lepage E, Gisselbrecht C, Coiffer B, Bosly A, Tilly H, et al. Comparison of autologous bone marrow transplantation with sequential chemotherapy for intermediate-grade ad high-grade non-Hodgkin's lymphomas in first complete remission: a study of 464 patients. J Clin Oncol 1994; 12: 2524-6. [ Links ]
55. Verdonck LF, Van Putten WLJ, Hagenbeck A, Schouten HC, Sonneveld P, Van Imhoff GW, et al. Comparison of CHOP chemotherapy with autologous bone marrow trasplantation for slowly responding patients with aggressive non-Hodgkin's lymphoma. N Engl J Med 1995; 332: 1045-51. [ Links ]
56. Montalbetti L, Della Volpe A, Airaghi ML, Landoni C, Brambilla-Pisoni G, Pozzi S. Primary cardiac lymphoma. A case report and review. Min Cardioangiol 1999; 47: 175-82. [ Links ]