Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.24 no.4 abr. 2007
Perfil lipídico en pacientes VIH (+) no tratados. Infección VIH: ¿factor de riesgo cardiovascular?
Lipid profile in untreated HIV positive patients. HIV infection: cardiovascular risk factor?
B. Baza Caraciolo, C. Pérez de Oteyza, D. Carrió Montiel, J. C. Carrió Montiel, M. Salguero Aparicio, J. del Romero Guerrero
Centro Sanitario Sandoval. IMSALUD Área 7 de la Comunidad de Madrid. Madrid
Dirección para correspondencia
RESUMEN
Introducción: La publicación de casos de pacientes VIH (+) con enfermedad vascular inexplicada, ha puesto en marcha múltiples estudios para tratar de conocer si los pacientes VIH (+) presentan un incremento del Riesgo Cardiovascular (RCV). Nos hemos propuesto: caracterizar el perfil lipídico de pacientes VIH (+) no tratados comparándolo con el que presentan sujetos VIH (-) y valorar si alguna de las alteraciones halladas influye de forma directa sobre la estimación del RCV.
Pacientes y métodos: 407 varones homosexuales: 251 VIH (+) no tratados, y 156 VIH (-). Determinaciones bioquímicas: colesterol total (COL), HDL-colesterol (HDL), VLDL-colesterol, LDL-colesterol (LDL), triglicéridos (TG), apolipoproteínas A1 y B (ApoA1 y ApoB) y Lipoproteína a. Cocientes de aterogénicos: COL/HDL, LDL/HDL y log (TG/HDL). Los pacientes VIH (+) se dividieron en 3 grupos según recuento de linfocitos CD4.
Resultados: Los pacientes VIH (+) presentaron COL, HDL, y ApoA1 menores y cocientes de RCV mayores. Estas diferencias también se mostraron entre cada grupo de pacientes VIH (+) según recuento de CD4 y el grupo control VIH (-). Un 76% de los pacientes VIH (+) presentaban concentraciones bajas de HDL (menor de 40 mg/dL), frente a un 31% de los sujetos VIH (-).
Conclusiones: El perfil lipídico de los pacientes VIH (+) no tratados difiere del que presentan sujetos VIH (-). Desde los estadios mas inmunoconservados de la infección existe una disminución marcada del HDL, paralela a la disminución de ApoA1 que se mantiene a lo largo de todos los niveles de CD4. El descenso de HDL en la infección VIH multiplica el RCV global de los sujetos infectados, independientemente de la presencia de otros factores de riesgo.
Palabras clave: VIH. Lípidos. Riesgo cardiovascular.
ABSTRACT
Introduction: Some cases of HIV (+) patients with unexplained vascular disease have been reported and many studies are being performed to determine whether HIV infected individuals have an increased cardiovascular risk (CVR). We propose: to describe lipid profile of untreated HIV (+) patients and to compare it with the HIV (-) and to assess whether any of the lipid abnormalities influence in CVR estimation.
Material and Methods: 407 homosexual males: 251 untreated HIV (+),and 156 HIV (-). Biochemistry parameters: Total Cholesterol (CHOL), HDL-Cholesterol (HDL), VLDL-Cholesterol, LDL-Cholesterol (LDL), Triglycerides (TG), Apolipoproteins A1 and B (ApoA1 y ApoB) and Lipoprotein a. Atherogenic rates: CHOL/HDL, LDL/HDL and log (TG/HDL). HIV (+) patients were classified into three groups according to CD4 lymphocytes number.
Results: HIV (+) patients had lower CHOL, HDL, and ApoA1 and higher CVR rates. These differences showed also between each HIV (+) group according to CD4 number and control group HIV (-). 76% of the HIV (+) patients showed low levels of HDL (less than 40 mg/dL) as compared with 31% of HIV (-) subjects.
Conclusion: Untreated HIV(+) patients´lipid profile is different from the HIV (-) subjects´one. There are decreases in HDL and Apo A1 from the beginning of the infection that persist along all the CD4 levels. HDL decrease in HIV infection multiplies global CVR in HIV infected individuals, independently of other risk factors.
Key words: HIV. Lipids. Cardiovascular risk.
Introducción
Varios estudios epidemiológicos han sugerido que el riesgo y/o la incidencia de enfermedad coronaria arterial (ECA) son mayores en pacientes con infecciones y/o enfermedades inflamatorias crónicas.
La respuesta de fase aguda (RFA), es una reacción temprana y altamente compleja del huesped inducida por un estímulo nocivo que incluye la infección, la inflamación, traumatismos, quemaduras, necrosis isquémica y cáncer.
La RFA se caracteriza por un incremento en el recambio proteico al que contribuyen los componentes del sistema de defensa del organismo. Estos incluyen la proliferación leucocitaria y síntesis de citoquinas, inmunoglobulinas, y las llamadas proteínas de fase aguda (PFA).
En la típica RFA al estrés de una infección bacteriana se produce un aumento en la concentración de las llamadas PFA positivas (proteína C reactiva, precursor sérico del amiloide , fibrinógeno...) y una disminución de las las PFA negativas (proteínas generalmente de transporte: albúmina, transferrina, lipoproteínas...) (2).
Se ha propuesto que los cambios estructurales y funcionales de las lipoproteínas asociados a esta RFA podrían ser un posible nexo entre infección/inflamación y arterioesclerosis (AE) (3).
La RFA a infecciones bacterianas ha sido bien estudiada. En cuanto a las infecciones virales agudas, los datos disponibles, aunque limitados en la literatura, sugieren que también los virus pueden producir una RFA. No se conoce, sin embargo, si esta RFA puede producirse por infecciones virales crónicas subclínicas como la infección por el virus de la inmunodeficiencia humana (VIH). Algunos investigadores sugieren, no obstante, que la infección VIH produce una RFA similar a la producida por infecciones virales sintomáticas (2).
Desde el inicio de la pandemia por el VIH se han descrito alteraciones en el metabolismo lipídico de los individuos infectados (4,5).
La hipertrigliceridemia fue la primera dislipemia que se publicó en pacientes VIH positivos. Posteriormente, se han descrito otras alteraciones lipídicas como: descensos en el colesterol total (COL), apolipoproteínas y colesterol de las lipopoproteínas de alta densidad (HDL) (7,8).
Por tanto, la infección VIH por sí misma puede provocar dislipemia y probablemente podría intervenir, como otras infecciones crónicas, en la patogenia aún no esclarecida de la enfermedad aterosclerótica (9).
No debemos olvidar además que el uso generalizado del tratamiento antirretroviral de gran actividad (TARGA), que ha supuesto una reducción importante de la mortalidad, también ha dado paso a nuevos problemas relacionados a menudo con la toxicidad de los fármacos: la hipercolesterolemia, la hipertrigliceridemia, la resistencia a la insulina y el depósito central de grasa. Estas alteraciones, como es conocido, están independientemente asociadas con un incremento del riesgo cardiovascular (RCV) en la población general. En cuanto a su patogénesis no se conoce completamente y parece ser multifactorial incluyéndose la interacción entre factores genéticos del huesped, la infección VIH y las drogas antirretrovirales. (10). Todo esto unido a la publicación de casos de pacientes VIH (+) con enfermedad vascular inexplicada (11,12) ha hecho que durante los últimos años, múltiples estudios hayan tratado de responder a la pregunta fundamental de si los pacientes VIH (+) presentan un incremento del RCV, y si este riesgo está en relación con los fármacos antirretrovirales, con los factores de RCV clásicos o con el propio VIH.
Puesto que no han sido muy numerosos los estudios que se han realizado en pacientes no tratados, y sobre todo si tenemos en cuenta la práctica universalización del TARGA en algún momento de la enfermedad en nuestro medio, nos pareció interesante plantearnos el estudio de las alteraciones lipídicas que produce la infección VIH por sí misma en aras de conocer la situación de la que parten los pacientes antes de ser tratados. Nos planteamos por tanto: caracterizar el perfil lipídico de pacientes VIH (+) no tratados y compararlo con el que presentan sujetos VIH (-) de características generales superponibles (edad, sexo, categoría de exposición/transmisión). Relacionar las alteraciones lipídicas observadas con el estado de inmunodepresión, mediante la subdivisión de los pacientes VIH(+) en grupos, según recuento de linfocitos CD4 en sangre periférica y comparar estos grupos. Estudiar la distribución de factores de riesgo cardiovascular (FRCV) clásicos y hábitos tóxicos en dos subgrupos de pacientes VIH (+) y sujetos VIH (-).
Material y métodos
El estudio se realizó con un total de 407 varones homosexuales que se seleccionaron aleatoriamente entre los 14724 sujetos que acudieron al Centro Sanitario Sandoval (CSS) entre enero de 2002 y abril de 2005, para realizar bien diagnóstico de infección VIH por su práctica de riesgo y recibir educación sanitaria o bien para seguimiento de la infección ya diagnosticada previamente. El CSS, pertenece al Área Sanitaria 7 (IMSALUD) de la Comunidad de Madrid y es una unidad asistencial ambulatoria orientada a la prevención, diagnóstico y tratamiento de los pacientes con infecciones de transmisión sexual, incluida la infección VIH.
Del total de sujetos seleccionados, 251 eran pacientes VIH (+) no tratados, de edad media 31 años, (DT 5) y 156 eran sujetos VIH (-) de edad media 30 (DT 6) años.
Ninguno de los pacientes VIH (+) tenía evidencia de síndrome de inmunodeficiencia adquirida (SIDA), según la clasificación de los CDC y la OMS de 1993 para Europa. Un 89% de los pacientes se encontraban en estadios A1 y A2 de dicha clasificación El tiempo medio desde el diagnóstico de la infección era de 3 años (DT 3).
Se excluyeron del estudio los pacientes VIH(+) y sujetos VIH (-) con evidencia de citolisis hepática: alanín-amino-transferasa (ALT) mayor de 45 UI/L para evitar posibles efectos de la enfermedad hepática sobre los lípidos. Asimismo y por idéntica razón, se excluyeron todos aquellos que presentaban marcadores de infección hepática aguda o crónica por el Virus de la Hepatitis B o Virus de la Hepatitis C. También fueron excluidos los que tenían evidencia analítica documentada de presencia de otras infecciones bacterianas agudas en el momento de nuestro estudio (lúes, uretritis por gonococo, clamydia...).
Se realizó extracción de una muestra de sangre a todos los sujetos tras 10-12 horas de ayuno para realizar las siguientes determinaciones bioquímicas en suero: colesterol total (COL), HDL colesterol (HDL), triglicéridos (TG). VLDL colesterol (VLDL) y LDL colesterol (LDL) se obtuvieron aplicando la fórmula de Friedewald: (13) VLDL = TG/5; LDL = COL - (HDL+VLDL), no utilizándose si los TG mayor de 300 mg/dL.
Asimismo se calcularon los cocientes aterogénicos o de riesgo cardiovascular COL/HDL, LDL/HDL y log(TG/HDL) y se determinaron: lipoproteína a ( Lp a ), apolipoproteína A1 (Apo A1 ) y apolipoproteína B (Apo B).
A los pacientes VIH (+) se les realizó recuento de linfocitos CD4 en sangre total. Los pacientes se dividieron en 3 grupos de acuerdo a dicho recuento de linfocitos CD4: grupo 1 (mayor 500 cels/mL), grupo 2 (500-301 cels/mL) y grupo 3 (menor o igual 300 cels/mL). Estas divisiones, no coinciden exactamente con las de los estadios de los CDC, ya que se ha hecho prevalecer las recomendaciones actuales de inicio de tratamiento en torno a los 300-350 CD4/mL. Los datos de las variables en relación con FRCV y hábitos tóxicos se obtuvieron de las historias clínicas y de un cuestionario realizado sobre estas variables.
Se trata por tanto de un estudio observacional descriptivo transversal en el que se han comparado dos grupos de sujetos, uno de ellos VIH (+) y el otro VIH (-) de similares características: edad, sexo y categoría de exposición/transmisión. Las técnicas estadísticas para comparar medias de las variables cuantitativas fueron la t-de Student para muestras independientes (2 grupos) y el análisis de la varianza para un factor (3 o más grupos) junto con el procedimiento de comparaciones múltiples de Scheffé. La comparación de porcentajes se realizó mediante el test de Chi cuadrado o el test exacto de Fisher cuando fue necesario. El paquete estadístico utilizado ha sido SPSS versión 11.0
Resultados
Parámetros lipídicos, lipoproteínas y cocientes analíticos de RCV en el grupo VIH (+) y VIH (-)
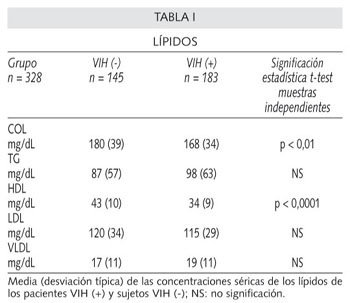
Los resultados de la concentración sérica media de los lípidos de los pacientes VIH (+) y de los sujetos VIH (-) se encuentran resumidos en la tabla I .
COL y HDL fueron significativamente más bajos en los pacientes VIH (+). Aunque los TG se mostraron más altos en los pacientes VIH (+), no llegaron a alcanzar significación. Tampoco existió diferencia significativa en los valores de LDL y VLDL.
Un 76 % de los pacientes VIH (+) presentaban concentraciones bajas de HDL (menor de 40 mg/dl), frente a un 31 % de los sujetos VIH (-) (Fig. 1). Diferencia estadísticamente significativa.
En cuanto a las concentraciones séricas de las lipoproteínas, representadas en la figura 2, cabe destacar la concentración significativamente más baja de Apo A1 en el grupo de pacientes VIH (+) frente al de sujetos VIH (-); no existiendo diferencias significativas en los valores de Apo B y Lp a.
Los cocientes aterogénicos: COL/HDL, LDL/HDL y log (TG/HDL) fueron significativamente más altos en los pacientes VIH (+) (Fig. 3).
PACIENTES DIVIDIDOS SEGÚN RECUENTO DE LINFOCITOS CD4 TOTALES
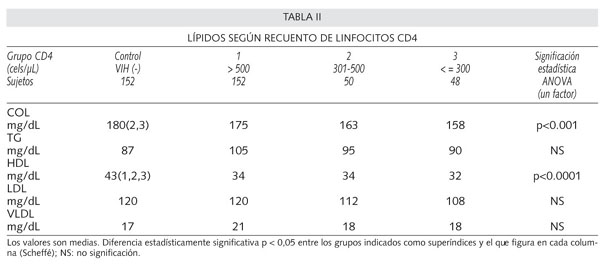
Los resultados de las concentraciones medias de lípidos según los grupos por linfocitos CD4 de los pacientes VIH(+) y del grupo control de sujetos VIH(-) se muestran en la tabla II.
COL y HDL mostraron diferencias significativas entre los distintos grupos . En ambos casos, se demostró que tal diferencia se debía a la existente entre el grupo control de sujetos seronegativos (COL y HDL significativamente mayores) y cada uno de los grupos de pacientes VIH (+) según recuento de CD4: grupos 1, 2 y 3 para HDL y grupos 2 y 3 para COL.
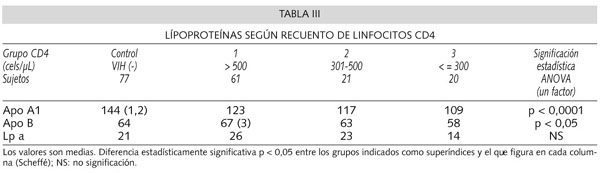
Como podemos observar en la tabla III: Apo A1 asímismo presentó diferencias significativas entre los distintos grupos. Esta diferencia era igualmente debida a la que existía entre el grupo control de sujetos seronegativos (Apo A1 más alta) y cada uno de los 3 grupos de los seropositivos. Apo B se mostró significativamente más alta en el grupo 1 que en el grupo 3.
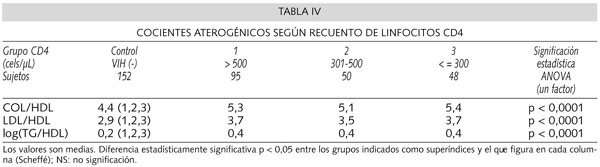
En cuanto a los cocientes aterogénicos: COL/HDL, LDL/HDL y log (TG/HDL) todos ellos mostraron diferencias significativas que se debieron a las existentes entre el grupo de seronegativos, (cocientes de riesgo menores), y cada uno de los 3 grupos de los seropositivos. (Tabla IV).
Los resultados del análisis de los FRCV clásicos y hábitos tóxicos obtenidos a partir de una muestra de 140 sujetos: 59 VIH (-) y 81 VIH (+) se recogen en la tabla V.
Discusión
Los procesos infecciosos e inflamatorios en general, aunque pueden tener un origen etiológico bien distinto, comparten el hecho de mantener una respuesta de fase aguda (RFA) más o menos dilatada en el tiempo. Son precisamente los cambios estructurales y funcionales de las lipoproteínas asociados a esta RFA los que se barajan como el posible nexo entre infección/inflamación y arterioesclerosis (AE) (3).
La infección VIH es un proceso infeccioso crónico, que comparte muchos de los cambios lipídicos que se han descrito en relación a la respuesta infecciosa/inflamatoria en general.
La hipertrigliceridemia constituye el trastorno lipídico más característico de los procesos inflamatorios crónicos y en concreto de la infección VIH. El mecanismo patogénico de la elevación de los TG parece explicarse, en infecciones humanas (7), incluida la infección VIH, tanto por un aumento de la producción de VLDL como por una reducción de su aclaramiento (3).
La hipertrigliceridemia es la primera alteración lipídica que se describió en relación a la infección VIH, aunque no es la primera en aparecer. Se hace especialmente manifiesta en los estadios más avanzados de la enfermedad en los que generalmente se tienen concentraciones plasmáticas elevadas de citoquinas lipogénicas (15-17).
En consonancia con lo anterior, cabe destacar que en nuestro estudio, aunque se observó un discreto aumento de los TG en los pacientes VIH (+) éste no llegó a alcanzar el nivel de significación. No debemos olvidar que ninguno de nuestros pacientes seropositivos se encontraba en fase de sida, y que casi el 90% se encontraban en los dos estadios más precoces de la enfermedad (A1 y A2).
En cuanto al COL, en nuestro estudio se ha puesto de manifiesto un descenso del mismo en los pacientes seropositivos respecto de los sujetos seronegativos.
Ante la imposibilidad por el momento, de realizar un estudio de seguimiento, el cual constituiría la manera ideal de investigar la evolución de éste y otros cambios lipídicos en el curso de la enfermedad VIH, decidimos que la división de los pacientes VIH (+) en distintos grupos, según recuento de linfocitos CD4, nos ofrecería una aproximación bastante cercana a la realidad.
En efecto, hemos observado que sólo los grupos más inmunodeprimidos mostraban un COL significativamente menor que el grupo control VIH (-). En cuanto a la fracción LDL, aunque se observa asimismo una disminución en los pacientes VIH (+) más inmunodeprimidos, ésta no llegó a alcanzar significación.
Estos hallazgos concuerdan con algunas referencias que en la literatura señalan que en el hombre la infección/inflamación disminuyen el COL sérico debido a descensos de ambos: LDL y HDL colesterol. El decremento en COL va acompañada por una reducción de los niveles de Apo B. El mecanismo patogénico de dicha disminución del COL parece estar relacionado con una disminución en su síntesis y secreción producida por la acción de algunas citoquinas (interleuquinas 1 y 6, interferón-2) (18).
Es evidente que el hecho de que las concentraciones de COL total y LDL desciendan durante la infección VIH, podría parecernos favorable desde el punto de vista del RCV. Sin embargo, hay que tener en cuenta otros aspectos. Por un lado, se ha descrito en pacientes con SIDA, al igual que en otros trastornos infecciosos crónicos, que el descenso cuantitativo de LDL se asocia con un descenso también en el tamaño de las partículas LDL, resultando LDL pequeñas y densas (patrón subclase B) (19). Estas partículas LDL son más proaterogénicas porque tienen una menor afinidad por el receptor LDL, cruzan mejor la barrera endotelial y son más susceptibles de modificaciones oxidativas lo que propicia una rápida captación y acumulación de COL en los macrófagos (20).
Por otro lado, nosotros hemos observado, de acuerdo con otros autores (2,8,21), un descenso en la infección VIH del HDL y su lipoproteína predominante, Apo A1. Esta disminución aparece para ambos parámetros, HDL y Apo A1, precozmente en el curso de la enfermedad. Así, cuando se dividieron los pacientes VIH (+) según recuento de CD4, se observaba diferencia significativa con el grupo control seronegativo, ya desde los estadios más inmunocompetentes. Dicha diferencia se mantenía asimismo con los demás grupos.
Entre los mecanismos que podrían explicar este descenso del HDL, se encuentra el hecho de que la molécula de HDL circulante durante la infección, conocido como "HDL de fase aguda", tiene características diferentes del HDL normal (menor contenido en Apo A1 y un mayor contenido en precursor sérico del amiloide), lo que hace que sea rápidamente aclarado de la circulación. Otros mecanismos que también se han puesto de manifiesto para explicar el descenso de HDL y Apo A1 son: la sobreexpresión de lipasa endotelial, que posee actividad fosfolipasa A1, y el decremento de actividades de la lipasa hepática y de la lecitin colesterol acil transferasa, enzimas que participan en la maduración de las HDL nacientes secretadas por el hígado, y en el transporte reverso del colesterol.
No debemos olvidar que las HDL proporcionan un efecto antiaterógeno no sólo porque posibilitan el transporte reverso del colesterol, proceso por el cual, el COL se retira de las células periféricas y es transportado al hígado para su metabolismo y/o excrección biliar,3 sino que también las HDL inhiben la oxidación de las LDL, estimulan la producción de prostaciclinas (vasodilatadoras y antitrombóticas) e inhiben la apoptosis endotelial y la agregabilidad plaquetaria. Además estudios recientes, en pacientes VIH (+), atribuyen a la fracción HDL propiedades beneficiosas adicionales sobre la producción de citoquinas. Parece ser que el efecto modulador que ejerce sobre éstas consigue no sólo inhibir la expresión de moléculas de adhesión de conocido efecto proaterogénico sino también mejorar la respuesta virológica cuando estos pacientes reciben tratamiento (23).
En definitiva, el descenso mantenido de la fracción HDL, puesto de manifiesto en nuestro estudio ya desde los grupos más inmunocompetentes, es lo que hace sin duda que los cocientes aterógenicos: COL/HDL, LDL/HDL y log (TG/HDL) se hallen elevados en los pacientes VIH (+) a pesar del descenso del COL y LDL. Esta elevación es también significativa, respecto de los sujetos VIH (-), desde los grupos más inmunoconservados.
Las recomendaciones del ATP III (Third Report of the National Colesterol Education Program Adult Treatment Panel III), cambiaron la definición de HDL bajo de 35 mg/dL a 40 mg/dl, por considerar que dicho nivel está fuertemente asociado a enfermedad coronaria (24). Si se aplican dichas recomendaciones es de remarcar que la proporción de HDL bajo entre los pacientes VIH (+) de nuestro estudio asciende hasta un 76% frente a un 31 % de los sujetos seronegativos.
La Lp a, es una lipoproteína que consiste en una partícula de LDL a la que se une de forma covalente una glucoproteína llamada apolipoproteína a. La Lp a se considera en la actualidad como un factor de riesgo emergente para el desarrollo de enfermedad coronaria arterial. Todavía no está claro si es un reactante de fase aguda. Así mientras algunos estudios demuestran la elevación de sus niveles durante el stress, otros sugieren que no existen cambios o incluso existe una reducción (3). En la infección VIH, algunos autores describen valores superiores de Lp(a) en pacientes seropositivos (6,25), aunque existe una tendencia mayor a la elevación en aquellos individuos VIH (+) en TARGA y fundamentalmente cuando la terapia contiene inhibidores de la proteasa (26). En nuestro caso, y posiblemente debido a que ninguno de nuestros pacientes recibía tratamiento antirretroviral no se demostró variación significativa en este parámetro; es más se observó una disminución aunque no llegó a ser significativa en los pacientes VIH (+) más inmunodeprimidos (< 300 cels/µL), hecho que podría hallarse en relación con la disminución de LDL.
El estudio de los FRCV clásicos en nuestro trabajo nos pareció interesante teniendo en cuenta el hecho de que algunos de ellos pueden incidir sobre el metabolismo lipídico (tabaquismo, diabetes, sedentarismo...) Puesto que no existieron diferencias significativas en cuanto a la prevalencia de dichos FRCV en ambos grupos, las alteraciones lipídicas halladas parecen deberse a la acción del propio VIH.
No queremos dejar de resaltar la alta prevalencia del tabaquismo, un 52% entre los pacientes VIH (+), que es concordante con la que presentan los datos derivados del estudio DAD (27) y de otros estudios (28). Esta circunstancia nos debe hacer reflexionar sobre la necesidad de reforzar las acciones de mentalización sobre hábitos de vida saludables en general en la población seropositiva, siendo el tabaquismo en particular, una diana fundamental en esta empeño por parte de los médicos que brindan cuidados a este tipo de enfermos.
En cuanto a los hábitos tóxicos de ambos grupos es importante señalar que la prevalencia del consumo de drogas no inyectadas en el grupo seropositivo duplica la del seronegativo. El mayor consumo de estas sustancias tóxicas entre los pacientes VIH (+) sin duda podría hallarse en relación con uno de los factores más importantes que intervienen en la transmisión del VIH en el colectivo homosexual, la relajación de las conductas de prevención durante las prácticas sexuales.
En resumen, el perfil lipídico de los pacientes VIH (+) no tratados, tiene características que difieren significativamente del que presentan sujetos VIH (-): COL, HDL y Apo A1 son menores en VIH (+) y los cocientes analíticos de RCV: COL/HDL, LDL/HDL y Log (TG/HDL) son mayores en VIH (+). Los cambios lipídicos de los VIH (+), en relación al estado de inmunodepresión, parecen seguir el siguiente patrón: inicialmente, desde estadios precoces de la infección, se produce una disminución marcada de la fracción HDL del colesterol, paralela a la disminución de Apo A1. Este descenso de HDL y Apo A1 se mantiene a lo largo de todos los grupos de CD4. El patrón lipídico anteriormente descrito, conlleva una elevación significativa en los cocientes aterogénicos: COL/HDL, LDL/HDL y log (TG/HDL) desde el inicio de la infección VIH, que se mantiene a lo largo del curso de la enfermedad. El descenso del HDL en la infección VIH multiplica el riesgo cardiovascular global de los sujetos infectados, independientemente de la presencia de otros factores de riesgo.
A la vista de todo lo anterior y de acuerdo con otros autores (29), nos parece razonable considerar la infección VIH por sí misma, como factor de riesgo cardiovascular (FRCV) tal como ocurre con el tabaco, la hipertensión arterial, la hipercolesterolemia y la diabetes y recomendable prestar una mayor atención a éstos factores de FRCV clásicos y otros (adicción a drogas) durante el seguimiento del paciente VIH (+) de cara al posterior inicio del TARGA y a las modificaciones morfológicas y metabólicas que éste puede conllevar. En este sentido recientemente algunos autores (30) han sugerido la posibilidad de retrasar el inicio del TARGA hasta niveles de CD4 menores (cercanos a 200 cels/mL ) cuando los sujetos presenten un RCV elevado, lo que permitiría un tiempo para llevar a cabo cambios en el estilo de vida, o posible tratamiento de sus dislipemias.
Bibliografía
1. Epstein SE, Zhou YF, Zhu J. Infection and atherosclerosis:emerging mechanistic paradigms.Circulation 1999; 100: 20-8. [ Links ]
2. Jahoor F, Gazzard B, Phillips G, Sharpstone MD, Frazer ME, Heird W, et al. The acute-phase protein response to human immunodeficiency virus infection in human subjects. Am J Physiol Endocrinol Metab 1999; 76: 1092-8. [ Links ]
3. Khovidhunkit W, Kim MS, Memon RA, Shigenaga JK, Moser AH, Feingold KR, et al. Effects of infection and inflammation on lipid and lipoprotein metabolism: Mechanisms and consequences to the host. J Lipid Res 2004; 45: 1169-6. [ Links ]
4. Rodriguez FF, Muñoz A. Alteraciones del metabolismo de los lípidos en los pacientes infectados por el virus de la inmunodeficiencia humana. Una hipótesis acerca de su patogenia. Med Clin (Barc) 2000; 115: 145-50. [ Links ]
5. Ducobu J, Payen MC. Lipids and AIDS. Rev Med Brux 2000; 21: 11-7. [ Links ]
6. Constans J, Pellegrin JL, Peuchant E, Dumon MF, Pellegrin I, Sergeant C, et al. Plasma lipids in HIV-infected patients: A prospective study in 95 patients. Eur J Clin Invest 1994; 24: 416-20. [ Links ]
7. Grunfeld C, Pang M, Doerrler W, Shigenaga JK, Jensen P, Feingold KR. Lipids, lipoproteins, triglyceride clearance and cytokines in Human Immunodeficiency Virus Infection and the Acquired Immunodeficiency Syndrome. J Clin Endococrinol Metab 1992; 74: 1045-52. [ Links ]
8. Baza B, Sánchez J, Carrió D, Del Corral S, Quintana A, Neila A, et al. Dislipemias en pacientes VIH. Rev Diagn Biol 2001; 50: 141-6. [ Links ]
9. Miralles C, Las Heras M. Datos epidemiológicos sobre enfermedad cardiovascular en pacientes en tratamiento antirretroviral. En: Estrada V, ed. Riesgo cardiovascular y VIH. Scientific Communication Management, 2004; p. 27-54. [ Links ]
10. Green ML. Evaluation and management of dyslipidemia in patients with HIV infection. J Gen Intern Med 2002; 17: 797-810. [ Links ]
11. Galler B, Pulik M, Genet P, Chedin P, Hiltgen M. Vascular complications associated with use of HIV protease inhibitors. Lancet 1998; 351: 1958-9. [ Links ]
12. Vittecoq D, Escaut L, Monsuez JJ. Vascular complications associated with use of HIV protease inhibitors. Lancet 1998; 351: 1959. [ Links ]
13. Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, withouth use of the preparative ultracentrifuge. Clin Chem 1972; 18: 499-502. [ Links ]
14. Frohlich J, Dobiasova M. Fraccional esterification rate of colesterol ratio of triglycerides to HDL-cholesterol are powerful predictors of positive findings on coronary angiography. Clin Chem 2003; 49: 1873-80. [ Links ]
15. Grunfeld C, Kotler DP, Shigenaga JK, Doerrler W, Tierney A, Wang J, et al. Circulating Interferon-a Levels Hypertriglyceridemia in the Acquired Immunodeficiency Syndrome. Am J Med 1991; 90: 154-62. [ Links ]
16. Christeff N, Lortholary O, Casassus P, Thobie N, Dalle MT, Veyssier P, et al. Serum lipid concentration with reference to the clinical and immunological status of HIV infected men. Ann Med Interne 1995; 146: 490-5. [ Links ]
17. Grunfeld C, Kotler DP, Hamadeh R, Tierney A, Wang J, Pierson RN, et al. Hypertriglyceridemia in the Acquired Immunodeficiency Syndrome. Am J Med 1989; 86: 27-31. [ Links ]
18. Ettinger WH, Varma VK, Sorci-Thomas M, Parks JS, Sigmon RC, Smith TK, et al. Cytokines decrease apolipoprotein accumulation in medium from Hep G2 cells. Arterioscler. Thromb 1994; 14: 8-13. [ Links ]
19. Feingold KR, Krauss RM, Pang M, Doerrler W, Jensen P, Grunfeld C. The Hypertriglyceridemia of Acquired Immunodeficiency Syndrome is associated with an increased prevalence of Low Density Lipoprotein subclass pattern B. J Clin Endocrinol Metab 1993; 76: 1423-7. [ Links ]
20. Chapman M, Guerin M, Bruckert E. Atherogenic, dense low-density lipoproteins. Pathophysiology and new therapeutic approaches. Eur Heart J 1998; 19 (Supl. A): A24-30. [ Links ]
21. Riddler SA, Smit E, Cole SR, Li R, Chmiel JS, Dobs A, et al. Impact of HIV infection and HAART on serum lipids in men. JAMA 2003; 289: 2978-82. [ Links ]
22. Stein O, Stein Y. Atheroprotective mechanisms of HDL. Atherosclerosis 1999; 144: 285-301. [ Links ]
23. Alonso-Villaverde C, Segues T, Coll-Crespo B, Pérez-Benalte R, Rabassa A, Gomila M, et al. High-density lipoprotein concentrations relate to the clinical course of HIV viral load in patients undergoing antiretroviral therapy. AIDS 2003; 17: 1173-9. [ Links ]
24. Summary of the Third Report of the National Colesterol Education Program Adult Treatment Panel III. Rev Cardiovasc Med 2001;2: 160-5. [ Links ]
25. Kritz H, Efthimiou Y, Stamatopoulos J, Najemnik C, Sinzinger H. Association of lipoprotein (a), prostaglandin I (2)-synthesis stimulating plasma factor, biological half-self of prostaglandin I(2) and high-density lipoproteins in HIV-1 infection of different stages. Prostaglandins Leukot Essent Fatty Acids 2000; 63: 309-14. [ Links ]
26. Oppel K, Bratt G, Erikson M, Sandstrom E. Serum lipid levels associated with increased risk for cardiovascular disease is associated with highly active antiretroviral therapy (HAART) in HIV-1 infection. Int J STD AIDS 2000; 7: 451-5. [ Links ]
27. Friis-Moller N, et al (for the Data Collection on Adverse Events of Anti-HIV Drugs (DAD) Study Group). Combination Antiretroviral Therapy and the Risk of Myocardial Infarction. N Eng J Med 2003; 349: 1993-2003. [ Links ]
28. Bergersen BM, Sándwich L, Bruun JN, Tonstad S. Elevated Famingham risk score in HIV-positive patients on highly active antiretroviral therapy: Results from a Norwegian study of 721 subjects. Eur J Clin Microbiol Infect Dis 2004; 23: 625-30. [ Links ]
29. Hsue PY, Lo JC, Franklin A. Bolger AF, Martin JN, Deeks SG, et al. Progression of atherosclerosis as assessed by carotid intima-media thickness in patients with HIV infection. Circulation 2004; 109: 1603-8. [ Links ]
30. Moerman F, Van Gompel A, Nimmegeers K, Moerman J. Highly active antiretroviral therapy. BMJ 2005; 330: 1341-2. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Begoña Baza Caraciolo.
Plaza de Francisco Morano, 3, esc 2, 1C.
28005 Madrid.
e-mail: begobaza@gmail.com
Trabajo aceptado: 5 de diciembre de 2006