Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.24 no.8 ago. 2007
Valoración de los modelos APRI y Forns para el diagnóstico no invasivo de fibrosis en pacientes con hepatitis C coinfectados y no coinfectados por VIH
Valuation of APRI and forns models for non-invasive diagnosis of fibrosis in patients with hepatitis C in coinfected and non-coinfected with HIV
C. Ramos Paesa, F. Marcilla, G. López, E. Hueso, A. Pascual, J.M. Aguirre
Hospital Universitario Miguel Servet. Zaragoza
Dirección para correspondencia
RESUMEN
Introducción: Los índices APRI y de Forns (IF), son modelos no invasivos a partir de datos rutinarios de laboratorio para la predicción de fibrosis hepática en pacientes con hepatitis crónica C. El propósito de nuestro estudio es confirmar el valor de estos modelos para predecir fibrosis significativa en estos pacientes y si pueden disminuir la necesidad de la biopsia hepática en coinfectados y no coinfectados por el VIH.
Pacientes y métodos: Incluimos 60 pacientes con hepatitis crónica y datos histológicos, 33 coinfectados por VIH. El 73% tenía fibrosis leve (F0-F1), el 23% grave (F3-F4) y el 18,3% cirrosis histológica. Calculamos y comparamos los índices APRI e IF con el grado de fibrosis hepática.
Resultados: Los valores de APRI < 0,5 o > 1,5 e IF < 4,2 o > 6,9, indicativos de fibrosis leve o severa, sólo han podido aplicarse en el 53% y 49% de los casos respectivamente. Ningún parámetro bioquímico, ni el APRI o el IF se asociaron con el grado de fibrosis en los pacientes no coinfectados con el VIH. Sólo observamos asociaciones en los pacientes VIH(+): la fibrosis severa (F3-4) con un mayor nivel de gammaglobulinas [24,5% vs. 30% (p < 0,05)] y de GGT [77 (46,5) vs. 32 (48,5) (p < 0,05)], y una menor tasa de protrombina [72 vs. 91% (p < 0,05)] y de plaquetas 109 [129 (40) vs. 170 (78) (p < 0,05)]; se observó un mayor porcentaje de APRI < 0,5 (41,6%) con fibrosis leve (F0-1) frente al observado (0) en la grave (F3-4) (p < 0,05); la especificidad (E) del APRI < 0,5 para establecer fibrosis leve o inexistente fue del 100%, pero la sensibilidad (S) era excesivamente baja (41%), con un valor predictivo positivo (VPP) de 100%, pero un valor predictivo negativo (VPN) muy bajo (36,3%).
Conclusiones: Nuestro estudio mostró que estos modelos no evitan la necesidad de biopsias hepáticas. Más de la mitad de los pacientes no pueden ser clasificados apropiadamente y la S y VPN son muy bajos. La combinación de estos índices con los niveles de gammaglobulinas, Gamma-GT, GOT, GPT, plaquetas y tiempo de protrombina, sólo han podido servir de orientación sobre el grado de fibrosis o inflamación hepáticas, y de forma limitada a los pacientes coinfectados con el VIH.
Palabras clave: Métodos no invasivos. Hepatitis C. Fibrosis.
ABSTRACT
Background: APRI and Forns (IF) index are noninvasive models consisting of routine laboratory data for the prediction of liver fibrosis in patients with chronic hepatitis C. The aim of our study was to confirm the value of these models to predict significant fibrosis in these patients and if they may decrease the need for performing liver biopsy specimens in coinfected and HIVnon-coinfected.
Patients and method: We included 60 patients with chronic hepatitis C and histologic data, 33 were coinfected with HIV. Mild fibrosis (F0-F1) was found in 73% patients, severe fibrosis (F3-F4) in 23% and cirrhosis in 18.3%. We calculated and compared APRI and IF with the stage of liver fibrosis.
Results: The APRI score < 0.5 or > 1.5 and IF < 4.2 or > 6.9, as predictors of mild or severe fibrosis, were only available in 53% and 49%. Neither laboratory nor APRI and IF were associated with liver fibrosis in non-coinfected patients. We only found association in HIV coinfected patients: severe fibrosis (F3-4) whit higher gammaglobulins [24.5% vs. 30% (p < 0.05)] and Gamma-GT levels [77 (46.5) vs. 32 (48.5) (p < 0.05)], and lower prothrombin time [72% vs. 91% (p < 0.05) ] and platelets.109 count [129 (40) vs. 170 (78) (p < 0.05)]; APRI was lower than 0.5 in 41.6% patients with mild fibrosis (F0-1) against none with severe (F3-4) (p < 0.05); specifity (E) of APRI < 0.5 for predicting mild fibrosis was 100%, but sensivity (S) was very low (41%), with a positive preditive value (VPP) of 100%, but a negative predictive value (VPN) also very low ( 36.3%).
Conclusions: Our study showed that these models don't avoid the need for liver biopsies. More than a half of patients are not appropriately classified according to findings on liver biopsy and S and VPN are very low. The combination of these index with gammaglobulins, Gamma-GT, AST, ALT and platelet levels and protrombine time, only may be an approach to degree of fibrosis or inflammation liver in HIV co-infected patients.
Key words: Non-invasive methods. Hepatitis C. Fibrosis.
Introducción
La hepatitis crónica por el virus de la hepatitis C (VHC) progresa a cirrosis hasta en el 25% de los casos a los 20 años (1-5), haciéndolo de forma más rápida y agresiva en los coinfectados por el VIH (6). El grado de inflamación y fibrosis obtenido a partir de la biopsia percutánea del hígado, a pesar de las limitaciones asociadas, es el factor pronóstico más importante de progresión (7-11).
Varios índices bioquímicos, que pudieran sustituir a la biopsia, como el de Forns (IF) (12) y el APRI (13) por separado o de forma conjunta (14), obtenidos a partir de parámetros de uso habitual, han obtenido una buena sensibilidad y especificidad para diferenciar pacientes sin fibrosis significativa (IF < 4,2; APRI < 0,5) de aquellos que sí la tienen (IF > 6,9; APRI > 1,5) con resultados dispares (15-18), habiendo sido validados para los coinfectados por el VIH (19,20).
El tratamiento con Interferon Pegilado y Ribavirina consigue tasas de respuesta sostenida global del 50%, siendo inferior en los coinfectados por el VIH (21-23). Dado que la posibilidad de respuesta es mayor para los genotipos 2/3 (88%) que para el genotipo 1 (40%), algunos autores consideran indicado el tratamiento directamente en los primeros y sólo en aquellos que presentan datos histológicos de progresión en los segundos, para lo que se precisa la realización de una biopsia (24,25).
Nosotros hemos investigado la validez del IF y APRI en la predicción de fibrosis en pacientes con hepatitis crónica C con y sin infección asociada por el VIH, para valorar si su utilización pudiera permitirnos realizar el seguimiento de la evolución de la hepatopatía y tomar decisiones adecuadas en cuanto a la terapia, prescindiendo de la biopsia hepática.
Material y métodos
Revisamos las historias clínicas de 60 pacientes con hepatitis C crónica a quienes se realizó una biopsia hepática percutánea. En 33 casos existía coinfección por el VIH. Todos presentaban serología frente al virus de la hepatitis C y ARN positivo. El estadio de fibrosis se valoró entre F0 y F4 usando la clasificación METAVIR, convirtiendo otras escalas según establece Okechukwu O (26). Todas las biopsias fueron evaluadas por el mismo patólogo. Clasificamos el estadio fibrosis en leve (F0-F1) y avanzada (F3-F4), y el grado de actividad necroinflamatoria en A1 (leve) y A2-3 (moderada-severa). Se recogieron datos bioquímicos y hematológicos de plaquetas (c/L.109), colesterol (mg/dl), gammaglobulinas (%), actividad de protrombina (%), GOT (U/l), GPT (U/l) y GGT (U/l) en el momento de la biopsia y en dos ocasiones más en los 6 meses previos y posteriores, estableciéndose el APRI e IF para dichos períodos. Se determinó el porcentaje de casos que modificaron dichos índices, según el momento de la determinación.
Se calculó el IF (disponible para 39 casos) según la fórmula [7,811-3,131 x ln (no de plaquetas ) + 0,781 x ln (GGT) + 3,467 x ln (edad) - 0,014 x (colesterol)] y el APRI como [no de veces el valor normal de GOT/plaquetas x109 x 100].
Los pacientes se clasificaron según el resultado de acuerdo con los puntos de corte propuestos por Wai y Forns (15,16): APRI < 0,5 o IF < 4,2 (fibrosis leve); APRI > de 1,5 o IF > 6,9 (fibrosis severa). También se valoró de la misma forma la combinación de ambos índices APRI+IF (17) < 0,5+ < 4,2 y > 1,5+ > 6,9 respectivamente.
Se analizaron otras variables: Edad, sexo, genotipo del virus C (38 casos), tiempo de evolución desde el probable contagio cuando se conocía (fecha de la transfusión o riesgo parenteral o el primer año de inicio de adicción a drogas por vía parenteral) y el nivel de linfocitos CD4 en los infectados por el VIH (c/mm3), analizando sus posibles asociaciones.
En el análisis estadístico calculamos la sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) del APRI < 0,5 e IF < 4,2 para el grado de fibrosis leve. Las variables cualitativas se describen mediante distribución de porcentajes de cada una de las categorías y las cuantitativas con la media (desviación estándar) para distribuciones normales o la mediana (intervalo intercuartílico) en el caso contrario. El estudio de la asociación de variables cualitativas se realizó mediante la prueba de la χ2 o el test de Fisher cuando fue necesario. La comparación de variables cuantitativas se efectuó con las pruebas de la t de Student o la U de Mann-Whitney, según la variable siguiera o no una distribución normal. Algunos de los resultados se presentan mediante la odds ratio (OR) y su intervalo de confianza (IC) del 95%, considerando significativo un valor de p inferior a 0,05. Se utilizó el programa de análisis estadísticos G-Stat 2.0.
Resultados
Los dos grupos, VIH(+) y VIH(-), son homogéneos para las variables estudiadas salvo para la edad, que era inferior en los coinfectados por VIH [31 (5) vs. 41 (15)]. Aunque el grado de lesión histológica no presenta diferencias significativas, existe un mayor porcentaje de cirrosis en los VIH(+) (24 vs. 11%) y predomina el genotipo 1 (63%), realizado en 38 casos, 29 de los cuales eran VIH(+) (Tabla I).
Los valores de APRI < 0,5 o > 1,5 e IF (39 casos) < 4,2 o > 6,9, indicativos de fibrosis leve o severa, sólo pudieron aplicarse en el 53 y 49% de los casos respectivamente. Cuando estudiamos la asociación de ambos índices (APRI+IF) sólo es posible en el 21% de los casos para índices < 0,5-4,2 y en el 2% para índices > 1,5-6,9 (Tabla I).
No existe asociación del grado de fibrosis con ningún parámetro bioquímico, APRI, IF, ni su combinación en los pacientes VIH(-).
Tan sólo observamos asociaciones en los pacientes VIH(+): el tiempo de evolución estimado desde el contagio parece mayor en los que presentan un mayor grado de fibrosis (13,5 vs. 10 años) (p = 0,05); un grado de fibrosis severo (F3-4) se relaciona con un mayor nivel de gammaglobulinas [24,5% (6,3) vs. 30% (3,5) (p < 0,05)] y de GGT [77 (46,5) vs. 32 (48,5) (p < 0,05)], y con una menor tasa de protrombina [72% (14) vs. 91% (19) (p < 0,05) ] y de plaquetas 109 [129 (40) vs. 170 (78) (p < 0,05)] (Tabla II).
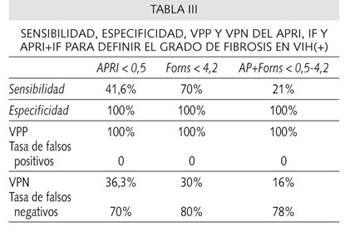
Asimismo, en los VIH(+) se observa un mayor porcentaje de APRI < 0,5 en casos con fibrosis leve (F01) (41,6% vs. 0) (p < 0,05) y una mediana de IF más elevada en el grupo de fibrosis severa [4,3 (0,9) vs. 6,2 (0,8) (p < 0,05)], sin que se aprecien asociaciones con índices < 4,2 o > 6,9 (Tabla II). La E de los índices para establecer fibrosis leve o inexistente es del 100%, pero la S es excesivamente baja del 70% (IF < 4,2), 41% (APRI < 0,5) y 21% (APRI+IF < 0,5-4,2), con un VPP del 100%, pero con VPN muy bajo. Es decir, ningún índice inferior al corte establecido tendrá fibrosis elevada, pero muchos valores superiores presentarán fibrosis escasa (Tabla III). Por otra parte, utilizando el APRI sólo se hubieran evitado 10 de las 60 biopsias, con el IF sólo 7 de las 39 en las que se estudió, y con la combinación de ambos 4 de las 39.
Analizando los casos con genotipo 1 en los VIH, sólo se observa asociación de la fibrosis con el nivel de gammaglobulinas [(F0-1) 24% (3,9) vs. (F3-4) 31% (8,5)] y no hay relación entre APRI < 0,5 o IF < 4,2 con el grado de fibrosis, aunque en ninguno de los dos grupos hay casos con fibrosis severa. En este caso, sólo se hubieran evitado 4 biopsias de 17 aplicando APRI < 0,5 y 4 de 12 utilizando el IF < 4,2.
Al valorar el grado de actividad necroinflamatoria, apreciamos asociaciones sólo para los pacientes VIH (+), relacionándose una actividad mayor (A2-3) con un mayor nivel de GOT [60 (59) vs. 138 (187) (p < 0,01)] y de GPT [128 (80) vs. 206 (191) (p < 0,01)], una mayor tasa de GOT > 100 [13% vs. 43% (OR 7,5; IC95% 1,5-33,3) (p < 0,01)] y un mayor APRI [0,2 (0,7) vs. 1,3 (3,2) (p < 0,01)]. Asimismo un APRI < 0,5 se asoció con una inflamación leve (A1) 53% vs. 11% [OR 9,1; IC95% 1,5-54,5 (p < 0,05)]. No existe asociación con los niveles de gammaglobulinas o GGT, que sí se relacionan con fibrosis.
Al estudiar los índices APRI e IF en dos muestras de momentos diferentes cercanas al de realización de la biopsia, de los 36 casos en los que se pudo obtener, se observaron modificaciones en el 25-35% para el APRI respecto al límite 0,5 y del 19-31% cuando se consideró el corte 1,5. Para el IF, las variaciones fueron del 14-21% para el límite 4,2 y del 3% para el corte 6,9. Es decir, dependiendo del momento en que se realice la extracción, es posible observar cambios sustanciales que modifican la situación con respecto a los límites establecidos hasta en el 20-30% de los casos.
Discusión
El conocimiento del grado de fibrosis hepática mediante biopsia percutánea es imprescindible para establecer la posibilidad de progresión a cirrosis y hepatocarcinoma en la hepatitis crónica por VHC, y por lo tanto el pronóstico y la necesidad de tratamiento (9,11,27). Las limitaciones que plantea la biopsia percutánea (15,16,28,29) han promovido el desarrollo de nuevos métodos diagnósticos bioquímicos y de imagen que pudieran predecir el grado de fibrosis de forma no invasiva (30,31).
La utilidad de marcadores sencillos y asequibles como el IF < 4,2, APRI < 0,5 o una combinación de ambos (12,13), parece dirigida preferentemente a excluir fibrosis avanzada con valores predictivos descritos algo dispares del 72-96%, 71-86 y 82,9% respectivamente (12,13,14).
Nosotros sólo hemos observado algunas asociaciones de estos índices en los coinfectados por el VIH, sin que hayamos podido demostrar relaciones en los no coinfectados. Sólo un APRI < 0.5 se ha relacionado con una fibrosis leve (F0-1), con E y VPP de 100%, pero con una S de 41,6% y VPN de 36,3% muy bajos. Para el IF tan sólo se aprecia asociación directa con el grado de fibrosis, pero no es posible definirla para los cortes establecidos, aunque observamos para IF < 4,2 una E y VPP también del 100%. Lo mismo ocurre para la combinación APRI+IF. Estos datos expresan que ningún valor inferior a los cortes establecidos para fibrosis leve tendrá fibrosis elevada, pero muchos valores superiores a los cortes presentarán también fibrosis escasa, por lo que su utilización hubiera podido evitar la biopsia en pocos casos. Si sólo tenemos en cuenta el genotipo 1, tampoco su utilización hubiera evitado las biopsias en la mayoría de las ocasiones.
A la vista de nuestros resultados, no podemos confirmar la validez de estos marcadores de fibrosis como sustitutos de la histología en los casos de no coinfectados por el VIH. Tan sólo en los coinfectados, los valores que indican fibrosis leve pueden dar cierta información, pero el escaso número de pacientes en los que se puede aplicar y la evidente variabilidad de los indicadores según el momento de la extracción de sangre que se considere no nos permiten recomendarlos en sustitución de la biopsia.
Analizando diversos parámetros de forma individual, en los pacientes coinfectados por el VIH apreciamos que la fibrosis severa (F3-4) se asocia de forma directa con el porcentaje de gammaglobulinas y el nivel de GGT, y de forma inversa con la tasa de protrombina y plaquetas, sin poder establecer un determinado corte discriminativo. También en ellos, la actividad necroinflamatoria, como predictor independiente de progresión a fibrosis (32,33,34), se asocia a mayores niveles de GOT, GPT, APRI y mayor tasa de GOT > 100 (Tabla IV), como otros autores han observado (35).
En conclusión, nuestros resultados no confirman lo observado en otros estudios, sobre todo en los no coinfectados por el VIH, quizás debido a que estos indicadores, al no reflejar directamente la actividad fibrogénica en el hígado, están sujetos a múltiples factores de variación externos que no dependen del grado de fibrosis. Por ello, consideramos que estos índices sólo pueden orientarnos, en los casos de coinfección por VIH, para considerar situaciones de fibrosis o inflamación leves y que junto a niveles de gammaglobulinas, GGT, GOT, GPT, plaquetas y actividad de protombrina pueden darnos sólo una ligera idea de la situación, sin que sean lo suficientemente fiables como para sustituir a los datos histológicos. Sin embargo, es posible que otros marcadores bioquímicos no invasivos de fibrosis, la elastografía, la Resonancia Magnética o su combinación puedan incluso superar en valor predictivo a los métodos histológicos (36).
Bibliografía
1. Solà Lamoglia R. Historia natural y situaciones clínicas de la hepatitis C. En: Diago M, Planas R, ed. Manual de hepatitis C: Aspectos biológicos, clínicos y terapéuticos. Madrid: Médica Panamericana, 2004; 81-104. [ Links ]
2. Niederau C, Lange S, Keintges T, Erhardt A, et al Prognosis of chronic hepatiris C: results of a large, prospective cohort study. Hepatology 1998; 28: 1687-95. [ Links ]
3. Gordon SC, Bayati N, silverman AL. Clinical outcome of hepatitis C as a function of mode of transmission. Hepatology 1998: 28: 562-7. [ Links ]
4. Forns X, Ampurdanes S, Sánchez-Tapias JM, et al. Long-term follow-up of chronic hepatitis C in patients diagnosed at a tertiary-care center. J Hepatol 2001; 35: 265-71. [ Links ]
5. Freeman AJ, Dore GJ, Law MG, et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. Hepatology 2001; 34: 809-816. [ Links ]
6. Martín-Carbonero L. Enfermedad hepática en pacientes coinfectados. En: Soriano V, González-Lahoz ed. Coinfección por VIH y virus de la hepatitis C. Mallorca: Permanyer SL 2003: 17-24. [ Links ]
7. Regev A, Berho M, Jeffers LJ, et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol 2002; 97: 2614-18. [ Links ]
8. Bedossa P, Risso D, Botta F, et al. Validity and clinical utility of the aspartate aminotransferase-alanine aminotransferase ratio in assessing disease severity and prognosis in patients with hepatitis C virus-related chronic liver disease. Arch Intern Med 2003; 163: 218-224. [ Links ]
9. Romero Gómez M, Castellano VM, Sánchez Muñoz DJ, et al. Factores agravantes de la lesión hepática en la hepatitis C crónica. Rev And Pat Digest 2002; 25: 178-83 [ Links ]
10. Sheuer PJ, Standich REA, Dhillon AP, et al. Scoring of chronic hepatitis. Clin Liver Dis 2002: 6: 107-112. [ Links ]
11. Romero Gómez M, Castellano VM, Grande L, et al. Serum leptin levels correlate with heptic steatosis in chronic hepatitis C. Am J Gastroenterol 2003;98: 1135-41. [ Links ]
12. Forns X, Ampudanés S, Llovet JM, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2002; 36: 986-92. [ Links ]
13. Wai CT, Greeson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38: 518-26. [ Links ]
14. Romero Gómez M, Ramírez Martín del Campo M, Otero MA, et al. Estudio comparativo de dos modelos que utilizan parámetros bioquímicos en el diagnóstico no invasivo de la fibrosis hepática en pacientes con hepatitis C. Med Clin 2005; 124: 761-4. [ Links ]
15. Friedman SL. Liver fibrosis-from bench to bedside. J Hepatol 2003; 38: S38-S53. [ Links ]
16. Sandrin L, Fourquet B, Hasquenoph JM, et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Bio 2003; 29: 1705-13. [ Links ]
17. Imbert-Bismut F, Ratziu V, Pieroni L, et al. Biochemical surrogate markers of liver fibrosis and activity in a randomized trial of peginterferon alfa-2b and ribavirin. Hepatology 2003; 38: 481-492. [ Links ]
18. Poynard T, McHutchinson J, Manns M, et al. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective stydy. Lancet 2001; 357: 1069-75. [ Links ]
19. Spinzi G, Minoli G. To biopsy or not to biopsy. Hepatology 2001; 34: 438-9. [ Links ]
20. Nunes D, Fleming C, Offner G, et al. HIV infection does not affect the performance of noninvasive markers of fibrosis for the diagnosis of hepatitis C virus-related liver disease. J Acquir Immune Defic Syndr 2005; 40: 538-544. [ Links ]
21. Fried M, Shiffman M, Reddy R, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975-82. [ Links ]
22. Manns M, McHutchinson J, Gordon S, et al. Peginterferon alfa-2b plus ribavirin compared with inteferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358: 958-65. [ Links ]
23. Moreno L, Quereda C, Moreno A, et al. Pegylated interferon alpha-2b plus ribavirin for the treatment of chronic hepatitis C in HIV-infected patients. AIDS 2004; 18: 67-73. [ Links ]
24. National Institutes of Health. Consensus Development Conference: Management of hepatitis C. Final Statement. Gastroenterology 2002; 123: 2082-99. [ Links ]
25. Soriano V, Miró J, García-Samaniego J, et al. Consensus Conference on chronic viral hepatitis and HIV infection: Updated Spanish Recommendations. J Viral Hepato 2004; 11: 2-17. [ Links ]
26. Okechukwu O, Según O. A comparative análisis of six current histological classification schemes and scoring systems used in chronic hepatitis reporting. Rev Esp Patol 2004; 37: 269-277. [ Links ]
27. Sheuer PJ. Classification of chronic viral hepatitis: a need for feassessment. J Hepatol 1991;13: 372-4. [ Links ]
28. Alberti A, Benvegnu M. Manegement of hepatitis C. J Hepatolo 2003; 38: S104-S118. [ Links ]
29. Dienstag JL. The role of liver biopsy in chronic hepatitis C. Hepatology 2002; 36 (Supl. 1):152-60. [ Links ]
30. Shiffman ML. Retretment of pataients with chronic hepatitis C. Hepatology 2002; 36: S128-S134. [ Links ]
31. Piccinino F, Sagnelli E, Pasquale G, Giusti G. Complications following percutaneous liver biopsy. A multicentre retrospective study on 68.276 biopsies. J Hepatol 1986; 2: 165-73. [ Links ]
32. Ryder SD, Irving WL, Jones DA, et al. Trent Hepatitis C Study Group. Progression of hepatic fibrosis in patiets with hepatitis C; a prospective repeat liver biopsy study. Gut 2004; 53: 451-55. [ Links ]
33. Fontaine H, Nalpas B, Poulet B, et al. Hepatitis activity index es a key factor in determining the natural history of chronic hepatitis C. Hum Pathol 2001; 32: 904-9. [ Links ]
34. Baroni GS, Pastorelli A, Manzin A, et al. Heaptic stellate cell activation and liver fibrosis are associate with necroinflammatory injury and Th 1-like response in chronic hepatitis C. Liver 1999; 19: 212-9. [ Links ]
35. Imbert-Bismut F, Ratziu V, Pieroni L, et al. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet 2001; 357: 1069-75. [ Links ]
36. Halfon P, Bourliere M Deydier R et al. Independent prospective multicenter validation of biochemical markers (Fibrotest-Actitest) for the prediction of liver fibrosis and activity in patients with chronic hepatitis C: the Fibropaca study. Am J Gastroenterol 2006; 101: 547-55. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Carlos Ramos Paesa.
C/ Segovia, 1, esc. 1ª 2º A.
50007 Zaragoza.
e-mail: ramosprobable@gmail.com
Trabajo aceptado: 16 de abril de 2007