INTRODUCCIÓN
El liquen plano corresponde a una enfermedad inflamatoria mucocutánea crónica relativamente comúnde etiología poco clara(1), con una prevalencia en la población general estimada entre1-2%(2). La principal zona de afección es la piel, seguida de la cavidad oral y mucosa genital, pero puede afectar a cualquier mucosa con un epitelio escamoso(3, 4). Si bien la causa de liquen plano es aún desconocida, la literatura describe distintos factores que pudiesen tener un rol en su etiopatogenia (Tabla 1), pero no hay evidencia de que ninguno de ellos corresponda verdaderamente al agente causal(5, 6). Respecto a su patogenia, se sabe que corresponde a una reacción inmunológica tipo 1 mediada por células(Linfocitos T CD4+ y CD8+) ante cambios antigénicos en la piel y mucosas(7, 8). Estos mecanismos efectores en conjunto con un tratamiento basado principalmente en corticoides explican que varios autores consideren al liquen plano como una enfermedad autoinmune(4).
TABLA 1. Posibles factores asociados a la etiopatogenia del LPO
| Virus hepatitis C | Se postula un efecto indirecto a través de la respuesta inmune producida contra la infección por VHC, especial mente en ciertas áreas geográficas (Europa, Japón)(9, 10). |
| Ansiedad, depresión y estrés | Factores psicogénicos que generan una alteración de la respuesta inmune. Esta desregulación inmunológica explicaría en parte las manifestaciones clínicas del LPO(11, 12). |
| Deficiencias hematínicas | Deficiencias de hematínicos producto de la presencia de autoanticuerpos contra células parietales podrían teneruna influencia en el LPO. Se ha observado mejoría en los signos y síntomas del LPO posterior a la administración de suplementos vitamínicos(13, 14). |
| Autoinmunidad* | Desregulación en la respuesta inmunológica que lleva a una reacción contra antígenos epiteliales propios(6, 12). |
*Teoría más aceptada.
CARACTERÍSTICAS CLÍNICAS
El liquen plano oral (LPO) es una patología no infecciosa relativamente común de la cavidad oral, afectando principalmente a mujeres (ratio mujer/hombre de 1.5-2:1)entre la 4ta y 5ta década de vida(4, 7). La afectación en niños o jóvenes es inusual, aunque existen reportes de casos pediátricos de hasta 9 años(2, 3). Menos de 1/3 de los pacientes con liquen plano oral presenta o presentará afección de la piel y/u otras mucosas con revestimiento escamoso (principalmente genital) en el transcurso de la enfermedad(2, 7, 12). Pese a su alta frecuencia, el diagnóstico de LPO suele producir problemas diagnósticos en clínicos no familiarizados con la enfermedad, ya que posee una gran variedad de presentaciones clínicas; reticular, papular, en placa, atrófico, erosivo/ulcerativo y vesiculoso/buloso (Figura 1), las que pueden presentarse de forma simultánea y multifocal(3, 15). Además, con el transcurso del tiempo las lesiones pueden sufrir periodos de exacerbación o remisión (parcial o completa), así como cambios en su morfología y color(1, 4). Semiológicamente hablando, sus distintas presentaciones clínicas se pueden agrupar en dos categorías; lesiones blancas-queratósicas (forma reticular, papular y en placa) o rojas-erosivas (forma atrófica, erosiva/ulcerativa y vesiculosa/bulosa); esto es independiente del aspecto que pudiesen tener las lesiones en su periferia(2, 16) (Figura 1). Respecto a su sintomatología, ésta es altamente variable en intensidad y naturaleza; en algunos casos puede ser totalmente asintomático, mientras que en otros pueden presentar desde un leve ardor al comer, hasta un dolor que imposibilita la ingesta de alimentos, el habla y otras actividades diarias, por lo que puede impactar negativamente la calidad de vida(5, 11, 17). Las formas atróficas, erosivas y vesiculosas son las que suelen asociarse a la presencia de grados variables de discomfort o dolor(1, 6, 7).

Figura 1. Formas clínicas de liquen plano oral afectando distintas partes de la cavidad oral. Erosivo/ulcerativo (A), erosivo dando origen al aspecto de gingivitis descamativa (B), papular/reticular (C) ulcerativo (D), placa (E) y ulcerativo (F).
Independiente de la forma clínica, en la gran mayoría de los pacientes se observan estriaciones blanquecinas intraorales características(6, 7). Estas líneas o estrías blanquecinas que tienden a interceptarse, pueden ser bastante tenues en algunas ocasiones y generalmente se asocian a un fondo eritematoso de intensidad variable(7). Su distribución tiende a ser bilateral y simétrica, pudiendo presentarse en zonas distintas a la de las lesiones principales(6, 12) (Figura 2). En algunos casos, se observan áreas de hiperpigmentación melánica(18), generalmente en relación con zonas reticulares (Figura 3). Estas zonas corresponden a una incontinencia melánica que refleja el efecto post inflamatorio de la lesión sobre los melanocitos, pero carecen relevancia ya que no se asocian con una mayor severidad o duración de la enfermedad(18).

Figura 2. Estriaciones blanquecinas tenues en bordes laterales linguales en un paciente con liquen plano erosivo gingival.

Figura 3. Áreas de hiperpigmentaciónmelánica asociada a un liquen plano reticular (A) y a un liquen plano erosivo/ulcerativo (B).
Cualquier zona de la cavidad oral puede verse afectada y más de la mitad de los casos presenta múltiples sitios orales afectados(2, 4). Su ubicación más frecuente es la mucosa yugal, seguido en orden de frecuencia por la lengua, encía adherida y piso de boca, mucosa labial y paladar(3, 7), observándose generalmente de forma bilateral y simétrica(2, 16). En su ubicación gingival, tanto la apariencia clínica como la sintomatología presentan gran variabilidad, lo que puede dificultar el diagnóstico(4). La manifestación gingival de aspecto atrófico-erosiva produce una imagen de gingivitis descamativa, muchas veces indiferenciable clínicamente de la producida por otras patologías(12, 13), con la particularidad de que en el LPO se encontrará acompañada frecuentemente de lesiones blanquecinas tanto en la encía adherida como libre o en otras partes de la boca(4). En aquellos casos atípicos en que la mucosa palatina esté comprometida, es importante plantear un diagnóstico diferencial con lupus eritematoso (cuando afecta la cavidad oral suele producir una úlcera o área atróficade aspecto “liquenoide” en paladar duro) y penfigoide mucomembranoso, ya que en estas enfermedades el paladar duro es de los sitios orales más comúnmente afectado pudiendo dar imágenes clínicas similares a LPO(12) (Figura 4).
DIAGNÓSTICO
Hasta la fecha no existe un criterio específico universalmente aceptado respecto de cómo establecer un diagnóstico de liquen plano oral(7), lo cual sin duda ha generado controversias y discusiones en campo de la patología oral(2, 19). Si bien la OMS ha establecido criterios clínicos e histopatológicos(20) (Tabla 2), distintos estudios demuestran una baja correlación clínico-patológica utilizando dichos criterios, a lo cual se suma bajos niveles de concordancias intra e interboservador tanto en la evaluación clínica como en la histopatología(12, 21). Lo anterior podría explicar la heterogeneidad e inconsistencia de resultados entre distintas investigaciones sobre LPO(12).
TABLA 2. Criterios clínicos e histopatológicos para el diagnóstico de LPO según la OMS
| Criterios clínicos | Criterios histopatológicos |
|---|---|
| • Usualmente múltiple y de distribución simétrica. | • Orto o paraqueratosis. |
| • Lesiones blancas de tipo papular, reticular (red de líneas ligeramente solevantadas de color blanco grisáceo), anular o en placa. | • Grosor epitelial variable, a veces se observen retepegs en forma de dientes de sierra. |
| • Líneas blancas que se irradian desde la pápula. | • Cuerpos de Civatte en el estrato basal del epitelio o lámina propia superficial. |
| • Lesiones atróficas con o sin erosiones. | • Banda delgada de material eosinofílico en la membrana basal. |
| • Bulas son inusuales, pero pueden estar presentes. | • Infiltrado celular en banda confinado en la lámina propia superficial, conformado principalmente por linfocitos. |
| • Degeneración del estrato basal epitelial. |
A pesar de que en un gran número de casos el diagnóstico de LPO podría realizarse sólo con los hallazgos clínicos, se aconseja (y los presente autores así lo creen) siempre confirmar el diagnóstico mediante la histopatología(3, 6, 21), en la cual se esperaría observar un denso infiltrado linfocitario subepitelial en banda, con un aumento de infiltración de linfocitos intraepitalies, degeneración los queratinocitos basales y disrupción de la membrana basal(2, 8) (Tabla 2). Recomendamos que la biopsia sea obtenida de áreas representativas de las lesiones, lo cual puede ameritar la toma de más de una muestra si existen múltiples lesiones y/o manifestaciones clínicas, o bien si presenta lesiones de aspecto inusual (sospecha de alteraciones displásicas o malignización)(12, 13). Además, debemos enfatizar que el análisis microscópicodebe ser complementado con la presentación clínica de las lesiones, mejorando así la correlación clínica-patológica(3, 21). Ocasionalmente podría ser necesaria la inmunofluorescencia directa como herramienta de apoyo en el diagnóstico mediante la detección de fibrinógeno depositado en la zona de la membrana basal, especialmente para realizar diagnósticos diferenciales con otras entidades que imitan histológicamente al LPO(7). Sin embargo, esta característica no es exclusiva del LPO y no puede ser considerada como un hallazgo diagnóstico por sí solo(21, 22). La confirmación del diagnóstico con ayuda del análisis histopatológico es de gran importancia, considerando que el tratamiento del LPO involucra el uso de corticoides, inmunosupresores y otros fármacos que no están exentos de reacciones adversas(4). Se debe tener en mente que la toma de una biopsia posterior al tratamiento con corticoides (p.ej. en caso de duda del diagnóstico por mala respuesta al tratamiento) puede dificultar el diagnostico histopatológico producto de alteraciones microscópicas secundarias a sobreinfecciones o a alteraciones en el patrón y composición del infiltrado inflamatorio, por lo que es importante estar seguros del diagnóstico antes de iniciar el tratamiento(12). Otro objetivo de la toma de biopsia, y quizás el más importante, correspondería a detectar a presencia de alteraciones premalignas (p.ej. displasia epitelial) o malignas en las lesiones de LPO, lo cual podría modificar la frecuencia de controles o bien el esquema terapéutico(7, 16). Sin embargo, esto parece tener más utilidad desde el punto médico legal, ya que la ausencia de elementos premalignos en la biopsia no descarta la presencia de éstos en otro sector de la lesión biopsiada o bien en otras zonas de la cavidad oral(3).
Desde un punto de vista clínico, aparte de una meticulosa inspección visual aconsejamos palpar las lesiones, ya que la induración del tejido pudiese reflejar áreas en vías demalignización hacia un carcinoma oral de células escamosas (13).
DIAGNÓSTICOS DIFERENCIALES
El diagnóstico de LPO plantea el diagnóstico diferencial con distintas entidades dependiendo de su presentación clínica (Tabla 3). El principal diagnóstico diferencial de LPO es con una reacción liquenoide oral (RLO), debido a su gran similitud, y a veces idéntica presentación clínica, principalmente con las formas atrófico-erosiva y/o reticular(13, 16). La RLO corresponde a una reacción de hipersensibilidad de la mucosa oral ante algún compuesto local (principalmente ante alguna restauración con contenido de mercurio o níquel), pero también puede aparecer como respuesta ante algún fármaco ingerido de forma sistémica(3, 4). Si bien los criterios diagnósticos de RLO no se encuentran estrictamente definidos, su mayor tendencia a ser unilateral y presentarse de generalmente de forma atrófico-erosiva, sumado a la presencia de un infiltrado linfocitario con limites difusos de ubicación más profunda en la lámina propia ayudan a diferenciarlo del LPO(7).Respecto a la RLO asociada a medicaciones sistémicas, hay un gran número de fármacos clasificados como agentes causales; entre ellos los más asociada dos corresponden a AINEs (p.ej. ibuprofeno), anticonvulsivantes (p.ej. valproato), antihipertensivos (p.ej. atenolol), antimaláricos (p.ej. hidroxocloroquina) y antiretrovirales (p.ej. zidovudine)(3, 12, 16). Cuando la RLO es producto de la ingesta de un fármaco sistémico, diferenciarla de LPO se vuelve aún más complejo por varias razones(3, 7, 13):
TABLA 3. Principales diagnósticos diferenciales de LPO modificado de Cheng, 2016(12)
| Penfigo vulgar | La mayoria de los casos presentan compromiso oral, muchas veces como primera manifestacion de la enfermedad (un 50%-90% de ellos); multiples areas extensas de erosiones o ulceras dolorosas, las que tienden a progresar en severidad; paladar y orofaringe entre los sitios mas comunmente afectados; lesiones tienden a sobre infectarse con candida. En la gran mayoria de los casos, lesiones cutaneas suelen aparecer en un periodo de 1-3 meses posterior a las lesiones orales(27,28). |
| Penfigoide mucomembranoso | Por lo comun afecta a la encia a modo de gingivitis descamativa; erosiones y/o ulceras sin un componente reticular; debido a la friccion y microtraumatismos de la cavidad oral las vesiculas se encuentran frecuentemente rotas; ademas de la encia tiende a afectar otros sitios de la cavidad oral, entre ellos el paladar; signo Nikolsky suele ser positivo(29). |
| Reaccion liquenoide por contacto | Similar a LPO, pero tiende a ser unilateral localizado en aquella zona de la mucosa en contacto con el material restaurador o agente saborizante; mucosa yugal o borde lateral de la lengua tienden a estar afectados(7,16). |
| Reaccion liquenoide por farmacos | Similar a LPO; su expresion puede presentarse de manera sincronica al medicamento causal o bien desarrollarse de manera tardia al uso de este (hasta varios meses despues). Generalmente es bilateral(7, 12). |
| Lupus eritematoso | Compromiso oral en un 25% de los pacientes, por lo general con lesiones liquenoides de tipo erosivo o ulcerativo; ulcera central rodeada por estrias queratosicas que se irradian; localizado frecuentemente en el paladar y reborde alveolar; tiende a acompanarse de lesiones cutaneas y foto sensibilidad; suele presentarse como lesion unica(30, 31). |
| Enfermedad de injerto contra huesped | Similar a LPO; en pacientes que hayan recibido trasplante de injerto alogenico de medula osea(3). |
| Estomatitis ulcerativa cronica | Similar a LPO, no responde a la terapia con corticoides(7, 12). |
| Leucoplasia oral | Mayoria de los casos unilaterales, placas homogeneas y sin estriaciones asociadas; fuerte asociacion a la presencia de habitos como alcohol, tabaco y betel quid(7,26). |
Puede observarse con mayor frecuencia una afección bilateral
No siempre se puede restringir o sustituir el uso del posible “fármaco causal” (paciente con polifarmacia o la no autorización del médico tratante), imposibilitando confirmar dicha relación causal.
La lesión oral puede aparecer semanas a años después de la administración de dicho fármaco.
La lesión puede demorar varias semanas a meses en desaparecer posterior a la discontinuación del fármaco.
El estudio histopatológico, si bien es cierto puede ser sugerente de RLO, no permite hacer el diagnóstico diferencial con LPO por sí solo, por lo que su complementación con la anamnesis y examen clínico es fundamental.
En cuanto a la RLO por contacto, esta puede ser causada por la presencia de restauraciones dentales, principalmente amalgamas (Figura 5) (aunque también resinas compuestas y ionómeros de vidrio, aunque con mucho menor frecuencia) o incluso agentes saborizantes que incluyen canela, eugenol, mentol o menta(3, 7). Cuando la lesión es gatillada por un material restaurador, ésta se presenta por lo general unilateral en la mucosa de la zona en contacto directo con la obturación (principalmente borde lateral lingual o mucosa yugal), lo que facilita el diagnóstico y tratamiento, ya que el recambio del material de la obturación por uno de menor riesgo de hipersensibilidad (p.ej. resina compuesta) debería inducir la resolución de la lesión en un periodo de 2 a 4 semanas(12, 16). En aquellos pacientes que presentan un gran número de restauraciones por amalgama, diferenciar una RLO de LPO se vuelve más complejo debido a una presentación múltiple y bilateral de las lesiones (en caso de presentar obturaciones en cuadrantes opuestos) y la imposibilidad en algunas ocasiones de poder recambiar todas las obturaciones involucradas (p.ej. por el costo económico involucrado). En estos casos, una prueba cutánea de alergia a materiales dentales es una buena herramienta para confirmar el diagnóstico y no indicar así un recambio masivo de restauraciones de forma innecesaria(3, 23-25).
Otro diagnóstico diferencial relevante, especialmente en presencia de un liquen plano oral en placa, es con una leucoplasia oral (LO)(13) (Figura 6). La LO corresponde a un término clínico que se refiere a una lesión predominantemente blanca no desprendible al raspado que no puede ser diagnosticada clínicamente como otra patología de la mucosa oral (diagnóstico por exclusión). La LO corresponde una lesión potencialmente maligna frecuente, con una tasa promedio de transformación maligna estimada en un 12%(26). La inspección visual es fundamental para el diagnóstico diferencial, pues las leucoplasias suelen ser lesiones únicas, a excepción de una forma atípica de leucoplasia denominada leucoplasia verrucosa proliferativa (LVP), en la cual se observan lesiones múltiples. Sin embargo, su clínica difiere bastante a la de un liquen plano en placa (Figura 6). Por otro lado, si bien aquellas LO homogéneas pueden imitar una lesión de LPO en placa, éstas no presentan estriaciones blanquecinas asociadas, a diferencia de prácticamente todos los casos de LPO en que si se observarán las clásicas “estrías de Whickham”, ya sea en los márgenes de la lesión o en otras partes de la cavidad oral(13). Si bien los aspectos semiológicos son los de mayor trascendencia para diferenciar ambas entidades, los hábitos del paciente pueden ser de ayuda, considerando que la inmensa mayoría de los pacientes con LO reportan hábitos de alcohol, tabaco o uso de betel quid(13, 26). De todas formas, debido a las similitudes entre un LPO en placa con una LO, y considerando la naturaleza potencialmente maligna de ambas patologías, es aconsejable confirmar el diagnóstico por medio de una biopsia(3).

Figura 6. Leucoplasia verrucosa proliferativa. Se observan múltiples placas blanquecinas no desprendibles al raspado afectando la encía adherida y libre (A-D).
Por último, se debe tener presente que otras patologías aparte del LPO pueden manifestarse a modo de gingivitis descamativa, entre ellas penfigoide mucomembranoso y pénfigo vulgar, por lo que además de una completa anamnesis y examen clínico intra y extra oral, aconsejamos la toma de una biopsia asociada a estudios de inmunofluorescencia para poder diferenciarlas, cuando el caso lo amerite(13).
TRATAMIENTO
Como toda enfermedad crónica, su curso involucra períodos de exacerbación-remisión y su tratamiento es complejo(3, 5). Sólo en un porcentaje menor de casos las lesiones sanan de forma completa y definitiva(16, 32), mientras que en la inmensa mayoría de los pacientes el objetivo terapéutico consiste en mantener los episodios de exacerbación (lesiones erosivas/ulcerativas, vesiculosas) lo más atenuados posible y disminuir la sintomatología(1, 7). Lesiones asintomáticas (principalmente aquellas blancas), no requieren de tratamiento medicamentoso, pero deben ser controladas periódicamente para detectar posibles cambios sugerentes de malignización(4, 13). Si bien se han evaluado múltiples alternativas terapéuticas para el LPO, la evidencia es insuficiente para atribuir de forma categórica mayor efectividad a un tratamiento específico(3, 5). La crioterapia utilizada en el pasado ha sido desplazada por distintas formulaciones que incluyen; corticoides, inhibidores de la calcineurina, agentes inmunosupresores, retinoides, amino salicilatos, entre otros(16, 17).
El uso de corticoides tópicoses considerado el tratamiento de primera elección(5, 18). Se ha reportado que más del 50% de los casos de LPO pueden ser manejados de forma exitosa mediante el uso de corticoides tópicos(4). Al seleccionar el tipo de corticoide, es recomendable iniciar la terapia con corticoides de mediana intensidad (p.ej. fluticasona) e ir escalando en intensidad a medida que el caso lo requiera (p.ej. betametasona), hasta llegar a las formas más potentes (p.ej. clobetasol) las cuales han demostrado ser las más efectivas en el tratamiento sintomático del LPO(5, 33). La aplicación debiese realizarse 2-3 veces al día y mantenerse por 2-3 semanas, para luego ir disminuyendo la administración de forma progresiva hasta encontrar una dosis de mantención o bien retirar el medicamento de forma completa(16, 33). Existen distintas presentaciones de corticoides tópicos (ungüento, aerosol, pastas, colutorios, entre otros), y su elección depende principalmente de la extensión y ubicación de las lesiones orales(13, 17). Para lesiones localizadas en la encía, el uso de preparados en base a oro o plastibase presentan gran utilidad, ya que son fáciles de aplicar y su adherencia a la mucosa se prolonga en el tiempo(16). Para lesiones presentes en zonas donde es más difícil retener una crema o ungüentos (lengua, piso de boca, cara interna de mejilla), el uso de enjuagatorios o espray es más recomendable(7). De todas formas, la combinación de uno o más corticoides en distintas presentaciones tópicas es de gran utilidad ante la presencia de multiplicidad de lesiones.
Al indicar tratamiento tópico, es de vital importancia asegurarse que el paciente lo use de manera correcta tanto en frecuencia, cantidad y modo de aplicación, por lo cual se debe dar énfasis en la posología facilitándole al paciente las indicaciones por escrito(16). En el tratamiento tópico la dosis del principio activo varía en función de la frecuencia de aplicación y el contacto directo de la droga con el tejido lesionado, por lo que, si no hay un contacto prolongado entre éstos, el tratamiento no será efectivo(33). En caso de indicar enjuagatorios de corticoides, el paciente debe mantener la solución al menos durante 5 min en boca y evitar enjuagarse, comer o tomar líquidos durante los próximos 30 minutos. En caso de usar cremas o ungüentos, se recomienda secar la mucosa previamente a la aplicación y evitar el consumo de alimentos y líquidos en lo ideal 1 hora posterior a la aplicación(33). Seguir estas indicaciones es trascendental para el éxito de la terapia. En caso de no haber respuesta o que ésta sea insuficiente con corticoides tópicos, la inyección intralesional de corticoides (betametasona, triamcinolona) es una buena alternativa antes de iniciar terapia sistémica, ya que ha mostrado buena eficacia y seguridad reduciendo el riesgo de posibles reacciones adversas derivadas de la administración sistémica(17, 18).
Para aquellos casos que debido a la extensión o severidad de las lesiones la terapia tópica no ha logrado el efecto esperado, se aconseja el uso de inmunomodulares tópicos (como inhibidores de la calcineurina) o bien corticoides sistémicos (típicamente prednisona)(5, 34). Respecto al uso de inhibidores de calcineurina tópicos, como lo son la ciclosporina, tacrolimus o pimecrolimus, han mostrado una efectividad similar a la terapia tópica con corticoides, sin embargo, su costo económico es considerablemente mayor y no están exentos de reacciones adversas severas(5, 16). En caso de optar por corticoides sistémicos, se recomienda usarlos por un tiempo reducido(1-4 semanas) con el objetivo de lograr una mejoría rápida de las lesiones ulcerativas y evitar posibles efectos adversos secundarios a su administración(18). Una vez logrado esto, se deben retirar de forma gradual y se debe continuar el tratamiento con corticoides tópicos(7, 13). En un porcentaje no menor de pacientes, el retiro del corticoide sistémico produce una reagudización de la enfermedad(18). En estos casos, se aconseja combinar o alternar el uso de la terapia sistémica con tratamientos tópicos(18, 33), y de ser necesario, considerar el uso de inmunosupresores sistémicos como la azatioprina o micofenolato de mofetilo, para reducir los efectos adversos de la corticoterapia sistémica extendida(7).
Otra opción terapéutica incluye la suplementación con hematínicos. Algunos estudios han reportado deficiencia de vitamina B12, ácido fólico, hierro o bien la presencia anemia en pacientes con LPO. La administración del hematínico deficiente ha mostrado mejoría parcial o total en los síntomas asociados a las lesiones orales(35, 36).Sin embargo, no hay evidencia contundente sobre la efectividad de la terapia en el LPO mediante la suplementación con hematínicos.
Aparte de los tratamientos propuestos, se recomienda fehacientemente eliminar o reducir en lo posible aquellos factores irritantes presentes en la cavidad oral, tales como prótesis desajustadas, restauraciones irregulares/ásperas, biofilm, entre otros. El control de dichos irritantes biológicos, mecánicos o químicos sobre las lesiones de LPO ha demostrado reducir los signos y síntomas asociados, especialmente en aquellos casos con compromiso gingival(3). Además, es de gran importancia controlar de forma continua al paciente, no sólo para evaluarlos efectos del tratamiento y posibles reacciones adversas a éste, sino que también para detectar cambios en las lesiones del LPO que pudieran sugerir cambios potencialmente malignos o malignos (12).
Complicaciones del tratamiento
Una de las ventajas de la terapia tópica por sobre la sistémica, es que se asocia con una menor frecuencia y severidad de efectos adversos(32). Si bien es cierto que los corticoides tópicos también se absorben sistémicamente, los niveles absorbidos son bajos y no suelen producir efectos adversos importantes como aquellos observados con las formas sistémicas(4, 7) (como lo son el aumento de la glicemia y presión arterial, aumento de peso, alteración del estado de ánimo, irritación gastrointestinal, osteoporosis, edema cutáneo e inhibición eje hipotálamo-hipófisis adrenal)(13, 17). En cuanto a la terapia tópica con corticoides, el principal efecto adverso observado es la candidiasis orofaríngea, generalmente del tipo pseudomembranosa(7, 16) (Figura 7). Un número considerable de pacientes desarrollarán candidiasis secundaria al uso de corticoides tópicos como consecuencia de su efecto inmunosupresor local(6, 33). El uso de miconazol en gelal 2% una vez al día y/o enjuagues de clorhexidina al 0.12% durante 2-3 semanas han mostrado reducir el riesgo de candidiasis iatrogénica(37). Es importante mencionar que el uso tópico de inhibidores de la calcineurina (tacerolimus y primecrolimus) se ha asociado a una mayor incidencia de reacciones adversas locales (p. ej. ardor o escozor) y un mayor costo económico en comparación a los corticoides tópicos(7). Si bien se ha vinculado el uso de estos medicamentos con un mayor riesgo de transformación hacia un carcinoma oral de células escamosas (COCE), producción de autoanticuerpos (antinucleares y anti DNA) e incluso la posibilidad de desarrollar una enfermedad tipo lupus eritematoso(5-7, 16), se debe ser cauteloso a la hora de considerar estas advertencias ya que hasta el momento el nivel de evidencia científica que las respalda es débil.
MALIGNIZACIÓN
Mucho se ha discutido, y no es el propósito de esta revisión entrar en dicha discusión, del potencial de malignización del liquen plano oral hacia un COCE. En el 2005 la OMS clasificó al LPO como una condición potencialmente maligna(38), presentando una tasa de malignización que va desde el 0% al 12,5% dependiendo del estudio analizado(6). Lamentablemente no se tiene gran claridad acerca de los factores involucrados con un mayor riesgo de malignización de LPO, sin embargo algunos estudios han observado una mayor predisposición en pacientes masculinos con hábitos de alcohol y/o tabaco o bien aquellos con infección por VHC, posiblemente por su efecto directo en la desregulación del ciclo celular o bien indirectamente producto de la cirrosis hepática(15). Por el contrario de lo que se podría pensar, la presentación clínica del LPO y el tratamiento mediante corticoides no han mostrado influir en el riesgo de transformación maligna(4, 19). Es importante destacar entonces que cualquier forma clínica de LPO puede malignizarse, independiente del tratamiento empleado(4, 16). Además su malignización puede ocurrir en cualquier parte de la cavidad oral, aunque existe cierta predilección por el borde lateral de la lengua(3, 6), y no se encuentra necesariamente asociado a alguna lesión en particular(2, 4). Si bien el tiempo transcurrido desde el diagnostico de LPO hasta su malignización (período de la tencia) es en promedio 62 meses(6), existe una gran variabilidad entre los casos, el cual va desde unos pocos meses hasta varios años(19).
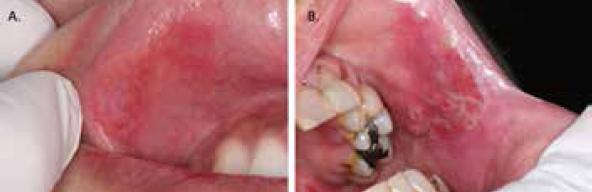
De acuerdo con lo expuesto se aconseja que todos los pacientes con liquen plano oral seancontroladosen lo ideal dos veces al año de manera continua, ya sea por un dentista general o bien especialistas en medicina oral, en busca de indicios tempranos de transformación maligna(3, 6, 15). El diagnóstico temprano de una lesión maligna cobra aun mayor importancia si se considera que la sobrevida en pacientes diagnosticados con COCE desciende significativamente si el tratamiento no se realiza en los estadios iniciales de la enfermedad(39). En cada control, el clínico debiese buscar signos sugerentes de transformación maligna, los que incluyen: desarrollo de lesiones moteadas o de aspecto inusual/atípico (p.ej. superficie verrucoide) (Figura 8), lesiones con bordes indurados detectados mediante palpación, crecimientos exofíticos y ulceraciones con fondo necrótico. En caso de encontrar alguno de estos signos, la lesión debe ser biopsiada.
PUNTOS PRÁCTICOS ACERCA DEL LPO
Es una de las principales causas de ulceración oral en pacientes sobre 40 años, especialmente en mujeres.
Presenta una gran variedad de manifestaciones clínicas, lo que puede producir cierta confusión con otras lesiones. Su bilateralidad y la presencia de estriaciones blanquecinas (estrías de Whickham) son esenciales para su diagnóstico.
A pesar de que en la mayoría de los casos su diagnóstico es eminentemente clínico, debe ser confirmado por medio de una biopsia. Su estudio histopatológico también entregará valiosa información acerca de los posibles cambios displásicos o malignos que pudiese presentar las lesiones de LPO.
No existe un tratamiento que logre la cura completa y definitiva del LPO.
El objetivo terapéutico es esencialmente sintomático, por lo que aquellos pacientes que no presenten sintomatología asociada a las lesiones (principalmente aquellas blancas) solo requieren de controles periódicos.
La gran mayoría de los casos de LPO responden de forma satisfactoria al uso de corticoides tópicos. En caso de no obtener buenos resultados, es fundamental asegurarse de que éstos estén siendo usados de manera correcta (tanto en modo de aplicación, frecuencia y duración) antes de cambiar el tratamiento.
Pacientes en tratamiento con corticoides deben ser monitoreados regularmente para detectar la aparición de reacciones adversas, especialmente con el uso de corticoides sistémicos.
Todos los pacientes con liquen plano oral, incluso aquellos asintomáticos, deben ser controlados al menos una vez al año por su (aunque bajo) potencial de malignización.