INTRODUCCIÓN
los microorganismos que componen la microbiotaresidente del huésped. La microbiota, sus metabolitos, nutrientes y detritus, así como el ambiente donde habita se reconoce como el microbioma(1).
En la cavidad bucal hay una variedad importante de microorganismos, incluyendo virus, hongos, arqueas y protozoos, pero el grupo predominante son las bacterias, de las cuales se han identificado más de 700 especies, representando los estreptococos un 20% de estas bacterias(2,3). En circunstancias normales, la composición y proporción de las comunidades microbianas orales se mantiene estable, lo que se conoce como "homeostasis microbiana"(4). Esta composición es característica de cada ubicación anatómica (piel, boca, intestino, pulmón, vagina, etc.) a pesar de la continua transferencia de microorganismos entre ellas(4).
Esta microbiota residente (adaptada durante el proceso evolutivo) no vive una relación pasiva con el huésped, sino que contribuye directa e indirectamente a la fisiología, nutrición, bienestar y a su sistema de defensa frente a otros patógenos(5,6,7). No obstante, hasta hoy no existe una composición específica de microbiota validada, ni para la salud bucal ni para la disbiosis oral. Se ha afirmado que la diversidad representa un microbioma oral saludable. Sin embargo, cuando se compara la diversidad del microbioma oral en pacientes con cáncer colorrectal y pacientes control, sorprendentemente, la diversidad es mayor en pacientes con enfermedad que en controles sanos(8). Lo mismo parece ocurrir en el caso de la periodontitis(9,10).
Actualmente, la periodontitis se describe como una disbiosis periodontal resultante de un ambiente inflamatorio alterado y un cambio en la microbiota que beneficia y amplifica la respuesta inflamatoria con una composición de microbioma que destruye los tejidos del huésped a través de enzimas y mediadores inflamatorios. Al mismo tiempo, un desequilibrio del microbioma sano se utiliza en un modelo sinérgico por patógenos como P. gingivalis que entonces se benefician de esta disrupción e inducen un daño(11,12).
Por otro lado, durante la inflamación, el pH de la bolsa gingival aumenta de 7 a 7,5(13) y esto puede potenciar la actividad de proteasas de de los patógenos periodontales. Un aumento del pH de 6,95 a 7,5 produce un aumento de P. gingivalis en proporción al resto de la comunidad (aproximadamente un 80%), produciendo un desequilibrio a favor del denominado "Complejo Rojo", en el que también participan Treponema denticola y Tannerella forsythia (14). Estas bacterias del complejo rojo inducen enzimas de destrucción tisular y una respuesta inmune alterada. Los metabolitos resultantes de la destrucción tisular crean condiciones ácidas y anaeróbicas favoreciendo así el crecimiento de otras especies patógenas y un cambio disbiótico y virulento en el microbioma(15), desencadenado de manera colateral efectos inflamatorios sistémicos(16).
BACTERIAS Y ENFERMEDADES RELACIONADAS CON LA SALUD
Sabemos que los estreptococos orales se asocian con un estado saludable en la cavidad oral, neutralizando el aumento del "Complejo Rojo" a través de una acción antagonista. En este sentido, dado que Porphyromonas gingivalis no puede mantener su crecimiento por debajo de pH 6.5, el ambiente ácido producido por el metabolismo de los carbohidratos en presencia de Streptococcus mutans, inhibe el cambio de patógeno dificultando la presencia de Porphyromonas gingivalis(17). Además, un estudio in vitro, ya clásico, mostró que la presencia de Streptococcus spp inhibe el crecimiento de Tannerella forsythia y Prevotella intermedia(18). En base a ello, podemos decir que de forma general que el género Streptococcus protege la homeostasis del microbioma de la disbiosis periodontal y del aumento de las bacterias patógenas periodontales(19,20). Sin embargo, la relación de dicho género y caries es un factor limitante para considerar a los estreptococos como un protector general de un microbioma saludable. Un estudio reciente basado en la secuenciación del ADN, no pudo encontrar una diferencia en la proporción de Streptococcus mutans entre el sujeto activo en caries y el sujeto libre de caries(21). Pero si sabemos que Streptococos mitis es incapaz de representar un papel en este equilibrio homeostático(22).
Por otro lado, los hábitos exhaustivos y enérgicos de higiene oral con dentífricos fuertes o abrasivos, así como la interferencia en la microbiota con antibióticos o antisépticos puede resultar en un cambio microbiano, en el crecimiento excesivo de bacterias resistentes o la colonización por especies exógenas (y a menudo patógenas) debido a la pérdida de resistencia frente a la colonización(23-26). El estilo de vida y la dieta, además, pueden ser responsables de una disbiosis oral de tipo inflamatorio (tabaquismo, abuso de alcohol)(27). Así, si bien la higiene bucal es primordial para la salud oral y general, un intento de aumentar la eficacia puede inducir a un mayor uso de antisépticos, antibacterianos y productos químicos que son una de las principales causas de lo que hoy se reconoce como disbiosis oral(7). Si nos centramos en otros factores, como cambios en la dieta (por ejemplo, una mayor frecuencia de consumo de alimentos / bebidas que contienen azúcar), cambios en la dentición (por ejemplo, después de la erupción, extracciones o inserción de prótesis) o una reducción en el flujo de saliva como efecto secundario de la medicación o la radioterapia, también se pueden producir desequilibrios en la microbiota(28,29,30). Enfermedades sistémicas, destacando la diabetes, también pueden inducir un cambio hacia especies anaeróbicas en la microbiota subgingival y pueden perpetuar una disbiosis oral bien establecida que desafía la salud general(31).
LA BOCA COMO HÁBITAT MICROBIANO
Para identificar los determinantes ecológicos clave que influyen en los patrones de colonización, es necesario comprender las propiedades de la boca que influyen en la colonización microbiana. La boca presenta superficies que no se desprenden (dientes), que sirven de hábitat para el crecimiento microbiano, lo que lleva a una extensa formación de una biopelícula (placa dental). Por el contrario, la descamación natural que ocurre en las membranas mucosas asegura que la carga bacteriana sea relativamente ligera en las superficies mucosas. La saliva mantiene las condiciones térmicas de humedad a un pH de entre 6.75 y 7.25, que es óptimo para el crecimiento de muchos microorganismos. Así, la saliva tiene una profunda influencia en la ecología de la boca(32,33). Su composición iónica promueve sus propiedades amortiguadoras y su capacidad para remineralizar el esmalte. Los componentes orgánicos (glicoproteínas y proteínas) pueden: (a) influir en el establecimiento y selección de la microflora oral ya sea recubriendo las superficies orales, promoviendo así la adhesión de ciertos organismos actuando como una película de acondicionamiento selectivo, o agregando otras especies y facilitando su eliminación mediante la deglución, y (b) actuar como nutrientes endógenos(34). La saliva también contiene componentes de inmunidad innata y adaptativa y, por lo tanto, puede inhibir directamente algunos microorganismos exógenos (32,35).
Si bien la placa dental se forma de forma natural y es beneficiosa para el huésped, ya que previene la colonización por especies exógenas, después de la limpieza, las superficies de esmalte se recubren nuevamente con una película acondicionadora que contiene moléculas derivadas del huésped y las bacterias. Los primeros colonizadores se conservan cerca del diente, crecen y modifican las condiciones ambientales locales para la colonización por otras especies como los anaerobios obligados. Posteriormente se forman biopelículas multiespecie(36). Esta biopelícula mantiene una composición bacteriana relativamente estable debido a un equilibrio dinámico de interacciones microbianas sinérgicas y antagonistas. Los cambios en el equilibrio, por otro lado, predisponen a la enfermedad. Las interacciones entre la microbiota oral, el medio ambiente y el huésped deben tenerse en cuenta(36).
CASCADA DE FACTORES QUE INTERRUMPEN LA HOMEOSTASIS ORAL: SIGNOS Y SÍNTOMAS
El diagnóstico de disbiosis oral es clínico más que una tarea de laboratorio. La presencia de inflamación, halitosis, sangrado o sensibilidad debe alertar sobre una disbiosis oral en curso. Así, una exposición frecuente de la placa a un pH bajo (por ejemplo, el causado por ingesta frecuente de carbohidratos fermentables en la dieta)(37), conduce a la proliferación de Streptococus mutans y Lactobacillus a expensas de especies menos tolerantes a los ácidos. Esto inclinaría el equilibrio hacia la desmineralización. La sensibilidad temprana debe considerarse un signo temprano de disbiosis oral. Por otro lado, los factores que reducen el flujo de saliva conducirían a cambios similares en la microbiota. La boca seca y la falta de humedad deben considerarse signos tempranos de disbiosis oral. Las infecciones secundarias pueden ocurrir como parte de la boca seca y la disbiosis oral. Y finalmente, la acumulación de placa alrededor del margen gingival conduce a una respuesta inflamatoria del huésped y un mayor flujo de líquido crevicular gingival. La microbiota subgingival cambia a organismos Gram negativos anaeróbicos estrictos y asacarolíticos. Todo esto hace que, en las enfermedades periodontales, el potencial redox de las bolsas sea menor que el de las zonas sanas(38). La respuesta inflamatoria también conduce a un aumento de la secreción del fluido clevicular gingival (FCG) y un pequeño aumento en el pH local (7.5)(13). Este aumento del pH parece afectar las proporciones de 3 anaerobios productores de pigmento negro. Por debajo de 7,0 Prevotella melaninogenica es el organismo dominante, a 7,25 P. intermedia aparece como la especie predominante, mientras que a pH 7,5 Porphyromonas representa casi el 100%(39,40). Esto puede ser indicativo de la influencia significativa de un pequeño cambio en el pH local en el equilibrio de la microbiota. Un cambio en el pH es indicativo de disbiosis oral.
Si bien son las condiciones del hábitat, por ejemplo, cambios en el pH, las que pueden facilitar un protagonismo de determinadas especies como Porphyromonas en un rango de pH como el anteriormente descrito, una vez activada la cascada inflamatoria y la destrucción tisular queaparece con el aumento de las condiciones anaeróbicas y ácidas, a su vez perpetuas el estado de disbiosis(15).
En un reciente estudio se demostró que tanto en el grupo de pacientes afectados de gingivitis como en el grupo de pacientes con periodontitis, el valor de pH salival medido antes y después del tratamiento periodontal (raspado y alisado radicular) se alcanizaba después del tratamiento a la vez que se acompañaba de la mejora de los parámetros clínicos. Además, el pH salival en el grupo de pacientes sanos era al inicio del estudio claramente más alcalino que en los grupos con gingivitis y periodontitis(41). Del mismo modo, en un estudio en pacientes con enfermedad periodontal severa, asociada a enfermedad cardiovascular, donde el grado de severidad periodontal estaba fuertemente correlacionado con valores de pH bajos (6,5 en periodontitis grado IV), se apreció un incremento significativo del pH transcurridos 3 meses desde la higienización oral realizada (Raspaje supragingival)(42).
Todo lo anterior nos induce a pensar que la utilización de una pasta dentífrica con prebióticos y antinflamatorios naturales para el cuidado del microbioma oral y con un buen equilibrio en sus componentes permitirá mantener el ecosistema, mejorando los factores beneficiosos y limitando los perjudiciales, y potencialmente puede beneficiar la salud oral previniendo el crecimiento de la microbiota nocivo o modulando los factores pro-inflamatorios en la cavidad oral. Nuestra hipótesis es que la utilización de pasta dental específica mejora la microbiota y la carga inflamatoria oral en un grupo de pacientes. Y por ello nuestro objetivo es: Evaluar los efectos de una pasta dentífrica específica [PDE] en la microbiota y factores inflamatorios orales. Así como determinar si existen cambios en la microbiota oral, después de la administración de un PDE versus placebo, evaluar si el uso de una PDE mejora los factores pro-inflamatorios medidos mediante citoquinas en un grupo de pacientes y analizar la opinión de los pacientes con respecto al producto.
MATERIAL Y MÉTODOS
Diseño: Ensayo Clínico Randomizado, cuya población de estudio son pacientes atendidos en el Hospital Odontològic Universitat de Barcelona (HOUB), en el Máster de Medicina, Cirugía e Implantoloigía oral // Máster de Odontología en Pacientes Oncológicos e Inmunocomprometidos, que acudan a una visita de rutina en el periodo del estudio y deseen participar. Se establecerán dos grupos: Grupo estudio [GE] que utilizará una pasta dentífrica específica [PDE], que contiene aceite de oliva virgen extra, betaina y xilitol + monofluorfosfato de sodio (1,450 ppm F-) + Excipientes (humectantes, solventes, espesantes, edulcorantes, conservantes, etc.). Y Grupo control [GC] que utilizará una pasta placebo sin ingredientes activos.
Criterios inclusión y exclusión: Se incluyen pacientes mayores de 18 años, que otorguen su consentimiento informado para participar en el estudio y no presenten patología médica asociada (ASA III y IV). Se excluyen pacientes que no deseen participar del estudio; Alérgicos a los componentes de la pasta; En tratamiento activo con antibióticos o haber recibido tratamiento antibiótico en los últimos siete días; O que sean portadores de Brackets u otra aparatología de ortodoncia.
Tamaño de muestra: Es un estudio piloto y no hay una "n" muestral establecida, dado que la variable principal es valorar la modificación en el nivel de microbiota analizada mediante PCR cuantitativa, establecemos un mínimo de 10 pacientes por grupo.
Aleatorización: Generación de la secuencia aleatoria: La muestra será por conveniencia y la secuencia de asignación aleatoria se realizará a través del programa Excel del Paquete de Microsoft Office 2019 (Microsoft Corporation, Washington, USA, 2013), mediante una asignación restringida con una distribución 1:1 para recibir [PDE, GE] o un placebo [Otra pasta dental idéntica pero sin los ingredientes activos GC].
Producto: El producto testado es un dentífrico desarrollado con la composición Saliactive que incluye aceite de oliva virgen extra, betaina y xilitol para el cuidado del microbioma oral comercializado como YOTUEL MICROBIOME CARE® (Bio Cosmetics Laboratories S.L., Madrid, España).
Ciego: Tanto los participantes como el investigador principal (Clínico tratante) serán cegados. El ciego se logrará mediante la administración de un placebo, del mismo color, tamaño, forma, sabor y envoltorio que la intervención de interés, solo diferirá que el placebo no contendrá los productos activos de la intervención: aceite de oliva virgen extra, betaina & xilitol + sal de flúor (1,450 ppm F-) + Excipiente específico de la casa Biocosmetics (Madrid, España) (humectantes, solventes, espesantes, saborizantes, entre otros). El microbiólogo y el analista de datos no formaran parte del equipo de investigación que realizará la intervención del ensayo, ni participaran en la recogida de muestras del paciente y no tendrán acceso a las hojas de aleatorización.
ASPECTOS ÉTICOS:
La participación de los pacientes en el estudio será voluntaria, respetando el principio de autonomía, e informada en relación con la naturaleza y los propósitos del estudio, donde a cada participante se le entregará una hoja informativa y un documento de consentimiento informado el que deberá firmar si consiente participar en el estudio. Los investigadores se comprometen a que todos los procedimientos a realizarse se harán de acuerdo con la Declaración de Helsinki de principios éticos para las investigaciones médicas en seres humanos de la Asociación Médica Mundial (64ª Asamblea General, Fortaleza, Brasil, octubre 2013). Los investigadores facilitarán al paciente toda la información sobre el estudio y contestarán a todas sus dudas. La intimidad de todos los participantes será salvaguardada en todo momento, así como la protección de sus datos de acuerdo con lo establecido por la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. El paciente puede abandonar el estudio en cualquier momento sin ser necesario ningún tipo de justificación. El estudio ha sido aprobado por el Comité de ética de Hospital Odontológico Universidad de Barcelona en fecha 31 de marzo de 2022 (nº 20/2022)
DESCRIPCIÓN DE LA INTERVENCIÓN - PROCEDIMIENTOS:
Los pacientes que acepten participar del estudio serán aleatorizados al GE o GC. Se realizarán dos visitas, la primera como medición basal y la segunda después de finalizada la intervención (30 ±5 días).
I.-Primera visita:
-En la primera visita, después de aceptar participar en el estudio, se realizará una historia clínica completa. A cada paciente se le realizará exploración oral extra e intraoral y también una ortopantomografía si la que presenta es de menos de 1 año. Se registrarán:
-Exploración de la mucosa oral;
-Índice CAOD(43): analizando el número de dientes cariados (C), ausentes (A) y obturados (O);
-Índice de placa O'Leary(44): Se calculará el porcentaje de superficies lisas teñidas (mesial, distal, vestibular, palatino/lingual) sobre el total de superficies dentarias;
-Se realizará un periodontograma completo, excluyendo los terceros molares, midiendo la profundidad de sondaje y la pérdida de inserción clínica en 6 sitios por diente, con la SONDA CP-12. La clasificación de periodontitis, si es necesario, se clasificará mediante las recomendaciones establecidas por la Sociedad Española de Periodoncia y Osteointegración (SEPA 2012) y el último consenso europeo (45);
-Sialometria: Secreción salival no estimulada: el paciente se colocará sentado y con la cabeza hacia adelante, facilitando la acumulación de saliva en el suelo de la boca. La saliva se irá depositando en intervalos cortos en un vaso durante 5 minutos. A continuación, el contenido recolectado se medirá en un tubo graduado. Secreción salival estimulada: en la misma posición que la prueba anterior, el paciente masticará una porción de parafina durante 5 minutos. La saliva es coleccionada en el vaso en intervalos cortos durante el período de masticación. Después, el contenido se medirá en un tubo graduado;
-pH salival: En uno de los vasos con saliva acumulada, se medirá el pH salival mediante tiras de papel FILTERLAB (WHA10360005, Whatman® Panpeha™ pH indicator strips, Barcelona, Spain) cuyo color será comparado con una escala cromática. Que establece un color para cada valor de pH (1 al 14);
-Análisis microbiológico: Se tomarán muestras con puntas de papel estériles introducidas en el surco gingival de un mínimo de tres dientes, a ser posible 16, 22, 41, 47 (siempre que estén presentes en boca y en su defecto el más cercano por medial). Se introducirán en un criotubo de 2 ml y se enviaran inmediatamente al laboratorio de microbiología de la UB donde se congelará a -80ºC para posterior procesado mediante técnica de q-PCR (PCR a tiempo real) para analizar patógenos orales: 16S global y Fusobacterium nucleatum.
-Análisis de citoquinas: Se realizará en muestras de saliva no estimulada, recogida en tubos de 15 ml que se enviarán inmediatamente al laboratorio de microbiología de la UB donde se procesarán mediante técnica de citometría de flujo para evaluar el grado de inflamación oral: se determinará la concentración de TNF, IL-1 beta e IL-4.
Al término de la visita se entregará a los pacientes la pasta dentífrica específica o la pasta placebo para un mes. Se le indicará que debe cepillar tres veces al día de la manera habitual. El paciente será citado 30 días después para la segunda visita.
II.-Segunda visita:
Se repetirá exactamente el mismo procedimiento que en la primera visita, registrando la misma información. Además, se realizará una encuesta a los participantes para la opinión sobre el producto. También se realizar una profilaxis dental y si es el caso una tartrectomia.
Análisis estadístico:
Los datos serán registrados en el programa Excel del Paquete de Microsoft Office 2019 (Microsoft Corporation, Washington, USA, 2013). La descripción de variables numéricas se realizará según su distribución en media y desviación estándar o mediana y rango. Las variables categóricas en frecuencia y porcentaje. La comparación de variables categóricas se realizará con el test de chi cuadrado y la numérica, según la distribución de las variables, con el test de Student para muestras independientes y muestras pareadas o el test U de Mann-Whitney y test de rangos asignados de Wilcoxon. El riesgo relativo estimado será reportado con sus respectivos intervalos de confianza al 95%. Se realizará un análisis por intención a tratar. Un valor p<0.05 será considerado como estadísticamente significativo. Todos los análisis se realizarán con el programa estadístico SPSS versión 20.
RESULTADOS
Finalmente, se incluyen un total de 26 pacientes. 65,3% (n=17) mujeres y 34,6% (9) hombres. La edad media es de 48,76 ±21,3 años. Los datos más relevantes de salud oral de encuentran en la Tabla 1. Referente a los antecedentes médicos, 8 (30,7%) no refieren y el más repetido en el resto, es la hipertensión arterial con un 15,4% (4 pacientes) y diabetes (7,6%) con 2 pacientes diabéticos. Once (42,3%) no refieren tomar ningún medicamento. En cuanto a los hábitos tóxicos 5 pacientes eran bebedores moderados y uno fumador y bebedor (Tabla 2).
Tabla 1. Datos más relevantes de la muestra.
| Valor | PRE (n=26) | POST (n=22) | ||||
|---|---|---|---|---|---|---|
| CAOD | 13,7±7,61 | 13,7±7,61 | ||||
| N° de dientes | 24,7±5,83 | 24,7±5,83 | ||||
| índice de placa de O'leary | 45,7±31,8 | SD | ||||
| índice de sangrado | 9,48 ±36,1 | SD | ||||
| pH | 6,8±0,51 | 6,8±00,48 | ||||
| N | B | MB | N | B | MB | |
| Secreción salival | 16 (61,5%) | 8 (30,7%) | 2 (7,6%) | 13 (59,09%) | 7 (31,8%) | 2 (9,09%) |
| Secreción salival estimulada | 19 (73,07%) | 4 (15,3%) | 3 (11,53%) | 14 (63,63%) | 6 (27,2%) | 2 (9,09%) |
| Grado 1 | Grado 2 | Grado 3 | ||||
| Enfermedad periodontal | 8 (30.7%) | 9 (34,6%) | 9 (34,6%) | SD | SD | SD |
PRE: la visita 1; POST: La vista 2 al mes ± 3 días; SD: Sin diferencias; N: normal; B: bajo; MB: Muy bajo.
Tabla 2. Antecedentes médicos.
| Antecedentes medicos | Cantidad | Porcentaje (%) | Medicamentos | Cantidad | Porcentaje (%) |
|---|---|---|---|---|---|
| HTA | 4 | 15,38461538 | Lorazepam | 1 | 3,846154 |
| DM tipo II | 2 | 7 692307692 | Ácido alendrónico | 1 | 3,846154 |
| Osteoporosis | 2 | 7,692307692 | Sertralina | 1 | 3,846154 |
| Artrosis | 2 | 7,692307692 | Hidroclorotiazida | 2 | 7,692308 |
| IRC | 1 | 3,846153846 | Hierro | 1 | 3,846154 |
| Asma | 2 | 7,692307692 | Lexatin | 1 | 3,846154 |
| Hipotiroidismo | 1 | 3,846153846 | iCalcio | 2 | 7,692308 |
| Insomnio | 2 | 7,692307692 | Paracetamol | 1 | 3,846154 |
| Linfoma de Hodgkin | 1 | 3,846153846 | Tramadol | 1 | 3,846154 |
| Migrañas crónicas | 1 | 3,846153846 | Fontex | 1 | 3,846154 |
| Válvula aórtica bicúspide | 1 | 3,846153846 | Fluoxetina | 1 | 3,846154 |
| Ansiedad | 1 | 3,846153846 | Zolpidem | 1 | 3,846154 |
| Úlcera estomacal | 1 | 3,846153846 | Eutirox | 2 | 7,692308 |
| Depresión | 1 | 3,846153846 | Foster | 1 | 3,846154 |
| Anemia | 1 | 3,846153846 | Enalapril | 1 | 3,846154 |
| No refiere | 8 | 30,76923077 | Alprazolam | 2 | 27,692308 |
| Hipertiroidismo | 1 | 3,846153846 | Lisinopril | 1 | 3,846154 |
| Omeprazol | 2 | 7,692308 | |||
| Hábitos tóxicos | Cantidad | Porcentaje (%) | Adiro | 1 | 3,846154 |
| Bebedor/a social | 5 | 19,23076923 | Propanolol | 1 | 3,846154 |
| Fuma tabaco | 1 | 3,846153846 | Ramipril | 1 | 3,846154 |
| No refiere | 15 | 57,69230769 | Aldactone | 1 | 3,846154 |
| Deprax | 1 | 3,846154 | |||
| Atenolol | 1 | 3,846154 | |||
| Metformina | 1 | 3,846154 | |||
| Letrozol | 1 | 3,846154 | |||
| Vitamina D3 | 1 | 3,846154 | |||
| Nolotil | 1 | 3,846154 | |||
| Pristiq | 1 | 3,846154 | |||
| No refiere | 1 | 42,30769 |
A la visita de control para analizar los resultados, 4 pacientes no acuden por lo que no es posible obtener datos finales de ellos, quedando la población para análisis final en 22 pacientes. De los 22 pacientes finalizados, 18 (69%) siguieron las pautas recomendadas y 4 no, no hicieron la higiene de la manera indicada, de ellos 3 eran test y uno placebo. Finalmente 12 fueron test y 10 fueron placebo. Para el análisis de 16S solo 10 muestras tuvieron suficiente concentración de DNA obtenido en µg/ml para poder ser analizadas, 5 GC y 5 GE.
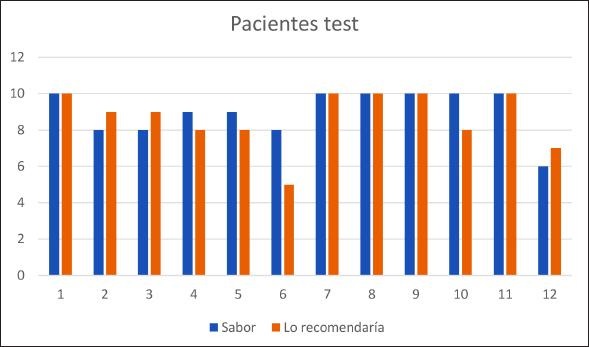
La sensación subjetiva de encontrar la boca mejor fue de 11 pacientes, de estos 7 eran test y 4 control (p=0.1); 10 pacientes encontraron la boca igual y solo uno (placebo) la encontró peor. Figuras 1 y 2. Sólo dos pacientes etiquetaron el sabor como 6 (valor más bajo), uno test y uno placebo. Todos los demás lo etiquetaron como valor 7 o superior. De hecho, en el grupo test 7 de 12 (75%) lo etiquetaron con valor 9 o 10. Frente a la pregunta si comprarían el producto 10 de 11 (90,9%) respondieron con 8 o más. Ningún paciente refirió intolerancia o reacción adversa alguna.
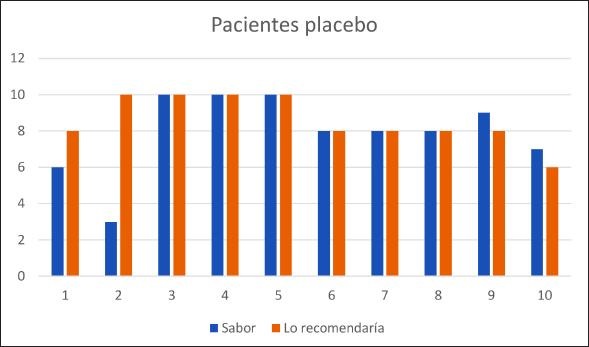
Figura 2. Respuesta de los pacientes en cuanto al sabor y nivel de recomendación en el grupo control.
Es de destacar, que, sin ser significativos, dos pacientes que utilizaron el test, mejoraron su respuesta salival, uno pasando de muy baja la saliva en reposo y el otro la estimulada. Las modificaciones de pH no fueron significativas entre los dos grupos al analizarlas antes y después (Tabla 1).
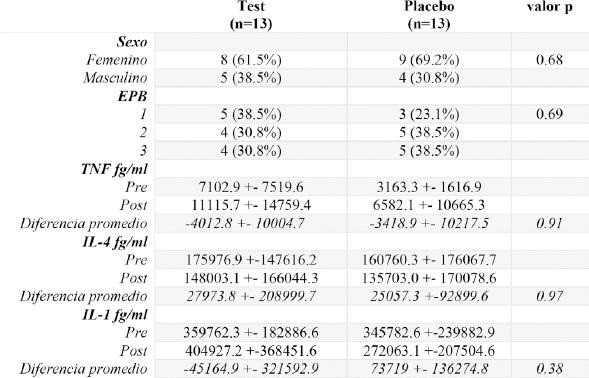
Respecto al nivel de citoquinas, solo se pudieron analizar 16 muestras, después del tratamiento con el test, se observa aumento en los niveles de TNF e IL-1 y disminución en los niveles de IL-4. Al comparar las diferencias promedio en los niveles de citoquinas pre y post intervención, no se observan diferencias estadísticamente significativas entre el grupo test y el grupo placebo respecto a los niveles de TNF (p=0.91), IL-4 (p=0.97) e IL-1 (p=0.38) (Tabla 3). La distribución por sexo es similar entre los grupos comparados (p=0.68). Tampoco se observan diferencias respecto a los niveles de EPB entre los grupos (p=0.69).
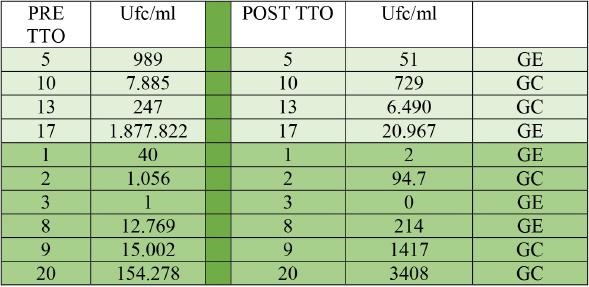
En lo referente al análisis de 16S, los datos obtenidos se presentan en la Tabla 4, observándose que en el caso del GE baja la carga en todos los pacientes y por el contrario en el GC, baja en 4 y sube en 1, sin significación (p=0.2918), con un descenso medio en el GE del 98,34% frente al 92,7% (en los cuatro que desciende del GC).
DISCUSIÓN
En la población de estudio no resalta ninguna patología de manera específica. Los datos referidos a la hipertensión arterial y la diabetes se encuentran dentro de lo esperado, si tenemos en cuenta la media de edad de la población estudio(46-49). Los datos de caries y/o enfermedad periodontal, así como de hábitos tóxicos no difieren sustancialmente de los publicados por la encuesta de salud pública oral española del 2020(50).
El 69% de los pacientes no siguieron las pautas prescritas. En cuanto al cumplimiento, si bien puede parecer un porcentaje bajo, en algunos estudios, tan solo referentes a cuestionarios el cumplimiento es del 61,6%(51).
El producto se ha mostrado muy adecuado en su uso y si bien no es significativo el resultado, los pacientes del grupo test se encuentran más confortables de manera general que los del grupo control. Ningún paciente suspende el producto y tan solo uno lo valora con un 5 en cuanto a su recomendación y 10 de 12 pacientes que responden, lo valoran con un 8 o más en cuanto al sabor y su nivel de recomendación, aspecto, en muchas ocasiones controvertido al ser un producto nuevo para el paciente.
Si nos centramos en el objetivo fundamental de este estudio, analizar las modificaciones de la microbiota/microbioma con el uso continuado de una determinada pasta dentífrica, los resultados muestran una tendencia a la mejoría de las variables estudiadas. Es conocido que la administración de probióticos, como coadyuvante al tratamiento periodontal(52), mejora los parámetros inflamatorios del medio bucal, en concreto de los microorganismos periodontopatógenos, y lo más importante, en ausencia de efectos secundarios nocivos(53). Basados en este concepto, que incluye el cepillado de las superficies dentales y gingivales como fundamento inicial de la prevención, hay grupos de trabajo que valoran como herramienta importante en el mantenimiento de la salud oral y como prevención de patologia dento-periodontal, la utilización de sustancias que vehiculizadas con la aplicación de la pasta dentífrica, pueden incidir positivamente en los pacientes(54-56). Este aspecto es claro en la prevención de la caries con pastas que contengan la combinación de fluoruro y arginina, en diferentes concentraciones, incluso hasta el 8% como defienden Koopman et al.(57), que considera la arginina por su efecto inhibidor sobre la sacarosa como un verdadero prebiótico. Además, en la literatura encontramos que las pastas dentífricas que contienen proteínas y enzimas generan un cambio en la microbiota oral que se asocia con un biofilm mucho más saludable, mejorando la salud oral(58), en concreto demuestran incrementos significativos en 12 taxones asociados a la salud de las encías, incluida Neisseria spp, y una disminución significativa en 10 taxones asociados con la enfermedad periodontal, incluido Treponema spp; no obstante los autores no especifican que tipo de compuesto utilizan, simplemente hablan de pastas dentífricas que contienen fluoruros y proteínas frente a otra pasta que no los contiene. Además, la utilización de aceites naturales propios de plantas de ciertas regiones (en concreto aceite de melaluca australiana, asociada a extracto atanólico de propoleo polaco) también puede ocasionar cambios cualitativos y cuantitativos de la microbiota oral, resultando un potenciador importante de la salud oral(59).
El cepillado, la pasta de dientes y el enjuague bucal ayudan a prevenir las infecciones orales, en el estudio de Ardizzoni et al.(60) por medio de modelos in vitro, se evalúa los efectos de colutorios comerciales sin alcohol, con distinta composición (4 con cloro-digluconato de hexidina, 1 con fluoruro, 1 con aceites esenciales, 1 con cloruro de cetilpiridinio y 1 con triclosán), en ambientes ricos en C. albicans, y un grupo de Streptococos viridans. Los enjuagues bucales que contienen digluconato y cloruro de cetilpiridinio fueron los más efectivos en el deterioro de la capacidad de C. albicans para adherirse a superficies bióticas y abióticas, provocando secreción de citoquinas proinflamatorias por parte de las células epiteliales orales. Además, estos mismos enjuagues bucales fueron efectivos para impedir la formación de biopelículas por un grupo de Streptococus viridans que, cooperan con el cariogénico S. mutans, facilitando el establecimiento de biofilm por parte de este último. Por otro lado antisépticos de amplio uso en higiene oral como el triclosán han demostrado en estudios animales estar detrás de inflamación en el tracto digestivo(61).
No obstante, no todos los estudios están de acuerdo en que la utilización de ciertos componentes en las pastas dentífricas mejora el microbioma en pacientes afectos de periodontitis leve o moderada(62). Y un aspecto que puede ser negativo son las colonias bacterianas que pueden albergar los cepillos de dientes, dependiendo de la pasta dentífrica utilizada(63). En el estudio que presentamos tanto la carga bacteriana como el componente inflamatorio, todo y no siendo significativo, probablemente debido al bajo número de pacientes, se ha visto mejorado con la pasta del estudio.
Dentro de los componentes naturales que potencialmente pueden prevenir la aparición de patologías dento-periodontales tenemos las tioflavinas, procedentes de extractos de té negro, que han demostrado eficacia, mediante la medición de 16SrRNA, produciendo una reducción significativa de patógenos orales (p. ej., Prevotella, Selenomonas y Atopobium) incrementando el número de bacterias asociadas a la salud bucal. Además, el uso de pasta de dientes con tioflavinas (TF) enriquecía las funciones en transportadores, sistema de componentes y metabolismo de aminoácidos. En conjunto, los resultados proporcionan evidencia de la aplicación de pasta de dientes que contiene TF como un producto prometedor para el cuidado bucal, pendiente de confirmación en estudios a largo plazo, en pacientes con patología activa y en concentraciones diferentes a las utilizadas en este estudio(64).
Por otro lado, estudios recientes han demostrado que el Aceite de Oliva Virgen Extra (AOVE) actúa como prebiótico, estimulando el crecimiento de bacterias beneficiosas como Lactobacillus y Bifidobacterium, y a la vez como antibacteriano ya que suprime el crecimiento de patógenos(65,66). Esta doble actividad se le atribuye al conjunto de compuesto fenólicos presentes en el AOVE(67).
De igual manera, los polifenoles presentes en el AOVE, más de 100 compuestos fenólicos diferentes, entre los que se encuentran el hidroxitirosol, el tirosol y la oleuropein, son asimismo responsables del efecto anti-inflamatorio y antioxidante que se ha relacionado con la exposición al aceite de oliva virgen extra (AOVE)(68). En este sentido son numerosos los estudios que demuestran los efectos terapéuticos del consumo de AOVE como parte de la Dieta Mediterránea frente a las enfermedades cardiovasculares y las enfermedades asociadas a problemas cognitivos como la enfermedad de Alzheimer(69).
Por otro lado, la betaína también llamada trimetilglicina es un aminoácido que se encuentra ampliamente distribuido en animales, plantas y microorganismos. Funciona como antinflamatorio y osmoprotector, propiedad esta última que le confiere capacidad para proteger células, proteínas y enzimas sometidas a estrés osmótico tales como los que pueden ocurrir en las células de la membrana mucosa de la cavidad oral(70).
Además, en estudios clínicos previos, la composición testada ahora en este estudio ha demostrado una reducción significativa de la microbiota patógena así como una reducción de parámetros clínicos asociados a inflamación, en concreto sangrado e índice de placa(71).
Finalmente, dentro del concepto de evitar productos químicos en el cuidado de la salud oral es muy interesante el artículo de Lugo-Frores et al.(72), que menciona la utilización de otros componentes procedentes del mundo vegetal como alternativa a los productos químicos utilizados habitualmente en la formulación de los productos de higiene oral, llegando un poco más lejos, incluyendo conceptos como antioxidantes, que podrían tener un papel protector en la prevención del cáncer oral, sin por ello perder de vista el preocupante aumento de las metástasis al exponerse a aceite de palma(73).
Como limitaciones más destacadas de este estudio, es la baja "n" de la población, lo que determina que sea un estudio piloto y la ausencia de enfermedad inflamatoria oral en los pacientes. Y como fortalezas podemos destacar que, en grupo de pacientes sanos, los productos testados, en ausencia de ingredientes activos químicos, o no modifican, o en todo caso mejoran la carga inflamatoria oral a la vez que reducen la carga bacteriana. Este aspecto es especialmente interesante si tenemos en cuenta que en el grupo de pacientes no resalta patología oral.
CONCLUSIÓN
Este estudio clínico preliminar permite concluir que el producto analizado es bien aceptado por los pacientes y que reduce tanto la inflamación oral (valorada mediante citoquinas) como la carga bacteriana global (valorada mediante 16S) todo y que los resultados no son significativos. Sería conveniente un estudio en una muestra más amplia y con patología periodontal para evaluar los resultados en una boca con clara disbiosis y a la vez poder explicar el mecanismo por el que un dentífrico sin antisépticos puede reducir la carga bacteriana y la inflamación oral.