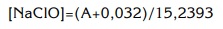INTRODUCCIÓN
La vida útil de hipoclorito de sodio (NaOCl) es limitada, varios estudios señalan la posibilidad de discrepancias entre la concentración esperada y la concentración real en soluciones de NaOCl usadas como irrigantes endodónticos. El presente estudio investigó si existe alguna diferencia en la concentración usada por endodoncistas (o estudiantes de la especialidad) y dentistas generales.
La eliminación de microorganismos y restos orgánicos juega un rol muy significativo en un tratamiento endodóntico exitoso. El espacio pulpar y los túbulos dentinarios son fuentes de microorganismos residuales y muchas veces causan infecciones persistentes después de un tratamiento de endodoncia. La desinfección del sistema de canales radiculares (SCR) puede lograrse mediante el uso de soluciones de irrigación durante la instrumentación mecánica. Las soluciones de irrigación antibacterianas pueden alcanzar las ramificaciones del canal y las zonas de difícil acceso e impregnar completamente a través de los túbulos dentinarios. (1).
Varias soluciones de irrigación en diferentes concentraciones con actividad antibacteriana se han recomendado para el uso de irrigar y desinfectar los canales radiculares en combinación con una adecuada preparación del canal radicular. Claramente, el uso de la mejor solución irrigante antimicrobiana efectiva durante la preparación quimio- mecánica es de gran importancia clínica y la solución de NaOCl es hasta la fecha, la solución de irrigación del canal radicular más utilizada, pero no existe un acuerdo general en cuanto a su concentración óptima, que varía desde 0,5 % a 5,25 %. (2)
Concentraciones de NaOCl desde 0,5% a 5% pueden ser efectivas matando bacterias en estado planktónico. Para la remoción de restos pulpares y predentina se requiere una concentración de 1% o superior. Mientras más alta la concentración de cloro disponible, mejores son las propiedades de disolución de tejidos. (3)
Estas propiedades antibacterianas y la capacidad de hipoclorito de sodio para disolver la materia orgánica y eliminar los residuos sueltos durante la preparación quimio mecánica del SCR han sido ampliamente investigadas. Se demostró que NaOCl al 5,25% era un potente agente antimicrobiano y un disolvente tejido pulpar eficaz. También se observó que tanto la capacidad antibacteriana y disolvente de tejido orgánico del NaOCl al 5,25% disminuían cuando la solución de irrigación es diluida. (4)
Debido a todo lo anterior es importante conocer la concentración de hipoclorito que se utiliza en la práctica clínica y si existen diferencias entre especialistas en endodoncia y dentistas generales.
MARCO TEÓRICO
HIPOCLORITO DE SODIO
El NaClO es el irrigante más comúnmente usado en endodoncia. Contiene cloro en estado de oxidación +1 adjudicándole un fuerte poder oxidante en sustancias orgánicas y microorganismos. El ácido hipocloroso es el responsable de la actividad antibacteriana.
El NaClO opera mediante tres mecanismos de acción:
Saponificación: actúa como solvente orgánico al ser capaz de degradar grasas en sales de ácidos grasos (jabón) y glicerina.
Oxidación: actúa oxidando aminoácidos formando principalmente aldehídos.
Cloraminación: es la interacción del cloro y el grupo amino con la formación de cloraminas, las que interfieren en el metabolismo celular de las bacterias. Ésta acción antibacteriana se debe a la inhibición de enzimas esenciales de las bacterias por medio de la oxidación.
El NaClO es usado frecuentemente en concentraciones que varían entre los 0,5% y 6% (5) (6).
La concentración ideal de NaClO para su uso en endodoncia es un tema ampliamente debatido y tras numerosos estudios aún no existe un consenso. Se sabe que una menor concentración es menos dañina y disminuye las posibilidades de formar compuestos tóxicos al ser mezclado con CHX (7).
La actividad antimicrobiana del NaClO depende de su concentración, siendo 5,25% la más eficiente en la eliminación de microorganismos facultativos tales como E. faecalis (8) (9) (10) Gomes y cols. 2001, Radcliffe y cols. 2004, Vianna y cols. 2004), aeróbicos como S. aureus y C. albicans y anaeróbicos como P. gingivalis, P. endodontalis y P. intermedia (10).
El NaClO al 5,25% disminuye el módulo elástico y la flexibilidad de la dentina, no así cuando es empleado en una concentración de 0,5% (11). Esto se debe en gran parte a la acción proteolítica del hipoclorito concentrado en la matriz dentinaria (12). Cuando es usado al 6% es capaz de desorganizar el biofilm y eliminar las bacterias de éste (13).
El NaClO es el único irrigante endodóntico que disuelve tejido necrótico y materia orgánica. Disuelve efectivamente remanentes pulpares y colágeno, principal componente de la parte orgánica de la dentina (14).
La presencia de materia orgánica (exudado inflamatorio, tejido remanente y bacterias) debilita el efecto del NaClO, por lo tanto, el tiempo y la irrigación constante son factores importantes en su efectividad (14).
Entre las debilidades del NaClO se describen sabor desagradable, fuerte irritación de los tejidos periapicales e inhabilidad de remover el barro dentinario por sí solo, pues sólo remueve materia orgánica (15).
El NaClO es el principal irrigante en la terapia endodóntica y el único capaz de disolver materia orgánica, incluyendo biofilm (13) y la parte orgánica del barro dentinario (14), por lo tanto debe ser usado durante la instrumentación mecánica. Sin embargo, cuando se usa como irrigación final posterior al lavado con ácido etilendiaminotetraacético (EDTA) o ácido cítrico (AC) se produce erosión de las paredes dentinarias por lo que esto debe evitarse (16).
Las soluciones de hipoclorito de sodio pueden ser adquiridas en supermercados, farmacias y casas dentales. El porcentaje de concentración de soluciones de NaOCl se refiere al peso por volumen de cloro libre disponible, que es la forma de ácido hipocloroso (HOCl) solo del cloro. NaOCl es la sal sódica del ácido hipocloroso (HOCl). (3)
Debido NaOCl es degradado por la luz, el aire, los metales y contaminantes orgánicos, se cree que la falta de estabilidad química es un factor importante que puede afectar negativamente a las propiedades de limpieza. Por lo tanto, se recomienda el uso de la solución madre fresca. Por otra parte, el contenido de cloro de soluciones tiende a disminuir después de que la botella se ha abierto. La temperatura de almacenamiento y de la concentración de las soluciones es otro factor importante que pueden afectar la tasa de descomposición. (4)
La vida útil de NaOCl es limitada y se puede ver mermada por muchos factores, ello es debido a que el HOCl es una molécula oxidante como inestable: Puede reaccionar con una amplia variedad de moléculas orgánicas o metales que pueden estar presentes en la solución como contaminantes, lo que en general resulta en la cloración de las moléculas disponibles y en la formación de agua. La exposición a la luz, calor, aire, metales y sustancias orgánicas que también pueden disminuir la concentración de cloro disponible con la concurrente pérdida de propiedades antimicrobianas y disolvente de tejidos. (3)
Piskin y Turkun demostraron que todas las soluciones mostraron degradación en función del tiempo y que hay un deterioro más rápido en soluciones que contienen 5% de cloro disponible almacenado a 24 ° C que en los almacenados a 4 ° C. (17)
Pese a que la estabilidad de NaOCl se ha investigado ampliamente, algunos factores todavía son inciertos. Para evitar la pérdida de cloro libre disponible, que tiende a ocurrir en soluciones altamente concentradas de NaOCl, autores han recomendado la dilución de NaOCl tan pronto como sea posible después de su compra y luego almacenar las soluciones diluidas. Sin embargo, la dilución de NaOCl puede bajar el pH, y a un pH casi neutro la vida útil de NaOCl es muy limitada.
En el año 2012 se hizo un estudio online con miembros de la Sociedad Americana de Endodoncia respecto a sus tendencias de irrigación. Los resultados arrojaron que más del 90% posee como primera elección el hipoclorito de sodio (NaOCl) como irrigante endodóntico, y de ellos el 57% lo utilizaban en concentraciones mayores al 5%.
No hay que olvidar que finalmente la concentración de hipoclorito a utilizar para la irrigación del sistema de canales radiculares es una decisión personal del dentista.
ESPECTROFOTOMETRÍA
La espectrofotometría es uno de los métodos de análisis cuantitativo más usado, y se basa en la relación que existe entre la absorción de luz por parte de un compuesto y su concentración. Cuando se hace incidir luz monocromática (de una sola longitud de onda) sobre un medio homogéneo, una parte de la luz incidente es absorbida por el medio y otra transmitida (18).
Cada sustancia tiene su propio espectro de absorción, el cual es una curva que muestra la cantidad de energía radiante absorbida por la sustancia, Absorbancia (A), en función de cada longitud de onda del espectro electromagnético, es decir, a una determinada longitud de onda de la energía radiante, cada sustancia absorbe una cantidad de radiación que es distinta a la que absorbe otro compuesto (18). Para hacer las determinaciones cuantitativas se elige, en general, la longitud de onda correspondiente a la máxima absorbancia, pues a esa longitud de onda el error de medición es mínimo y la sensibilidad máxima (19).
Las mediciones de A se hacen por comparación entre la muestra problema y un estándar arbitrario o referencia. Ésta es llamada referencia de 100%, y se le asigna una A de cero (18).
La longitud de onda de trabajo corresponde, generalmente, a la longitud de onda en la cual la A del analito (sustancia a analizar) es máxima, y recibe la denominación de Lambda máximo (λmáx.). Para seleccionar el λmáx. se hace un espectro de absorción o curva espectral, que consiste en una gráfica que informa la absorbancia de una solución (a una concentración adecuada), la que es medida a distintas longitudes de onda y en la longitud de onda de mayor absorbancia se determina el λmáx (18).
Las mediciones de A se hacen en la zona de longitudes de onda donde se espera que absorba la sustancia problema. Si se trata de sustancias coloreadas, las mediciones se realizan en la zona visible del espectro electromagnético (380 a 800nm) (18).
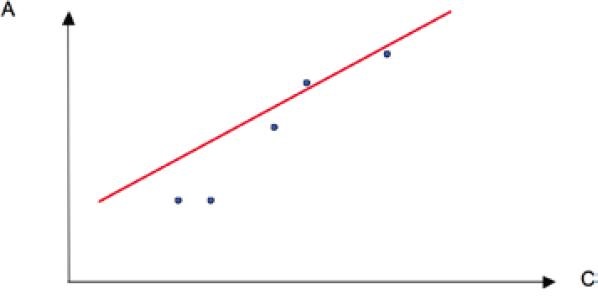
La Curva de Calibración es uno de los métodos más utilizados para determinar la concentración de una muestra problema. Corresponde a una gráfica que relaciona la concentración de al menos cinco soluciones estándar de concentraciones conocidas, con la A de cada uno de ellos a la longitud de onda máxima (λ máx.) (18).
Al hacer la curva de calibración, se debe emplear la longitud de onda de máxima absorbancia (λmáx.), para obtener una recta con la máxima pendiente y así tener mayor sensibilidad y precisión al hacer las mediciones (18).
Se relaciona una variable medible (por ejemplo absorbancia) con una variable a determinar (concentración) por medio de una función lineal. Al reemplazar la variable independiente de dicha función se obtiene la concentración de la muestra.
El método espectrofotométrico se ha validado para ser utilizado en la cuantificación de sustancias químicas específicas (19).
HIPÓTESIS
No existe diferencia en la concentración de hipoclorito de sodio en soluciones de hipoclorito de sodio usadas por endodoncistas y dentistas generales.
OBJETIVO GENERAL
Evaluar la concentración de hipoclorito de sodio usado en la práctica clínica tanto de endodoncitas como dentistas generales.
OBJETIVOS ESPECÍFICOS
Determinar la concentración real de hipoclorito de sodio disponible en las distintas soluciones de NaOCl recolectadas.
Determinar si existe diferencia entre la concentración de hipoclorito de sodio utilizada por endodoncias versus dentistas generales.
Contrastar la concentración real de hipoclorito de sodio de las muestras obtenidas con la esperada.
MATERIALES Y MÉTODO
El estudio fue analítico experimental. El tamaño muestral fue por conveniencia.
Los sujetos que participaron en este estudio fueron especialistas en endodoncia y dentistas generales que se desempeñan tanto en la atención pública como privada, en la ciudad de Santiago de Chile. Participaron del estudio de manera voluntaria, para lo cual llenaron un consentimiento informado y completaron una encuesta previamente validada (ver anexos Nº1 y 2). Cada sujeto aportó una muestra de la solución de hipoclorito de sodio que utilizaba en su práctica clínica.
Las muestras fueron recolectadas en recipientes plásticos oscuros y fueron almacenadas sin estar expuestas a la luz y refrigeradas hasta su análisis.
Las muestras fueron procesadas de forma anónima.
PROCEDIMIENTOS DE LABORATORIO
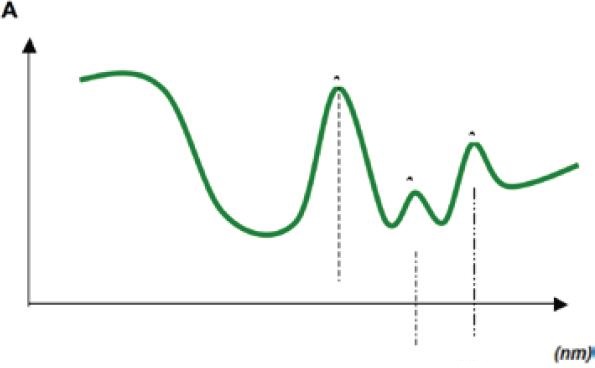
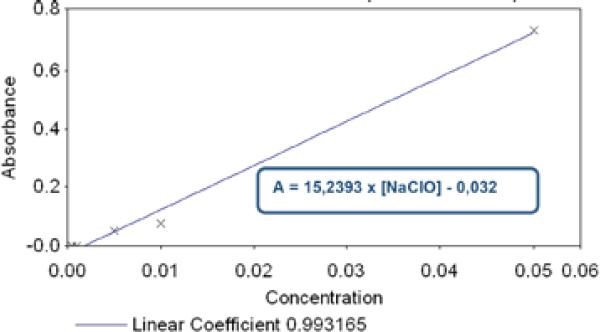
En primer lugar, se tomó 1 ml de solución de NaClO al 5% (estándar ALDRICH®). Se corrió la muestra en el espectrofotómetro con lo que se leyó su absorbancia (A) en el rango UV-visible (200-800 nm) y luego se graficaron los datos obtenidos para obtener su curva espectral. Los altos niveles de absorbancia no permitieron determinar la lambda máxima (λmax). Por lo tanto, a partir de la solución de NaClO al 5% se realizaron una serie de diluciones seriadas (0.5%- 0.05%- 0.03%- 0,01%- 0,005%- 0,001%- 0,0005%) obteniendo así soluciones de concentración conocida. En estas diluciones se determinó la longitud de onda a la cual NaClO tiene máxima absorbancia, el λmax (Gráfico 1), y se construyó la curva de calibración (Gráfico 2), la cual se utilizó para determinar la concentración de NaClO en las muestras recolectadas.
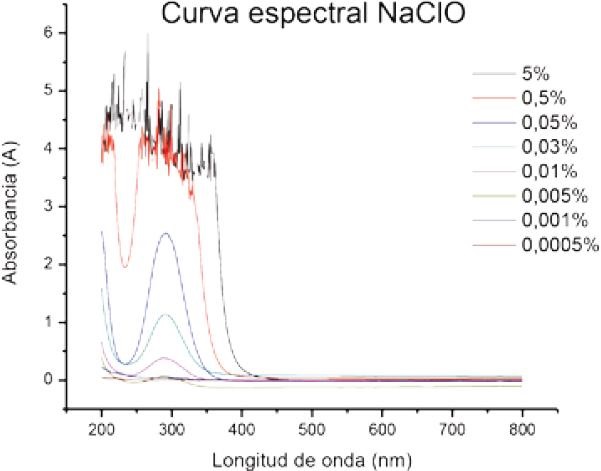
Gráfico 1: Espectros de Absorción de NaClO al 5% y diluciones a distintas concentraciones. λmax: 292 nm.
Como suponemos que las concentraciones de las muestras recolectadas al igual que el estándar poseerán altos niveles de absorbancia (que el espectrofotómetro no podrá leer bien), cada muestra se diluyó 100 veces antes de hacerlas correr en el espectrofotómetro.
La curva de calibración nos entrega la ecuación de la curva, mediante la cual podremos obtener la concentración de NaClO de las distintras muestras:
Donde A es el valor de absorbancia obtenido al hacer correr cada muestra en el espectrofotómetro.
Pero como las muestras fueron diluidas 100 veces hay que multiplicar el resultado obtenido mediante esta fórmula por 100 para obtener la concentración real de NaClO.
ANÁLISIS ESTADÍSTICO
Para el análisis estadístico se emplearon los Test de Student y Fischer para medir si existían diferencias entre las concentraciones de hipoclorito de sodio utilizadas por endodoncistas y dentistas generales. Para la encuesta se utilizaron porcentajes simples y se interpretaron los datos.
RESULTADOS
Las muestras obtenidas de la 1-15 corresponden a endodoncistas mientras que las muestras obtenidas de la 31 a 41 corresponden a dentistas generales.
Para confirmar si la hipótesis está correcta, se realizó la prueba estadística T de Student, la cual sirve para comparar las medias de dos muestras con distribución normal.
Tabla 1. Valores de absorbancia obtenidos.
| muestra 1 | 0.786 |
| muestra 2 | 0.795 |
| muestra 3 | 0.795 |
| muestra 4 | 0.850 |
| muestra 5 | 0.774 |
| muestra 6 | 0.783 |
| muestra 7 | 0.781 |
| muestra 8 | 0.784 |
| muestra 9 | 0.803 |
| muestra 10 | 0.791 |
| muestra 11 | 0.815 |
| muestra 12 | 0.821 |
| muestra 13 | 0.798 |
| muestra 14 | 0.782 |
| muestra 15 | 0.818 |
| muestra 31 | 0.732 |
| muestra 32 | 0.751 |
| muestra 33 | 0.757 |
| muestra 34 | 0.729 |
| muestra 35 | 0.732 |
| muestra 36 | 0.746 |
| muestra 37 | 0.751 |
| muestra 38 | 0.739 |
| muestra 39 | 0.782 |
| muestra 40 | 0.753 |
| muestra 41 | 0.727 |
Tabla 2. Concentración de NaClO:
| muestra 1 | 5,178% |
| muestra 2 | 5,237% |
| muestra 3 | 5,237% |
| muestra 4 | 5,598% |
| muestra 5 | 5,009% |
| muestra 6 | 5,519% |
| muestra 7 | 5,514% |
| muestra 8 | 5,165% |
| muestra 9 | 5,290% |
| muestra 10 | 5,211% |
| muestra 11 | 5,369% |
| muestra 12 | 5,408% |
| muestra 13 | 5,257% |
| muestra 14 | 5,152% |
| muestra 15 | 5,388% |
| muestra 31 | 4,824% |
| muestra 32 | 4,949% |
| muestra 33 | 4,988% |
| muestra 34 | 4,800% |
| muestra 35 | 4.824% |
| muestra 36 | 4,916% |
| muestra 37 | 4.949% |
| muestra 38 | 4,870% |
| muestra 39 | 5,152% |
| muestra 40 | 4,962% |
| muestra 41 | 4,791% |
Primero se analizó si la varianza muestral de ambos grupos (endodoncistas y dentistas generales) son estadísticamente hablando, iguales. Para ello se utilizó el Test F de Fischer.
TEST F DE FISCHER
A continuación se puede ver una tabla con los valores de F y Fcrítico con un intervalo de confianza de 95% (es decir ◻ =5%)
| Endodoncistas | Generales | |
|---|---|---|
| Media | 0,7984 | 0,7454 |
| Varianza | 0,0004 | 0,0003 |
| Observaciones | 15 | 11 |
| Grados de libertad | 14 | 10 |
| F | 1,5637 | |
| P(F<=f) una cola | 0,2411 | |
| Valor crítico para F (una cola) | 2,8647 |
Se puede apreciar que F<Fcrítico, por lo tanto las varianzas de las muestras son iguales.
Debido a que ya se determinó que la varianza entre las muestras son iguales, se aplicará el test t de Student para dos muestras con varianzas iguales.
TEST T DE STUDENT
A continuación se presenta una tabla con los valores con un intervalo de confianza de 95% (es decir ◻=5%):
| Endodoncistas | Generales | |
|---|---|---|
| Media | 0,7984 | 0,7454 |
| Varianza | 0,00041 | 0,00026 |
| Observaciones | 15 | 11 |
| Varianza agrupada | 0,00035 | |
| Diferencia hipotética de las medias | 0 | |
| Grados de libertad | 24 | |
| Estadístico t | 7,18442 | |
| P(T<=t) dos colas | 0,00000 | |
| Valor crítico de t (dos colas) | 2,06390 |
En este caso se pudo observar que testadístico> tcrítico, la diferencia entre las medias de ambos grupos (endodoncistas y dentistas generales) si es significativa.
ENCUESTAS REALIZADAS
¿Cuál es la concentración de hipoclorito de sodio de su muestra?
| N° encuestas | 1% | 2% | 5% | Otra |
|---|---|---|---|---|
| 1 | 1 | |||
| 2 | 1 | |||
| 3 | 1 | |||
| 4 | 1 | |||
| 5 | 1 | |||
| 6 | 1 | |||
| 7 | 1 | |||
| 8 | 1 | |||
| 9 | 1 | |||
| 10 | 1 | |||
| 11 | 1 | |||
| 12 | 1 | |||
| 13 | 1 | |||
| 14 | 1 | |||
| 15 | 1 | |||
| 31 | 1 | |||
| 32 | 1 | |||
| 33 | 1 | |||
| 34 | 1 | |||
| 35 | 1 | |||
| 36 | 1 | |||
| 37 | 1 | |||
| 38 | 1 | |||
| 39 | 1 | |||
| 40 | 1 | |||
| 41 | 1 |
Con los resultados de esta encuesta se procedió a hacer el análisis estadístico si la media de la concentración de hipoclorito de sodio que creían tener los dentistas en sus muestras (tanto generales como endodoncistas, cada caso por separado) era igual a la obtenida a través de la curva de espectofometría. Para ello se utilizó nuevamente el Test t de Student, pero esta vez para muestras pareadas.
Se eliminaron las encuestas en que las respuestas hayan sido "otra concentración" (distinta a 1, 2 o 5%).
En el primer caso, con dentistas generales al aplicar el test t de Student se obtiene lo siguiente:
| Concentración real | Encuesta | |
|---|---|---|
| Media | 0,0509 | 0,0210 |
| Varianza | 0,0000 | 0,0001 |
| Observaciones | 10 | 10 |
| Coeficiente de correlación de Pearson | 0,7876 | |
| Diferencia hipotética de las medias | 0 | |
| Grados de libertad | 9 | |
| Estadístico t | 9,3044 | |
| P(T<=t) dos colas | 0,0000 | |
| Valor crítico de t (dos colas) | 2,2622 |
Para este caso el valor de Estadístico t es mayor al Tcrítico, por lo tanto rechazamos la hipótesis nula, es decir si existe diferencia estadísticamente hablando (con un intervalo de confianza del 95%) entre las medias de la muestra de la concentración real con la encuesta.
Para el segundo caso de endodocistas, al aplicar el test t de Student se obtiene lo siguiente:
| Concentración real | Encuesta | |
|---|---|---|
| Media | 0,0548 | 0,0445 |
| Varianza | 0,0000 | 0,0001 |
| Observaciones | 11 | 11 |
| Coeficiente de correlación de Pearson | 0,0521 | |
| Diferencia hipotética de las medias | 0 | |
| Grados de libertad | 10 | |
| Estadístico t | 2,8033 | |
| P(T<=t) dos colas | 0,0187 | |
| Valor crítico de t (dos colas) | 2,2281 |
Dado que el valor del Estadístico t es mayor que el Tcrítico, rechazamos la hipótesis nula y se puede afirmar que si existe diferencia estadística (con un intervalo de confianza de 95%) entre las medias de la concentración real observada y las encuestas a los endodoncistas.
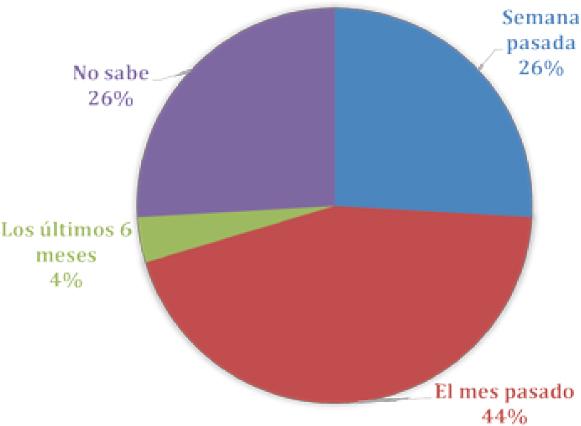
¿Cuándo adquirió el contenido de su muestra?
| N° encuestas | Semana pasada | El mes pasado | Los últimos 6 meses | No sabe |
|---|---|---|---|---|
| 1 | 1 | 1 | ||
| 2 | ||||
| 3 | 1 | |||
| 4 | 1 | |||
| 5 | 1 | |||
| 6 | 1 | |||
| 7 | 1 | |||
| 8 | 1 | |||
| 9 | 1 | |||
| 10 | 1 | 1 | ||
| 11 | 1 | |||
| 12 | 1 | |||
| 13 | 1 | |||
| 14 | 1 | |||
| 15 | 1 | |||
| 31 | 1 | |||
| 32 | 1 | |||
| 33 | 1 | 1 | ||
| 34 | 1 | |||
| 35 | 1 | |||
| 36 | 1 | |||
| 37 | 1 | |||
| 38 | 1 | |||
| 39 | 1 | |||
| 40 | 1 | |||
| 41 | 1 |
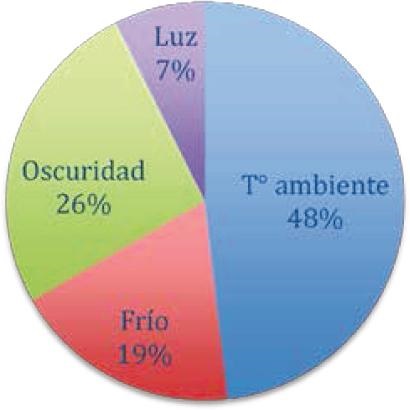
¿Cómo almacena la solución de hipoclorito de sodio?
DISCUSIÓN
El hipoclorito de sodio (NaClO) es una importante herramienta para el tratamiento endodóntico. Durante y después de la preparación del canal, el canal es irrigado con NaClO para limpiar y desinfectar el sistema de canales radiculares. Para la disolución de tejidos, se requiere al menos de una concentración del 1% de NaClO: Mientras más alta la concentración de NaClO son mejores sus propiedades de disolver tejidos. Para propósitos de desinfección la concentración mínima de NaClO debe ser de al menos 0,5%. (20) En nuestro estudio todas las muestras alcanzaron valores por sobre el 4,7% (tanto en dentistas generales como endodoncistas) por lo que dichas soluciones serían eficaces tanto disolviendo tejido orgánico como desinfectando.
En Chile no existen estudios que midan la diferencia entre las concentraciones de soluciones de hipoclorito de sodio utilizadas por dentistas generales y endodoncistas. En la literatura tampoco se han encontrado estudios similares. Si bien nuestro estudio arrojó que si había diferencia estadísticamente significativa entre la concentración de hipoclorito de sodio en las soluciones utilizadas por dentistas generales y endodoncistas se debe considerar que el tamaño muestras fue pequeño y que sólo contempló profesionales de la ciudad de Santiago de Chile.
Respecto a la concentración real versus la encuestada, nuestro estudio arrojó en el caso de los dentistas generales que la concentración real no se asemeja con la encuestada. Entonces se puede afirmar que los dentistas generales están utilizando concentraciones de NaOCl distintas a las ellos presumen estar usando, mayores. En el caso de los dentistas generales que la concentración real sea mayor que la esperada es crítico, ya que muchos de ellos lamentablemente no ocupan goma dique, por lo que se pueden producir accidentes con peores consecuencias que si lo ocupasen NaOCl menos concentrado, como quemaduras químicas. Al ver las medias de ambas muestras para entender porque se está rechazando la hipótesis nula, en el primer caso la media de la concentración real fue de 5,09%, en cambio la media de la concentración encuestada fue de 2,10%. Por lo tanto, los dentistas generales están usando concentraciones mucho mayores de NaOCl de las que ellos creen. Mientras que en el caso de los especialistas las concentraciones si se asemejan, no obstante que con el test t se rechazó la hipótesis lo que puede resultar contradictorio; ya que en la mayoría de los casos se observan concentraciones reales mayores al 5%, de hecho, el promedio es de 5,48% y para las encuestadas el promedio es de 4,45%. Es decir, las concentraciones reales son incluso mayores que las esperadas.
Existe un estudio realizado en los países bajos donde se compara la concentración libre disponible de cloro en soluciones de hipoclorito de sodio obtenido de prácticas dentales para la irrigación versus las expectativas de los profesionales realizado durante los años 2014. Dicho estudio arrojó como resultado que el promedio de concentración esperada del hipoclorito era del 2% mientras que la concentración real encontrada fue menor. Lo preocupante de los resultados fue que un 15% de las muestras presentó una concentración de cloro libre disponible menor al 1%, que es la concentración mínima necesaria para la disolución de tejidos y una adecuada desinfección. (3).
El 48% de los encuestados almacena su solución de hipoclorito a temperatura ambiente, un 19% lo hace en frio, un 26% en oscuridad y un 7% con luz normal. Hay que recordar que las soluciones de NaOCl son inherentemente inestables, los aniones de hipoclorito se descomponen en clorato (CLO3-) y cloro (Cl). La tasa de descomposición depende del pH y de la concentración del hipoclorito. Además factores como temperatura, exposición a luz UV y presencia de trazas de iones, son importantes para la cinética de la descomposición. (21). Se pudo determinar que ambos tanto como endodoncistas como dentistas generales usan apropiados métodos de almacenaje del hipoclorito de sodio del punto de vista para minimizar la perdida de Cloro libre.
Respecto a la adquisición y data de las muestras, el 44% de los encuestados respondió que el mes pasado, el 26% la semana pasada, otro 26% no sabe y un 6% los últimos 6 meses. La data del hipoclorito en conjunto con su temperatura de almacenamiento puede ser crítico. Un estudio del año 1943 mostró que Luego de 3 meses de almacenamiento a temperaturas elevadas todas las muestras presentaron un precipitado cristalino. Ello ocurre por la descomposición por calor de iones de hipoclorito a iones de cloruro. A medida que la concentración de iones de cloruro aumenta, la solución comienza a saturarse y los cristales de cloruro de sodio se forman (22). Se concluye que numerosos factores pueden influenciar la concentración como las condiciones de almacenamiento dilución, calentamiento. Se recomienda un almacenaje cuidadoso, en un lugar frio y oscuro o en botellas opacas no reactivas con tapa hermética. (21).
CONCLUSIONES
Existe diferencia en la concentración de hipoclorito de sodio en soluciones de hipoclorito de sodio usadas por endodoncistas y dentistas generales.
Todas las muestras recolectadas poseen una concentración igual o mayor al 4,7% de hipoclorito.
Existe diferencias entre la concentración real de hipoclorito de sodio en soluciones para la irrigación y la encuestada en el caso de dentistas generales. En este caso las concentraciones reales son más de dos veces mayores a las encuestadas.
Existe diferencias (pequeñas) entre la concentración real de hipoclorito de sodio en soluciones para la irrigación y la esperada en el caso de dentistas generales. Siendo incluso un poco mayores las reales a las encuestadas.