My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Gaceta Sanitaria
Print version ISSN 0213-9111
Gac Sanit vol.17 n.6 Barcelona Nov./Dec. 2003
ORIGINALES
Incidencia de enfermedad neumocócica invasiva
en Cantabria (1995-2001) e implicaciones para
el calendario vacunal
A. González a /L.J. Viloria b /J.A. Sanz c /L. Ansorena d
aEspecialista en Pediatría y en Medicina Preventiva y Salud Pública. Jefe de Sección de Promoción y
Educación para la Salud. Dirección General de Salud Pública y Consumo de Cantabria. Cantabria.
bSección de Epidemiología. Dirección General de Salud Pública y Consumo de Cantabria. Cantabria.
cEspecialista en Medicina Preventiva y Salud Pública. Jefe de la Unidad de Admisión y
Documentación Clínica. Hospital de Laredo. Cantabria.
dEspecialista en Medicina Preventiva y Salud Pública. Jefe de la Unidad de Admisión y
Documentación Clínica. Hospital de Sierrallana. Santander. Cantabria. España.
Correspondencia: A. González de Aledo Linos.Valdenoja, 46,7º I- 39012 Santander (Cantabria). España.
Correo electrónico: gonzalezdealedo_a@gobcantabria.es
Recibido: 7 de enero de 2003.
Aceptado: 6 de mayo de 2003.
(Incidence of invasive pneumococcal disease in Cantabria, Spain, [1995-2001] and implications for the childhood inmunization schedule)
| Resumen Objetivo: Describir la incidencia de enfermedad neumocócica invasiva en Cantabria en los años 1995-2001. Método: Consulta de los registros del conjunto mínimo básico de datos (CMBD) de los hospitales públicos de Cantabria, así como altas de los hospitales privados, registro de enfermedades de declaración obligatoria (EDO), y diagnósticos microbiológicos e historias clínicas de los niños ingresados en el Servicio de Pediatría del Hospital Cantabria (el hospital de referencia de tercer nivel). Resultados: Se obtuvo una incidencia de meningitis de 5,55, 5,03 y 0,76/100.000 en los niños < 2 años, ≥ 2 y < 5 años, y ≥ 5 años de edad, respectivamente, y de enfermedad invasiva de 11,11, 11,32 y 1,49/100.000 en los mismos grupos de edad. Conclusiones: La incidencia en Cantabria de meningitis y de enfermedad invasiva neumocócica es baja. Se discuten los factores a tener en cuenta para introducir la vacuna neumocócica conjugada en el calendario vacunal de Cantabria. Palabras clave: Meningitis neumocócica. Infecciones neumocócicas. Vacunas neumocócicas | Abstract Objective: To describe the incidence of invasive pneumococcal disease in Cantabria (Spain) between 1995 and 2001. Method: We reviewed the records of the Minimum Data Set (MDS) of public hospitals in Cantabria, discharges from private hospitals and the registry of diseases of mandatory reporting, as well as the microbiologic diagnoses and medical records of children discharged from the Pediatric Service of the Cantabria Hospital (the tertiary care hospital in our autonomous community). Results: We obtained a meningitis incidence of 5.55, 5.03 and 0.76/100,000 in children < 2 years, ≥ 2 and < 5 years, and ≥ 5 years respectively, and an incidence of invasive disease of 11.11, 11.32 and 1.49/100,000 in the same age groups. Conclusions: The incidence of meningitis and invasive pneumococcal disease in Cantabria is low. We discuss factors that should be taken into account when introducing the pneumococcal conjugate vaccine in the childhood immunization schedule of Cantabria. Key words: Pneumococcal meningitis. Pneumococcal infections. Pneumococcal vaccines. |
Introducción
En España se autorizó en junio de 2001 la vacuna neumocócica conjugada heptavalente, que incluye 7 de los 90 serotipos, y que por su naturaleza es eficaz desde los primeros meses de la vida al estimular la inmunidad timodependiente y generar memoria inmunológica. Como para cualquier vacuna, previamente a su generalización es imprescindible conocer la importancia de la enfermedad en la comunidad para compararla con la incidencia de efectos adversos (análisis beneficio-riesgo), y secundariamente para realizar los análisis coste-beneficio y coste-utilidad. Los primeros son imprescindibles, para estar seguros de que la enfermedad evitada tiene mayor incidencia y gravedad que los efectos adversos vacunales graves. Por el contrario, los estudios coste-beneficio y coste-utilidad son optativos, pues la prioridad en el destino de los recursos sanitarios es una decisión política.
Para ayudar en la toma de decisiones relativas a esta enfermedad, y concretamente en el análisis beneficio-riesgo en Cantabria, nos propusimos conocer la carga de la enfermedad neumocócica invasiva en nuestra comunidad, fundamentalmente en los niños en quienes estaría indicada la vacuna.
Métodos
Se ha hecho una búsqueda activa y retrospectiva de casos de enfermedad neumocócica invasiva en Cantabria entre el 1 de enero de 1995 y el 5 de diciembre de 2001. Para ello, se ha consultado en primer lugar el conjunto mínimo básico de datos (CMBD) hospitalarios de los 3 hospitales públicos de Cantabria (Hospital Universitario Marqués de Valdecilla/Hospital Materno-Infantil Cantabria, Hospital de Laredo y Hospital de Sierrallana). Se han revisado los códigos 038.2 (septicemia neumocócica) y 320.1 (meningitis neumocócica) como diagnósticos principales o secundarios. Se han incluido las neumonías con bacteriemia, pero no las neumonías sin bacteriemia, debido a que no son una indicación de la vacuna conjugada (que está autorizada sólo para la prevención de la enfermedad invasiva, siendo su efecto sobre las formas no invasivas sólo marginal), y a que los casos ingresados representan sólo una pequeña parte de las neumonías que se producen en la comunidad. Se revisaron las historias clínicas de los casos seleccionados del CMBD.
En segundo lugar, se han revisado los diagnósticos microbiológicos y las historias clínicas del Servicio de Pediatría del Hospital Cantabria; la definición de caso fue en las historias clínicas la sintomatología compatible y el aislamiento de neumococo en un lugar habitualmente estéril, y en el diagnóstico microbiológico la identificación del neumococo mediante los métodos de cultivo habituales. En tercer lugar, se revisaron las meningitis notificadas a través del sistema de enfermedades de declaración obligatoria (EDO). Se realizó la búsqueda activa de casos en los hospitales privados de Cantabria (Clínica Mompía y Clínica Reinosa) para recopilar los que hubieran podido atender. Esta búsqueda activa en distintas fuentes da una incidencia superior a los registros pasivos (descubre casos no incluidos en éstos) y, por tanto, refleja la incidencia máxima con los medios diagnósticos actuales. Finalmente, los casos detectados se han clasificado en: < 2 años (a los que va dirigida la vacuna), ≥ 2 y < 5 años (a quienes podría dirigirse en un futuro si se modifica la ficha técnica) y, por último, ≥ 5 años sin límite superior, es decir, incluyendo adultos. Los casos se estudiaron de manera nominal y se cruzaron los diferentes registros para evitar repeticiones.
Resultados
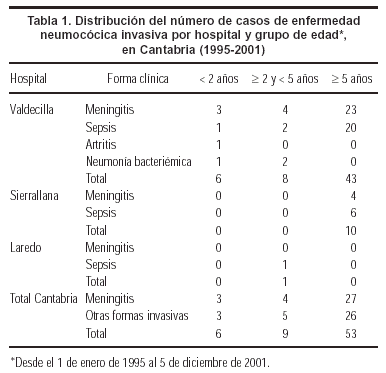
Los casos que se encontraron en cada hospital público en los 7 años analizados fueron los que se exponen en la tabla 1. Los dos hospitales privados no habían tenido ningún caso. Nueve de los 68 casos (13,2%) se detectaron en registros distintos del CMBD (7 procedentes del Hospital Cantabria y 2 del registro EDO). Estos casos incluían, entre otros, un niño con sepsis fallecido en urgencias antes de ingresar, un niño con artritis y 3 niños con neumonía bacteriémica. Además, se incluyó a 3 niños con factores de riesgo, susceptibles de ser vacunados, según las indicaciones actuales, con alguna de las vacunas disponibles (conjugada y/o polisacárida): uno con inmunodeficiencia, uno con rabdomiosarcoma, y otro con síndrome de Down. En estos casos, la tasa anual por 100.000 personas de cada grupo de edad fue la que se expone en la tabla 2.
Los serogrupos y serotipos de los neumococos aislados no estuvieron disponibles en todos los casos, por lo que no fueron objeto de análisis en este trabajo.
Discusión
En el presente estudio se ha obtenido la incidencia más próxima posible a la realidad de enfermedad invasiva por neumococo en Cantabria con los medios diagnósticos actuales, al incluir todas las formas invasivas (no sólo sepsis y meningitis), a los que presentan factores de riesgo (muchos de los cuales ahora se evitarían al ser indicación de vacunación selectiva) y a los de cualquier edad, aunque la protección de la vacuna conjugada no sea completa hasta recibir 3 dosis, es decir, a los 6 meses. Además, hay que aclarar que no todos los casos contabilizados se evitarían mediante la vacunación, pues no se conoce si su serotipo está incluido en la vacuna o no. En Estados Unidos, la vacuna heptavalente cubre sólo el 82,2% de los aislamientos en Europa: alrededor del 70%, y en España; alrededor del 78%1,2. La exclusión de los subgrupos citados en este párrafo dejaría a los auténticos beneficiarios de la vacunación generalizada, respecto a la actual vacunación selectiva, en aproximadamente la mitad.
Al comparar nuestros datos de enfermedad invasiva con otros países y comunidades autónomas, Estados Unidos tiene una incidencia de 165 y 203 casos/100.000 niños menores de un año y de 1-2 años, respectivamente, de hasta 2.396/100.000 niños de 1-2 años de algunas razas indias, y de 24/100.000 en el conjunto de la población, incidencia altísima que justificó la introducción de la vacuna en el calendario infantil en 20013. Australia y Nueva Zelanda también tienen tasas elevadas (superando los 30 y 55/100.000 en niños < 5 años), mientras que los países europeos oscilan entre 10 y 20/100.000 niños < 5 años4. En las comunidades autónomas españolas se han encontrado cifras dispares, unas más altas que las nuestras, como 61,3/100.000 < 2 años en Cataluña5, 48,4/100.000 < 2 años en Guipúzcoa6, 79/100.000 < 2 años en Sabadell7, o 93,4/100.000 < 2 años en Navarra y el País Vasco8, y otras similares a las nuestras, como 13,6/100.000 < 2 años en Murcia9 o 13,7/100.000 < 5 años en Valencia10. Un reciente trabajo de revisión bibliográfica recopila todos los estudios publicados en España7. Finalmente, la comparación (en Cantabria) con gérmenes similares también da cifras inferiores para el neumococo: la enfermedad invasiva por Haemophilus influenzae tipo b antes de la introducción de la vacuna era de 33/100.000 < 5 años (3 veces mayor) y por meningococo B en la temporada epidemiológica 2000-2001 fue de 62,93/100.000 < 5 años (5,6 veces mayor).
Las desigualdades en la incidencia de enfermedad invasiva entre regiones pueden obedecer a diferencias epidemiológicas reales o en los sistemas de registro y/o en la práctica asistencial. Respecto a los sistemas de registro, el 13,2% de los casos de Cantabria no estaban incluidos en el CMBD, lo que subraya la importancia de la notificación correcta y de utilizar distintas fuentes de información. Y la práctica asistencial explica algunas diferencias en pediatría, pues muchas de las bacteriemias neumocócicas se diagnostican en lactantes con fiebre sin foco (especialmente en los estudios prospectivos si realizan hemocultivo en todos ellos), siendo una manifestación de la llamada «bacteriemia oculta», un síndrome autolimitado que se cura sin antibióticos y que sólo en el 6% se complica con manifestaciones focales como osteomielitis, neumonía o meningitis11,12. Los países, hospitales o estudios prospectivos en que el protocolo diagnóstico incluye hemocultivo obtienen tasas de incidencia de bacteriemia superiores, pero los casos que finalmente han precisado ingreso reflejan mejor la incidencia de enfermedad clínicamente significativa.
Estas limitaciones diagnósticas no existen para la meningitis, enfermedad siempre sintomática y que requiere ingreso. Por eso, muchos autores sostienen que la meningitis es la que debería usarse a efectos epidemiológicos y comparativos. La incidencia de meningitis neumocócica en Cantabria en niños < 5 años fue de 2,3/100.000 en el período 1977-199013, y de 5,2/100.000 en el período 1995-2001, que analizamos actualmente, y las diferencias entre regiones no son tan importantes como para la enfermedad invasiva; por ejemplo, para niños < 5 años: 3,9/100.000 en Valencia14, 3,5 en Guipúzcoa6, o 1,35 en Murcia9, y para < 2 años: 6,75 en Cataluña15, 7,19 en Galicia15, 6,73 en Navarra15, 6 en Murcia9, 8,1 en Guipúzcoa6, 8,19 en Madrid15 o, excepcionalmente, 15,52 en el País Vasco15. Tampoco existen diferencias importantes entre los países europeos y Estados Unidos: 4,7 frente a 3,4/100.000 niños < 5 años4. No obstante, hay que señalar que un reciente estudio prospectivo de un año de duración en 5 comunidades autónomas españolas (no seleccionadas aleatoriamente) obtuvo una incidencia de meningitis en menores de 2 años un 58% más elevada que otro estudio retrospectivo de 3 años de duración en las mismas comunidades, lo que ejemplifica las diferencias importantes que pueden derivarse del diseño metodológico de los trabajos15,16.
En efecto, desde el punto de vista metodológico, conviene juzgar los estudios desde una triple perspectiva. En primer lugar, su duración, pues en una enfermedad poco incidente como ésta puede haber diferencias importantes de un año a otro, especialmente en las comunidades autónomas pequeñas; cuanto mayor sea el período analizado, más concluyentes serán los resultados. En segundo lugar, su carácter prospectivo o retrospectivo, pues aquéllos incluirán más bacteriemias ocultas. Nuestro estudio es retrospectivo, por lo que no podemos descartar que un estudio prospectivo pudiera encontrar una incidencia superior. En tercer lugar, y quizá lo más importante, es si se han desagregado los casos con y sin factores de riesgo, pues en la situación actual la cuestión no es cuántos casos se evitarían con la vacunación generalizada frente a la ausencia de vacunación, sino con la vacunación generalizada frente a la selectiva, que ya se aplica. Lamentablemente, esta información no se facilita en la mayoría de los estudios.
Cualquier vacuna se considera contraindicada si el riesgo de efectos adversos graves supera el de contraer la enfermedad natural. En el Northern California Kaiser Permanente (estudio de seguimiento de una amplísima cohorte de vacunados) se estudió a 17.000 niños, y se hallaron convulsiones en los 3 días siguientes a la vacunación en 41/100.000 niños y en 14/100.000 dosis, el doble que el grupo control17. La mayoría, pero no todas, fueron convulsiones febriles. Además, 43 niños tuvieron que ser retirados del estudio debido a que presentaron convulsiones18. Sin embargo, un estudio posterior en el que cada niño fue su propio control, al comparar los 3 días previos y posteriores a la vacunación, no encontró asociación19. La incidencia de otras reacciones graves, como anafilaxia (a los productos vacunales o al látex del vial), sólo se conocerá en los estudios realizados después de la comercialización de las vacunas.
Otro problema que se debate es la selección de serotipos. Existe la posibilidad de que la presión vacunal sobre sólo 7 de ellos provoque el surgimiento de otros igualmente patógenos que ocupen su lugar. Para las formas no invasivas (otitis) y para los portadores sin manifestaciones clínicas, se ha demostrado un incremento de serotipos no vacunales al disminuir los vacunales, incremento que para las otitis se cuantifica en un 33%3,20. Respecto a los portadores nasofaríngeos, el optimismo sobre el impacto que su disminución tendría en la circulación del germen se ve empañado por el remplazo de serotipos, de forma que los niveles totales de colonización puede que no se modifiquen a medio plazo21-27. Por el momento, los serotipos no vacunales cuya incidencia aumenta provocan menos enfermedades invasivas que los vacunales, por lo que el efecto inmediato es positivo. Pero si finalmente acabara produciéndose el mismo reemplazo para las formas invasivas (lo que sólo se sabrá al cabo de unos años), sólo habríamos provocado un cambio etiológico sin afectar a la incidencia. Naturalmente, esta posibilidad será objeto de estudio a medida que la vacuna vaya utilizándose en otros países.
Otros aspectos a considerar son los siguientes: a) ya están ensayándose vacunas conjugadas 9 y 11-valentes que mejorarían la cobertura de serotipos invasivos en un 11,6% (de un 78 a un 89,6%)2, cuya comercialización hará difícil decidir la actitud a seguir con los niños que actualmente se vacunen con la heptavalente (¿volver a vacunarlos para mejorar la cobertura en 2 o 4 serotipos?), y b) están en estudio vacunas asociadas de neumococo + meningococo C + Hib que simplificarán el calendario en un futuro, al disminuir el número de inyecciones. Un reciente estudio realizado en Estados Unidos ha comprobado que el 40% de los médicos considera más importante la vacuna neumocócica que la de la hepatitis B y el 26%, que la de la polio, y que el 20% retrasa estas vacunas (hepatitis B o polio) por administrar la antineumocócica28, lo que desde el punto de vista de la salud pública es un error que debe evitarse en España.
De lo anterior se deduce que quedan lagunas de conocimiento en ambos lados de la balanza de la relación beneficio-riesgo. En el lado del beneficio, la incidencia real en todo el país (no sólo en algunas comunidades autónomas), el conocimiento de los casos que se evitarían con la vacunación generalizada frente a la vacunación selectiva (pues la tercera opción, la ausencia de vacunación, ya no se da en España), y las ventajas de esperar a vacunas de espectro ampliado o mejores asociaciones vacunales. Y en el lado del riesgo, los efectos adversos vacunales en estudios poscomercialización y el posible reemplazo de serotipos. Actualmente, se está realizando un estudio de incidencia en todas las comunidades autónomas, y varios estudios poscomercialización en otros países, que permitirán llenar estas lagunas.
Mientras tanto, es conveniente recordar que la enfermedad neumocócica es tanto o más importante (en términos de morbimortalidad) en los adultos que en los niños, y que la vacuna polisacárida está indicada en los mayores de 65 años, a pesar de lo cual su inclusión en España no es objeto del mismo debate que la vacunación infantil. Cantabria incluyó en julio de 2000 la vacuna polisacárida 23-valente para los individuos > 65 años y para las personas de 2-65 años con factores de riesgo, lo que ha alcanzado hasta octubre de 2002 una cobertura del 63,08%, por lo que es previsible conseguir el objetivo fijado de un 90% en 3 años. Esta vacuna tiene un espectro de protección mayor que la conjugada (23 serotipos en lugar de 7), que cubre en Estados Unidos el 100% de los aislamientos de casos invasivos en niños, y en España el 93,9% frente al 78% la conjugada2,29,30. Por todo ello, de momento en Cantabria se recomienda y suministra la vacuna polisacárida, y la conjugada sólo para los niños menores de 2 años con factores de riesgo.
Agradecimientos
Al Dr. Fernando Rojo Roldán, del Servicio de Admisión y Documentación Clínica, y a la Dra. M. José Lozano de la Torre, del Servicio de Pediatría (ambos del Hospital Universitario Marqués de Valdecilla) por su ayuda en la búsqueda y recopilación de los casos clínicos.
Bibliografía
1. Robinson KA, Baughman V, Rothrock G, Barret NL, Pass M, Lexau C et al. Epidemiology of invasive Streptococcus pneumoniae infections in the United States, 1995-1998: Opportunities for prevention in the conjugate vaccine era. JAMA 2001;285:1729-35. [ Links ]
2. Fenoll A, Jado I, Vicioso D, Berrón S, Yuste JE and Casal J. Streptococcus pneumoniae in children in Spain: 1990-1999. Acta Pediatrica 2000;435(Suppl):44-50. [ Links ]
3. Advisory Committee on Immunization Practices (ACIP). Preventing pneumococcal disease among infants and young children. MMWR 2000;49(RR-9):1-35. [ Links ]
4. Casal J. Situación de la enfermedad invasora por Streptococcus pneumoniae en España. Primer Congreso de la Asociación Española de Vacunología, Cádiz, 15-17 de noviembre de 2001. [ Links ]
5. Domínguez A, Ciruela P, Martínez A, Carmona G, Torner N, Cardeñosa N, et al. Epidemiology of invasive pneumococcal disease in infants in Catalonia (Spain). Abstract book of 19 th annual meeting of the European Society for Pediatric Infectious Diseases, 2001. p.109. [ Links ]
6. Iglesias L, Pérez-Yarza EG, García Arenzana JM, Valiente A, Pérez-Trallero E. Epidemiología de la enfermedad invasiva neumocócica en Guipúzcoa (1981-2001). An Esp Pediatr 2002;57:401-7. [ Links ]
7. Casado A, García M, Pérez A, Rodríguez M. Incidencia de las infecciones neumocócicas pediátricas en España. Revisión bibliográfica. An Esp Pediatr 2002;57(Supl 1):7-13. [ Links ]
8. Bernaola E, Arístegui J, Herranz M, García A, Fernández C, y Grupo de Estudio de Enfermedad Invasora Neumocócica en el País Vasco y Navarra. Estudio de la incidencia de enfermedad neumocócica invasora entre 0-5 años en el País Vasco y Navarra. An Esp Pediatr 2002;57:301-9. [ Links ]
9. Espín MI, Sandoval A, Ruiz J, Navarro JA, García J, Pérez Flores D. Enfermedad neumocócica invasiva en niños de la Región de Murcia. Gac Sanit 2002;16:385-91. [ Links ]
10. Díez J, Morant A, Pereiro J, Gimeno C, Brines J, González A. Childhood invasive pneumococcal disease in Valencia (Spain). Population-based surveillance system. Abstract book of 17th annual meeting of the European Society for Pediatric Infectious Diseases, 1999; p. 92. [ Links ]
11. Harper MB y Fleisher GR. Bacteriemia oculta en el grupo de edad de 3 meses a 3 años. MTA-Pediatría 1994;15:625-40. [ Links ]
12. Daum RS. Pneumococcal vaccines for children: an update. Concise Rev Pediatr Infect Dis 1998;9:823-824. [ Links ]
13. Alonso J, Madrigal V, García Fuentes M. Meningitis neumocócica en la población infantil de Cantabria. An Esp Pediatr 1992;36:441-5. [ Links ]
14. Morant A, Díez J, Gimeno C, De La Muela N, Pereiro J, Brines J. Epidemiología de la meningitis producida por Haemophilus influenzae tipo b, Neisseria meningitidis y Streptococcus pneumoniae en niños de la Comunidad Valenciana, España. Rev Neurol 1998;26:34-37. [ Links ]
15. Casado J, Arísyegui J, Rodrigo de Liria C, Martinón JM, Fernández C, y Grupo para el Estudio de la meningitis neumocócica. Prevalencia de meningitis neumocócica en niños españoles. An Esp Pediatr 2002;56:5-9. [ Links ]
16. Casado J, Fenoll A, Arístegui J, Rodrigo de Liria C, Martinón JM, Berrón S, et al. Meningitis neumocócica en niños españoles: incidencia, serotipos y resistencia antibiótica. Estudio prospectivo multicéntrico. An Esp Pediatr 2002;57:295-300. [ Links ]
17. Anónimo. Pneumococcal 7-valent Conjugate Vaccine (Diptheria CRM197 protein), final package Insert 2/16/00. [ Links ]
18. Grupo de estudio de la utilización en España de la vacuna conjugada. Vacuna neumococo conjugada: recomendaciones de salud pública. Madrid: Ministerio de Sanidad y Consumo; 2001. [ Links ]
19. Hansen J, Black S, Shinefield H, Lewis E, Kaiser Permanente Oakland CA, Malinoski F, et al. Lack of association of seizures with receipt of seven valent pneumococcal conjugate vaccine (Prevenar, Wyeth) (abstract 355). Clin Infect Dis 2001;33:1149. [ Links ]
20. Eskola J, Kilpi T, Palmu A, Jokinen J, Haapakoski J, Herva E, et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media. N Engl J Med 2001;344:403-9. [ Links ]
21. McIntyre P. Vacunas neumocócicas. Vaccines Children Pract 2000;3:15-7. [ Links ]
22. Dagan R, Givon N, Yagupsky P, Porat N, Janco J, Chang I, et al. Effect of a 9-valent pneumococcal vaccine conjugated to CRM197 (PncCRM9) on nasopharyngeal carriage of vaccine type and non-vaccine type S. peumoniae strains among day care center attenders. 38th annual Interscience Conference on Antimicrobial Agents and Chemotherapy, San Diego, California 24 de septiembre de 1998. [ Links ]
23. Lipsitch M. Bacterial vaccines and serotipe replacement: lessons from Haemophilus influenzae and prospects for Streptococcus pneumoniae. Emerg Infect Dis 1999;5:336-45. [ Links ]
24. Edwars KM, Wandling G, Palmer P, Decker MD. Carriage of pneumococci among infants immunized with a 9-valent pneumococcal conjugate vaccine at 2, 4, and 6 months of age. 37th Annual Meeting of the Infectious Diseases Society of America (IDSA). Philadelphia, 18-21 de noviembe de 1999. [ Links ]
25. Eskola J, Anttila M. Pneumococcal conjugate vaccines. Pediatr Infect Dis J 1999;18:543-51. [ Links ]
26. Pelton SI, Klein JO. The future of pneumococcal conjugate vaccine for prevention of pneumococcal diseases in infants and children. Pediatrics 2002;110:805-14. [ Links ]
27. Mbelle N, Huebner RE, Wasas A, Kimura A, Chang I, Klugman K. Immunogenicity and impact on nasopharyngeal carriage of a nonavalent pneumococcal conjugate vaccine. J Infect Dis 1999;180:1171-6. [ Links ]
28. Schaffer SJ, Szilagyi PG, Shone LP, Ambrose SJ, Dunn MK, Barth RD, et al. Physician perspectives regarding pneumococcal conjugate vaccine. Pediatrics (edición electrónica) 2002;110:e68 (consultado 18/12/2002). Disponible en: http://www.pediatrics.org/cgi/content/full/110/6/e68 [ Links ]
29. García Arenzana JM, Piñeiro L, Vicente D, Alkorta M, Pérez E. Neumococos invasivos y nuevas vacunas. Abstract VIII Congreso SEIMC. Palma de Mallorca, mayo 1998. [ Links ]
30. Bégué P. Pneumococcal diseases in children in 1998. Vaccines Children Pract 1998;1:13-7. [ Links ]