Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Gaceta Sanitaria
versión impresa ISSN 0213-9111
Gac Sanit vol.18 no.1 Barcelona ene./feb. 2004
ORIGINALES
Serosubtipos de meningococo B causantes
de enfermedad invasiva en Cantabria y concordancia
con la cepa de la vacuna cubana
Álvaro González de Aledoa /Luis Viloriab
aEspecialista en Pediatría y en Medicina Preventiva y Salud Pública. Jefe de Sección de Promoción y Educación para la Salud.
bSección de Vigilancia Epidemiológica.
Correpondencia: A. González de Aledo Linos. Valdenoja, 46. 7º I. Santander (Cantabria). España.
Correo electrónico: gonzalezdealedo_a@gobcantabria.es
Recibido: 27 de marzo de 2003.
Aceptado: 20 de septiembre de 2003.
(Meningococcus B serosubtypes causing invasive disease in Cantabria [Spain] and agreement with the Cuban vaccine strain)
| Resumen Objetivo: Conocer los serosubtipos de meningococo B causantes de enfermedad invasiva en Cantabria y el porcentaje de concordancia con la cepa de la vacuna cubana VA-Mengoc-BC. Métodos: Revisión retrospectiva de todos los casos de enfermedad invasiva por meningococo B declarados a través del sistema de Enfermedades de Declaración Obligatoria (EDO) entre el 1 de enero de 1998 y el 28 de febrero de 2003, los aislamientos bacteriológicos del Hospital Universitario Marqués de Valdecilla y la serosubtipificación hecha en el laboratorio de referencia de Majadahonda. Resultados: De los 117 casos declarados, se identificó el serosubtipo de 79 (67,5%). La coincidencia con la cepa vacunal cubana fue del 67, el 71 y el 76% en los grupos de edad de 0 a 19 años, 18 meses a 19 años, y de 4 a 19 años, respectivamente. Incluyendo las cepas con protección cruzada, estos porcentajes se elevan al 83, el 83 y el 84%, respectivamente, en los mismos grupos de edad. Conclusiones: El porcentaje de coincidencia con la cepa vacunal cubana y con las cepas heterólogas con protección cruzada es alto, por lo que esta vacuna podría ser de utilidad para la situación epidemiológica de Cantabria. Palabras clave: Vacunas meningocócicas. Infecciones meningocócicas. | Abstract Objective: To determine the serosubtypes of meningococcus B causing invasive disease in Cantabria and the percentage of agreement with the Cuban vaccine strain, VA-MENGOC-BC. Methods: We performed a retrospective review of all cases of invasive disease due to meningococcus B declared through the Diseases of Mandatory Reporting System between 1st January 1998 and 28th February 2003. The bacteriological isolates of the «Marqués de Valdecilla» University Hospital, and the serosubtyping performed in the Majadahonda reference laboratory (Madrid, Spain) were also analyzed. Results: Of the 117 declared cases, serosubtype was identified in 79 (67.5%). The agreement with the Cuban vaccine strain was 67%, 71% and 76% in the age groups of newborn to 19 years, 18 months to 19 years, and 4 to 19 years, respectively. When strains with cross-protection were included, these percentages increased to 83%, 83% and 84%, respectively, in the same age groups. Conclusions: The percentage of agreement between the Cuban vaccine strain and heterologous strains with cross-protection was high. Therefore, this vaccine could be useful in Cantabria. Key words: Meningococcal vaccines. Meningococcal infections. |
Introducción
En Cantabria, la campaña de vacunación contra el meningococo C con vacuna polisacárida se llevó a cabo en febrero de 1997, realizándose 3 semanas después de superarse la tasa primaria de ataque de 10/100.000 en el grupo de riesgo, y consiguiendo vacunar al 93,45% de la población diana en las primeras 2 semanas y al 98,75% en las siguientes. Posteriormente, se mantuvo la vacunación de los lactantes de 18 meses hasta abril de 1999, y en octubre de 2000 se procedió a la revacunación con vacuna conjugada de los menores de 6 años y a su introducción en el calendario vacunal, con coberturas superiores al 97%. Tras estas campañas, se produjo la práctica eliminación de la enfermedad por meningococo C y su sustitución por el serogrupo B, que es el que actualmente está produciendo más morbimortalidad en nuestra comunidad. Dado que se comercializa en otros países una vacuna contra el meningococo B de origen cubano, efectiva contra la cepa homóloga, pero cuya eficacia contra cepas heterólogas (distintas de la vacunal) se discute, nos propusimos conocer los serosubtipos de meningococo B causantes de enfermedad invasiva en Cantabria, para valorar la posible utilidad de la citada vacuna en nuestra situación epidemiológica.
Médodos
Se ha realizado una revisión de los aislamientos bacteriológicos de todos los casos de enfermedad invasiva por meningococo B declarados en Cantabria entre el 1 de enero de 1998 y el 28 de febrero de 2003, mediante los registros de las enfermedades de declaración obligatoria de la Dirección General de Salud Pública y Consumo, y cruzando estos datos con los aislamientos del Servicio de Microbiología del Hospital Universitario Marqués de Valdecilla. Posteriormente, se han cotejado con la serosubtipificación de las cepas de meningococo B realizada en el laboratorio de referencia del Centro Nacional de Majadahonda, del Instituto de Salud Carlos III.
Se ha considerado cepa homóloga a la B:4:P1.15, que es la incluida en la vacuna cubana, y cepas con protección cruzada a las B:NT:P1.15, B:NT:P1.14, y B:15:P1.15, que son las que, entre las aisladas en Cantabria y según la bibliografía, en los ensayos de bactericidas son lisadas por anticuerpos bactericidas presentes en el suero de vacunados con la vacuna cubana1-3. Las otras cepas, cuya protección cruzada no se ha documentado, no se consideraron cubiertas por la vacuna, aunque esta ausencia de datos no significa que la protección no pueda existir.
Finalmente, se ha calculado el porcentaje de cepas homólogas y cepas con protección cruzada que se han aislado en los casos de enfermedad invasiva en Cantabria, estratificados en 4 grupos de edad: de 0 a 19 años (todo el grupo de riesgo), de 18 meses a 19 años (el grupo de riesgo definido en 1997 para la vacuna polisacárida en función de la ausencia de protección en los menores de 18 meses), de 4 a 19 años (grupo en que el efecto protector de la vacuna cubana es máximo) y, finalmente, en el conjunto de la población.
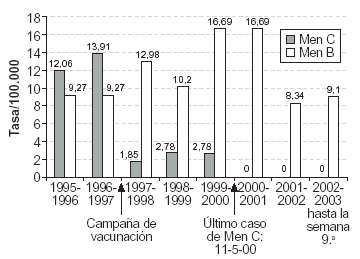
En la figura 1 se muestran las tasas de incidencia por 100.000 habitantes de 18 meses a 19 años (grupo de riesgo) para ilustrar la evolución de los serogrupos B y C y la influencia de la campaña de vacunación.
Resultados
En el período de estudio se han declarado en Cantabria 117 casos de enfermedad invasiva por serogrupo B en todas las edades. De ellos, se ha conseguido la serotipificación de 79 (67,5%). De estos 79 serotipificados, 39 (49,3%) tenían entre 4 y 19 años. Los resultados de estos 79 aislamientos están detallados en la tabla 1. Cabe resaltar que 53 (el 67,08%) correspondieron al serosubtipo B:4:P1.15, es decir, son homólogos a la cepa cubana.
Por edades, los resultados están expuestos en la tabla 2, donde se observa que la coincidencia con la cepa homóloga de la vacuna cubana es del 67, el 71 y el 76% en los grupos de edad de 0 a 19 años, 18 meses a 19 años y 4 a 19 años, respectivamente, porcentajes que, si se incluyen las cepas con protección cruzada, se elevan al 83, el 83 y el 84%, respectivamente, en los mismos grupos de edad.
De los 3 casos letales de los que se dispone del serosubtipo, 2 corresponden a la cepa cubana y uno a la B:2a:P1.5 o cepa recombinante.
Discusión
Tras las distintas campañas contra el meningococo C desarrolladas en Cantabria, se consiguió la eliminación de esta infección en nuestra comunidad, habiéndose declarado el último caso en mayo de 2000. Paralelamente, hemos constatado un incremento en la incidencia del serogrupo B, que alcanzó un pico en las temporadas 1999-2001, y llegó en el grupo de riesgo a una tasa de 16,69/100.000, superior a la que existía por el serogrupo C antes de la campaña de vacunación de 1997 (fig. 1). Además, la letalidad del serogrupo B ha aumentado desde el 0% en 1997-1998, al 4% en 1999-2001, y al 14-15% en 2002-2003. A ello puede haber contribuido la difusión por la cornisa cantábrica (País Vasco y Cantabria), a partir de otoño de 2001, de una nueva cepa, la B:2a:P1.5, procedente del switching o recombinación capsular entre cepas del serogrupo B y el C, que terminan expresándose como serogrupo B. Una vez que aparece esta cepa recombinante, si previamente ha existido una fuerte presión (p. ej., mediante vacunación) contra un serogrupo, la cepa recombinante encuentra condiciones favorables para su propagación, al ser capaz de eludir la respuesta inmunitaria inducida por la vacuna contra el otro serogrupo. La facilidad de diseminación y la ausencia de respuesta inmunitaria favorecen su incidencia y letalidad.
Figura 1. Incidencia de serogrupos B y C en el grupo de 18
meses a 19 años de edad.
A principios de los ochenta, Cuba padeció una epidemia de meningitis B que alcanzó su pico en 1984, con una incidencia de 14/100.0003. Esta epidemia siguió a una campaña de vacunación altamente eficaz contra el meningococo C, realizada en 1979 con la vacuna polisacárida A+C, situación muy parecida a la de Cantabria4,5. La epidemia de meningitis B fue causada por un serosubtipo predominante, contra el que se desarrolló una vacuna con tecnología propia en el Instituto Finlay, de La Habana, que consiguió acabar con la epidemia y disminuir la letalidad mediante una campaña amplia de vacunación (dirigida al grupo diana de 3 meses a 24 años) y, posteriormente, mediante la inclusión de la vacuna en su calendario5,6. Esta vacuna cubana (VA-Mengoc-BC) se ha comercializado posteriormente en más de 20 países desde 1987. Consta de proteínas de la membrana externa del meningococo B (cepa cubana Cu385/83, correspondiente al serosubtipo B:4:P1.15, con 50 μg por dosis) y del polisacárido del meningococo C (50 μg por dosis)4. Si esta asociación fuera suficientemente efectiva en Cantabria, disminuiría la incidencia del serogrupo B y serviría como segunda dosis inmunizante contra el serogrupo C (no como dosis booster en sentido estricto, pues las vacunas polisacáridas no generan memoria inmunológica), lo que garantizaría otros 5 años de protección (10 años para los más optimistas) del grupo de riesgo, esta vez contra los 2 serogrupos.
De la vacuna cubana se ha usado más de 40 millones de dosis en Cuba, Ucrania, Mongolia, Argentina, Brasil, Colombia, Paraguay, Uruguay y otros países con epidemias de meningococo B, en los que ha resultado efectiva para su control, y en Cuba forma parte del calendario vacunal a los 3 y 5 meses desde 19915-7. Respecto a su efectividad clínica, aunque es moderada en los menores de 4 años (28-47%), en las edades mayores es buena (el 74% en los mayores de 4 años, el 83-94% en los de 10-14 años)4,7-13. En Cuba y Brasil, la efectividad vacunal en menores de 6 años es del 92 y el 75%, respectivamente4,6. Además, en las zonas donde la vacunación se ha realizado en forma de campaña masiva y rápida, la efectividad clínica ha sido aún mayor: el 99% en La Habana, el 99,8% en Ciego de Ávila o el 98% en Holguín (porcentajes referidos a niños de 3 meses a 5 años), aunque algunos autores ponen en duda estas cifras4,14. La duración de la protección se estima al menos en 5 años. La vacuna disminuye la tasa de portadores y produce respuesta anamnésica si se revacuna con una tercera dosis unos meses o años después6,15.
Se ha argumentado que esta efectividad clínica no sería reproducible en países donde el serosubtipo de meningococo B circulante fuera distinto del vacunal. No obstante, algunos ensayos realizados en modelos animales y estudios de anticuerpos bactericidas con sueros de pacientes vacunados demostraron que su protección es de amplio espectro contra otros serosubtipos del serogrupo B (al menos los circulantes en Sudamérica), y no sólo contra la cepa vacunal u homóloga1,2,4,9,16. Estos resultados se han cuestionado posteriormente, en estudios de anticuerpos bactericidas desarrollados en el contexto de una epidemia en Chile por una cepa distinta de la vacunal17. No obstante, se ha comprobado y se admite universalmente que la tasa de anticuerpos bactericidas contra el meningococo no se correlaciona con la protección clínica, y que esta falta de correlación es aún mayor para el serogrupo B que para el C, debido a su escasa inmunogenicidad y a que los anticuerpos pueden dirigirse contra antígenos subcapsulares, que no se miden con la técnica serológica utilizada3,15. Esta ausencia de correlación también se comprobó en Cantabria en el estudio de anticuerpos bactericidas desarrollado tras la campaña de vacunación contra el serogrupo C de 1997, con diferencias de hasta un 93% entre la eficacia clínica y la «protección serológica» en las edades menores18. Además, otros anticuerpos no bactericidas pueden ser protectores a través de mecanismos diferentes15. Así pues, el mejor parámetro de protección es la efectividad clínica de la vacuna, y a ésta se refieren los porcentajes de protección comprobados para la vacuna cubana y citados en el párrafo anterior.
En 1998 se publicó el primer estudio con la vacuna cubana en población europea (Islandia) auspiciado por la OMS en jóvenes de 15-20 años, en el que se indicó de nuevo la escasa correlación entre los anticuerpos bactericidas y la protección clínica. Como ejemplo, la vacuna cubana, que era considerada más efectiva clínicamente, inducía menos tasa de seroconversión que la vacuna noruega alternativa, producida por el National Institute of Public Health, de Oslo. También se observó que la aplicación de una tercera dosis de la vacuna cubana incrementaba la protección cruzada contra cepas no vacunales (heterólogas)15.
Como resumen de todos los trabajos citados, puede concluirse lo siguiente: la vacuna es inmunógena con 2 dosis contra cepas homólogas desde los primeros meses; es inmunógena contra cepas heterólogas, incluso desde los 2 años con una tercera dosis; es clínicamente efectiva contra cepas homólogas desde los 3 meses, y es clínicamente efectiva contra cepas heterólogas desde los 4 años. La efectividad clínica es mayor cuando se usa en forma de campaña masiva, tal vez por sumarse la inmunidad de grupo a la protección individual.
En este contexto, hay que señalar que en 1999 el laboratorio GSK adquirió los derechos de la patente de la vacuna cubana para su comercialización en Europa y que está desarrollando estudios clínicos en colaboración con el fabricante de la vacuna (el Instituto Finlay, de La Habana) para valorar la efectividad de la vacuna cubana, ligeramente modificada, en España y en Inglaterra. En España está en marcha un ensayo de fase II en adolescentes para evaluar su inmunogenicidad, seguridad y pauta de dosificación, y tal vez cuando estos resultados estén disponibles se decida su autorización, lo que facilitaría su uso. Pero, mientras tanto, es posible que estos estudios retrasen, en cierto modo, su eventual utilización hasta que se disponga de los resultados definitivos en varios grupos de edad, lo que puede llevar varios años. Las otras vacunas contra el meningococo B fabricadas por otros laboratorios, que se están probando en varios países (de momento con menor eficacia que la vacuna cubana), no están comercializadas, por lo que su utilización actual no se plantea15,19.
A la vista de nuestros resultados, consideramos que la vacuna cubana sería efectiva en la situación epidemiológica de Cantabria, quizá con una efectividad algo menor que la de otras vacunas pediátricas a las que estamos acostumbrados, pero aun así se justifica su uso ante la carencia de alternativas más eficaces. En el escenario menos favorable a la vacuna --limitando la campaña al grupo de 4-19 años, que representa el 49,3% de los casos--, se evitaría el 56% de las enfermedades invasivas en este grupo de edad (el 76,92% de coincidencia con la cepa homóloga con el 74% de efectividad vacunal en este grupo de edad). En el más favorable --vacunando a la población desde lactantes hasta los 19 años en forma de campaña masiva, como la de 1997--, se evitaría el 82% de los casos de todo el grupo de riesgo (el 83,07% de coincidencia con las cepas homólogas y heterólogas cubiertas por la vacuna con el 99% de efectividad vacunal, descrita en algunas campañas en Cuba). A lo anterior habría que añadir el beneficio de inmunizar simultáneamente contra el serogrupo C y, lo que es más importante, evitar algunos fallecimientos. En un reciente trabajo publicado sobre la vacuna cubana, en colaboración entre el Imperial College School of Medicine, de Londres, y el Instituto Finlay, se concluye: «La vacuna tiene un excelente perfil de seguridad y puede ser un complemento útil a la profilaxis antibiótica en el manejo de las epidemias de serogrupo B homólogas»3. La pregunta es si se puede considerar que éste sea el caso de Cantabria, que ha alcanzado una incidencia de casi 17/100.000 en el grupo de riesgo que corresponde a una incidencia de 12/100.000 de la cepa homóloga. Con incidencias muy inferiores se vacunó en algunas comunidades autónomas en 1997 y 1998 contra el serogrupo C.
Bibliografía
1. Regueira M, Palmerio S, Gutiérrez MM, Malberty A, Sotolongo F y García AM. Estudio de cepas de Neisseria meningitidis circulantes en la Argentina 1991-1993 y ensayo de sueros de vacunados con una vacuna antimeningocócica de origen cubano contra cepas de los diferentes tipos y subtipos causantes de enfermedad. Rev Hosp Niños B Aires 1994;36: 242-6. [ Links ]
2. Sotolongo F, Martínez OM, Camaraza MA, Gutiérrez M, Galguera MA, Izquierdo L, et al. Bactericidal activity in sera from recipients vaccinated with VA-Mengoc-BC against strains of different serotypes and subtypes. En: Pathobiology and immunobiology of Neisseriaceae. Proceedings of the VIII International Pathogenic Neisseria Conference. México: Instituto Nacional de Salud Pública, 1994. [ Links ]
3. Morley SL, Cole MJ, Ison CA, Camaraza MA, Sotolongo F, Anwar N, et al. Immunogenicity of a serogroup B meningococcal vaccine against multiple Neisseria meningitidis strains in infants. Pediatr Infect Dis J 2001;20:1054-61. [ Links ]
4. Almeyda L, Rico O. Información general sobre la enfermedad meningocócica en Cuba. Vacuna para su prevención y alcance. Rev Hosp Niños B Aires 1994;36:234-41. [ Links ]
5. Galguera MA, Gutiérrez M, Caro E, Rodríguez L, Sotolongo F, Sierra VG, et al. Studies of serogroup B strains of Neisseria meningitidis: main causal agent of the meningococcal disease in Cuba after 1980. En: Pathobiology and immunobiology of Neisseriaceae. Proceedings of the VIII International Pathogenic Neisseria Conference. México: Instituto Nacional de Salud Pública, 1994; p. 222-8. [ Links ]
6. Sierra VG, Campa C, Terry H, Echeverry ML. Epidemiologic & laboratory evaluation of the Cuban meningococcal vaccine BC. Three years of follow up. En: Pathobiology and immunobiology of Neisseriaceae. Proceedings of the VIII International Pathogenic Neisseria Conference. México: Instituto Nacional de Salud Pública, 1994; p. 909-15. [ Links ]
7. Pérez A, Dickinson F, Baly A, Martínez R. The epidemiological impact of antimeningococcal B vaccination in Cuba. Mem Inst Oswaldo Cruz 1999;94:433-40. [ Links ]
8. Maiden MCJ, Spratt BG. Meningococcal conjugate vaccines: new opportunities and new challenges. Lancet 1999;354: 615-6. [ Links ]
9. Sierra GV, Campa HC, Varcacel NM, García IL, Izquierdo PL, Sotolongo PF, et al. Vaccine against group B Neisseria meningitidis: protection trial and mass vaccination results in Cuba. NIPH Ann 1991;14:195-207. [ Links ]
10. Rico O, Jiménez R, Pereira C. Meningococcal disease and VA-Mengoc-BC in minors less than 1 year of age. Cuba 1983 to 1991. Rev Cubana Med Trop 1996;48:34-9. [ Links ]
11. Pérez A, Meneses FO. VA-Mengoc-BC vaccine: its impact on meningococcal disease in children 1-4 years old. Rev Cubana Med Trop 1999;51:189-93. [ Links ]
12. Rico O, Bravo JR, Díaz M. Effectiveness of VA-Mengoc-BC in children from 0 to 5 years of age in Cuba. First year of observation. Rev Cubana Med Trop 1994;46:94-8. [ Links ]
13. Moraes JC, Perkins BA, Camargo MC, Hidalgo NT, Barbosa HA, Sacchi CT, et al. Protective efficacy of a serogroup B meningococcal vaccine in Sao Paulo, Brazil. Lancet 1992; 340:1074-8. [ Links ]
14. Rico O, Pereira C, Fernández AA. The post-licensing efficacy of VA-Mengoc-BC in children under 6 in Holguín, Cuba. The first year of observation. Rev Cubana Med Trop 1995;47:59-64. [ Links ]
15. Perkins BA, Jonsdottir K, Briem H, Griffiths E, Plikaytis BD, Hoiby EA, et al. Immunogenicity of two efficacious outer membrane protein-based serogroup B meningococcal vaccines among young adults in Icelean. J Infect Dis 1998;177:683-91. [ Links ]
16. Sifontes S, Infante JF, Pérez P, Caro E, Sierra G, Campa C. The hyperferremic mouse model for the evaluation of the effectiveness of VA-Mengoc-BC against Neisseria meningitidis B clinical isolates. Arch Med Res 1997;28:41-5. [ Links ]
17. Tappero JW, Lagos R, Ballesteros AM, Plikaytis B, Williams D, Dykes J, et al. Immunogenicity of 2 serogroup B outer-membrane protein meningococcal vaccines: a randomized controlled trial in Chile. JAMA 1999;281:1520-7. [ Links ]
18. González de Aledo A, García Merino J. Seroprevalencia de anticuerpos bactericidas frente al meningococo C en Cantabria 10 meses después de la campaña de vacunación. Rev Esp Salud Pub 1998;72:365-7. [ Links ]
19. Navarro Alonso JA. Perpectivas de la vacuna frente al meningococo B. Vacunas 2000;1:10-3. [ Links ]