My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Gaceta Sanitaria
Print version ISSN 0213-9111
Gac Sanit vol.19 n.2 Barcelona Mar./Apr. 2005
REVISIONES
Los medicamentos en la Unión Europea:
el tándem comercio-salud
Fernando Antoñanzasa / Roberto Rodrígueza / José Antonio Sacristánb / Rafael Illac
aUniversidad de La Rioja. Logroño. La Rioja. España.
bLaboratorios Lilly. Madrid. España.
cMinisterio de Administraciones Públicas. Barcelona. España.
| (Drugs in the European Union: the health-market tandem) |
| Resumen | Abstract Objectives: To characterize the peculiar economic nature of the pharmaceutical market in the EU, to study potential groupings of countries based on several pharmaceutical variables, to analyze some recent regulations designed to create the single market, and to present some thoughts on the decision making process in public health from the perspective of current public health budgets. Method: We performed an economic analysis of health and pharmaceutical macrovariables, cluster analysis, review of EU pharmaceutical and industrial regulations and review of pharmaceutical budgeting legislation in the member states. Results: The pharmaceutical market of the EU was characterized and EU countries were classified into two principal groups according to 5 selected variables. EU regulations tend to promote R + D and drug production and thus the EU industrial sector is backed up. National regulations differ in terms of pricing and drugs reimbursement. Conclusions: The creation of a single market for drugs in theEU should take this regulatory diversity into account and seek equilibrium between economic factors and public health. This single market may be a dangerous strategy if it becomes a general dogma and even more so if deadlines are fixed andshort. Keywords: Pharmaceutical industry. European single market. Pharmaceutical policy. Pharmaceutical budgets. |
Correspondencia: Fernando Antoñanzas Villar.
Universidad de La Rioja. Departamento de Economía y Empresa. Edificio Quintiliano.
Cigüeña, 60. 26004 Logroño. La Rioja. España.
Correo electrónico: fernando.antonanzas@dee.unirioja.es
Recibido: 14 de junio de 2004. Aceptado: 12 de enero de 2005.
Introducción
Los medicamentos son un conjunto de productos de alto valor añadido, en términos económicos, y de alto valor estratégico desde la perspectiva sanitaria, industrial y política. Los medicamentos desempeñan un papel fundamental en la terapéutica de los pacientes y su empleo tiene importantes consecuencias en la calidad de vida y en la salud pública. Los medicamentos, en tanto en cuanto bienes de consumo especiales, son, sin duda, los artículos sujetos a una mayor regulación administrativa por los Estados miembros. Eso genera dificultades en el contexto del mercado único. Las situaciones a las que obedece tal regulación son múltiples; las tensiones entre las que se debaten las diferentes instituciones con capacidad reguladora también tienen diversos orígenes.
La apuesta de la Unión Europea (UE) por un «mercado único del medicamento», en el que se da prioridad al componente de política industrial, plantea serios interrogantes desde la perspectiva sanitaria. También puede afectar seriamente a la continuidad de la industria farmacéutica de países con una estructura industrial como la de España y a la capacidad de las autoridades sanitarias de los Estados miembros para hacer frente a sus responsabilidades de cobertura sanitaria, tanto por la vía presupuestaria como por la posible pérdida de «cultura farmacéutica», con el debilitamiento o incluso la desaparición de su base profesional, tanto privada como pública, tal vez reconducida a actuar en áreas marginales.
En el presente artículo pretendemos caracterizar, en una primera parte, la naturaleza económica singular de este mercado para, seguidamente, analizar algunas de as normas que regulan el mercado –atendiendo a ese tándem salud/comercio, que no siempre quedará en equilibrio–, y finalizaremos con unos apuntes acerca de cómo se adoptan las decisiones más importantes desde la perspectiva financiera de los ciudadanos: la presupuestación pública, que facilita el cumplimiento del principio de la equidad de acceso a los bienes sanitarios, como mandato constitucional en los países de la UE.
Naturaleza económica del mercado de medicamentos en la Unión Europea
Ante todo, un mercado es un espacio para resolverlos problemas de decisión relacionados con qué se va a consumir, cómo se van a producir los bienes y servicios y para quién van a ser distribuidos. La solución del mercado es un conjunto de precios y cantidades para los diferentes bienes y servicios. No obstante, esta solución tan sencilla e inmediata para los problemas económicos requiere un conjunto de elementos para que funcione, esto es, para que de las decisiones de cada agente individual que busca su propio interés se obtenga una solución óptima para la sociedad. Estos elementos son de diferente índole (jurídica, institucional, política, administrativa, informativa, etc.) y constituyen el denominado marco institucional del mercado.
La importancia de un mercado se puede abordar según diferentes criterios y mediante diferentes métodos. En este caso se ha optado por presentar un análisis de los elementos más característicos, como son los flujos comerciales internacionales, los productos, las cantidades intercambiadas y los precios. Adicionalmente, se incluirá un análisis más exhaustivo referido al caso español.
El comercio de medicamentos en la UE
El comercio farmacéutico de la UE, según el origen y el destino de los productos, es fundamentalmente de carácter intraeuropeo, ya que en el «espacio común europeo» tiene lugar la mayor parte de los intercambios (el 78% de las importaciones y el 74% de las exportaciones), mientras que los orígenes y destinos externos a la propia UE son de menor proporción. Además, estas proporciones han crecido en los últimos años. Dentro de las compras y ventas hacia o desde otros países europeos, destaca Suiza con un 8% del flujo comercial de medicamentos 1 .
En cuanto al detalle de las operaciones comerciales de los países de la UE y de Suiza, Estados Unidos y Japón y referidos al año 2000 (tabla 1), se observa que los países con mayores tasas de cobertura (cociente entre las exportaciones y las importaciones) no son precisamente los de mayor tamaño en cuanto a Producto Interior Bruto (PIB) o número de habitantes, sino aquellos en los que confluyen razones de políticas de Investigación y Desarrollo (I+D) de sus empresas y de su consumo interno, como Suiza, Suecia y Dinamarca, con tasas superiores al 240%, o bien de localización industrial, como Irlanda, con una tasa de cobertura del 373%, alcanzada en buena medida por la exportación de genéricos. En valores absolutos, Suiza con 7.512 millones de euros, Alemania con 4.636, Francia con 3.959, Irlanda con 3.828 y el Reino Unido con 3.783 son los países del espacio económico europeo con mayor saldo positivo del comercio farmacéutico. Grecia, con un 21% de tasa de cobertura, Portugal con un 30%, Noruega con un 32%, Finlandia con un 38% y España con un 57% son los países de la UE con menores coberturas relativas de este comercio. En el contexto mundial, Japón tiene una tasa de cobertura similar a la de España, y Estados Unidos tiene una tasa del 84%. Los saldos negativos absolutos de mayor cuantía corresponden a Japón (2.203 millones de euros), Estados Unidos (1.980) y España (1.703).
La evolución de esta situación, medida a través de la comparación de la situación del comercio exterior entre los años 1992 y 2000, indica que hay una tendencia, en general, a ampliar los importes y no a cambiar su signo. Es decir, los países que tenían un saldo positivo en 1992, 8 años después lo tienen mayor y lo mismo para los que mantenían un déficit en 1992, que después lo han visto aumentado. Sólo 2 países –Italia, que ha presentado una reducción en el déficit de más del 60% durante el lapso analizado, y los Países Bajos, que ha cambiado de signo pasando a ser un país netamente exportador– constituyen excepciones a esa regularidad empírica1 .
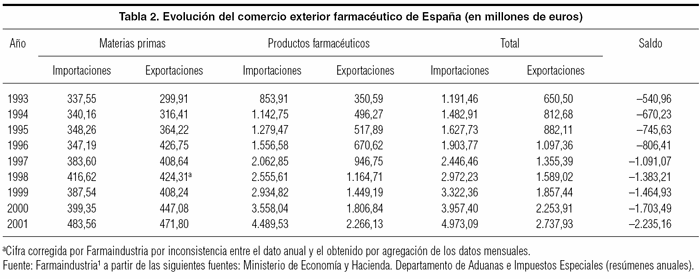
No obstante, a fin de conocer mejor la composición y la evolución del saldo exterior español, en la tabla 2 se expone la desagregación entre materias primas y productos ya elaborados. En este sentido, se constata un aumento considerable de la exportación de materias primas durante el período de 9 años analizado. El saldo de este grupo de bienes, a pesar de ser negativo en 1993, ha pasado a ser positivo desde 1995 y luego negativo en 2001. A su vez, destaca el gran crecimiento registrado en las importaciones de productos terminados, de manera que su ritmo de crecimiento medio ha sido de un 20,2% anual, mientras que el de las exportaciones fue de un 23,1% durante el período analizado. Así, como los saldos iniciales eran deficitarios, la brecha en valores absolutos ha crecido considerablemente. Además, el importe global, dado que las materias primas representan una menor proporción en el total, no ha conseguido modificar la tendencia deficitaria de los productos terminados. Entre las explicaciones de este fenómeno habría que indicar la liberalización del comercio, acontecida durante el período analizado como consecuencia de la incorporación plena de España a la UE, con la subsiguiente eliminación de las normativas más proteccionistas vigentes hasta entonces, además de los avances terapéuticos logrados por la industria multinacional –basados en las elevadas inversiones de I+D llevadas a cabo esencialmente fuera de España– y que se materializaban en importaciones de productos que sólo necesitaban el re-envasado o reetiquetado para ser distribuidos en el mercado nacional. En este caso, como las políticas de I+D suelen dar sus frutos a medio y largo plazo, la tendencia apuntada, desgraciadamente para la balanza de pagos española, es previsible que se mantenga durante varios años sin grandes modificaciones.
Los productos objeto de intercambio en el mercado: número de especialidades, innovación y características
El mercado de medicamentos está constituido por una amplia variedad de productos que se pueden analizar a partir del concepto jurídico de especialidad farmacéutica, el cual permite individualizar cada entidad medicamentos a que exige una autorización legal de comercialización. La definición legal de especialidad farmacéutica no es homogénea para todos los países que se citan, por lo que las comparaciones han de tomarse con cierta cautela. En la UE, las especialidades registradas en cada país no coinciden. Su cuantía es inferior a las10.000 especialidades en todos los países. No obstante, hay amplias diferencias: por ejemplo, en el año 2000, en Alemania había 9.684, mientras que en Dinamarca y Finlandia su número era inferior a 1.900, y en España era de 5.6371 . La reciente evolución de su cuantía es creciente para todos los países de la UE: excepto Bélgica, España y Finlandia, los demás países han experimentado un aumento en el número de las especialidades.
Los principios activos que dan lugar a las especialidades farmacéuticas tampoco coinciden en los países de la UE. Hay grandes diferencias, de modo que en el período 1990-2001 en el Reino Unido y Alemania se introdujeron 43 y 38 principios activos, respectivamente, mientras que en Austria, Bélgica y Finlandia fueron de 3 o menos. En España, durante ese mismo período se incluyeron 11 nuevos principios activos, al igual que en Dinamarca.
Esta forma de definición del producto farmacéutico basada en el principio activo es mucho más homogénea que la de especialidad y, por tanto, es más apropiada para las comparaciones internacionales. En cualquier caso, se sigue observando una gran variedad en el rango de productos que el mercado incluye en cada país. Nótese que hasta la década de los noventa los registros nacionales constituían la primera causa de segmentación de mercados –esto es, un principio activo o sus especialidades asociadas podían no registrarse en un país y sí en otros de la UE–, característica que ahora se está corrigiendo con los procedimientos europeos de registro que facilitan la admisión simultánea del producto en los mercados de todos los países de la UE. Una facilidad que, como se verá en el siguiente apartado, ha quedado en ocasiones desvirtuada por la negociación de precios y/o financiación en cada Estado miembro, lo cual ha ocasionado retrasos en la comercialización de las especialidades de más de 1 año entre los primeros y últimos países en gestionar dicho proceso.
En España, la tendencia al registro de nuevos medicamentos ha sido creciente durante la pasada década: en 1999 se registraron 661 nuevas especialidades, cifra muy superior a las 309 registradas en 1991, y de ellas, 611 fueron de carácter ético –que requieren prescripción médica–, aunque conforme con las clasificaciones aplicadas en los boletines de la Información Terapéutica del Sistema Nacional de Salud, sólo el 10% correspondió a lo que se denomina una «importante mejora terapéutica» y ninguna se consideró como «novedad terapéutica excepcional» 2 . No obstante, los criterios aplicados para dicha clasificación constituyen un asunto controvertido.
También conviene resaltar que en el período 1998-2002 ha habido un descenso en la comercialización de nuevas moléculas químicas y biológicas en el contexto mundial, de modo que se ha pasado de las 217 en los años 1988-1992, a 231 en el período 1993-1997,y a 178 en 1998-2002. Además, la tendencia decreciente se ha acusado más en Europa, mientras que Estados Unidos y Japón han sostenido un aumento en dicha comercialización durante los 3 quinquenios (datos de Script-Eppia, varios años).
En el contexto de la UE las innovaciones plenas tienden a registrarse rápidamente en todos los países, mientras que otros fármacos se difunden en función de las características de los mercados locales. En este sentido, Danzon3 ha resaltado la correlación, aparentemente contradictoria, entre los países con una estricta regulación de precios (por tanto, de nivel medio «aparente» de precios bajos) y un mayor consumo de medicamentos más nuevos y caros (y mercado de genéricos poco desarrollado).
La industria farmacéutica está considerada como una de las más dinámicas en cuanto a innovación. En el ámbito de la UE, en el año 2000, el esfuerzo inversor en I+D se situó próximo al 20% del valor de mercado de su actividad total. Dicho esfuerzo investigador representó una proporción de los gastos de I+D totales de cada país de entre el 2,8% (Irlanda) y el 15,4% (Reino Unido); en España supuso un 6,2%. Sin embargo, hay notables diferencias entre los diversos países, como se pone de manifiesto en la tabla 3. Resulta significativo que los mayores niveles de esfuerzo innovador corresponden a los países que presentan una mejor balanza comercial (Suecia, Dinamarca, Suiza y el Reino Unido), en tanto que los menores niveles de esfuerzo se corresponden con los países claramente deficitarios, como España (a excepción de Irlanda por su industria de genéricos). Además, la menor proporción de I+D en el ámbito farmacéutico está estrechamente relacionada con la menor proporción de I+D total respecto al PIB de los países considerados. Tal hecho se justifica por la razón de que la competencia en la industria farmacéutica se centra en gran medida en la innovación y tiene un carácter global, aun cuando se tengan que sortear las diversas barreras de las regulaciones nacionales.
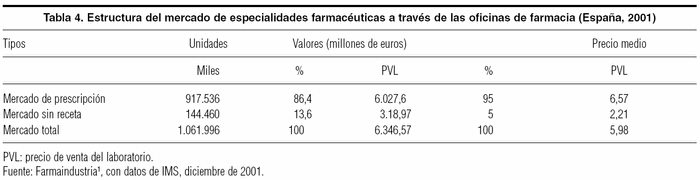
La cantidad consumida de medicamentos en el mercado nacional y en el europeo es muy difícil de obtener con precisión. Se debe tener en cuenta las diferentes clases de medicamentos disponibles: publicitarios (de cuyo consumo no hay un registro centralizado), de prescripción para uso ambulatorio (cuyos datos son más inmediatos de obtener, especialmente de los prescritos con receta oficial), y de prescripción de uso y distribución hospitalarios (para los que tampoco hay un registro de consumo oficial y público). Con estas salvedades, una entidad privada –International Medical Statistics– estima su importe a través de una muestra de oficinas de farmacia, cuyos datos para España en el año 2001 se resumen en la tabla 4. En ella se observa que el número de unidades prescritas fue de 917 millones y que el mercado sin receta supuso unos 144 millones, esto es, un 13,6% de los medicamentos dispensados a través de las oficinas de farmacia. Por grupos terapéuticos destaca el relacionado con el sistema nervioso central, seguido del aparato digestivo y el metabolismo. En todo caso, de los valores totales de la presente tabla estarían ausentes los consumos de medicamentos hospitalarios. Algunas estimaciones, como la efectuada por Costas4 , cifran su cuantía en un10% del presupuesto de la atención especializada, lo cual situaría su importe en torno a los 1.800 millones de euros durante el año 2003.
Los precios
En un mercado, el componente del precio, junto con la cantidad, es determinante del valor de los bienes consumidos. El precio está intervenido en casi todos los países de la UE a excepción de Dinamarca, Alemania y Suecia, donde hay libertad de precios5 . El coste de los medicamentos consta de varios componentes: el precio de venta del laboratorio, el margen del mayorista, el margen de la oficina de farmacia y el IVA. En la tabla 5 se puede observar la composición relativa del precio, en una selección de países europeos para el año 2000. Nótese que los valores presentados son un promedio estimado en los países con márgenes y tipos de IVA variables, y por ello la comparación no es totalmente precisa de forma directa. En España, los precios de los laboratorios, los márgenes de los mayoristas y de las oficinas se sitúan en la zona intermedia del intervalo, y el IVA grava los productos en una proporción menor que en otros países. En cualquier caso, estas proporciones están sujetas a cambios, y sus efectos pueden afectar a las decisiones de prescripción, como ha resaltado Juárez6en relación con los efectos de la aplicación del Real Decreto Ley 5/2000 de 23 de junio sobre la contención del gasto farmacéutico.
Los precios no son similares, al menos considerados en su conjunto, en los diferentes países de la UE. En la tabla 6 se muestran los precios medios ponderados, según el consumo de cada país, de los medicamentos en los principales países de la UE. Las diferencias respecto a los precios medios españoles sonde más del doble, tasas que son difíciles de hallar en productos no perecederos y de alto consumo en los mercados de los países miembros. Como se observa en la tabla, entre los países citados, Francia aparece como el que tiene menores precios, y las diferencias con los Países Bajos y Alemania se acortan al corregir por el poder de compra. En cualquier caso, estos valores hay que tomarlos con cautela por varias razones, tal como han alertado algunos autores6,7 . Entre ellas destaca que la ponderación de los precios por el consumo de cada producto introduce una distorsión para la simple comparación de precios –podría ocurrir, por ejemplo, que siendo los precios de 2 productos exactamente iguales en 2 países, las diferencias en la prescripción condujeran a diferentes precios medios en cada uno de los países–. En este sentido, no hay un acuerdo sobre la fórmula del índice (Paasche o Laspeyres) más adecuada para las comparaciones, ya que cada una de ellas puede enmascarar un criterio político subyacente, tal como señaló Berndt8 .
Valor de la factura farmacéutica
El importe de los fármacos consumidos es difícil de conocer con precisión, debido a las características de dicho consumo (prescripción y dispensación en las oficinas de farmacia, consumo por parte de los pacientes hospitalizados, prescripción y dispensación hospitalaria para los pacientes ambulatorios y los de libre adquisición en las oficinas de farmacia). Además, hay diferentes entidades financiadoras de los productos, lo cual complica más la agregación de las partidas. No obstante, y a fin de establecer alguna comparación, se ha recurrido a la base de datos de la OCDE y Farmaindustria, que ofrecen una buena aproximación al respecto (tabla 7). El consumo en España en el año 2000 ascendió a 10.626 millones de euros, o lo que es equivalente a unos 264 euros per cápita (el mayor fue el de Francia, con 470 euros per cápita). Esta cifra per cápita, en términos absolutos, es la menor junto con el importe de Grecia y del Reino Unido de todos los países de la UE. Cuando se compara ese valor con los de otros países, una vez corregidos por la capacidad adquisitiva, los resultados son diferentes. De esta suerte, observamos que varios países tienen un consumo per cápita inferior al de España (Austria, Dinamarca, Finlandia, Grecia, los Países Bajos, Irlanda, Italia, el Reino Unido y Suecia).
Empleo y concentración del sector
En cuanto a los agentes que intervienen en la cadena de producción y distribución de los productos farmacéuticos, en España y en el año 2000, había 262 laboratorios con actividad productiva (con 10 trabajadores o más) que empleaban a 38.700 personas. Esta cifra de empleo queda alejada de los principales países europeos en cuanto al sector: Alemania (con 115.000 empleados), Francia (95.300), el Reino Unido (65.000) e Italia (72.500). En el mercado mundial la producción se encuentra concentrada en pocas empresas. Las 20 mayores empresas facturan el 60% del mercado mundial, y el 86% figura entre las 50 primeras. La producción de los laboratorios en España fue de casi el 7% de la europea, de nuevo alejada de los países mencionados, donde en alguno de ellos se llega a generar más del 20% (p. ej., Francia y Alemania)1 .
En síntesis, y según la Comisión Europea, el sector farmacéutico europeo constituye por tamaño el quinto sector industrial, y representa la mayor contribución individual a la balanza comercial europea en ámbitos de gran intensidad de alta tecnología, que es asimismo un sector con puestos de trabajo de elevada cualificación. Además, los indicadores muestran que la industria europea continúa siendo un sector económico de gran crecimiento y potencial. Todos los países con una elevada producción farmacéutica en la UE disfrutan de una balanza comercial positiva con Estados Unidos. El año 2001, los países de la UE exportaron cerca de 90.000 millones de euros en fármacos. Las tasas de empleo se mantuvieron relativamente estables en la década de los noventa, tanto en la UE como en Estados Unidos. Europa continúa siendo el lugar en el que los trabajadores del sector son más numerosos, ya que representan más del doble que en Estados Unidos.
La distribución mayorista y minorista
En el ámbito de la distribución, además de las diferencias que ya se han presentado en cuanto a los márgenes con que operan los agentes, tanto los mayoristas como los minoristas, y la variedad de especialidades y presentaciones que manejan, ha de resaltarse que como consecuencia de la variedad de regulaciones y tradiciones en estos países las condiciones de competencia resultan muy diversas.
En el ámbito mayorista la situación española ha resultado bastante estable en los últimos años: unas 100 empresas disponen de unos 200 centros de distribución o almacenes. Su principal característica es el elevado control de estas empresas por parte de los distribuidores minoristas, ya que en torno al 50% de éstas y el 70% de los almacenes son propiedad de titulares de oficinas de farmacia, mayoritariamente a través de cooperativas. La agrupación de los farmacéuticos para su propio suministro ha llevado a una estructura de la distribución minorista que puede calificarse de atomizada. No obstante, esta baja concentración ha de matizarse debido a la existencia de 4 centrales de compras que agrupan un importante número de distribuidores mayoristas, como ha destacado Gascón9 .
El alto número de empresas distribuidoras se reproduce en Europa tan sólo en los países mediterráneos (tabla 8). Esto se observa en particular en Grecia e Italia, y en cuanto a número de almacenes, también en Francia, donde además se ha producido un fuerte proceso de concentración de empresas, coincidente con un fuerte retroceso de las cooperativas10 .
La situación resulta distinta en los países escandinavos y de la Europa central9 . En ellos la presencia de cooperativas es nula o muy pequeña y, por el contrario, los laboratorios farmacéuticos participan o se están introduciendo en el ámbito de la distribución, a excepción de Bélgica. El Reino Unido presenta condiciones algo diferentes, debidas en parte a la regulación sobre las oficinas de farmacia. En este país se da el hecho de que son los distribuidores los que están adquiriendo oficinas de farmacia para asegurar la clientela, exactamente la situación inversa a la que se plan-tea en España, donde además es poco importante la presencia de capital de la industria farmacéutica en la distribución mayorista.
Las instituciones comunitarias, como señalan Albaet al11, no han intervenido en la regulación de los aspectos más significativos de la distribución minorista de los medicamentos, como la libertad de establecimiento, el monopolio farmacéutico o la exclusividad en la venta de fármacos. Por tanto, cada Estado miembro mantiene regulaciones muy diferenciadas que dan lugar a una estructura variable. Sin embargo, se establece un nexo común: la dispensación de medicamentos prescritos por un médico ha de realizarse por un profesional cualificado, un farmacéutico.
En definitiva, además de la diversidad de los productos disponibles en cada uno de los mercados, de las diferentes regulaciones sobre precios y sobre márgenes de las oficinas de farmacia, que se han comentado anteriormente, las distintas normativas llevan a sistemas de atención al público con grandes diferenciasen ciertos aspectos tan relevantes como la accesibilidad (tabla 8). En términos medios, en el ámbito comunitario (con datos del año 2000) hay una oficina de farmacia por cada 6.000 habitantes1, si bien la dispersión es elevada ya que en Dinamarca hay una farmacia por cada 18.500 habitantes, y en Bélgica y España una por cada 2.000. Estas diferencias no se explican de forma directa por el tipo de regulación, pues ha de hacerse notar que tanto Dinamarca como España utilizan criterios de limitación basados en la población, aunque éstos son muy diferentes, lo que da lugar a la presencia de pocas pero grandes oficinas en el caso danés, y a muchas y pequeñas en el caso español. En Bélgica, la tasa de habitantes por oficina de farmacia también es baja, derivada de la libertad de establecimiento.
Caracterización de los países de la Unión Europea según las técnicas de agrupación de datos
En lo expuesto con anterioridad, se ha procedido a desarrollar diferentes análisis univariantes que vinculaban los modelos sanitarios de cada país con diversas variables económicas. Para complementar este análisis se propone llevar a cabo una clasificación de los diferentes patrones sanitarios a partir de una visión conjunta de las variables más relevantes de los países de la UE. La finalidad de este ejercicio radica en que permitiría extraer los potenciales patrones del sector farmacéutico y los países que configuran cada uno de dichos patrones. Si de este modo se detectan numerosos patrones, ello indicaría la coexistencia de diversos planteamientos en el sector analizado y una potencial dificultad de convergencia a corto plazo, si cada uno mantiene su propia identidad. Por el contrario, si los resultados mostraran una baja diversidad y no respondieran a patrones contrarios, estarían sentadas las bases para una convergencia futura.
El desarrollo de este análisis de agrupación de datos (cluster analysis) sigue varias etapas: selección de las variables, elección de la técnica de análisis, selección de la medida de semejanza, algoritmo de clasificación de los individuos a los grupos y validación de la clasificación12 .
La elección más importante en la aplicación de esta técnica consiste en la selección de las variables más significativas que describen el contexto farmacéutico de cada país. A partir de la información disponible, reflejada en las tablas anteriores, se han extraído las variables cuantitativas más características, de modo que no estuviesen correlacionadas entre sí y, por tanto, que fueran complementarias. De esta manera, se han seleccionado las siguientes: cobertura de las exportaciones/importaciones, proporción de I+D sobre ventas, proporción del precio de venta del laboratorio respecto del precio final, gasto farmacéutico per cápita en unidades de paridad de poder adquisitivo, y habitantes por oficina de farmacia.
Dado el reducido número de países (menos de 30), se ha empleado una técnica de análisis jerárquica, para lo cual se ha combinado la distancia cuadrática como medida de semejanza, y el método de Ward como criterio de clasificación de los individuos a los grupos, por ser el criterio más eficiente13-17. Para validar los resultados se ha empleado el análisis de la varianza (ANOVA). Los cálculos se llevaron a cabo mediante el programa SPSS (versión 12.0).
El dendograma representado en la figura 1 muestra el proceso de clasificación y en la tabla 9 se presentan las características propias de los 3 patrones detectados. El grupo 1 está formado por Alemania, Suiza, Portugal, Irlanda, Italia, el Reino Unido, Bélgica, España, Francia y Grecia, caracterizado por tener un mayor gasto per cápita y un menor número de habitantes por farmacia que los restantes grupos. El grupo 2 lo integran Austria, Finlandia, los Países Bajos, Suecia y Noruega, y presentan una menor cobertura de exportaciones/importaciones y una mayor proporción del precio de venta del laboratorio respecto del precio final. Finalmente, Dinamarca, por su peculiar idiosincrasia, constituye per se el grupo 3. En la fase de validación, se ha comprobado que las variables que mejor reflejan las diferencias entre los grupos son –en orden decreciente de importancia por su significación estadística– el número de habitantes por farmacia y el gasto per cápita en unidades de poder adquisitivo. Como se puede observar, para las otras variables de la clasificación (el grado de cobertura y la proporción del precio del laboratorio) no se han detectado diferencias significativas entre los distintos países.
De este modo, parece haber 2 patrones que clasifican o agrupan a los 15 países de la Unión Europea estudiados respecto de las variables elegidas entre las tablas del presente estudio. Así pues, una potencial convergencia de los países hacia una única agrupación sería factible si se acercasen los valores de las variables más características de los países hoy incluidos en una agrupación a los intervalos en los que se sitúan las variables del otro grupo. La pertinencia de tal acercamiento y las políticas para lograrlo escapan al propósito de este ejercicio.
Los resultados obtenidos del análisis han de tomarse con cierta cautela, porque no son significativas todas las diferencias en el análisis de la varianza. Además, la clasificación está en función de la selección de variables que, a su vez, depende de la información disponible, lo cual apuntaría a que alguna magnitud económica omitida caracterizaría mejor los patrones farmacéuticos originales (p. ej., las proporciones de copagos, las políticas de precios de referencia, etc.).
Intervenciones de la administración comunitaria para la consolidación del mercado único
La revisión de las cifras macroeconómicas más relevantes del mercado farmacéutico en la UE perfila un diagnóstico optimista. Sin embargo, los temores frente a la posible pérdida de liderazgo debidas a la inversión en I+D durante los últimos años en Estados Unidos (5 veces superior en el año 2000 a la de la UE) y haber decidido que la industria farmacéutica haya de contribuir de forma notable al objetivo estratégico que la UE se fijó en Lisboa (Consejo Europeo de junio de 2000) de construir «la economía basada en el conocimiento más competitiva y dinámica del mundo, capaz de crecer de manera sostenible con más y mejores empleos y mayor cohesión social» (objetivo ratificado en el Consejo Europeo de Bruselas, el 21 de marzo de 2003), han marcado una toma de postura arriesgada: entre la duplicidad de políticas, industrial y de salud pública, que convergen sobre el mercado de medicamentos, se ha optado claramente por la priorización de la visión industrial del sector.
Así pues, con estas ideas estratégicas en mente, se pasa a analizar el contexto legislativo en materia farmacéutica, reflejo de las políticas de integración europea y elemento imprescindible para el funcionamiento de este mercado, que ha precisado desde antaño numerosas normas para salvaguardar principios constitucionales, como la salud y la equidad de acceso a los cuidados sanitarios. También se considerarán otras cuestiones más relacionadas con la propia seguridad derivada del consumo de medicamentos.
La construcción europea se ha basado en el principio de la subsidiariedad. Dicho principio establece el marco de actuación de los gobiernos de los Estados miembros y el de las autoridades europeas. En función de este principio, aplicado también al sector sanitario y destacado por la Comisión de las Comunidades Europeas en 1998, si no se acuerda lo contrario, las materias objeto de regulación se entiende que son nacionales y, por tanto, las autoridades comunitarias no entrarían en ese ámbito. Es decir, se mantendría la soberanía nacional en la regulación de los mercados.
La creación del mercado único europeo en este sector necesita modificaciones en las normas nacionales e incluso alguna norma europea que amplíe el marco más limitado de las políticas nacionales; tal es el caso de la ley de patentes europea, que afecta también a los medicamentos. Paulatinamente, la UE ha ido introduciendo algunas normas en el escaso margen de maniobra que deja el principio de subsidiariedad, para ir cumpliendo los fines más generales de la propia comunidad, teniendo en cuenta la particularidad de los fármacos como productos, del sector industrial que los produce y de los sistemas sanitarios que intervienen en el proceso de financiación y demanda.
Las normas comunitarias se producen por iniciativa de diferentes instituciones y mediante variados procedimientos legales de aprobación (Comisión Europea, Consejo Europeo [formado por los jefes de Estado], Consejo de la Unión Europea [formado por miembros con rango al menos de ministro, esto es, con capacidad para comprometer a su país en los acuerdos], Parlamento Europeo, Comité Económico Social y Comité de las Regiones, estos últimos 2 órganos con carácter consultivo). Dichas normas pueden ser de diferente categoría: tratados, reglamentos, directivas y decisiones. Unas normas son directamente aplicables en todos los Estados miembros y otras requieren una transposición a las normativas nacionales (para salvaguardar, entre otros, el principio de la subsidiariedad, fundamento del ordenamiento y construcción europeos). Precisamente el objetivo del mercado único ha llevado a plantear el cambio a Reglamentos de algunos de los puntos que como Directivas no acaban de ser transpuestos (por dificultades de diversa índole) a las normativas nacionales, como ha sido el caso de la clasificación de los medicamentos.
Además, las instituciones comunitarias pueden crear grupos de trabajo para materias concretas, cuyos informes acostumbran a marcar el espíritu de las normas posteriores. Como más adelante se mencionará, el «G10, Medicamentos» ha sido uno de ellos.
Entre los logros legislativos encaminados a conseguir el mercado único en materia farmacéutica cabe citarla legislación que desde 1988, y especialmente desde 1992, ha ido conduciendo a una apertura de los mercados nacionales, a simplificar las normas de registro y comercialización de productos, así como al seguimiento de los resultados derivados del consumo (la farmacovigilancia), fundamental para garantizar la seguridad y la mejora de la calidad de los fármacos. En este sentido, en 1993, el Consejo de Ministros de la CE adoptó medidas para establecer el futuro sistema de autorización de comercialización de medicamentos para su uso en humanos y en animales, y creó la Agencia Europea para la Evaluación de Medicamentos. Como consecuencia de ello, desde 1995, las compañías que desearan obtener un rápido acceso al mercado único europeo podían escoger entre 2 procedimientos nuevos, además del ya existente de obtener la autorización nacional y que continuó en vigor: a) el centralizado, que otorga una única autorización para toda la UE, y b) el descentralizado, basado en el reconocimiento mutuo de las autorizaciones de comercialización nacionales, aplicable a un número variable de Estadosmiembros18.
También, como uno de los elementos legislativos más destacables, merece la pena señalar la directiva 2001/83/CE, que establece un código comunitario sobre medicamentos (modificada por la directiva 2003/63/CE, que incorporó elementos de la International Conference of Harmonisation) para la presentación del expediente de solicitud de autorización respecto a la comercialización de un medicamento. Esta directiva ya se encuentra actualmente transpuesta en España mediante la Orden SCO/3461/2003, de 26 de noviembre, por la cual se regula la evaluación, la autorización, el registro y las condiciones de dispensación de especialidades farmacéuticas y otros medicamentos de uso humano fabricados industrialmente. Mediante esta orden se codificaron todas las directivas de medicamentos, agrupadas en un texto único, lo que facilita su compresión. En este sentido, puede concluirse que las normas comunitarias disponibles son un elemento crucial para el funcionamiento del mercado único porque homologan en los Estados miembros 4 de los procesos fundamentales en la comercialización de los productos farmacéuticos.
Recientemente, se ha publicado el Reglamento número 726/2004 (Diario Oficial de la Unión Europea [DOUE], de 30 de abril de 2004), por el que se establecen procedimientos comunitarios para la autorización y el control de los medicamentos de uso humano y veterinario, y se crea la Agencia Europea de Medicamentos. En dicho texto ya no se deja de manera opcional que los laboratorios soliciten la autorización en un registro nacional o en uno centralizado, sino que para ciertos productos como los de alta tecnología, y en particular los derivados de la biotecnología, el procedimiento centralizado es obligatorio. Esta obligatoriedad se hace en aras del alto nivel científico que debe tener una institución encargada de este cometido. Por otra parte, en realidad no se crea ex novo la agencia mencionada, sino que se modifican algunas de las funciones y organización de la ya vigente Agencia Europea de Evaluación de Medicamentos. Esta institución y el nuevo procedimiento son dos elementos de gran importancia en la regulación del sector farmacéutico.
La consecución de un mercado único es un objetivo que no se consigue fácilmente, debido a problemas técnicos y, además, exige renunciar a parcelas de decisión y a intereses nacionales y sectoriales. Algunos de los intereses están especialmente relacionados con la defensa de los aspectos sanitarios frente a los comerciales (más vinculados con el mercado único). Por ello, el propio objetivo en sí mismo queda cuestionado. Así, como reflejo de lo anterior, la evolución del espíritu normativo no ha sido totalmente lineal y ha habido cambios, matices y diferentes pareceres entre las diversas instituciones europeas. No obstante, desde1998 se observa una clara determinación en las autoridades comunitarias por conseguir el mercado único de medicamentos, atendiendo, especialmente, a los intereses de las grandes empresas del sector. Se dice reconocer las particularidades del mercado farmacéutico, pero se explicita la creencia de que no justifican su exención de las normas del mercado único. Valga como ejemplo de ello la propuesta del Consejo Europeo (1 de julio de 2003), acerca de la patente comunitaria y la rápida aplicación por los Estados miembros de la Directiva CE/98/44 de protección jurídica de las intervenciones biotecnológicas.
Se admite que el medicamento no es un artículo de consumo más, pero se considera que debe haber una libre fijación de precios como sucede con cualquier otro producto, cuando menos los que no afectan al gasto público (por adquisición directa o por no precisar receta médica). En este sentido, se ha ido creando un clima propicio para dar facilidades a la reclasificación de los productos sujetos a prescripción y que pasen a ser de libre dispensación o de libre venta, ya que se estima que afectan menos a la salud pública (lo cual no necesariamente es cierto, dado que parece confundirse financiación pública con salud pública). He aquí uno de los elementos de conflicto entre los salubristas y los promotores de conseguir fundamentalmente metas industriales.
Dentro de esta línea de pensamiento, a partir de 2001, y mediante una serie de dictámenes del Comité Económico Social se percibe un intento de matizarla apuesta comunitaria de favorecer los intereses industriales, de manera que se incorporen más argumentos sanitarios, y moderar así los excesos de confianza en la autorregulación del mercado. Como ejemplo ilustrativo puede citarse el Dictamen del Comité Económico y Social, DOUE de 16 de enero de 2001 (2002/C14/24) sobre «El papel de la UE para una política farmacéutica que responda a las necesidades de los ciudadanos: mejorar la asistencia, relanzar la investigación innovadora y controlar la dinámica del gasto sanitario».
Además, el mencionado Comité se preocupa por las tareas que perderán los Estados miembros debido ala inclusión en el proceso centralizado de todos los nuevos principios activos (promovida por la consecución del mercado único), y en un comunicado de 2003, este comité señalaba que «dada su experiencia, las autoridades nacionales en materia de medicamentos deberían mantenerse y seguir siendo operativas », aunque conciertos matices, y manifestaba que sería posible, incluso deseable, que entre las autoridades nacionales hubiese una división de tareas o una especialización.
Igualmente, este Comité Económico y Social observa la creciente tendencia de los Estados miembros a completar la evaluación según criterios de seguridad/eficacia/calidad y propugna, en 2001, la necesidad de una evaluación de la innovación real e identifica como un peligro desincentivador de la I+D que se consigan precios elevados para productos que simplemente son nuevos y no verdaderas aportaciones terapéuticas. Aunque descartando su inclusión como criterio de autorización por los riesgos que detalla, este Comité propone crear instituciones públicas europeas que analicen esos avances o ventajas relativas, que establezcan y actualicen las metodologías, y que el resultado de su evaluación figure entre las informaciones para prescriptores y pacientes. El Comité se suma a la generalizada consideración de la potenciación de la I+D como un factor fundamental. No obstante, además de destacar –por la consecuente crítica de prestigiar y premiar una innovación per se–, reclama una mejor utilización de los fondos públicos para apoyar la I+D, y se centra más en productos innovadores y nuevas tecnologías de investigación para lograr mayor eficacia, refuerza la cooperación entre sector privado y estructuras académicas, recuerda la necesaria contribución de los centros asistenciales (hospitales, pero también de atención primaria) y, sobre todo, crea una mayor sinergia entre las Direcciones Generales de Empresa, Investigación y Sociedad de la Información (art. 7.2, 10.3 del Comité Económico y Social/2001).
Continuando en esta línea de preservar los aspectos sanitarios en la construcción del mercado único, el Comité también recuerda que la protección mediante patentes tiene una doble lectura: premiar al que con su esfuerzo de investigación logra resultados, pero también –y a cambio– pasar al dominio público esos avances para que sirvan a los nuevos progresos. En este sentido, el Comité advierte que no se inicia una verdadera competencia al concluir la patente. Una verdadera competencia en precios a través de un consecuente fomento de los genéricos –lo que supone la activa participación de todos los agentes (prescriptores, dispensadores, aseguradores, pacientes ) para compensarlas naturales estrategias empresariales que permiten a la industria prolongar en el tiempo el efecto de protección– sería un factor básico de estímulo de la verdadera innovación (arts. 10.5 y otros del Comité Eco-nómico y Social/2001). Así pues, el Comité reclama una decidida acción de la UE a favor de los genéricos.
En un mercado tan peculiar como el farmacéutico en el que una gran proporción del consumo no la pagan directamente los pacientes (en algunos países dicha proporción es cercana al 90%) sino los sistemas públicos de aseguramiento sanitario, la consecución del mercado único ha de considerar especialmente las repercusiones de las políticas comunitarias en las finanzas públicas de los Estados miembros. No obstante, la Comisión Europea ha ido considerando en diferentes documentos que el control de precios como principal medio de ajuste del gasto sanitario puede obstaculizarla libre circulación de productos farmacéuticos, amenos que el comercio paralelo ejerza un efecto dinámico. Además, la Comisión es consciente del papel fundamental de los precios en la consecución del mercado único y también de la compleja situación en la que hay tantos intereses nacionales, industriales, presupuestarios y, por supuesto, sanitarios en juego. Así, plantea 3 formas posibles de abordar el problema del imperfecto funcionamiento del mercado único de productos farmacéuticos en lo referente a los precios –todo ello a pesar de que el Tratado de Maastrich (art. 129) y el de Amsterdam (art. 152) plasman la realidad de que las instituciones europeas no tienen competencias para determinar un único precio para los medicamentos y que los gobiernos nacionales todavía mantienen su poder–: a) statu quo, solución que no permitiría garantizar suficientemente la integración de los mercados ni restablecer adecuadamente la competitividad; b) integración total, con la dificultad de fijar un nivel de precios adecuado para toda la comunidad, y c) integración progresiva, una solución intermedia que incorporaría progresivamente mecanismos normales de mercado en segmentos (productos sin prescripción, productos no sujetos a patente y productos objeto de patente) que se prestan suficientemente a la convergencia, cuando puedan ser aplicados sin comprometer el acceso de los pacientes a los medicamentos aun precio accesible, ni la capacidad de los Estados de cumplir sus objetivos de gasto público y de asistencia sanitaria.
Esa integración progresiva podría llevarse a cabo a través de varias medidas –señaladas por la propia Comisión– que, en sí mismas, constituyen una agenda de trabajo para la consolidación del mercado único, a la vez que un reconocimiento explícito de que todavía quedan áreas que dificultan la integración. Entre dichas medidas cabe citar las siguientes: a) relajar el control de precios y desarrollar una competencia efectiva; b) suprimir todos los controles de precios en medicamentos de venta libre (sin receta y, generalmente, no reembolsables) y, en determinadas condiciones, de productos cuya patente haya caducado; c) para los productos protegidos por patente el grado de liberalización variaría según la existencia de alternativas terapéuticas. Pues en los sectores en que los fabricantes tienen una posición de fuerza, la liberalización podría generar aumentos de precios. Así pues, debería intensificarse la competencia efectiva en el mercado; d) sustituir el mecanismo de fijación unilateral de precios por una política contractual; e) control de beneficios, basado también en la negociación; f) eliminación del reembolso público y aumento del copago por el paciente en productos de menor justificación terapéutica; g) los médicos deberían atenerse a las consignas de prescripción y no recetar medicamentos más caros para la misma indicación; h) fijar precios de referencia, límites de reembolso por categorías terapéuticas; i) fomento del uso y de la competencia de los productos genéricos; j) participación de los médicos prescriptores en el control del gasto, y presupuestos de prescripción junto con campañas de información sobre costes comparativos; k) aceleración del acceso al mercado (para el año 2000 se preveía una revisión del sistema de autorización para genéricos), y l) aumento de la transparencia del mercado.
También el Parlamento Europeo, en su Resolución A4-0205/1999, concluía que es vital completar el mercado interno de medicamentos y que los ciudadanos europeos tengan asegurado el acceso a la innovación. Incluso señalaba que para los medicamentos bajo patente, los precios deberían reflejar los criterios clínicos y de coste/efectividad.
Por otra parte, la propia Comisión Europea, como resultado de la reunión del Consejo Europeo de Lisboa, en 2000, en el que se indicaba que «la industria farmacéutica desempeña un papel decisivo tanto en el sector industrial como en el de la salud y puede contribuir de manera importante a alcanzar el objetivo estratégico, fijado en el Consejo Europeo, de que la UE se convierta en la economía más competitiva y dinámica del mundo », creó un Grupo de alto nivel para la innovación y el suministro de medicamentos, el «G-10, Medicamentos» ya mencionado. Dicho Grupo entregó al presidente Romano Prodi, el 5 de mayo de 2002, un amplio texto con múltiples recomendaciones y acciones. A partir de dicho texto, la Comisión Europea elaboró un documento (COM [2003] 383, de 1 de julio) que remitió al Consejo de la Unión Europea, al Parlamento, al Comité Económico y Social y al Comité de las Regiones. En dicho texto se plasman las líneas generales de la política farmacéutica conducente a la aceleración de los procesos para lograr el mercado único, insistiendo en las vías de información a los agentes sanitarios y pacientes sobre el valor terapéutico añadido de los nuevos fármacos, en la eficacia relativa (no sólo comparada con un placebo sino con otro fármaco ya disponible), la rentabilidad de los medicamentos, acometer sistemáticamente la evaluación de las tecnologías sanitarias, garantizar la aplicación del principio de transparencia para la fijación de los precios de los fármacos, y aplicar la Directiva 2001/20/CE de Principios de Buenas Prácticas Clínicas, entre otros aspectos.
En definitiva, el marco institucional actual facilita la consolidación del mercado único de fármacos y sienta las bases para potenciar las acciones de la industria europea de carácter más competitivo e innovador.
La financiación pública de medicamentos
Tras esta revisión del contexto institucional del mercado de medicamentos en la UE, cabe decir que la dirección está clara, que el ritmo de acercamiento se ha acelerado recientemente y que las cuestiones de financiación pública de los fármacos en los Estados miembros van a ser, en los próximos años, los elementos determinantes de la consolidación de dicho mercado, al condicionar las características de la demanda. A fin de profundizar en estas materias, se revisa a continuación uno de los instrumentos fundamentales para la adopción de las decisiones públicas que comprometen ingresos y gastos: los presupuestos de medicamentos.
El gasto sanitario público, como proporción del PIB, en España y para el año 1999 según la OCDE19, fue del 5,3%, valor que es seguido dentro de la UE por Grecia (4,7%), Portugal e Irlanda (5,1%), y alejado de los 2 primeros países, Alemania (7,8%) y Francia (7,3%).En términos per cápita, se mantiene la ordenación, y España (con 716 euros) es uno de los 3 países de la UE con menor valor destinado a la atención sanitaria. No obstante, cuando se considera el gasto farmacéutico público, España (con el 1,25% del PIB) junto con Portugal (1,30%) se encuentran a la cabeza de una ordenación cuyos valores centrales para los países de la UE se sitúan entre el 0,7 y el 1%. En cualquier caso, vale la pena mencionar que en términos per cápita, en España dicho gasto farmacéutico público fue de 192 euros, cercano a los 210 euros de promedio en los países de la UE.
Los presupuestos sanitarios públicos han crecido en España de una forma continua durante las últimas décadas, con una tasa de crecimiento del 6-8% superiora la del PIB. Frecuentemente, se ha justificado tal aumento desde una perspectiva tributaria por motivos de convergencia con los valores presupuestados en los países de la UE. A pesar de lo cual, en términos per cápita significó 716 euros en 1999, mientras que la media comunitaria fue de 1.600 euros. Aunque se han producido aumentos presupuestarios para la sanidad, el gasto sanitario público como una proporción del gasto sanitario total ha sido más bien estable (en torno al 78%); aun así, en algunos años, como en 1997, éste descendió. Conforme con los datos de la OMS20 para Europa, medidos en dólares corregidos por paridad de poder adquisitivo, el gasto sanitario medio fue de 1.771 dólares para la UE, mientras que en España esa magnitud fue de 1.183 y en Portugal de 1.148. En el extremo superior, Alemania alcanzó un valor de 2.364 dólares per cápita. Si la clasificación del gasto sanitario público se establece según la proporción del gasto farmacéutico respecto al primero, en España ésta supone el 22%, una de las proporciones mayores en el contexto comunitario, debido a varios factores, como el menor gasto en remuneraciones al personal sanitario (componente fundamental del gasto total) y la menor proporción de la atención hospitalaria en el gasto total, que podría haber sido sustituida por el empleo mayor de los fármacos en los procesos terapéuticos.
Los presupuestos sanitarios públicos se pueden analizar atendiendo a diferentes elementos: la técnica empleada para su elaboración (p. ej., la del incrementalismo, consistente en aumentar el importe corriente de un año en una determinada proporción para calcular el importe del siguiente); la consideración del criterio de la eficiencia del gasto público en su confección, es decir, si precisa una información acerca de la relación coste/efectividad de las intervenciones financiadas con fondos públicos; su potencial empleo como instrumentos de incentivación/desincentivación de los comportamientos de los agentes sanitarios y pacientes; su contribución para una gestión descentralizada territorialmente del gasto público sanitario, o para una gestión integral/compartimentada de la atención sanitaria (p. ej., en los ámbitos de atención primaria, especializada, prestación farmacéutica, etc.).
La aplicación de estos conceptos se ha revisado en los 6 países de la UE que cuentan con una población mayor. Como puede apreciarse en la tabla 10, la actividad financiera de las administraciones públicas, reflejada en los presupuestos, tiene algunos elementos comunes, como el empleo generalizado de los copagos –que actúan como medidas sobre la demanda y que repercuten en los gastos públicos–, y la existencia de presupuestos separados para las prestaciones farmacéuticas en todos los países excepto en el Reino Unido. No obstante, en dicho país, no se miden los efectos sobre la salud de los pacientes en un contexto de ausencia de compartimentación de los presupuestos, lo cual constituiría un paso más en el estudio de la eficiencia del gasto público, como ha manifestado Mc-Guire21. Precisamente, esta compartimentación presupuestaria, en lo que respecta a las prescripciones de fármacos mediante receta ordinaria, es un elemento de gran importancia a la hora de abordar una política sanitaria integral, en la que los factores sanitarios puedan combinarse de la forma más eficiente, independientemente de los ámbitos asistenciales donde se trate a los pacientes.
Respecto de los otros conceptos, los precios de referencia se aplican en Alemania, España, los Países Bajos e Italia, aunque de diferentes formas, y también constituyen un elemento de política presupuestaria. Además, los presupuestos farmacéuticos no incorporan en su elaboración criterios de eficiencia, como podría ser el caso del instrumento original del Planning Programming Budget System (PPBS) estadounidense. Sien algunos países se consideran las medidas de la eficiencia de los fármacos, como en el Reino Unido, tales informaciones no se llegan a plasmar en la elaboración de los presupuestos o en su ejecución, al menos de una forma sistemática. Los presupuestos de cada año se elaboran atendiendo al criterio del incrementalismo o a un refinamiento consistente en vincular su crecimiento con alguna variable, como la renta nacional o la proporción del gasto sanitario respecto del PIB.
Los presupuestos sanitarios y de farmacia son instrumentos para promover cambios en las prácticas asistenciales. Así, se emplean en Alemania, España, Italia y el Reino Unido de manera que los salarios de los médicos son modificados (al alza o a la baja) en función del cumplimiento de ciertos objetivos relacionados con la prescripción de fármacos. No obstante, en España la proporción del incentivo percibido por los médicos es baja respecto al salario anual bruto (un 2% aproximadamente), por lo que no tiene una gran capacidad de alterar las conductas de prescripción. Esos mismos países disponen de una descentralización del presupuesto para acercar la gestión sanitaria a los pacientes en cada área geográfica. En cualquier caso, los criterios para llevar a cabo tal descentralización no son iguales en cada país, ni dentro de cada uno, como ocurre en España, donde coexisten varios regímenes de financiación autonómica, y donde en algunas comunidades autónomas los presupuestos anuales dependen del grado de cumplimiento de los objetivos financieros y sanitarios en el año precedente, mientras que en otras se aplica de forma casi sistemática la técnica del incrementalismo presupuestario.
Como se ha podido observar, las cuestiones de presupuestación/financiación pública desempeñan un papel esencial en la evolución del mercado único de fármacos, ya que determinan u orientan la función de producción conjunta de los diferentes factores sanitarios para lograr la prestación de los servicios a los pacientes y, por otra parte, reflejan la política social y sanitaria de cada gobierno. Además, las políticas de presupuestación se suelen acompañar de otras medidas de carácter coercitivo o no coercitivo que las comunidades autónomas han desarrollado recientemente, ofreciendo a los médicos listas de fármacos con una comparación de las eficacias, los precios de las dosis unitarias, las características de seguridad, etc.22.
En el mercado de prescripción, los precios varían en los distintos países en función de diversos elementos (la regulación administrativa y la capacidad de pago, entre otros) pero, fundamentalmente, el pago por el consumo de los fármacos es público en más de un 80%. A pesar de que parece haber una convergencia en torno a dicha proporción, según las partidas presupuestarias revisadas, todavía puede afirmarse que hay muchas diferencias entre los países miembros de la UE en las cuestiones de financiación pública o reembolso de los fármacos. El acercamiento de las posiciones nacionales en estas materias donde las diferentes políticas sociales y sanitarias han tenido un amplio margen de maniobra en el pasado, ciertamente va a ser un elemento determinante en la construcción del mercado único durante los próximos años.
Conclusiones
Como ha podido observarse, un mercado es un conjunto de instrumentos que han de funcionar acompasadamente para que la solución generada en términos de precios y cantidades sea la deseada para todas las partes, o al menos logre un equilibrio estable que facilite la adopción de decisiones empresariales, de los agentes sanitarios y de los ciudadanos. En el caso de los medicamentos, y habida cuenta de sus características especiales, expuestas en la primera parte del artículo, las intervenciones públicas de los Estados miembros han regulado numerosos aspectos. Sin embargo, la construcción europea requiere unos compromisos entre los Estados miembros para que cedan ala propia UE algunas de sus competencias en aras de facilitar el desarrollo de nuevos productos, garantizar su seguridad, asegurar su disponibilidad en todos los países y, en definitiva, de facilitar estos medios para promover la salud y curar las enfermedades. Se ha constatado la falta de una política europea clara, con unos plazos concretos, hasta fechas muy recientes, y cuando se han establecido las directrices de la política se ha constatado también la dificultad de armonizar los intereses sanitarios con los industriales. Cada país todavía aplica sus políticas de carácter proteccionista en algunos aspectos.
El análisis de agrupamiento de datos ha permitido establecer 2 grupos de países a partir de la selección de ciertas variables cuantitativas. La integración de otras variables, junto con el análisis de esta clasificación facilitaría el diseño de una eventual política de convergencia europea en este mercado.
No hemos mencionado los efectos en el mercado farmacéutico de la incorporación de los 10 nuevos países a la UE el 1 de mayo de 2004. Los datos estadísticos referentes a los precios, los consumos y la distribución, entre otros, detallados en el primer apartado de este texto, no han podido encontrarse para dichos países. Únicamente la OCDE dispone de alguna publicación acerca del gasto agregado sanitario. De igual modo, los aspectos legislativos y de la financiación/presupuestación públicas tampoco son fácilmente accesibles. En este estado de información poco puede decirse acerca de los efectos de su incorporación, salvo que la ampliación ofrecerá nuevas oportunidades terapéuticas a los pacientes y comerciales a las empresas, siempre y cuando los precios y la financiación pública lo permitan.
No hay de momento una necesidad imperiosa de que los precios sean idénticos en todos los países, como no lo son tampoco en otros productos industriales, incluso en el mismo país. Sin embargo, el marco legal que contribuye a facilitar el funcionamiento del mercado ha de ser necesariamente más común para todos los países, que sea capaz de compaginar las cuestiones industriales y sanitarias tanto comunitarias como de los Estados miembros. En ello nos va el desarrollo de este sector industrial y la accesibilidad a estos productos de gran importancia para la salud y la calidad de vida, entre otros asuntos.
El objetivo del «mercado único de medicamentos», en este momento y a la vista del contexto normativo, puede tener sentido para la parte más puntera de la fracción productiva del sector farmacéutico europeo: la gran industria con expectativas de liderazgo en I+D yen el mercado mundial. Para el resto del sector productivo farmacéutico, incluidas las pequeñas y medianas empresas, pero también para una parte de las grandes empresas, esa prioridad es muy discutible y quizá debería completarse el diseño de la política industrial para el grupo selecto, que tiene obviamente sus necesidades, con una política industrial más coherente con la estructura real del sector productivo europeo. Algo más allá de rebajar las tasas de la Agencia Europea de Medicamentos, de facilitar los costes de traducciones de la documentación clínica para los registros o de suavizar las decisiones estratégicas que afectan al sector, recordando que siempre habrá unos mercados secundarios (de medicamentos huérfanos, genéricos ) que permitirán la subsistencia de esa otra industria de clase inferior.
En cuanto a la política farmacéutica en su conjunto, es también asumible que deberá arriesgarse en algunos aspectos si se pretenden alcanzar los «ambiciosos y difíciles objetivos económicos, sociales y de salud pública» (como de forma reiterada describe la Comisión), pero condicionarla absolutamente a una política industrial concebida para las exigencias de una mino ría selecta de empresas puede resultar muy arriesgado. El mercado único farmacéutico puede ser una estrategia peligrosa si se convierte en dogma general y más si se determinan plazos fijos y breves. En todo caso, con el logro de avances en materia de información, de garantías (y transparencia) en el proceso de evaluación y autorización de la nueva Agencia Europeas de Medicamentos, de clara identificación de la innovación y avance terapéutico reales, etc., es posible ir modificando y armonizando el sector farmacéutico.
Por el momento, aunque se han conseguido muchos avances en materias legales comunitarias (ya mencionados en el segundo apartado de este texto), el propio concepto de medicamento no acaba de quedar bien definido, y la razonable iniciativa de aplicar en primera instancia el principio de cautela en el caso de los productos frontera (con alimentación-dietética, etc.) no parece que quiera asumirse claramente. De esta suerte, en los distintos Estados miembros el «mercado farmacéutico» abarca cosas distintas. Partiendo de la variabilidad biológica y de la individualidad del proceso patológico, siguiendo por las influencias culturales que conllevan que en ciertos grupos sociales o áreas geográficas se admitan o se rechacen determinadas formas farmacéuticas (los supositorios, jarabes, comprimidos vaginales, óvulos, etc., tienen distinto grado de aceptación) o se tienda al consumo de grupos terapéuticos que no parecen correlacionarse con la morbilidad (tranquilizantes, vitaminas, aparato respiratorio ), y acabando con los hábitos de prescripción o modelos asistenciales que los distintos sistemas de protección desarrollados por cada Estado miembro han inducido, tanto en la población como en su personal sanitario, la implantación inflexible de un mercado único de medicamentos puede resultar traumática.
Para las autoridades sanitarias de los Estados miembros la tendencia iniciada es, asimismo, un riesgo considerable, con una progresiva marginación de su capacidad de intervención, por incomprensión de que su papel va más allá de la garantía de una oferta de recursos farmacológicos de alto nivel, de que los problemas de financiación pública de los medicamentos tienen sentido dentro de sus obligaciones para asegurar una asistencia sanitaria integral y que los medicamentos que no se financian públicamente o que se eliminen de esa cobertura siguen afectando a la salud pública Todo ello, unido a la previsible salida del sector de esas industrias farmacéuticas de la supuesta segunda categoría que predominan en ciertos países, como España, puede dar lugar a medio plazo a una desculturización farmacéutica y total dependencia exterior en ese ámbito.
Agradecimientos
Agradezco al profesor Agustín Ruiz sus comentarios a la primera versión del texto.
Bibliografía
1. La industria farmacéutica en cifras. Madrid: Farmaindustria, 2002 (consultada el 31/03/2004). Disponible en www.farmaindustria.es [ Links ]
2. Cuesta MT, Martínez de la Gándara M. Nuevos principios activos: revisión 1999. Información Terapéutica del Sistema Nacional de Salud. 2000;24:9-27. [ Links ]
3. Danzon PM. Pharmaceutical price regulation. National policies versus global interests. Washington DC: AEI Press;1997. [ Links ]
4. Costas E. El gasto farmacéutico público y el acuerdo de la Subcomisión: una nota. Papeles de Economía Española.1998;76:141-7. [ Links ]
5. Mossialos E. Pharmaceutical pricing, financing and cost containment in the European Union Member States. En: Leidle R, editor. Health care and its financing in the Single European Market. Amsterdam: IOS Press; 1998. p. 85-113. [ Links ]
6. Juárez C, Portillo F, Antoñanzas F. Financiación de las oficinas de farmacia. Farmacia Profesional. 2000:14;13-8. [ Links ]
7. Danzon PM, Chao LW. Cross-national price differences forpharmaceuticals: how large, and why? J Health Econ.2000;19:159-95. [ Links ]
8. Berndt ER. International comparisons of pharmaceutical prices: what do we know, and what does it mean? J Health Econ.2000;19:283-7. [ Links ]
9. Gascón F. Estructura de la industria de distribución farmacéutica en España y su eficiencia. X Congreso Nacional de Acede. Oviedo: 2000. [ Links ]
10. Granda E. Distribución farmacéutica: etapa final. Farmacia Profesional. 1997;11:7-12. [ Links ]
11. Alba S, Ardila R, Gutiérrez MV. La ordenación farmacéutica en la Unión Europea y sus Estados miembros. Noticias de la Unión Europea. 1998;165:59-75. [ Links ]
12. Johnson SC. Hierarchical clustering schemes. Psychometrica. 1967;32:241-54. [ Links ]
13. Kuiper FK, Fisher L. A Monte Carlo comparison of six clustering procedures. Biometrics. 1975;31:777-83. [ Links ]
14. Blashfield RK. Mixed models tests of clusters analysis: accuracy of four agglomerative hierarchical methods. PsycholBull. 1976;83:377-88. [ Links ]
15. Punj GN, Stewart DW. Cluster analysisi in marketing research: review and suggestions for application. J Mark Res.1983;20:134-48. [ Links ]
16. Milligan G. An examination of the effect of six types of error perturbation of fifteen clustering algorithms. Psychometrika.1980;45:325-42. [ Links ]
17. Milligan G. Ultrametric hierarchical clustering algorithms. Psychometrika. 1979;44:343-6. [ Links ]
18. Fraguas L. La libre circulación de medicamentos. Noticias de la Unión Europea. 2000;184:57-64. [ Links ]
19. OCDE (citado 14 Ene 2004). Disponible en: http://www.oecd.org [ Links ]
20. The WHO Health report 2000: Health systems, improving performance. Geneva: WHO; 2000. [ Links ]
21. McGuire A. UK budgetary systems and new health care technologies. Value Health. 2003;6 Suppl 1:64-73. [ Links ]
22. Cabiedes L, Ortún V. Incentivos a prescriptores. En: Puig J, editores. Análisis económico de la financiación pública de medicamentos. Barcelona: Masson; 2002. p. 143-60. [ Links ]
23. Garrison L, Towse A, Drummond M, Jönsson B, editores. Moving beyond the drug silo mentality in Europe. Value Health.2003;6 Suppl 1:1-77. [ Links ]