Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Gaceta Sanitaria
versión impresa ISSN 0213-9111
Gac Sanit vol.19 no.5 Barcelona sep./oct. 2005
DEBATE
Los inhibidores selectivos de la recaptación de serotonina
en la depresión infantil: un «culebrón» que refleja
importantes problemas de seguridad de los medicamentos
Salvador Peiróa / Pedro Cerveraa,b / Enrique Bernal-Delgadoa,c
aFundación Instituto de Investigación en Servicios de Salud, València, España;
bServicio de Farmacia de Atención Primaria del Área 12, Conselleria de Sanitat,
Generalitat Valenciana, Denia, Alacant, España; cInstituto Aragonés de Ciencias de la Salud,
Zaragoza, Red de Centros de Investigación en Epidemiología y Salud Pública (RCESP), España
| (Selective serotonin reuptake inhibitors in childhood depression: a soap opera that reflects serious problems of drug safety) |
Correspondencia: Salvador Peiró.
Fundación Instituto de Investigación en Servicios de Salud.
San Vicente, 112, 3.o. 46007 Valencia. España.
Correo electrónico: speiro@comv.es
Recibido: 26 de agosto de 2004.
Aceptado: 8 de marzo de 2005.
La polémica con los inhibidores selectivos de la recaptación de serotonina
El debate en torno a la seguridad de los inhibidores selectivos de la recaptación de serotonina (ISRS) es antiguo. Ya en 1991, la Food and Drugs Administration (FDA) celebró una controvertida reunión pública de su comité consultivo que no halló suficiente evidencia para establecer una asociación causal entre ISRS y suicidio. Desde entonces la polémica ha ido creciendo y trascendiendo el marco del debate científico para acabar en los tribunales o en los medios de comunicación. Sirva de ejemplo la condena en Estados Unidos a GlaxoSmithKline (GSK), fabricante de paroxetina, a indemnizar con 6,4 millones de dólares a los familiares de un paciente que asesinó a 3 miembros de su familia y se suicidó, a los pocos días del inicio del tratamiento con paroxetina, o el anciano absuelto del estrangulamiento de su mujer en Australia por estar bajo los efectos de la sertralina1. En televisión destaca el dramático reportaje emitido por la BBC británica titulado «Los secretos de Seroxat», en el que pacientes y familias relataban crudamente sus vivencias con paroxetina2. Emitido en 2002 y seguido por millones de personas, este programa tuvo un importante impacto mediático, con miles de llamadas y de correos electrónicos en los que otros pacientes relataban sus problemas con este fármaco, incluidos 13 suicidios y numerosos casos de síndrome de abstinencia grave (síndrome de «interrupción del tratamiento», según la hipérbole utilizada para aligerar semánticamente el cuadro) tras la cesación del tratamiento3. La BBC emitió, a partir de estas historias, un segundo programa en 2003 que incluía entrevistas a familiares de niños que se suicidaron mientras estaban en tratamiento con algún ISRS4.
Entre los escándalos políticos hay que citar la disolución por el Ministerio de Sanidad británico (apremiado por la prensa y los abogados de 4.000 demandantes contra los fabricantes de ISRS) del panel del Committee on Safety of Medicines de la Medicines and Healthcare Products Regulatory Agency (MHRA) que revisaba la seguridad de los ISRS, debido a las vinculaciones financieras de algunos de sus miembros con GSK5, o la ocultación al Comité de Expertos de la FDA, por la Dirección de este organismo, de un informe de sus propios técnicos que cuestionaba la seguridad de los ISRS en niños y adolescentes6.
Entre los menos ruidosos escándalos científicos cabe destacar la publicación de un trabajo de miembros de la Medical Products Agency de Suecia, que contrastaba los ensayos clínicos de ISRS presentados a esa Agencia con los publicados en revistas científicas, y demostraba un importante sesgo de publicación7, la constatación de que algunos ensayos clínicos con resultados negativos para paroxetina fueron publicados como favorables al fármaco8,9, y el metaanálisis publicado por miembros de la MHRA que comparaba los ensayos clínicos de ISRS publicados con los no publicados, y cuyos resultados confirmaban los riesgos de los ISRS (excepto fluoxetina) en niños y adolescentes y un importante sesgo de publicación10 que había dejado desinformada (o «contrainformada») a la comunidad científica y sanitaria, y a los pacientes en riesgo de efectos adversos potencialmente graves.
Los ISRS en la depresión mayor en niños y adolescentes
Los ISRS, con excepción de la fluoxetina en Estados Unidos, no han sido nunca autorizados por ninguna Agencia de medicamentos para su uso en niños o adolescentes en la indicación de depresión mayor, aunque la fluoxetina haya mostrado un perfil favorable en el metaanálisis que algunos miembros de la MHRA10 realizaron y alguno pueda estar autorizado en algunos países para el tratamiento del síndrome obsesivo-compulsivo. En junio de 2003, y en medio de la crisis mediática, legal y científica que se ha descrito en el apartado anterior, la MHRA hizo pública una alerta señalando que la paroxetina no debía utilizarse en menores de 18 años. No sólo no era eficaz en el tratamiento de la depresión en niños y adolescentes sino que, respecto a placebo, aumentaba entre 1,5 y 3,2 veces el riesgo de autolesiones y comportamiento potencialmente suicida (alerta accesible en: http://medicines.mhra.gov.uk/ ourwork/monitorsafequalmed/safetymessages/seroxat18.pdf). Esta decisión abría una nueva rama de la polémica de los ISRS, centrada en su uso en la infancia y adolescencia, cuya cronología se recoge en la tabla 1.
La alerta de la MHRA británica fue seguida casi inmediatamente, aun con diferente intensidad en la prohibición, por Estados Unidos, Canadá y diversos países de Europa, como Francia, Italia o Irlanda, pero no por la Agencia Europea de Medicamentos (EMEA) ni por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), que no tomaron posición en este momento. En diciembre de 2003, la MHRA extendía esta prohibición a todos los ISRS excepto la fluoxetina. Al tiempo, se iniciaba una gran polémica en la que se acusaba a GSK de haber ocultado los ensayos clínicos con resultados desfavorables a paroxetina y tergiversado la importancia de sus efectos adversos; esta polémica creció de tono al ver la luz un documento interno de GSK que sugería la no publicación de los ensayos pediátricos con paroxetina para no perjudicar las ventas en adultos9. Por estas fechas (a finales de abril de 2004, casi un año después de la alerta británica y cuando la prensa europea debate los resultados del metaanálisis publicado en The Lancet10), la EMEA publica su alerta sobre ISRS en niños y adolescentes. Poco después, el fiscal de Nueva York anunciaba el procesamiento de GSK por «persistente y repetido fraude» en la información de los resultados de los ensayos clínicos11 y, en tan sólo unos días, la multinacional británica publicaba en su página web todos los ensayos «ocultos». Mientras, los editoriales de las principales revistas médicas clamaban por el registro obligatorio y el acceso público a los ensayos clínicos.
A finales de junio de 2004, un año después que la Agencia británica y 2 meses después de la alerta de la EMEA, la AEMPS publicaba su alerta sobre ISRS. El texto de su nota (accesible en: www.agemed.es/documentos/notasPrensa/csmh/2004/cont_serotonina.htm) comenzaba curiosamente por «Recientemente [sic] se ha tenido conocimiento de casos de ideación suicida en niños y adolescentes con depresión tratados con paroxetina...». En realidad, en España, las polémicas sobre los ISRS parecen haber pasado de puntillas por la prensa general, la especializada, las revistas científicas y las administraciones sanitarias. De hecho, y salvo algún comentario de agencia en la prensa general o periódicos sanitarios, no hemos identificado ningún debate sobre el tema en el período desde la publicación de la alerta británica hasta la publicación de la alerta española (salvo una nota en la prensa especializada en la que algunos psiquiatras comentaban la polémica desde posiciones favorables al uso de ISRS en la depresión infantil12). Tampoco hemos podido detectar ninguna información a los médicos durante este período por parte de los fabricantes de ISRS (pese a que sí ofrecieron esta información en el Reino Unido, Canadá y Estados Unidos), ni de los Departamentos de Sanidad de los gobiernos autónomos.
Una aproximación al consumo pediátrico de ISRS en el Sistema Nacional de Salud
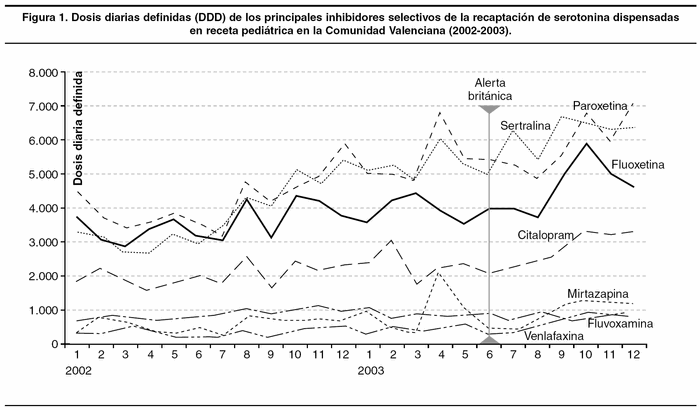
Una posible explicación a la ausencia de polémica en España podría ser que no hubiera ningún motivo para ello. Como declaraba un portavoz de GSK a un periódico general, «En España (...) no existe esa prescripción para niños de manera que (...) el problema no afecta a nuestro país»13. Para aproximar con algún dato la situación de los ISRS en el Sistema Nacional de Salud (SNS) hemos obtenido del sistema de informatizado de facturación de recetas todas las prescripciones de ISRS, en recetas extendidas por pediatras, durante los años 2002 y 2003 en la Comunidad Valenciana, y homogeneizado las diferentes presentaciones mediante su transformación en dosis diarias definidas (DDD), aproximadamente la dosis para tratar a un adulto, un día, en la principal indicación del fármaco. Dado que no existen DDD infantiles, se ha asumido, conservadoramente, que la dosis media en los menores de 18 años sería, como promedio, un 75% de la dosis en los adultos. En la figura 1 se muestra la evolución temporal de las DDD dispensadas en receta extendida por pediatras de los principales fármacos de este grupo. El consumo de ISRS prescritos por pediatras fue de 18.180 DDD en junio de 2003, lo que supondría que en esas fechas se dispensaban, en la Comunidad Valenciana, suficientes ISRS para tratar a 757 niños o adolescentes. Los ISRS más prescritos fueron paroxetina y sertralina (este último tenía autorizada la indicación pediátrica en el síndrome obsesivo-compulsivo). Sorprendentemente, estas cifras aumentaron tras la alerta británica hasta alcanzar las 24.587 DDD en diciembre de 2003, dosis suficiente para tratar a 1.024 niños.
Aunque estas cifras deben valorarse con mucha precaución, ya que la realidad es que no se dispone de datos de consumo de ISRS en niños (parte de las recetas podrían haber sido extendidas para adultos durante la atención continuada, y parte de las recetas a niños -sobre todo los mayores de 14 años- pueden haber sido extendidas por médicos generales y, por tanto, no contabilizadas), su extrapolación al conjunto del Sistema Nacional de Salud (también con todas las precauciones) implicaría que unos 10.000 niños en España estaban siendo tratados con estos fármacos a finales de 2003, cifra que sería muy similar a la señalada para el Reino Unido14, aunque muy por debajo de las estimaciones de millones de niños y adolescentes tratados en Estados Unidos9. En conjunto, éste es un problema suficientemente importante que no puede ser pasado por alto por las administraciones sanitarias, los fabricantes de estos productos y la propia comunidad sanitaria.
La confusión, los intereses comerciales y la burocracia como riesgos potenciales para los pacientes
La administración de ISRS en adultos, pese a las polémicas, no ha podido ser asociada con claridad a un incremento de suicidios15. De hecho, en los estudios poblacionales, longitudinales y transversales, las tasas de suicidio -en prácticamente cualquier grupo de edad- parecen descender conforme se incrementa la prescripción de antidepresivos, incluidos los ISRS16-20. Pero la políticas de difusión parcial y sesgada de los ensayos clínicos, el manejo abusivo de sus datos y análisis (tipos de pacientes seleccionados, definiciones operativas que clasifican los comportamientos de autoagresión como «labilidad emocional», análisis que excluyen los abandonos por efectos adversos, etc.)8 y lo que puede deducirse de los resultados de los ensayos disponibles en población pediátrica10 convierten en razonables las alertas sobre su uso en menores de edad (y probablemente se debería ser cuidadoso en sus indicaciones en adultos, vigilando estrictamente los comportamientos de los pacientes y evitando su empleo en casos leves, donde los beneficios esperados podrían ser menores). Por otro lado, no puede olvidarse que al menos una parte de las críticas a los ISRS proviene de círculos relacionados con los demandantes de indemnizaciones, que también tienen un claro conflicto de intereses, y que algunas medidas adoptadas por gobiernos o fiscalías parecen obedecer, al menos en oportunidad y formas, a intereses políticos. En resumen, los ISRS se acompañan de demasiado ruido, demasiados intereses y demasiada confusión (en buena parte, generada por sus fabricantes) para poder ver con claridad el interés primario: sus beneficios y riesgos para los pacientes jóvenes con depresión mayor.
En el caso de España, lo más sorprendente es que ninguno de los agentes implicados ha desempeñado el papel que pacientes y ciudadanos esperarían de ellos. Así, la AEMPS parece confiar en que la seguridad de los medicamentos deriva de los contenidos de la ficha técnica (no del uso real del medicamento) y consideró innecesario -a diferencia de las agencias de medicamentos de otros países- alertar a los médicos de las nuevas informaciones sobre seguridad de los ISRS hasta que se pronunció la EMEA. Formalmente, y ya que nunca aprobó la indicación pediátrica, no tenía por qué informar; pero este respeto a la formalidad burocrática olvidaba la seguridad de los miles de niños y adolescentes sujetos a tratamientos con estos fármacos. Las direcciones generales de farmacia de las comunidades autónomas también podían haber difundido las nuevas informaciones sobre seguridad. Y podían haber realizado análisis tan sencillos como los mostrados en la figura 1, e incluso podían haber informado directamente a los pediatras prescriptores de ISRS. Pero no lo hicieron.
Los fabricantes de ISRS, probablemente para no dañar la imagen de sus respectivos fármacos en adultos, también evitaron dar información a pediatras y psiquiatras sobre los riesgos de los ISRS en niños y adolescentes. Formalmente, y dado que en España no estaba autorizada la indicación en menores, no tenían por qué hablar del tema (aunque en otros países, también sin indicación pediátrica autorizada, sí lo hicieron). También olvidaron a los pacientes en tratamiento. Obviamente, algunos psiquiatras (y pediatras, aun con todos los problemas de la prescripción derivada) han estado prescribiendo ISRS a expensas de las indicaciones autorizadas y con los riesgos descritos. Tienen la excusa de que la AEMPS, las Direcciones Generales de Farmacia y los fabricantes no les informaron expresamente de la falta de eficacia y de seguridad de los ISRS. Pero también tienen la obligación de estar informados en beneficio de sus pacientes, especialmente cuando se prescribe un medicamento al margen de sus indicaciones autorizadas.
El resultado final de las actuaciones (o no) de todos los agentes implicados, cumpliendo sus obligaciones formales, acabó en el descuido de su objetivo principal, la seguridad de los pacientes, que, en buena medida, pasa por informar a los médicos (y por mantenerse informados).
Implicaciones del debate sobre los ISRS
El problema con los ISRS en la población pediátrica, más allá del caso particular (que tiene una importancia crucial), muestra que la combinación de intereses comerciales, investigación y publicación de resultados puede acabar por ser un problema. Lo más obvio es que este tipo de situaciones debería evitarse en origen. Y la forma de evitarlas es garantizar la aplicación estricta de los principios éticos de la investigación clínica, crear registros obligatorios de ensayos clínicos y difundir siempre sus resultados. La información útil para decidir si un medicamento es beneficioso o perjudicial para los pacientes no puede ser secuestrada por intereses comerciales, por legítimos que sean, y la no difusión de un ensayo clínico es una estafa intolerable a los individuos que voluntariamente corrieron riesgos al participar en él para que futuros pacientes se beneficiaran de nuevos conocimientos. Aunque se trate de un problema transnacional, la AEMPS y el propio Ministerio de Sanidad deberían desempeñar un papel activo en este terreno, porque mejorar la transparencia, ética y la calidad de la investigación clínica en cualquier país es una forma de beneficiar a los pacientes españoles.
Respecto a la situación en el SNS, el caso de los ISRS muestra que no sólo tenemos un problema de gasto farmacéutico, sino también de calidad y seguridad de la prescripción; todo esto hace visibles las debilidades de nuestras instituciones para enfrentar los problemas de seguridad de los medicamentos, y orienta la necesidad de cambios importantes. No sería oportuno entrar aquí en los detal les, pero sí señalar los ejes necesarios para estos cambios:
1. Centrar el sistema en los pacientes, antes que en las instituciones, los profesionales, la industria o los propios medicamentos. Esto implica que los indicadores, los análisis, los sistemas de información para la gestión y las actuaciones operativas deben tener como prioridad la efectividad y la seguridad de los tratamientos en los diferentes grupos de población.
2. Ayudar a los médicos a prescribir mejor y más prudentemente. Esto implica mejorar la formación y la información, pero también la utilización de las nuevas tecnologías de la información para ofrecer ayuda (alertas, interacciones, efectos adversos, retroinformación sobre la propia práctica, etc.) en el momento mismo de la prescripción. En este terreno, la necesidad de un plan de inversiones en infraestructuras de información sanitaria, al estilo de los realizados para las autopistas o los ferrocarriles, no es demorable.
3. Dar mucha más información a los pacientes -y en un lenguaje que puedan entender- de las indicaciones, las contraindicaciones y los efectos adversos de los tratamientos. Se hace difícil pensar que el problema con los ISRS en pediatría existiera si los padres hubieran visto en el prospecto un recuadro del tipo cajetilla de tabaco que dijera «este medicamento no está autorizado en niños y adolescentes, no mejora la depresión en este grupo de edad e incrementa el riesgo de comportamientos potencialmente suicidas».
4. Desarrollar mecanismos, fundamentalmente de transparencia, para que la industria farmacéutica prime la eficacia y la seguridad de los pacientes sobre sus -perfectamente legítimos- intereses económicos.
De una u otra forma, a las organizaciones sanitarias hay que valorarlas por diagnosticar y tratar adecuadamente a sus pacientes, por obtener los mejores resultados para éstos y por evitarles riesgos innecesarios. Esto implica que las organizaciones sanitarias deben construir un conjunto de normas, incentivos y desincentivos, cultura y comportamientos para conseguir estos objetivos. Si el ejemplo de los ISRS expresa la estructura actual del Sistema Nacional de Salud respecto a la prescripción, la necesidad de cambios es patente y, probablemente, urgente.
Postscriptum
Durante el período de evaluación y edición de este trabajo en Gaceta Sanitaria ha seguido la polémica con los ISRS. En agosto de 2004, el Fiscal de Nueva York llegó a un acuerdo con GSK (el pago de 2,5 millones de dólares y el compromiso de mantener la política de hacer públicos los resultados de los ensayos clínicos) y retiró la demanda que había interpuesto. GSK, por su parte, ha realizado varias declaraciones explicando que no ocultó información de los ensayos y que su comportamiento en este tema ha sido siempre acorde a la legislación y las normas éticas. La revisión de casos encargada por la FDA a la Universidad de Columbia confirmó el incremento de riesgo de suicidio en la revisión de estudios pediátricos. En septiembre de 2004, un panel de expertos convocado por la FDA urgía a que los prospectos de diversos ISRS incluyeran un «recuadro negro» con advertencias sobre el riesgo de comportamientos suicidas. La FDA incorporó esta recomendación, pero en marzo de 2005 suavizó -no sin polémica, por el papel de los fabricantes en el cambio- el texto de esta advertencia. Un comité de la Agencia Europea de Evaluación de Medicamentos, reunido en diciembre de 2004, corroboraba las alertas realizadas y, pocos días después, la AEMPS española reforzaba su alerta previa insistiendo en que «los ISRS no están autorizados para el tratamiento de la depresión o de los trastornos de angustia en niños y adolescentes y, en general, no deben ser utilizados en estos grupos de edad por su riesgo de comportamiento suicida». También advertía de la necesidad de un estrecho seguimiento en los «casos excepcionales» en que se establezca este tratamiento. También han aparecido en este período algunos trabajos científicos con resultados dispares, así como editoriales y comentarios a favor y en contra del uso de ISRS en niños.
En resumen, se mantiene el ruido de un proceso -demasiado largo y demasiado embarullado- que ha dejado tocada la reputación de agencias de medicamentos, fabricantes y muchos médicos, aunque las agencias de medicamentos se han posicionado con rotundidad por una utilización extremadamente restrictiva de estos fármacos en la población pediátrica (abril de 2005).
Bibliografía
1. Rosack J. SSRIs Called on carpet over violence claims. Psychiatr News. 2001;36:6. [ Links ] 2. Cowen PJ. Panorama: «the secrets of Seroxat». BMJ. 2002; 325:910. [ Links ] 3. Medawar C, Herxheimer A, Bell A, Jofre S. Paroxetine, panorama and user reporting of ADRs: consumer intelligence matters in clinical practice and post-marketing drug surveillance. Int J Risk Safety Med. 2002;15:161-9. [ Links ] 4. Watts G. Is this journalism that makes a difference? BMJ. 2003; 326:1093. [ Links ] 5. Bachtold D. Conflict-of-interest allegations derail inquiry into antidepressant's «dark side». Science. 2003;300:33. [ Links ] 6. Lenzer J. Secret US report surfaces on antidepressants in children. BMJ. 2004;329:307. [ Links ] 7. Melander H, Ahlqvist-Rastad J, Meijer G, Beermann B. Evidence b(i)ased medicine: selective reporting from studies sponsored by pharmaceutical industry: review of studies in new drug applications. BMJ. 2003;326:1171-5. [ Links ] 8. Jureidini JN, Doecke CJ, Mansfield PR, Haby MM, Menkes DB, Tonkin AL. Efficacy and safety of antidepressants for children and adolescents. BMJ. 2004;328:879-83. [ Links ] 9. Kondro W, Sibbad B. Drug company experts advised staff to withhold data about SSRI use in children. Can Med Assoc J. 2004;170:283. [ Links ] 10. Whittington CJ, Kendall T, Fonagy P, Cottrell D, Cotgrove A, Boddington E. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet. 2004;363:1341-5. [ Links ] 11. Dyer O. GlaxoSmithKline faces US lawsuit over concealment of trial results. BMJ. 2004;328:1395. [ Links ] 12. Los psiquiatras creemos que los ISRS son eficaces en niños. El Correo Farmacéutico, 12 de abril de 2004. [ Links ] 13. Reino Unido recomienda que no se venda un antidepresivo a menores. El mundo, 10 de junio de 2003. [ Links ] 14. Waechter F. Paroxetine must not be given to patients under 18. BMJ. 2003;326:1282. [ Links ] 15. Khan A, Khan S, Kolts R, Brown WA. Suicide rates in clinical trials of SSRIs, other antidepressants, and placebo: analysis of FDA reports. Am J Psychiatry. 2003;160:790-2. [ Links ] 16. McClure GM. Suicide in children and adolescents in England and Wales 1970-1998. Br J Psychiatry. 2001;178: 469-74. [ Links ] 17. Olfson M, Shaffer D, Marcus SC, Greenberg T. Relationship between antidepressant medication treatment and suicide in adolescents. Arch Gen Psychiatry. 2003;60:978-82. [ Links ] 18. Hall WD, Mant A, Mitchell PB, Rendle VA, Hickie IB, McManus P. Association between antidepressant prescribing and suicide in Australia, 1991-2000: trend analysis. BMJ. 2003;326: 1008. [ Links ] 19. Helgason T, Tomasson H, Zoega T. Antidepressants and public health in Iceland. Time series analysis of national data. Br J Psychiatry. 2004;184:157-62. [ Links ] 20. Jick H, Kaye JA, Jick SS. Antidepressants and the risk of suicidal behaviors. JAMA. 2004; 292:338-43. [ Links ]