Introducción
La Red de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud (RedETS), englobada por la Agencia de Evaluación de Tecnologías Sanitarias de Andalucía (AETSA), la Agéncia de Qualitat i Avaluació Sanitáries de Catalunya (AQUAS), la Agencia de Evaluación de Tecnologías Sanitarias de Galicia (AVALIAt), el Instituto Aragonés de Ciencias de la Salud (IACS), la Agencia de Evaluación de Tecnologías Sanitarias del Instituto de Salud Carlos III (ISCIII), el Servicio de Evaluación de Tecnologías Sanitarias del País Vasco (OSTEBA), el Servicio de Evaluación del Servicio Canario de la Salud (SESCS) y la Unidad de Evaluación de Tecnologías Sanitarias de Madrid (UETSM), fue creada por el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) en 2012 y regulada por la Orden SSI/1833/2013, de 2 de octubre, por la que se crea y regula el Consejo de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud1. Estas entidades compartían actividades desde 2006, cuando la Secretaría General del Ministerio de Sanidad impulsó, al amparo del Plan de Calidad del SNS, una colaboración coordinada y se creó la AUnETS, una plataforma electrónica de conocimiento compartido. El objetivo general de RedETS es fundamentar la toma de decisiones sobre la incorporación, la desinversión y las condiciones de uso apropiado de tecnologías sanitarias, promoviendo la equidad y la sostenibilidad del SNS. Esto se realiza mediante la síntesis de información científica rigurosa y de calidad en informes de evaluación de tecnologías sanitarias (ETS), guías de práctica clínica y otros productos basados en la evidencia. Entre las tecnologías sanitarias evaluadas se contemplan, entre otras, productos sanitarios, técnicas quirúrgicas y procedimientos diagnósticos o cribados (en ocasiones referenciados como «otras tecnologías»). Actualmente, fruto del trabajo en red, se comparten numerosos documentos publicados en la web de RedETS: 88 guías de práctica clínica, 513 informes de ETS y 53 desarrollos metodológicos2 (hay informes en la web anteriores a 2006). Además, entre otros servicios, la red da soporte científico a la toma de decisiones de inclusión, exclusión o modificación de las condiciones de uso de una técnica en la cartera común de servicios del SNS.
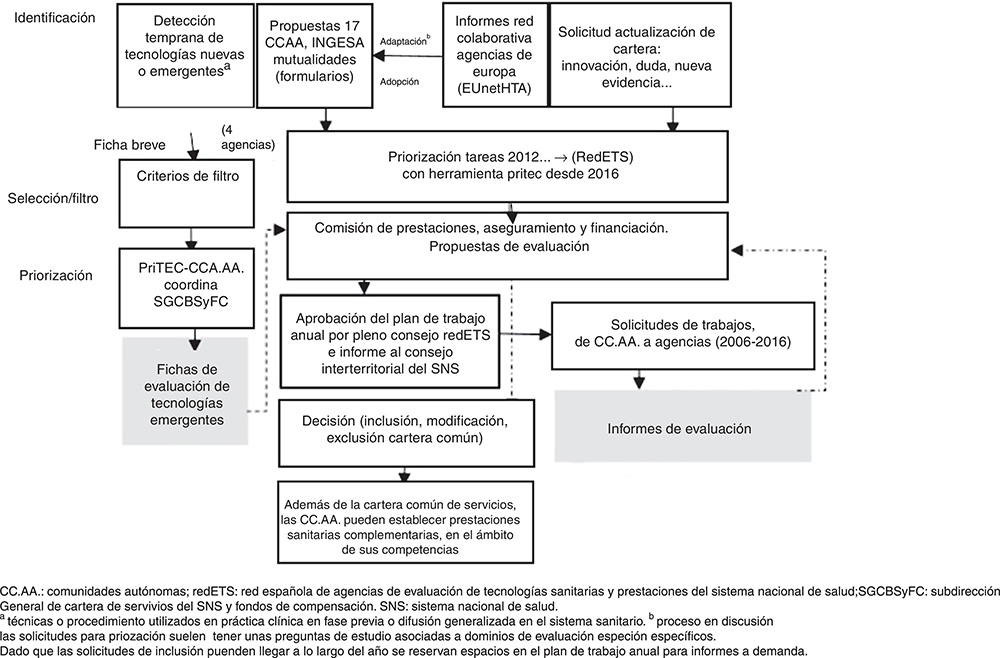
En el Real Decreto 1030/2006, de 15 de septiembre, se establece la cartera común de servicios del SNS y el procedimiento para su actualización3. Si tomamos el año 2006 como referencia de inicio, los informes de evaluación solicitados para el ámbito nacional estaban amparados en el Plan de Calidad para el SNS. A partir de 2012, la Comisión de Prestaciones, Aseguramiento y Financiación (CPAF) pasa a ser el agente coordinador de demandas de evaluación nacionales. Así, se han definido planes de trabajo centralizados y priorizados con una herramienta diseñada ad hoc para la priorización en evaluación de tecnologías (PriTEC)4. Las demandas de evaluación provienen de tres fuentes principales:
Solicitudes enviadas mediante un formulario estandarizado por parte de los servicios regionales de salud (cada comunidad autónoma las determina o establece la forma en que los profesionales sanitarios pueden enviar propuestas).
Solicitudes de actualización procedentes de las comunidades autónomas o a instancias de terceros.
Informes generados anualmente por una red colaborativa europea para la ETS (EUnetHTA)5, para su adaptación o adopción.
Una vez priorizados los encargos, se asignan a las agencias según presupuesto y experiencia. La CPAF se reúne periódicamente y toma decisiones, como elevar al CISNS propuestas de actualización de la cartera, considerando los informes solicitados y otros criterios de valoración, y garantizando la eficiencia y la equidad. En paralelo, se identifican tecnologías nuevas y emergentes, y se priorizan temas para elaborar con metodología propia las fichas de evaluación correspondientes6 (Fig. 1).
En la ETS, la pregunta de estudio y los datos disponibles determinan los dominios que deben o pueden ser evaluados. Los dominios que normalmente se evalúan son la eficacia, la efectividad, la seguridad, los aspectos organizativos, los aspectos éticos y el coste-efectividad. En ocasiones, los encargos incluyen explícitamente una evaluación económica. La importancia del contenido económico en los informes ha ido aumentando con el tiempo, e incluye no solo evaluaciones económicas completas, sino también análisis de costes, impacto presupuestario y revisiones sistemáticas de evaluaciones económicas7. Resulta pertinente observar y valorar el recorrido histórico de la actividad de RedETS en cuanto a evaluaciones económicas, centrándonos en dos aspectos: calidad e impacto.
El desarrollo de la calidad en los informes de ETS se enmarca en una estandarización metodológica. Así, si se aplicase habitualmente la lista de verificación de López-Bastida et al.8 para analizar la calidad de la evaluación económica en los informes sería lógico aplicarla también en los nuestros. Sobre su impacto, se ha ido recogiendo suficiente experiencia para un análisis autocrítico retrospectivo que permita mejorar las evaluaciones y comunicar la relevancia del trabajo conjunto. A pesar de no tener carácter vinculante, los informes de RedETS son considerados en las inclusiones, modificaciones o exclusiones de una tecnología sanitaria en la cartera común de servicios del SNS. Es habitual que las propuestas de la CPAF al CISNS sobre tecnologías sanitarias deriven en cambios de la cartera con órdenes que modifican los Anexos del RD 1030/2006, de 15 de septiembre. Sin embargo, no se ha estudiado hasta el momento el impacto en términos generales de los informes de ETS y la concordancia entre sus resultados explícitos, incluyendo las evaluaciones económicas completas y la decisión de inclusión o exclusión de las tecnologías sanitarias en el SNS. Por ello, es necesario reforzar el valor de la calidad de las evaluaciones, que no son meros informes, y señalar y explicar las relaciones entre los resultados de los informes y su inclusión o no en el SNS.
El objetivo de este trabajo fue evaluar la calidad de las evaluaciones económicas completas realizadas en RedETS sobre productos sanitarios9 entre 2006 y 2016, y analizar la relación de los resultados (y de las recomendaciones) de los análisis de coste-utilidad con su situación en la cartera común de servicios del SNS.
Método
Se seleccionaron las evaluaciones económicas completas publicadas entre 2006 y 2016 disponibles en la base de datos de informes de la página web de RedETS2. Para este proceso se utilizó un trabajo de identificación previo de evaluación económica realizado en 2016 por el SESCS10. De ese total se excluyeron los informes que no correspondían a productos sanitarios, excepto los de tecnologías de la información y la comunicación (como la telemonitorización), dado que tienen un abordaje de evaluación similar. Una vez seleccionados, se extrajo la siguiente información: agencia autora de la publicación, tipo de evaluación (coste-efectividad, coste-utilidad o ambos) y año de publicación.
Posteriormente, mediante la lista de verificación formal de calidad de documentos de evaluación económica de la guía de elaboración y adaptación de informes de RedETS11 (basada a su vez en el listado de López-Bastida et al.8), se valoró su calidad analizando el cumplimiento o no de cada uno de los 25 ítems (agrupados en 17 dominios) del listado (Tabla 1). Un técnico de evaluación de AQuAS, en colaboración con otro técnico de la misma agencia, lideró la identificación de los productos evaluados (y de los comparadores) y el análisis crítico.
Tabla 1. Dominios e ítems resumidos de la lista de verificación del instrumento para la evaluación de la calidad de los análisis económicos en evaluaciones de tecnologías sanitarias
| Dominio | Criterio |
|---|---|
| 1. Pregunta de estudio | 1. Establecimiento claro del objetivo y de la pregunta de investigación |
| 2. Presentación de resultados de efectividad y costes por subgrupos | |
| 2. Perspectiva | 3. Inclusión de la perspectiva social |
| 4. Presentación diferenciada de la perspectiva del financiador y social | |
| 3. Comparador | 5. La práctica clínica habitual es al menos una parte comparada |
| 6. La elección del comparador se justifica | |
| 4. Tipo de evaluación | 7. El tipo de análisis en relación con la cuestión está justificado |
| 5. Datos de eficacia/efectividad | 8. Fuentes de eficacia y efectividad detalladas con precisión |
| 9. Diseño y métodos detallados con precisión | |
| 6. Medidas de resultado | 10. Medidas de resultado seleccionadas clínicamente relevantes |
| 11. Escalas de calidad de vida relacionada con la salud validadas | |
| 7. Uso y costes de los recursos | 12. Los costes se ajustan a la perspectiva |
| 13. Las unidades físicas y los datos de costes se separan y detallan | |
| 8. Horizonte temporal | 14. El horizonte temporal capta todos los efectos diferenciales de la tecnología |
| 9. Modelización | 15. Las técnicas de modelaje, parámetros y supuestos se justifican y son transparentes |
| 10. Tasa de descuento | 16. La tasa de descuento se emplea para costes y resultados adecuadamente |
| 11. Variabilidad e incertidumbre | 17. Inclusión de análisis de sensibilidad |
| 18. Los parámetros y la distribución del análisis de sensibilidad se justifican | |
| 12. Equidad | 19. Los argumentos de justicia social se presentan de forma desagregada y transparente |
| 13. Transferibilidad | 20. El informe permite extraer conclusiones sobre transferibilidad o extrapolación a otros contextos |
| 14. Presentación de resultados | 21. Presentación de los elementos de costes y de los resultados del análisis incremental desagregada |
| 15. Limitaciones | 22. Presentación de limitaciones crítica y transparente |
| 16. Conclusiones | 23. Las conclusiones responden a la pregunta de investigación y se desprenden de los resultados |
| 17. Conflicto de interés | 24. Fuente de financiación, encargo o apoyo se indica |
| 25. Conflicto de intereses se informa |
Por último, se valoró el impacto de los informes analizando la relación de coincidencia o no entre los resultados de cada análisis de coste-utilidad (se excluyen los análisis de coste-efectividad) y la condición de inclusión o no en la cartera común de servicios del SNS de acuerdo con lo publicado en el Boletín Oficial del Estado12. Este proceso de extracción y valoración crítica del resultado de la evaluación económica en euros por año de vida ajustado por calidad (AVAC) fue liderado por un técnico de evaluación de AQuAS. La extracción de datos se realizó con una hoja de cálculo como plantilla única con columnas correspondientes a ítems de la lista de verificación antes referenciada. La plantilla permitió que las agencias autoras de los informes evaluados aportaran características de los trabajos y que pudiera valorarse conjuntamente la adecuación a los ítems. El análisis se completó compartiendo los resultados con técnicos de la Dirección General de la Cartera Básica de Servicios del SNS del Ministerio de Sanidad, Consumo y Bienestar Social. Las decisiones sobre la cartera común de servicios del SNS se analizaron cuando la decisión tomada difería de la que se hubiese tomado en caso de existir un umbral de coste-utilidad oficialmente reconocido y este fuese el extremo superior del rango identificado por Vallejo-Torres et al.13, de 20.000-25.000 € por AVAC. Los productos sanitarios cubiertos por la cartera común de servicios del SNS con un resultado de coste-utilidad por debajo del extremo superior de este rango no se consideró que diferían.
Resultados
La página web de RedETS2 incluía en el citado trabajo preliminar del SESCS 439 informes, de los cuales 174 abordaban aspectos económicos y 72 realizaban evaluaciones económicas completas. De estos 72 informes se seleccionaron 26 correspondientes a productos sanitarios, y quedaron 45 clasificados principalmente como cribados, procesos quirúrgicos e intervenciones preventivas. Considerando que uno era una actualización, se analizaron finalmente 25 evaluaciones económicas completas. La Tabla 2 muestra las principales características de estas 25 evaluaciones económicas completas. Son cuatro las agencias que realizaron dichas evaluaciones económicas y más del 60% de los trabajos contenían análisis de coste-utilidad, con una distribución bastante homogénea en el tiempo. Los análisis de coste-utilidad seleccionados fueron 15.
Tabla 2. Descripción de las 25 evaluaciones económicas completas de productos sanitarios de RedETS (2006-2016)
| Variable descriptora | Descripción |
|---|---|
| Agencia autora | OSTEBA (4 evaluaciones), UETS-Madrid (6), AETSA (7), SESCS (8) |
| Tipo de evaluación | Coste-efectividad (10 evaluaciones), coste-utilidad (12), coste-efectividad y coste-utilidad (3) |
| Año de publicación | 2008 (6 evaluaciones), 2009 (1), 2010 (2), 2011 (3), 2012 (3), 2013 (7), 2014 (1), 2015 (2) |
La Tabla 3 resume los resultados del análisis considerando los dominios de la lista de verificación de calidad de RedETS. El análisis mostró que los 15 análisis de coste-utilidad seleccionados cumplieron al menos 17 de los 25 ítems de verificación, y que 12 cumplieron 19 ítems. La Tabla 4 muestra el número de ítems cumplidos en los análisis de coste-utilidad y la relación entre los resultados y la decisión de inclusión en la cartera común de servicios del SNS. Los ítems que con más frecuencia no se cumplieron fueron el análisis por subgrupos (11/15), los juicios explícitos sobre equidad (15/15), el análisis de transferibilidad (12/15) y la inclusión de la perspectiva social (15/15).
Tabla 3. Valoración de los ítems de la lista de verificación del instrumento para la evaluación de la calidad de los 15 estudios de coste-utilidad de productos sanitarios publicados por RedETS
| Dominio | Criterio | Evaluaciones que cumplen con el ítem | Comentarios de interés sobre el proceso de evaluación | |
|---|---|---|---|---|
| N | % | |||
| 1. Pregunta de estudio | Criterio 1 | 15 | 100 | |
| Criterio 2 | 4 | 27 | Debería valorarse si siempre la interpretación es negativa, dado que en ocasiones puede ser innecesario diferenciar escenarios | |
| 2. Perspectiva | Criterio 3 | 0 | 0 | Todos los estudios consideraron la perspectiva de costes directos sanitarios del Sistema Nacional de Salud salvo dos (para una comunidad autónoma). Un estudio, entre los 26 de la publicación, consideró la perspectiva social |
| Criterio 4 | 0 | 0 | ||
| 3. Comparador | Criterio 5 | 14 | 93 | Cuatro diferentes formas de justificar:-De referencia-Práctica habitual / común / clásica actual (más habitual)-Opción recientemente ingresada-Todas las alternativas comercializadas fueron consideradas-No justificar explícitamente un comparador no tiene por qué significar que no corresponda a la práctica clínica habitual |
| Criterio 6 | 12 | 80 | ||
| 4. Tipo de evaluación | Criterio 7 | 15 | 100 | |
| 5. Datos de eficacia/efectividad | Criterio 8 | 15 | 100 | |
| Criterio 9 | 15 | 100 | ||
| 6. Medidas de resultado | Criterio 10 | 15 | 100 | |
| Criterio 11 | 15 | 100 | ||
| 7. Uso y costes de los recursos | Criterio 12 | 15 | 100 | |
| Criterio 13 | 15 | 100 | ||
| 8. Horizonte temporal | Criterio 14 | 15 | 100 | |
| 9. Modelización | Criterio 15 | 15 | 100 | |
| 10. Tasa de descuento | Criterio 16 | 15 | 93 | Un estudio con un horizonte temporal de 1,5 años no usó tasa de descuento (discutible) |
| 11. Variabilidad e incertidumbre | Criterio 17 | 15 | 100 | |
| Criterio 18 | 8 | 53 | Las principales variables incluidas fueron precios/costes, prevalencia y descuento. En ocasiones, no justificar las distribuciones en los análisis de sensibilidad probabilísticos no significa que sean inapropiadas | |
| 12. Equidad | Criterio 19 | 0 | 0 | |
| 13. Transferibilidad | Criterio 20 | 3 | 20 | Métodos encontrados utilizados para valorar la transferibilidad:-European Network of Health Economics Evaluation Database-Lista de verificación de RedETS-Adaptación de la red europea de agencias de evaluación de tecnologías sanitarias (EUnetHTA) |
| 14. Presentación de resultados | Criterio 21 | 15 | 100 | |
| 15. Limitaciones | Criterio 22 | 12 | 80 | El análisis de limitaciones se incluyó en todas las evaluaciones, pero no siempre como una sección o parte clara, explícita y separada de la discusión del informe |
| 16. Conclusiones | Criterio 23 | 15 | 100 | |
| 17. Conflicto de intereses | Criterio 24 | 15 | 100 | |
| Criterio 25 | 11 | 73 | ||
Tabla 4. Resultados de 15 evaluaciones con 19 ratios de coste-utilidad, ítems cumplidos y decisión de inclusión en la cartera
| Tecnología (agencia de la RedETS; año de publicación) | Comparación | €/AVAC en el caso base (orden) | Ítems cumplidos | Decisión en cartera básica | |
|---|---|---|---|---|---|
| Sistemas de monitorización continua de glucosa intersticial en tiempo real para la diabetes (SESCS; 2015) | Automedición de la glucemia | Sistemas de monitorización continua de glucosa intersticial en tiempo real | DM1: 2.554.723 DM2: 305.823 | 21 | No inclusión en cartera por no ser coste-efectivos (acuerdo de la CPAF de 2016) |
| Telemonitorización en pacientes con insuficiencia cardiaca y enfermedad pulmonar obstructiva crónica (OSTEBA; 2012) | Intervención múltiple de asistencia individualizada | Intervención múltiple de asistencia individualizada + telemonitorización | 115.561 | 17 | No inclusión |
| Recambio valvular aórtico mediante prótesis valvular percutánea frente al tratamiento quirúrgico habitual (OSTEBA; 2014) | Tratamiento quirúrgico habitual | TAVI | 119.575 | 19 | Inclusión con evaluación de comité multidisciplinario y protocolo de selección según Orden SSI/1356/2015a |
| Terapia de resincronización cardiaca (UETS-M; 2010) | Terapia farmacológica óptima (1) | TRC+TFO (2) vs.TRC-D+TFO (3) | (1) vs. (2): 28.612(1) vs. (3): 37.591 | 19 | Inclusión (disponible según Orden SSI/1356/2015). No debería incluirse DAI con TRCa |
| Terapia electroconvulsiva en el tratamiento de la depresión (SESCS; 2013) | TEC como primera línea | EMTR como 1.ª línea+TEC si no se responde a EMTR | 47.523 | 20 | No inclusión de EMTR. La TEC viene incluida en el Anexo III sección 7 del Real Decreto 1030/2006 |
| Desfibrilador automático implantable en prevención primaria (SESCS; 2011) | Tratamiento médico convencional + desfibrilador automático implantable | Tratamiento médico convencional | 38.371 (cardiopatía no isquémica) | 19 | Inclusión sin diferenciar entre isquémica tipo MADIT (que sí sería coste-efectiva) y no isquémica (disponible según Orden SSI/1356/2015)a |
| Desfibrilador automáticos implantable en prevención secundaria (SESCS; 2011) | Amiodarona | Desfibrilador automático implantable | 20.554b(estudio AVID) | 20 | Inclusión de acuerdo con un estudio AVID (disponible según Orden SSI/1356/2015) |
| Implantación percutánea de prótesis valvulares aórticas en pacientes con estenosis aórtica (UETS-M; 2011) | Tratamiento farmacológico | Prótesis | 27.279 | 18 | Inclusión con evaluación de comité multidisciplinario y protocolo de selección según Orden SSI/1356/2015a |
| Colocación aislada de stent frente a stent con angioplastia por balón y protección vascular en la arteriosclerosis carotídea (SESCS; 2010) | Angioplastia con balón | Colocación aislada de stent | 1633 | 19 | Inclusión (disponible según Orden SSI/1356/2015) |
| Stents coronarios que se utilizan en los pacientes con síndrome coronario agudo (UETS-M; 2013) | Stents liberadores de cuatro tipos diferentes defármacos | Cuatro tipos diferentes de fármacos liberados por stents EES: referencia | PES: dominado SES: dominado ZES: 75.448 | 19 | Inclusión (disponible según Orden SSI/1356/2015) |
| Stents recubiertos de fármacos en indicaciones de riesgo (UETS-M; 2008) | Stentsmetálicos | Stentrecubierto | Dominante (es decir, el recubierto es más barato y más eficaz) | 19 | Inclusión (disponible según Orden SSI/1356/2015) |
| Stents recubiertos de fármacos en indicaciones de riesgo (SESCS; 2012) | Stents metálicos | Stent recubierto | Dominante | 19 | Inclusión (disponible según Orden SSI/1356/2015) |
| Stents recubiertos de fármacos en cardiopatía isquémica (UETS-M; 2008 act.2013) | Stents metálicos | Stent recubierto | Dominante | 19 | Inclusión (disponible según Orden SSI/1356/2015) |
| Telemonitorización en pacientes domiciliarios con insuficiencia cardiaca o broncopatía cardiaca desde atención primaria (OSTEBA; 2013) | Procedimiento habitual | Telemonitorización en pacientes domiciliarios con insuficiencia cardiaca o broncopatía cardiaca desde atención primaria | Dominante | 18 | Inclusión (el software está incluido; el estudio, no) |
| Mutaciones en el gen APC para la realización de colectomías profilácticas en individuos en riesgo de cáncer colorrectal (AETSA; 2008) | No aplicar análisis de mutaciones en el gen APC | Aplicar | Dominante | 18 | Inclusiónc |
AETSA: Agencia de Evaluación de Tecnologías Sanitarias de Andalucía; APC: adenomatous polyposis coli; AVAC: años de vida ajustados por calidad; AVID: antiarrhythmics versus implantable defibrillators;CIDS:Canadian Implantable Defibrillator Study;DM1: diabetesmellitustipo 1; EES:everolimus eluting stent;EMTR: estimulación magnética transcraneana; FISH: hibridaciónin situfluorescente; IHC: inmunohistoquímica realizada sobre tejido; HER2: receptor-2 del factor de crecimiento epidérmico humano; MADIT:multicenter automatic defibrillator implantation;OSTEBA: Servicio de Evaluación de Tecnologías Sanitarias del País Vasco: PES:paclitaxel eluting stent;SESCS: Servicio de Evaluación y Planificación del Servicio Canario de la Salud; SES:sirolimus eluting stent;TAVI: recambio valvular aórtico mediante prótesis valvular percutánea; TEC: terapia electroconvulsiva; TFO: terapia farmacológica óptima; TRC: terapia de resincronización cardiaca; TRC-D: terapia de resincronización cardiaca más desfibrilador; UETS-M: Unidad de Evaluación de Tecnologías Sanitarias de Madrid; ZES:zotarolimus eluting stent.
aCaso en que no encaja la decisión o no de inclusión de la cartera común básica del Sistema Nacional de Salud de acuerdo con el umbral de 25.000 €/AVAC.
bNo se contabiliza la ratio que salió del ensayo CIDS porque no es excluyente de AVID y la toma de decisiones se consideró que se basaba en tener un escenario razonable coste-útil.
cEn 2013 solo no estaba disponible en Baleares, según la Tabla 3 de un informe del Mapa de análisis genéticos que se realizan en España en el SNS realizado por AETSA.
Tabla 5. Relación entre las ratios de coste-efectividad incremental analizadas y la inclusión o la exclusión en la cartera
| Inclusión en la cartera | No inclusión en la cartera | Total | |
|---|---|---|---|
| RCEI<25.000 €/AVAC | 9 | 0 | 9 |
| RCEI ≥25.000 €/AVAC | 6a | 4 | 10 |
| Total | 15 | 4 | 19 |
AVAC: año de vida ajustado por calidad; RCEI: ratio de coste-efectividad incremental.
aTerapia de resincronización cardiaca con o sin desfibrilador automático implantable (dos ratios) y desfibrilador automático implantable en prevención primaria están siendo reevaluados como parte del plan 2018 y 2019. El recambio valvular aórtico mediante prótesis valvular y la implantación percutánea de prótesis valvulares aórticas en pacientes con estenosis aórtica requieren protocolos. Para stents liberadores de fármacos, estudios de coste-utilidad, en espera de informes de eficacia y seguridad de los dispositivos actuales.
La relación entre las 19 ratios de coste-efectividad incremental (RCEI) correspondiente a los 15 análisis de coste-utilidad de productos sanitarios y la situación en cartera (Tablas 4 y 5) fue la siguiente:
Nueve fueron incluidos en la cartera común de servicios del SNS (RCEI<25.000 €/AVAC).
Seis fueron incluidos aunque tuvieron una RCEI ≥25.000 €/AVAC: desfibriladores automáticos implantables (DAI) en prevención primaria,stentsliberadores de fármacos, implantación percutánea de prótesis valvulares aórticas en estenosis aórtica, recambio valvular aórtico mediante prótesis valvular percutánea y terapia de resincronización cardiaca (esta última con dos resultados, con o sin DAI).
Cuatro fueron excluidos (RCEI ≥25.000 €/AVAC).
Discusión
En los 11 años analizados (2006-2016) se realizaron 25 evaluaciones económicas completas de productos sanitarios. Todas cumplieron una amplia mayoría de los ítems metodológicos evaluados. Asimismo, la práctica totalidad de los resultados de los 15 análisis de coste-utilidad tuvieron correspondencia y coherencia con la situación de la cartera común de servicios del SNS.
El análisis del rigor de las evaluaciones económicas utilizando listas de verificación es frecuente, en especial para comprobar la adecuación antes de publicar en revistas científicas. Así, por ejemplo, en el ámbito internacional destacan las de Consolidated Health Economic Evaluation Reporting Standards (CHEERS)14, Drummond et al.15 y Caro et al.16. En concreto, el método de la Red tiene ítems similares a los de CHEERS, pero el primero se orienta a validar la calidad de las evaluaciones económicas y el segundo se conceptualiza como ítems que deben ser incluidos al reportar una evaluación económica. Así, por ejemplo, CHEERS se centra en solicitar una buena descripción de las intervenciones o en la exposición del efecto de modificar todas las variables, mientras que el foco del método de la Red está en la adecuada definición de la pregunta de investigación o en la justificación de los parámetros del análisis de sensibilidad. Se dispone de referencias sobre el uso de este tipo de listados. Por ejemplo, solo en rehabilitación, en 2016 Howard-Wilsher et al.17 encontraron 30 revisiones sistemáticas sobre la calidad de la evaluación económica. No obstante, no hemos logrado encontrar referencias de autoanálisis del cumplimiento de una serie de criterios metodológicos de un conjunto de evaluaciones económicas históricas de una red de agencias.
El impacto de las ETS en España es distinto al de otras agencias, como por ejemplo el National Institute for Health and Care Excellence (NICE): las conclusiones o recomendaciones de los informes de RedETS son consideradas al tomar decisiones, pero en la práctica no son vinculantes18-19 (en el caso del NICE, el umbral de referencia se establece en 20.000-30.000 £/AVAC)20.
En España, este es el primer autoanálisis formal conocido realizado sobre el impacto de los resultados de evaluación económica de productos sanitarios en la toma de decisiones de la cartera común de servicios del SNS. Sus resultados muestran un amplio cumplimiento por parte de las agencias de los criterios metodológicos para los análisis de coste-utilidad, y que existe coherencia entre los informes de RedETS y las decisiones nacionales. La primera prueba de la relación entre resultados y situación en cartera es que el 68% de las evaluaciones analizadas eran coincidentes. Aun así, ante los resultados obtenidos, la CPAF decidió, por ejemplo, incorporar a la priorización de tecnologías por evaluar (dentro del plan de trabajo de 2018 de RedETS) una actualización del informe del DAI en prevención primaria. Tras quedar priorizada, esta tecnología está siendo evaluada de nuevo, con lo que se aporta robustez al sistema. Sobre la terapia de resincronización cardiaca ha habido innovación y cambios de costes suficientes en el mercado como para plantearse su reevaluación21-22, que ha sido priorizada y será analizada como parte del plan de trabajo de 2019. En relación con los stents liberadores de cuatro tipos de fármacos, no parece conveniente actualizar el análisis en los mismos términos, ya que el informe comparaba fármacos utilizados en dispositivos de primera y segunda generación y en este momento hay en el mercado dispositivos de tercera generación, y los más recientes reabsorbibles. Debería replantearse un análisis de coste-utilidad de los últimos dispositivos, una vez realizados sus informes sobre eficacia y seguridad.
Se ha considerado como criterio de análisis el nivel superior del rango tomado como umbral por Vallejo-Torres et al.13, de 20.000-25.000 €/AVAC (en 2019 es considerado de referencia por los economistas de la salud de la Red), si bien formalmente, en el periodo analizado, la cifra más utilizada fue de 30.000 €/AVAC23. Utilizar el umbral de 30.000 €/AVAC implicaría dejar de considerar fuera del rango la implantación percutánea de prótesis valvulares en estenosis aórtica. Es de interés que, tanto esta intervención como el recambio valvular aórtico mediante prótesis valvular percutánea (119.575 €/AVAC) se incluyen en cartera con un redactado excepcional por el que deben ser «evaluados por un comité multidisciplinario, en centros que dispongan de un servicio de cirugía cardiaca y de un protocolo escrito de selección de pacientes»24.
En relación con los stents, los informes invitan a desinvertir en stents no recubiertos en las circunstancias analizadas (indicaciones de riesgo, síndrome coronario agudo y cardiopatía isquémica). No obstante, como pueden darse otras circunstancias de uso aparte de las especificadas, se decide mantenerlas en cartera, aunque dado que son informes con evidencia de 5 o más años de antigüedad, y ante la innovación y los cambios en este mercado, podría plantearse su reevaluación en el plan de trabajo de 2020.
Es de especial interés el caso de los sistemas flash de monitorización de la glucosa en el líquido intersticial (FreeStyle Libre®) para la diabetes mellitus tipos 1 y 2. El informe decía que era coste-efectivo, pero como en pediatría no había estudios suficientes, se decidió realizar un estudio de monitorización. Para personas adultas, en las que había recomendación favorable y resultaba coste-efectivo, se están priorizando colectivos de pacientes para hacer una financiación escalonada.
Una limitación relevante de este trabajo es la dificultad para analizar las decisiones tomadas a partir de las 10 evaluaciónes económicas que no son análisis de coste-utilidad. Por este motivo, los/las economistas de la salud, entre otros/as profesionales, solicitan continuamente recoger datos de calidad de vida relacionada con la salud, así como información proporcionada por pacientes y cuidadores/as que permitan estos y otros análisis relevantes para quienes deben decidir y planificar. Un análisis específico en este sentido es una línea futura de interés. Una oportunidad de mejora sería articular una validación externa del cumplimiento de los ítems de verificación. Adicionalmente, cabe destacar que la cartera común de servicios del SNS debe garantizarse a todas las personas usuarias del sistema sanitario, si bien las comunidades autónomas pueden establecer prestaciones sanitarias complementarias en el ámbito de sus competencias. Asimismo, la industria de productos sanitarios es altamente innovadora y actualiza con frecuencia sus tecnologías y las correspondientes aplicaciones. Por tanto, las conclusiones de algunas evaluaciones pueden quedar obsoletas con la aparición de nuevos dispositivos, nueva evidencia o actualizaciones relevantes de precios y costes en el mercado. Finalmente, las agencias encuentran a menudo que la literatura y los estudios disponibles son limitados en cantidad o calidad.
Las líneas futuras de este trabajo serán, entre otras, realizar el mismo ejercicio con otros tipos de tecnologías y dar respuesta a los comentarios sobre el sistema de trabajo en análisis de coste-utilidad que puedan aparecer, optimizando la transparencia y trabajando en la mejora continua. Para esta función podrá tener un peso especial el Grupo de Interés en Evaluación Económica de RedETS, constituido en noviembre de 2017. La Tabla 5 resume el abordaje realizado para 6 de 19 casos incluidos por encima considerando 25.000 €/AVAC. Otras valoraciones podrían incluir solo los productos sanitarios con ratios superiores a este umbral, o incluso hacer estimaciones empíricas del rango de aceptabilidad o valor umbral que las personas decisoras pueden estar utilizando implícitamente en la práctica. Cabe mencionar que la evaluación de un medicamento para su inclusión en la cartera no se realiza en el marco de RedETS, que está enfocada a las «otras tecnologías» que resultan priorizadas en el SNS. Asimismo, también existen comités regionales que sustentan la toma de decisiones en su ámbito25-27. En este sentido, el presente trabajo, por tanto, da una relevante respuesta, aunque solo parcial, al debate público sobre la cartera de servicios en nuestro SNS28.
Las evaluaciones económicas de productos sanitarios publicadas por RedETS cumplen la mayoría de los aspectos de la lista de verificación de calidad, y por tanto pueden considerarse exhaustivas y rigurosas. Asimismo, una parte importante de los resultados de coste-utilidad fueron coherentes (lo que no implica que causales, dado que las decisiones son multicriterio) con la inclusión o no en la cartera común de servicios del SNS, y en los casos discrepantes existe un proceso de reevaluación actualmente en marcha para explicar esta diferencia. Por tanto, los informes de evaluación de RedETS son fuente de gran y fiable valor informativo para ayudar a decidir sobre si incorporar, modificar o desinvertir productos sanitarios en la cartera común de servicios del SNS. Finalmente, el análisis demuestra que la coherencia en la aplicación de criterios de coste-utilidad en el ámbito de las tecnologías sanitarias acorde al trabajo de RedETS es una realidad.
¿Qué se sabe sobre el tema?
Se han aportado valoraciones externas sobre las evaluaciones económicas de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias. No obstante, no se ha publicado un autoanálisis de su calidad observando sus documentos metodológicos, ni se ha autoanalizado la coherencia entre los resultados de coste-utilidad y la toma de decisiones.