Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.77 no.11 nov. 2002
ARTÍCULO ORIGINAL
INERVACIÓN DE LA GLÁNDULA LAGRIMAL EN
PACIENTES CON SÍNDROME DE SJÖGREN PRIMARIO.
ESTUDIO INMUNOHISTOPATOLÓGICO
INNERVATION OF THE LACHRYMAL GLAND IN PATIENTS WITH
PRIMARY SJÖGREN'S SYNDROME.
AN IMMUNOHISTOPATHOLOGICAL STUDY
RIVAS L1, MURUBE J2, TOLEDANO A3
| RESUMEN Objetivos: Estudiar los parámetros histopatológicos de la glándula lagrimal principal en pacientes con síndrome de Sjögren primario (SS1), comparar la relación existente entre los cambios morfológicos e inmunohistoquímicos de la inervación glandular, y analizar las diferencias inmunopatológicas entre el SS1, la queratoconjuntivitis seca (QCS) no inmunológica y personas controles. Palabras claves: Inervación glandular, inmunohistoquímica, microscopia electrónica, ojo seco, síndrome de Sjögren.
| SUMMARY Purpose: Histopathological parameters of the main lachrymal gland from patients with primary Sjögrens syndrome (SS1) were investigated, and the relation between morphological and immunohistochemical changes in the innervation of lachrymal gland in patients with SS1, as well as the immunopathological differences between SS1, non-autoimmune keratoconjunctivitis sicca (KCS) and controls were analysed. Key words: Dry eye, electron microscopy, glandular innervation, immunohistochemistry, Sjögrens syndrome.
|
Recibido: 21/9/01. Aceptado: 18/3/02.
Servicio de Oftalmología. Hospital Ramón y Cajal. Madrid.
1 Doctor en Medicina.
2 Doctor en Medicina. Universidad de Alcalá de Henares. Madrid.
3 Doctor en Medicina. Instituto Santiago Ramón y Cajal. CSIC. Madrid.
Correspondencia:
Luis Rivas
Unidad del Ojo Seco. Servicio de Oftalmología. Planta 9D
Hospital Ramón y Cajal
Ctra. de Colmenar, km 9,100
28034 Madrid
España
INTRODUCCIÓN
El síndrome de Sjögren primario (SS1) es una enfermedad inflamatoria crónica, sistémica, de progresión lenta, etiología desconocida y de patogenia autoinmune, que se caracteriza por la existencia de un proceso inflamatorio constituido predominantemente por linfocitos T CD4 activados (1) que destruyen progresivamente las glándulas exocrinas, con pérdida del parénquima glandular y la consiguiente hipofunción de la glándula (2). También es importante la afectación de numerosos órganos internos (3). La disminución en la secreción lagrimal y salival produce una queratoconjuntivitis seca (QCS) y xerostomía (4).
El SS1 predomina en las mujeres y, aunque la inmensa mayoría de los pacientes inician su enfermedad entre los 40 y 60 años de edad, es posible su comienzo a cualquier edad; incluso en la infancia (5). No se han descrito diferencias raciales, ni agentes medioambientales, aunque sí se ha observado una predisposición genética, endocrinológica, vírica o neuroendocrina (6).
Los cambios histopatológicos acontecidos en la glándula lagrimal son múltiples, con fibrosis y atrofia difusa, produciendo una posterior QCS. Además de otros factores, han sido descritas que estas alteraciones glandulares están relacionadas directamente con lesiones producidas en el ciertas áreas del sistema nervioso central (7).
El polipéptido intestinal vasoactivo (VIP) es un neuropéptido biológicamente activo que se encuentra en los nervios periféricos del intestino, en las glándulas exocrinas y en algunos ganglios. Tiene diversas funciones, entre las que destacan la vasodilatación, la relajación del músculo liso y la estimulación exocrina (8), lo que permite relacionar su presencia en la glándula lagrimal con la actividad secretora.
En la actualidad la mayoría de los tratamientos médicos oftalmológicos en pacientes con SS1 son sustitutivos lagrimales, raramente se incluyen tratamientos sistémicos. Ciertas características histoquímicas y morfológicas de la glándula lagrimal y de su estroma adyacente permitirían contribuir al mejor conocimiento de la enfermedad y así facilitar el estudio histopatológico de nuevos tratamientos médicos. Por ello, en el presente trabajo se ha estudiado la inervación periglandular, tanto a nivel morfológico como funcional, intentando profundizar en el conocimiento de este factor de predisposición, y buscando si el carácter autoinmune del SS1 es un factor desencadenante al compararlo con la QCS no inmunológica y con personas sanas.
MATERIAL Y MÉTODOS
Los pacientes con SS1 fueron diagnosticados entre los Servicio clínicos de Reumatología y Oftalmología, con el apoyo de los Servicios preclínicos de Inmunología y Anatomía Patológica. De los 33 pacientes participantes, 27 fueron mujeres (81,82%) y 6 hombres (18,18%), con edades comprendidas entre los 28 y 82 años (59,3 D.E. 20,5 años de edad media). En el estudio también participaron 33 pacientes con QCS no asociada a alguna enfermedad sistémica; de ellos, 23 fueron mujeres (69,70%) y 10 fueron hombres (30,30%), con edades comprendidas entre los 29 y 83 años (62,0 D.E. 22,3 años de media). Como controles participaron 33 personas sanas asintomáticas, sin alteraciones clínicas oftalmológicas ni orales, que iban a ser intervenidas quirúrgicamente de cataratas, de los cuales 25 fueron mujeres (75,76%) y 8 fueron hombres (24,24%), con edades comprendidas entre los 33 y 78 años (57,9 D.E. 23,6 años de media).
Todos los enfermos con SS1 cumplieron en su totalidad el Criterio Europeo (9), consistente en 6 grupos de pruebas, siendo necesarios resultados alterados en 4 grupos cualquiera:
1. Síntomas subjetivos oculares.
2. Síntomas subjetivos orales.
3. Signos objetivos oculares.
4. Características histopatológicas.
5. Implicación de la glándula salival.
6. Autoanticuerpos.
El criterio de exclusión incluye: preexistencia de linfoma, SIDA, sarcoidosis o enfermedad de rechazo del injerto contra el huésped.
Los dos primeros grupos de este criterio se incluyeron en la historia clínica de cada paciente. El tercer grupo fue valorado mediante la prueba de Schirmer, tinción vital con rosa de bengala y el tiempo de ruptura de la película lagrimal (BUT). El estudio morfológico se realizó en biopsias de las glándulas salivales menores. El quinto grupo se efectuó mediante la gammagrafía de las glándulas parótidas. Por último, las determinaciones serológicas estudiadas fueron los factores anti SS-A, anti SS-B, el factor reumatoide (FR) y los anticuerpos antinucleares (AAN).
La prueba de Schirmer sin anestesia se consideró anormal por debajo de 5 mm de humectación en 5 minutos. La tinción vital con rosa de bengala fue anormal cuando presentó más de 4 cruces, de acuerdo con la escala de van Bilsterveld. El BUT tuvo un valor anormal por debajo de los 7 segundos.
La biopsia de las glándulas salivales menores fue realizada por los cirujanos maxilofaciales y diagnosticada por un anatomopatólogo. La graduación se realizó de acuerdo a la escala usada habitualmente en Anatomía Patológica (de Chisholm y Mason), compuesta por 4 grados, donde los grados 3 y 4 son compatibles con el diagnóstico del síndrome de Sjögren. El grado 3 se caracteriza por la presencia de un foco de 50 o más linfocitos por 4 mm2 de tejido glandular; mientras que el grado 4 presenta dos o más focos por 4 mm2 de tejido.
La gammagrafía de las glándulas parótidas se consideró anormal si la secreción espontánea o la secreción mediante cítricos estuvo disminuida. Esta prueba fue realizada en el Servicio de Medicina Nuclear.
Las determinaciones serológicas estudiadas fueron los factores anti SS-A, anti SS-B, el factor reumatoide (FR) y los anticuerpos antinucleares (AAN). La detección de ellos se realizó utilizando técnicas de nefelometría, inmunofluorescencia indirecta y contrainmunoeletroforesis (o wester blot) según los métodos realizados por el Servicio de Inmunología, de acuerdo con las técnicas empleadas con los kits comerciales empleados. Se utilizaron títulos de dilución (1:40) en la determinación del título del FR y de los AANs. Los valores fueron considerados alterados cuando la concentración fue superior a 1:40. Los anticuerpos para los antígenos anti SS-A o SS-B se expresaron por valores positivos o negativos.
Una vez realizadas las pruebas que confirmaron la existencia del SS1 se estudió el factor neurológico de predisposición de la enfermedad mediante el examen ultraestructural y el estudio inmunohistoquímico del VIP sobre las terminaciones nerviosas.
La biopsia de la glándula lagrimal principal se realizó bajo anestesia tópica seguida de una inyección subconjuntival y supratemporal de lidocaína al 2% con adrenalina. Se prolapsó el lóbulo palpebral de la glándula lagrimal y se extrajo un pequeño fragmento de tejido de unos 3 mm3 y se colocó inmediatamente en el líquido fijador. No hizo falta sutura. Las muestras se dividieron en 2 partes: una, destinada al estudio morfológico y otra utilizada para el estudio inmunohistoquímico. La graduación en las biopsias de la glándula lagrimal fue la misma que la utilizada en las biopsias de las glándulas salivales menores.
El procesamiento instrumental de las biopsias siguió el protocolo habitual en un laboratorio de Anatomía Patológica. Se fijaron por inmersión en glutaraldehido al 1,5% tamponado con cacodilato sódico pH 7,4. Las biopsias fueron sometidas a una segunda fijación, en tetróxido de osmio al 1% en tampón Palade. La deshidratación se efectuó en concentraciones crecientes de acetona. El medio de contraste consistió en una solución de acetato de uranilo al 2%. La inclusión se realizó en Araldita (Durcupan-Ciba). Los cortes ultrafinos para el estudio de microscopia electrónica se realizaron con un grosor comprendido entre 60-70 nm. Estos cortes se depositaron sobre rejillas cubiertas por una membrana de soporte formvard, para su mejor extensión y soporte. Los cortes se tiñeron con citrato de plomo, según el método de Reynolds.
El estudio inmunohistoquímico utilizado fue la determinación del VIP (Vectastain ABC Kit, Vector Laboratories, Burlingame, USA) para estudiar la funcionalidad de las terminaciones nerviosas. Los cortes se fijaron en paraformaldehido al 4% y se cortaron en un criostato a –20°C, en secciones de 8 micras de espesor. El método utilizado ha sido el habitual en los laboratorios de Inmunología. El anticuerpo monoclonal fue usado a una concentración de 1:1000.
El análisis estadístico para comparar las medias de cada una de las pruebas estudiadas se realizó mediante la varianza y la prueba de la t de Student. Se consideraron resultados significativos a todos aquellos que mostraron una probabilidad superior al 95% (p<0,05).
RESULTADOS
Los 33 pacientes con SS1 mostraron más de una manifestación sistémica a la vez. Ningún paciente con QCS no inmunológica o persona sana presentó complicaciones sistémicas.
Las pruebas clínicas de Schirmer, el BUT y la tinción vital con rosa de bengala no presentaron diferencias significativas entre los pacientes con SS1 y con QCS no inmunológica, aunque sí respecto a los controles. Los estudios de laboratorio en los pacientes con SS1 revelaron la presencia de anticuerpos contra antígenos SS-A en el suero de 22 pacientes (66,7%) y contra antígenos citoplasmáticos SS-B en 10 pacientes (30,3%). Los títulos de los AAN en el SS1 superiores a 1:40 se observaron en 18 pacientes (54,5%) y el factor reumatoide lo fue en 25 pacientes (75,8%). Ninguna persona control ni con QCS presentó valores positivos para estos anticuerpos. Las biopsias de las glándulas salivales menores mostraron resultados alterados (grados 3 y 4) en 25 pacientes con SS1 (75,8%), mientras que en los pacientes con QCS y los controles fueron absolutamente normales.
La glándula lagrimal principal de los pacientes con SS1 se observó constituida por lobulillos, con una estructura muy semejante a la de las glándulas salivales. Las células secretoras estuvieron organizadas en acinos glandulares más o menos alterados y rodeadas por células mioepiteliales prácticamente intactas. Los conductos excretores poseyeron células caliciformes entre las células epiteliales que formaban los conductos. Se observó gran cantidad de linfocitos en acúmulos periféricos a dichos acinos, en acúmulos entre los acinos y, en menor frecuencia, dispersos entre los acinos glandulares, pero sin invadir nunca a los acinos. La estructura de los conductos excretores no se vio afectada por los acúmulos de linfocitos.
El estroma que rodeaba a la glándula lagrimal principal de pacientes con SS1 contuvo los mismos elementos que las personas sanas, aunque mucho más denso. Los vasos sanguíneos y los linfáticos fueron más estrechos, muchas veces casi ocluidos. En ninguna de las muestras estudiadas a nivel ultraestructural se observó alguna estructura que hiciese suponer la presencia de virus, de ningún tipo. Las fibras nerviosas estuvieron presentes en el tejido conectivo que rodea a las glándulas lagrimales. Estas fibras llegaron hasta la membrana basal periacinar, las células mioepiteliales, vasos sanguíneos, células plasmáticas y fibroblastos, pero nunca se observaron penetrando entre las células epiteliales de los acinos glandulares. La estructura de las terminaciones nerviosas (figs. l y 2) y las fibras mielinizadas (figs. 3-5) no presentó diferencias significativas respecto a la QCS no inmunológica, mientras que con respecto a los individuos sanos fueron significativamente menos abundantes. De igual forma, se observó que la tinción de las terminaciones nerviosas, mediante la reacción para el VIP, en las biopsias de los pacientes con SS1 presentó un número menor, aunque sin diferencia significativa, con relación a los pacientes QCS no inmunológica Las personas sanas sí presentaron variaciones significativas tanto respecto a la QCS no inmunológica como con pacientes con SS1 (figs. 6-8 y tabla I).

Fig. 1. Detalle del tejido conectivo que rodea a la glándula lagrimal de una persona sana. Se observan diversas terminaciones nerviosas próximas a un fibroblasto. Aumento original x8.000.
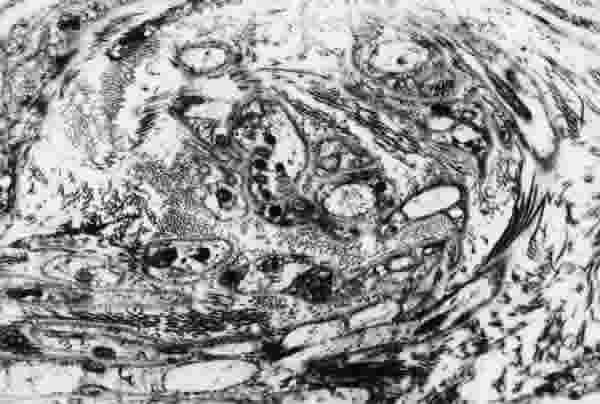
Fig. 2. Detalle de numerosas terminaciones nerviosas periglandulares en un paciente con SS1. Las fibras de colágeno son muy abundantes. Aumento original x6.000.

Fig. 3. Detalle de fibras mielinizadas en el tejido conectivo que rodea a los acinos glandulares de una persona sana. Aumento original x12.000.

Fig. 4. Detalle de una fibra mielinizada y varias no mielinizadas en el tejido conectivo periacinar de la glándula lagrimal de un paciente con queratoconjuntivitis seca (QCS). Aumento original x8.000.
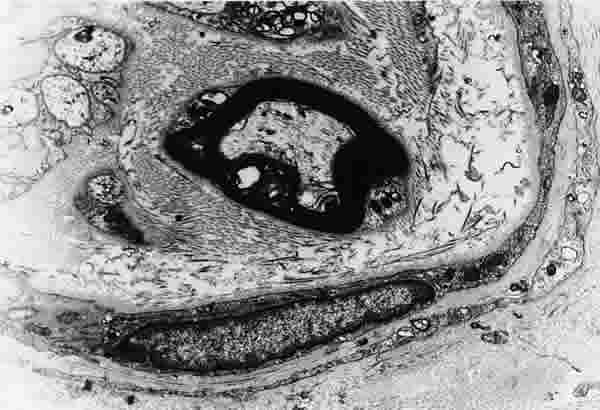
Fig. 5. Detalle de un nervio con una fibra mielinizada y varias no mielinizadas rodeadas por una célula de Schwan y una terminación de un fibroblasto del tejido conectivo periacinar de la glándula lagrimal de un paciente con síndrome de Sjögren primario (SS1). Aumento original x4.000.

Fig. 6. Reacción muy positiva del polipéptido intestinal vasoactivo (VIP) en el tejido conectivo periglandular de una persona sana. Aumento original x40.

Fig. 7. Reacción positiva del polipéptido intestinal vasoactivo (VIP) en el tejido conectivo próximo a los acinos glandulares de un paciente con queratoconjuntivitis seca (QCS). Aumento original x40.

Fig. 8. Reacción moderadamente positiva del polipéptido intestinal vasoactivo (VIP) en el tejido conectivo próximo que rodea a los acinos glandulares de un paciente con síndrome de Sjögren primario (SS1). Aumento original x40.
DISCUSIÓN
Aunque el mecanismo patogénico exacto de la respuesta inmune de la enfermedad aún no está aclarado, hay grandes evidencias de que es un proceso autoinmune progresivo en las glándulas exocrinas, que juega un papel muy importante en la destrucción tisular local (10), implicando a linfocitos infiltrados activados y a células epiteliales de las diferentes glándulas exocrinas (11). Además de este mecanismo principal, existen ciertas predisposiciones desencadenantes del SS1 que podrían contribuir también a una disminución funcional, como son los factores neurológicos (1,12). Todos nuestros pacientes con SS1 han mostrado terminaciones nerviosas y fibras mielínicas bien conservadas y en número semejante a los pacientes con QCS no inmunológica, aunque significativamente menor que en los controles. Además, mediante la técnica histoquímica del VIP se ha podido comprobar que su funcionalidad es lo suficientemente positiva como para considerar que su actividad neurológica es funcionalmente aceptable, por todo el estroma periglandular, ya que el número de terminaciones positivas al VIP fue aproximadamente del 60% de las observadas en las personas sanas; encontrándose una reacción positiva por todo el tejido conectivo conjuntival. Ello indica que la estimulación de las fibras nerviosas sobre la glándula lagrimal está jugando un papel activo en la secreción lagrimal (8).
El tratamiento médico con inmunosupresores en pacientes con SS1 va más lejos de los tratamientos oftalmológicos. Aquellos han mostrado, de forma general, mejorías significativas en la regeneración glandular y del estroma, aunque sin llegar a la normalidad (13). Por ello, en los casos de ojo seco grave es obligada la medicación inmunosupresora a base de prednisona (4). De igual manera, el tratamiento médico tópico con ciclosporina-A también ha mostrado una mejoría del perfil inmunopatológico glandular y de la conjuntiva (14). En cuanto a los tratamientos médicos contra la hiposecreción lagrimal dirigidos por oftalmólogos cada día existe una mayor gama. La conservación de numerosas terminaciones nerviosas activas y la presencia de células mioepiteliales bien conservadas permite suponer que la utilización de ciertos tratamientos sistémicos estimuladores (15-17) sería notablemente eficaz en la mejoría de la secreción glandular en pacientes con SS1.
Por todo ello, consideramos que el SS1 es una enfermedad autoinmune que provoca la destrucción del epitelio secretor de la glándula lagrimal principal, debido a la acción de los linfocitos infiltrados, aunque con una buena conservación de las células mioepiteliales periacinares. Tanto las terminaciones nerviosas como las fibras mielínicas tienen estructuras bien conservadas y están presentes por todo el estroma periglandular. Debido a la complejidad de las determinaciones y los datos concluyentes descritos por diversos autores (1,2) no podemos rechazar plenamente la existencia de una predisposición neurológica. Nuestros resultados indicaron que las terminaciones nerviosas en los pacientes con SS1 fueron significativamente menos activas que en las personas controles, no se las puede considerar como un factor de predisposición autoinmune que acentúen directamente la gravedad de la enfermedad, debido a que no presentan diferencias funcionales significativas respecto a los pacientes con QCS no inmunológica.
BIBLIOGRAFÍA
1. Fox FI, Kang H. Sjögrens syndrome. In: Kelly WM, Harris ED, Ruddy S, Sledge CB (eds). Textbook of Rheumatology. 4.ª edición. Philadelphia: WB Saunders Company; 1993; 1: 931-942. [ Links ]
2. Moutsopoulos HM. Sjögrens syndrome. In: Fauci A, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, Hauser SL, Longo DL (eds). Harrisons Principios de Medicina Interna. 14 edición. New York: McGraw-Hill; 1998; 1901-1904. [ Links ]
3. Seamone CD, Jackson WB. Immunology of the external eye. In: Tasman W (ed). Duane's Clinical Ophthalmology. Vol. 4. Philadelphia: Lippincott-Raven Publishers; 1995; 1-52. [ Links ]
4. Fox RI. Enfermedades sistémicas asociadas al ojo seco. En: Dodick JM, Donnenfeld ED (eds). International Ophthalmology Clinics. Ojo Seco. New York: CibaVision; 1995; 71-87. [ Links ]
5. Sánchez-Rodríguez A, Portugal-Álvarez J. Síndrome de Sjögren. In: Díaz-Rubio M, Espinós D (eds). Tratado de Medicina Interna. Madrid: Editorial Medica Panamericana SA; 1994; 2825-2827. [ Links ]
6. Murube J. Síndrome de Sjögren primario. In: Murube del Castillo J (ed). Ojo Seco-Dry Eye. Granada: Tecnimedia Editorial; 1997; 45-53. [ Links ]
7. Sibony PA, Walcott B, MCKeon C, Jakobiec FA. Vasoactive intestinal polypeptide and the innervation ofthe human lacrimal gland. Arch Ophthalmol 1988; 106: 1085-1088. [ Links ]
8. Obata H, Yamamoto S, Horiuchi H, Machinami R. Histological study of human lacrimal gland. Statistical analysis with special reference to aging. Ophthalmology 1995; 102: 678-686. [ Links ]
9. Vitali C, Bombardieri S, Moutsopoulos HM, Coll J, Gerdi R, Hatron PY et al. Assessment of the European classification criteria for Sjögrens syndrome in a series of clinically defined cases: results of a prospective multicentre study. The European Study Group on Diagnostic Criteria for Sjogrens Syndrome. Ann Rheum Dis 1996; 55: 116-121. [ Links ]
10. Kurrasch RHM, Wu AJ, Fox PC. Enfermedades orales asociadas al ojo seco. En: International Ophthalmology Clinics. Friedlaender M (ed). New York: Little, Brown and Company Inc., CibaVision SA; 1995; 89-100. [ Links ]
11. Tabbara K, Sharara N. Sjögrens syndrome: pathogenesis. Eur J Ophthalmol 1999; 9: 1-7. [ Links ]
12. Robbins SL. Trastornos de la inmunidad. En: Contran KS, Kumar V, Robbins SL (eds). Patolog¦a Estructural y Funcional. 4.ª edición. Madrid: Interamericana-McGraw-Hill. 1990; 1: 169-245. [ Links ]
13. Oroza MA. Estudio inmunohistoquímico y morfológico en oios de pacientes con síndrome de Sjögren primario. Madrid: Universidad Complutense. 2000; 220 pp. Tesis Doctoralis. [ Links ]
14. Tsubota K, Saito I, Ishimaru N, Hayashi Y. Use of topical cyclosporin A in a primary Sjögrens síndrome mouse model. Invest Ophthalmol Vis Sci 1998; 39: 1551-1559. [ Links ]
15. Álvarez MI, Rivas L, Rodríguez JJ, Murube J. Tratamiento con eledoisina en pacientes con querartoconjuntivitis seca. Arch Soc Esp Oftalmol 1996; 70: 245-252. [ Links ]
16. Vivino FB, Al-Hashimi I, Khan Z, LeVeque FG, Salisbury PL 3rd, Tran-Johnson TK et al. Pilocarpine tablets for the treatment of dry mouth and dry eye symptoms in patients with Sjögren syndrome: A randomized, placebo-controlled, fixed-dose, multicenter trial. P92-01 Study Group. Arch Intern Med 1999; 159: 174-181. [ Links ]














