Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.78 no.6 Jun. 2003
REVISIÓN
ESTADO ACTUAL DEL DIAGNÓSTICO Y CONTROL
EVOLUTIVO DEL GLAUCOMA
UPDATE ON GLAUCOMA DIAGNOSIS AND FOLLOW-UP
GONZÁLEZ DE LA ROSA MA1
| RESUMEN Objetivo: Comparar los diversos métodos propuestos para el diagnóstico y control evolutivo del glaucoma. Palabras clave: Glaucoma, hipertensión ocular, perimetría, nervio óptico, campo visual.
| SUMMARY Purpose: To compare the different methods proposed for glaucoma diagnosis and follow-up. Key words: Glaucoma, ocular hypertension, perimetry, optic nerve, visual field. |
Recibido:12/2/03. Aceptado: 6/6/03.
Servicio de Oftalmología. Hospital Universitario de Canarias. Universidad de La Laguna. Islas Canarias. España.
1 Doctor en Medicina.
El autor manifiesta que tiene interés comercial en el programa de perimetría TOP y en el perímetro PULSAR citados en este trabajo.
Correspondencia:
Manuel González de la Rosa
C/. 25 de Julio, 34
38004 Santa Cruz de Tenerife
España
E-mail: mgdelarosa@jet.es
INTRODUCCIÓN
El diagnóstico precoz del glaucoma no es solamente un objetivo esencial para prevenir el daño inicial del nervio óptico, sino también una necesidad social por razones de economía. La tendencia al tratamiento del hipertenso ocular como sujeto de riesgo supone una carga enorme e innecesaria para los individuos y para los estados, además de una importante fuente de daño iatrogénico.
La publicación de algunos estudios prospectivos realizados sobre hipertensos oculares había puesto en entredicho la importancia de la hipertensión ocular en el origen de la enfermedad glaucomatosa (1-4). Sin embargo, una reciente publicación ha indicado que el tratamiento del hipertenso reduce la frecuencia de aparición de daño en el nervio óptico (5,6). Realmente no queda muy claro porqué debemos creer más al último estudio que a los anteriores, pero hemos de admitir que sus resultados se aproximan más a lo que se ha admitido clásicamente.
No obstante, esta reciente investigación no nos debe llevar a la falsa conclusión de que esté justificado el tratamiento indiscriminado del hipertenso ocular, aunque éste sea un objetivo comercial deseado por algunos que han abierto polémicas que no puedo suponer desinteresadas. Ha de servir, exclusivamente, para estimularnos a seleccionar a aquellos sujetos con probabilidades de enfermar.
Las conclusiones de este trabajo nos deben orientar a vigilar especialmente la situación de los pacientes mayores, con presiones altas, relación copa/disco elevada o campo visual irregular. Finalmente nos han recordado que debemos incluir la paquimetría en el arsenal diagnóstico, dado que frecuentemente se subestima la presión ocular de los ojos con córneas más delgadas.
LA PERIMETRÍA BLANCO-BLANCO
Definimos como sensibilidad a la capacidad de una prueba para detectar patología y como especificidad a su habilidad para definir normalidad. El procedimiento más generalizado para la estimación del daño glaucomatoso es el estudio del campo visual con fondo y estímulo blanco, que se viene realizando por procedimientos automáticos desde hace un cuarto de siglo. La estimación de cuándo un campo visual es normal y cuándo glaucomatoso es, sin embargo, un problema no completamente resuelto. Los criterios propuestos han sido múltiples y los resultados igualmente variados. Aunque el tipo de muestra empleada y el programa utilizado influyen decisivamente en los resultados, una revisión general de la bibliografía (tabla I) y de algunas comunicaciones a congresos no publicadas (Birch MK, O'Donnell NP, Scott A, Wishart PK. Delphi Perimetry. United Kingdom Glaucoma Group Meeting. London.November, 1993), (Wegner A, Zahlmann G, Obermaier M, Mertz M. Visual field evaluation using artificial neural networks. XII International Perimetric Society Meeting. Würzburg. Junio, 1996.) nos indican que esta técnica tiene un promedio de la sensibilidad y especificidad de aproximadamente un 87% (7-21). Nuestras estimaciones, son superiores (22) [Manuel González de la Rosa, Victor Arteaga, Gustavo Baca, Marta González-Hernández. Glaucoma diagnosis using Tendency Oriented Perimetry. 14th Visual Field Symposium of the International Perimetric Society (IPS), Stratford, England June 26–9, 2002] pero aun suprimiendo nuestros trabajos, se podría aceptar como media una cifra del 86%.
LA PERIMETRÍA AZUL-AMARILLO
Numerosos trabajos han sugerido que el defecto detectado por la perimetría azul-amarillo (SWAP en la literatura inglesa y PALOC en la española) podría preceder al defecto de la perimetría convencional blanco-blanco. Sin embargo esta afirmación resulta contradictoria con el hecho de que no existe ningún trabajo que demuestre que la sensibilidad y especificidad de este procedimiento sean superiores a aquella, más bien al contrario. Los trabajos publicados, que curiosamente son muy pocos, indican un promedio de sensibilidad y especificidad de aproximadamente un 79% (tabla II) (23-27).
Son sin embargo abundantes los investigadores que advierten de su mayor variabilidad interindividual, su superior fluctuación a corto y largo plazo y su gran sensibilidad al «efecto fatiga» y al «efecto aprendizaje» (28-35). Algunos de estos problemas se han atribuido a la influencia del cristalino, cuya absorción al azul se incrementa con la edad. Sin embargo las propias experiencias de los defensores de esta técnica no prueban que se incremente su sensibilidad y especificidad al corregir su influencia (36).
Comienzan a aparecer voces discrepantes, que se alejan de las corrientes habituales defensoras de la perimetría azul-amarillo, al tiempo que se observa una dura resistencia de los usuarios en relación a su generalización. Algunos autores han sugerido que la supuesta mayor sensibilidad de la perimetría azul-amarillo es solamente el resultado de elegir un criterio inadecuado para discriminar normalidad y patología en ambas estrategias (35).
En el mismo sentido debería interpretarse la experiencia publicada recientemente por otro de los grupos que ha defendido durante años este procedimiento, el cual ha observado, en una gran muestra de pacientes, que la aparición de nuevos defectos a lo largo de la evolución de la enfermedad no es mayor en esta técnica que en la convencional (37).
Hace dos años presentamos un trabajo realizado con perimetría azul-amarillo, azul-azul y blanco-blanco en la reunión de la Sociedad Internacional de Perimetría, realizado con el perímetro Octopus 101 (Ayala E, Sánchez M, González-Hernández M, González de la Rosa M. White-White, Blue-Yellow and Blue-Blue perimetry in normal subjects. International Perimetric Society Meeting. Halifax, Septiembre 2000). Este estudio mostraba una alta variabilidad interindividual en la perimetría azul-amarillo, una elevada fluctuación, la presencia frecuente de falsos puntos patológicos y una gran pérdida de sensibilidad con la edad.
Dos años más tarde, en el mismo foro, el Dr. Mario Zulauf relataba que intentó hacer un trabajo con el mismo aparato y abandonó después de comprobar que solamente conseguía una especificidad del 55% (Mojon DS, Zulauf M. Short-wavelength automated perimetry in normal subjects. 15th Visual Field Symposium of the International Perimetric Society. Stratford, June 2002).
Una conclusión poco meditada podría llevar a pensar que el perímetro Octopus tiene alguna deficiencia que no posee el Analizador de Humphrey. Sin embargo nosotros nos hemos esforzado en comprobar la rigurosidad fotométrica del equipo suizo y hemos verificado que sus filtros de color son más selectivos, de manera que cumplen más rigurosamente con los criterios en los que se basa teóricamente la técnica: saturación de los pigmentos sensibles a las largas longitudes de onda para examinar los especializados en las cortas. Mi interpretación de esta paradoja es la siguiente: al cumplirse rigurosamente las condiciones del examen en el perímetro Octopus, se está estudiando un umbral absoluto, que carece de la estabilidad del umbral diferencial, que ha sido la que ha dado constancia y precisión a la perimetría blanco-blanco. Los filtros que usa Humphrey son menos selectivos, midiéndose en parte un umbral diferencial. Esto les proporciona una mayor estabilidad, pero les aleja de las condiciones teóricas que, por definición, debería poseer el examen. La perimetría SWAP de Humphrey no es una perimetría diferencial rigurosa como la blanco-blanco, pero tampoco separa perfectamente ambos colores. SWAP se sitúa en una posición intermedia, en la que el incremento de ruido se ha confundido con una mayor sensibilidad.
TECNOLOGÍA DE DOBLE FRECUENCIA (FDT)
Otro procedimiento defendido en los últimos años como útil para el diagnóstico precoz es la Perimetría de Tecnología de Doble Frecuencia (FDT). Una serie de barras claras y oscuras alternan a alta frecuencia temporal, de manera que se produce la ilusión de que su ancho se reduce a la mitad (se duplica su frecuencia espacial).
Realmente los trabajos que utilizan este procedimiento son muy crípticos respecto a cuál es el umbral que se mide realmente. No parece tenerlo nadie demasiado claro. Se va cambiando el contraste hasta que se percibe el estímulo o desaparece, de manera que realmente parece medir simplemente el umbral de contraste para una frecuencia espacial fija. La ilusión de duplicación de frecuencia parece tener una escasa relación con el umbral obtenido.
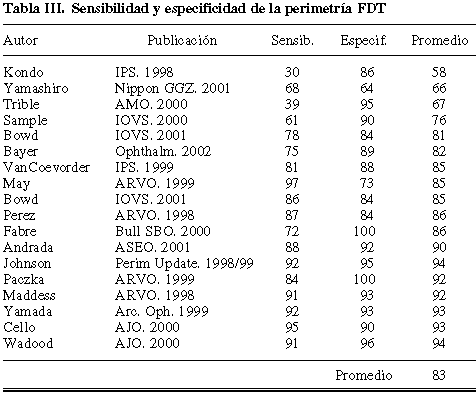
En general los estudios que se han publicado utilizando FDT muestran una alta especificidad, pero este hecho es simplemente el resultado de una elección específica del nivel de corte entre normalidad y patología que favorece a este aspecto, dado que el conjunto sensibilidad-especificidad se sitúa aproximadamente en el 83%, no superando por lo tanto a lo previamente descrito para la perimetría blanco-blanco (tabla III) (20-24,27,38-48).
Por esta razón, en los últimos años esta técnica ha dejado de publicitarse como favorecedora del diagnóstico precoz, para pasar a defenderse su utilidad como procedimiento de rastreo, a causa de su rapidez. Realmente su duración (un minuto) y su precisión son equivalentes a nuestra perimetría Delphi, que nunca alcanzó el éxito comercial a consecuencia de los ataques de algunos autores que argumentaban su escasa capacidad para definir la topografía de los defectos, aunque admitían que poseía un equilibrio de sensibilidad-especificidad del 85% (18). Sin duda éste es un argumento discutible (49) pero, en todo caso, FDT adolece de la misma limitación, aunque parece habérsele disculpado.
PERIMETRÍA FLICKER
La perimetría Flicker o de «parpadeo» estudia la frecuencia crítica de fusión (FCF) globalmente o en diversas regiones del campo visual. La técnica global («full flicker») ha proporcionado cifras de sensibilidad y especificidad en torno al 86%, es decir similares a otros procedimientos ya comentados (50). Sin embargo, en nuestra experiencia, usando la estrategia TOP, la investigación del umbral FCF punto a punto es un procedimiento de alta sensibilidad y especificidad, resultando incluso patológico en un 70% de los hipertensos oculares (51). Además estos defectos son reproducibles, tanto en LV y MD, en el 36,7% de los casos cuando se repite el examen (52) por lo que posiblemente estén indicando un sufrimiento neuronal precoz. Ha de reconocerse, sin embargo la incapacidad de las estrategias flicker para medir la evolución de los defectos y su difícil aplicación en personas de colaboración limitada.
PERIMETRÍA PULSAR
Nuestra perimetría Pulsar, en la que el estímulo cambia simultáneamente de contraste y frecuencia espacial al tiempo que alterna en fase y contrafase a 30Hz, presenta alta sensibilidad y especificidad y resulta patológica en el 34,5% de los hipertensos oculares, por lo que su información está siendo estudiada como índice de riesgo para la aparición de defectos convencionales (53,54). En este caso, contrariamente a lo que hemos señalado para Flicker, el procedimiento es capaz de medir la evolución de los defectos.
En mi opinión se podría pensar que una de las primeras cuestiones detectables en un nervio óptico en situación de sufrimiento es su incapacidad para transmitir la misma cantidad de información por unidad de tiempo, sobre todo cuando esta información posee características límite de detectabilidad, por ejemplo respecto a frecuencia espacial y contraste.
Estudios más amplios, especialmente análisis longitudinales comparativos con otros métodos diagnósticos, son necesarios para la verificación de las ventajas de este procedimiento.
FOTOGRAFÍA DE LA CAPA DE FIBRAS
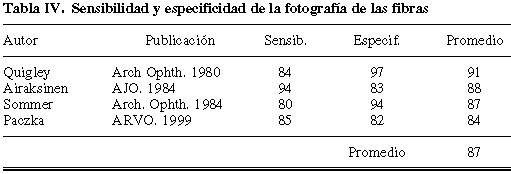
Pasando a los procedimientos diagnósticos objetivos, la fotografía con filtros selectivos para destacar la atrofia de la capa de fibras, ha sido también uno de los sistemas propuestos para el diagnóstico precoz. Los trabajos en los que se ha evaluado su sensibilidad y especificidad aportan cifras similares (promedio 87%, tabla IV) a las de la perimetría blanco-blanco (43,55-57) pero también se ha aclarado que resulta impracticable en un 42% de los glaucomas y un 24% de los normales (58) que es poco reproducible y que produce resultados demasiado dependientes del operador (59).
POLARIMETRÍA LÁSER (GDX)
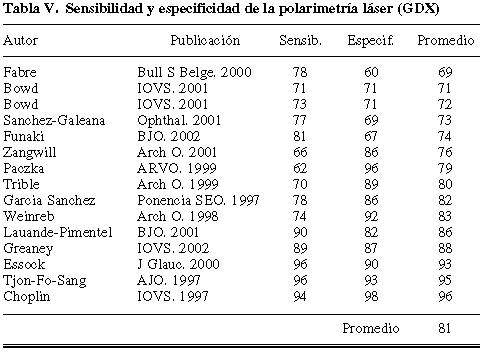
Respecto al análisis del espesor de la capa de fibras nerviosas mediante polarimetría láser (GDX), tampoco puede defenderse una superioridad evidente respecto a la perimetría blanco-blanco, si se tiene en cuenta la cifra del 81% (tabla V), como promedio de la sensibilidad y especificidad, que han estimado los diferentes trabajos publicados (20,24,43,60-70).
TOPOGRAFÍA PAPILAR
La mayor expectativa respecto al diagnóstico del glaucoma ha surgido, en los últimos años, de los procedimientos computarizados de análisis de la topografía papilar. Como en el caso de la perimetría azul-amarillo, son innumerables los trabajos que defienden la capacidad diagnóstica de la Planimetría, HRT, OCT y SLO frente a la perimetría blanco-blanco. Sin embargo un análisis global indica que su sensibilidad y especificidad alcanzan cifras similares (85% de media) a las que hemos comentado para la perimetría convencional (tabla VI), de manera que no parece estar demasiado justificado el optimismo de sus defensores (24,66,67,70-79).
Efectivamente, cuando se grafican como distribución normal los valores medios y desviaciones típicas de los diferentes índices publicados para sujetos normales y glaucomatosos por los fabricantes del HRT (fig. 1) se observa una importante superposición entre las gaussianas normales y patológicas, que hace prácticamente imposible defender la hipótesis de que la técnica posea realmente una precisión diagnóstica muy superior a la perimetría convencional.
Fig. 1. Distribución de frecuencias de los índices proporcionados por el HRT en sujetos normales,glaucomas iniciales, moderados avanzados.
PRUEBAS ELECTROFISIOLÓGICAS
Otro tanto cabría decir del electro-retinograma de damero («pattern ERG»), defendido por algunos como un procedimiento diagnóstico muy precoz, pero con el que se han obtenido cifras medias de sensibilidad y especificidad del 84% (80-85) (tabla VII). Muchos investigadores han puesto sus esperanzas en los nuevos sistemas multifocales de ERG y PEV, pero no existe por el momento información clara respecto a su sensibilidad y especificidad.
ESTUDIOS COMPARATIVOS
Los estudios realizados para comparar los diversos procedimientos diagnósticos subjetivos, más que resultar clarificadores, han dado lugar a las más diversas contradicciones. Mientras que unos autores han observado una precisión diagnóstica prácticamente igual en la perimetría FDT que en la perimetría blanco-blanco (20), afirmación que estaría en línea con el análisis global que venimos exponiendo, otros han afirmado encontrar claras ventajas con FDT (86). De la misma manera mientras que unos han encontrado mejores resultados con SWAP que con FDT (27) otros han obtenido justamente lo contrario (24).
De la misma manera, tampoco existe acuerdo respecto a las capacidades respectivas de los procedimientos objetivos. Unos autores encuentran ventajas en OCT respecto a GDX (66,87) y otros al contrario (88) aunque para estos últimos la planimetría superaría a ambos. La comparación entre técnicas subjetivas y objetivas ha dado el triunfo a las primeras en unos casos o incluso ha producido honrosos empates (24,27).
En general muchos de los trabajos que hemos venido señalando cometen el error de utilizar un índice para la clasificación previa («gold standard») de menor sensibilidad y especificidad que el índice valorado. De esta manera se construyen frecuentes sofismas estadísticos que llevan a conclusiones inconsistentes.
Pasando a mi experiencia personal, la perimetría blanco-blanco, usando la estrategia TOP, alcanza cifras de sensibilidad y especificidad superiores al 90% cuando el criterio discriminador utilizado es la varianza de pérdida (límite LV=7dB2) o un índice mixto en el que juegan un papel fundamental las varianzas de varias de las zonas en las que hemos dividido el campo visual en función del trayecto de las fibras nerviosas de la retina (89,90).
La probable razón de ello está en que TOP proporciona con poca frecuencia cifras elevadas de varianza en los pacientes normales, en contra de lo que ocurre con la estrategia convencional de Bracketing (91,92). Da la impresión de que TOP es capaz de detectar defectos iniciales del campo visual producidos por pequeñas depresiones locales o por el aumento de la fluctuación, mientras que en la estrategia convencional estas variaciones locales surgen incluso en sujetos normales, a causa de la independencia del cálculo de los umbrales de cada punto y de la asimetría del efecto fatiga, que afecta más a los puntos examinados al final del estudio (93). De esta manera, en la estrategia convencional aumenta la irregularidad del campo, incrementando falsamente el valor de LV, haciéndolo poco útil para el diagnóstico. Estas diferencias entre ambos tipos de examen pueden adquirir un gran interés si se tiene el cuenta el importante valor predictivo que ha demostrado poseer la varianza sobre el pronóstico de la hipertensión ocular (5,6).
GLAUCOMA EN FASE INICIAL
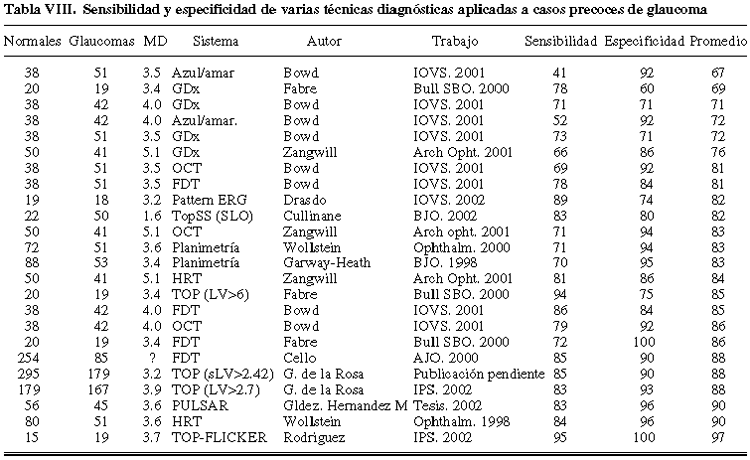
Para finalizar con esta parte de nuestro análisis debemos recordar que la selección del tipo de paciente influye decisivamente en los resultados de este tipo de estudios. La inclusión de un número elevado de glaucomas avanzados eleva falsamente los índices de sensibilidad. Una forma razonable de eliminar esta influencia es seleccionar los trabajos que han utilizado pacientes con glaucoma precoz. Escogiendo a aquellos que utilizan pacientes con un valor de MD bajo (tabla VIII) (20,24,67,73,75,79,94) se observa que los peores resultados diagnósticos se obtienen con la perimetría azul-amarillo y GDX, mientras que los mejores se consiguen con algunas técnicas de topografía papilar, Flicker, Pulsar y TOP blanco-blanco, cuando se utiliza como discriminador, en este último caso, a la varianza de pérdida.
EVOLUCIÓN DEL GLAUCOMA
Dadas las dificultades que hemos venido describiendo para establecer un diagnóstico sin conocer los antecedentes del paciente, diversos investigadores han trasladado la discusión previa al terreno de la capacidad de todas estas técnicas para detectar la evolución de la enfermedad. Como era de esperar, las discrepancias planteadas respecto a su eficacia diagnóstica se han reproducido en relación a los estudios de evolución. Desgraciadamente en este caso no es tan fácil hacer valoraciones promediadas, como las que hemos mostrado previamente, que nos pongan en evidencia la veracidad, relatividad o escasa verosimilitud de las opiniones de los defensores de cada procedimiento.
En general la capacidad de discriminar evolución por medio de la perimetría blanco-blanco ha sido infravalorada. Los estudios americanos se basan esencialmente en el recuento del número de puntos patológicos que forman racimos, criterio que no creo resulte demasiado eficiente (95). En mi opinión los métodos basados en análisis de regresión lineal del defecto medio o los defectos locales, presentan una mayor capacidad para detectar evolución. Fundamentalmente tenemos que referirnos al programa PeriTrend de Octopus, al Statpac2 de Humphrey o al Progressor del equipo dirigido por el Prof. Hitchings en Londres. Sin embargo no existe acuerdo respecto a cuál de ellos es el mejor. Los investigadores citados en último lugar han publicado resultados que superan a los del Statpac2 (96) iniciando una agria polémica entre ambos grupos (97,98).
Se ha encontrado que, en los pacientes con evolución en la excavación papilar, los cambios en la perimetría azul-amarillo son mayores que en la perimetría blanco blanco (27). Sin embargo, muchos de estos trabajos tienen una orientación sesgada, dirigida hacia un determinado objetivo, de manera que los resultados no pueden aceptarse sin crítica. A modo de ejemplo citaremos un trabajo que indica que el 35% de los pacientes que no progresan en blanco-blanco progresan en azul-amarillo y FDT y el 74-80% de los pacientes que progresan en blanco-blanco, progresan en azul-amarillo y FDT (99). Si el proyecto se hubiese planteado de otra manera, por ejemplo tomando como referencia los casos que evolucionan o no con azul-amarillo frente a los otros dos, es posible que los resultados hubiesen sido similares.
De la misma manera se ha afirmado que la fotografía de fibras y la perimetría azul-amarillo predicen la aparición de defectos en la blanco-blanco con tres años de antelación (100). Todo depende del criterio empleado para definir patología con uno u otro sistema, que no suele ser el mismo y ni siquiera comparable. Efectivamente, ya hemos comentado que en una gran muestra de casos, el número de nuevos escotomas se incrementa en el tiempo de igual manera en blanco-blanco que en azul-amarillo (37).
Los mismos problemas se plantean cuando se compara la perimetría blanco-blanco con la topografía papilar. En general se ha asegurado que la segunda consigue detectar evolución en más casos que la primera (5,6,101) pero influye sin duda en esta afirmación el criterio empleado en cada caso. Por ejemplo se puede describir que HRT detecta evolución en el 62% de los pacientes con cambio perimétrico usando el criterio AGIS y en el 29% de los que tienen campo estable (102) pero cabría preguntarse qué ocurriría si se hubiese hecho el planteamiento contrario, si el diseño del estudio se hubiese orientado a la valoración de la perimetría o si se hubiese utilizado un criterio de regresión para la evolución del campo. ¿Cuál hubiese sido el resultado si se hubiese analizado la capacidad de Progressor para detectar pacientes con o sin cambio en HRT?
Algún autor encuentra que en la mitad de los pacientes con defectos en la papila ésta evolucionó, pero solamente tres perdieron campo (103). Estas enormes diferencias solamente pueden explicarse por la orientación del experimento, porque en casos con papila totalmente excavada y sin capacidad de evolucionar, únicamente el campo visual contiene un remanente de información capaz de permitir detectar evolución (fig. 2). En papilas con daño inicial es posible, teóricamente, que la papila tenga una mayor potencialidad de medir evolución, dada la relación logarítmica entre anatomía y función, pero las diferencias que se han encontrado no parecen justificar resultados tan dramáticos que, muy probablemente, son debidos a los criterios utilizados.
Fig. 2. Excavación papilar "borde a borde" y campo visual residual en un caso de glaucoma avanzado.En la ponencia de la Sociedad Española de Oftalmología de 1984 (104) advertíamos que la supuesta precocidad de la anatomía respecto a la función, procede simplemente del desconocimiento de que entre ambas no existe una relación lineal. En una fecha reciente he recibido un e-mail del Prof. Greve en el que divulga, como novedad, la opinión de Pamela Sample en el mismo sentido: «In Perimetry the compression (artifact) of the scale at the early defect end may be the cause of the commonly held assumption that structural damage precedes measurable functional loss».
Esencialmente la limitación de la campimetría para medir evolución depende de la fluctuación de los índices que proporciona. Sin embargo esta fluctuación no es mayor que la que se observa en los índices que aportan los instrumentos objetivos como el HRT. Las únicas posibilidades de reducir la fluctuación son: cuidar los detalles técnicos del examen, promediar los resultados y realizar controles más frecuentes. Estas dos últimas opciones actúan de manera similar. El error se limita en un 25% si se duplica el número de controles o se promedian los resultados de dos exámenes, pero para reducirlo a la mitad habría que multiplicarlo por cinco.
DISCUSIÓN
A la vista de la literatura tenemos que afirmar que, en el estado actual de los conocimientos, no hay razones que obliguen a recomendar a los clínicos el uso de procedimientos de control diferentes de la perimetría estática blanco-blanco, como algo imprescindible.
Ha de aconsejarse el empleo de estrategias de corta duración, realizadas con la mayor frecuencia posible y por un perimetrista riguroso. Se ha de anotar la impresión subjetiva del comportamiento del paciente, porque los falsos positivos y negativos son un mal criterio de control (105,106). Ha de cuidarse no tomar en cuenta el resultado de la primera perimetría si es patológica, corregir la tonometría con el espesor de la córnea y, cuando se aplique la perimetría TOP, utilizar preferentemente como límite diagnóstico un valor de LV de 7 dB2, en lugar del nivel de MD o el número de puntos patológicos.
Aquellos que se dediquen preferentemente al glaucoma harán bien en adquirir un instrumento de topografía papilar, y a los que tengan inquietud investigadora les recomendaría trabajar sobre alguno de los sistemas que utilizan fenómenos temporales.
NOTA
En aquellos trabajos que muestran varias cifras de sensibilidad y especificidad asociadas a diversos criterios diagnósticos, se ha tomado la mejor de ellas.
BIBLIOGRAFÍA
1. Armaly MF. Ocular pressure and visual fields. A ten-year follow-up study. Arch Ophthalmol 1969; 81: 25-40. [ Links ]
2. Armaly MF, Krueger DE, Maunder L et al. Biostatistical analysis of the collaborative glaucoma study. I. Summary report of the risk factors for glaucomatous visual-field defects. Arch Ophthalmol 1980; 98: 2163-2171. [ Links ]
3. Bengtsson B. Manifest glaucoma in the aged I: occurrence nine years after a population survey. Acta Ophthalmol (Copenh) 1981; 59: 321-331. [ Links ]
4. Leske MC, Connell AM, Wu SY et al. Incidence of open-angle glaucoma: the Barbados Eye Studies The Barbados Eye Studies Group. Arch Ophthalmol 2001; 119: 89-95. [ Links ]
5. Kass MA, Heuer DK, Higginbotham EJ et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol 2002; 120: 701-713. [ Links ]
6. Gordon MO, Beiser JA, Brandt JD et al. The Ocular Hypertension Treatment Study: baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol 2002; 120: 714-720. [ Links ]
7. Schwartz B, Nagin P. Probability maps for evaluating autolated visual fields. Doc Ophthalmol Proc Series 1985; 42: 39-48. [ Links ]
8. Sommer A, Duggan C, Aver C, Abbey H. Analytic approaches to the interpretation of automated thereshold perimetric data for the diagnosis of early glaucoma. Trans Am Ophthalmol Soc 1985; 83: 250-267. [ Links ]
9. Enger C, Sommer A. Recognizing glaucomatous field loss with the Humphrey STATPAC. Arch Ophthalmol 1987; 105: 1355-1357. [ Links ]
10. Asman P, Heijl A, Olsson J, Rootzen H. Spatial analyses of glaucomatous visual fields; a comparison with traditional visual field indices. Acta Ophthalmol (Copenh) 1992; 70: 679-686. [ Links ]
11. Simon MA. Desarrollo de un sistema experto para el diagnóstico del glaucoma. Universidad de Valladolid. 1990. Tesina de Licenciatura. [ Links ]
12. Asman P, Heijl A. Glaucoma Hemifield Test. Automated visual field evaluation. Arch Ophthalmol 1992; 110: 812-819. [ Links ]
13. Zeyen TG, Zulauf M, Caprioli J. Priority of test locations for automated perimetry in glaucoma. Ophthalmology 1993; 100: 518-523. [ Links ]
14. Goldbaum MH, Sample PA, White H, Colt B, Raphaelian P, Fechtner RD et al. Interpretation of automated perimetry for glaucoma by neural network. Invest Ophthalmol Vis Sci 1994; 35: 3362-3373. [ Links ]
15. Chandramohan S, Khanna S, Ali B, Coleman A, Baker RS, Wilson MR et al. Comparison of Normative versus Non-normative based Methodology of Visual Field Analysys. Invest Ophthalmol Vis Sci 1996; 37: S507. [ Links ]
16. Anton A. Valor de las redes neuronales y la discriminación logística en el análisis de los defectos del campo visual. Universidad de Valladolid. 1996. Thesis doctoralis. [ Links ]
17. Cordoves L, González de la Rosa MA, Morales J. MD reproducibility with 30-2 and Delphi programs. Invest Ophthalmol Vis Sci 1996; 37: S506. [ Links ]
18. Wishart PK, Wardrop DR, Kosmin AS. Is visual field evaluation using multiple correlations and linear regressions useful? An evaluation of Delphi perimetry. Graefes Arch Clin Exp Ophthalmol 1998; 236: 493-500. [ Links ]
19. Morales J, Weitzman ML, González de la Rosa M. Comparison between Tendency-Oriented Perimetry (TOP) and octopus threshold perimetry. Ophthalmology 2000; 107: 134-142. [ Links ]
20. Fabre K, Michiels I, Zeyen T. The sensitivity and specificity of TOP, FDP and GDX in screening for early glaucoma. Bull Soc Belge Ophtalmol 2000; 275: 17-23. [ Links ]
21. Wadood AC, Azuara-Blanco A, Aspinall P, Taguri A, King AJ. Sensitivity and specificity of frequency-doubling technology, tendency-oriented perimetry, and Humphrey Swedish interactive threshold algorithm-fast perimetry in a glaucoma practice. Am J Ophthalmol 2002; 133: 327-332. [ Links ]
22. Garcia Feijoo J, Carmona Suarez EJ, Gallardo LM, Gonzalez Hernandez M, Fernandez Vidal A, Gonzalez de la Rosa M et al. Desarrollo de un sistema automático de discriminación del campo visual glaucomatoso basado en un clasificador neuro-fuzzy. Arch Soc Esp Oftalmol 2002; 77: 669-676. [ Links ]
23. Sample PA, Bosworth CF, Blumenthal EZ, Girkin C, Weinreb RN. Visual function-specific perimetry for indirect comparison of different ganglion cell populations in glaucoma. Invest Ophthalmol Vis Sci 2000; 41: 1783-1790. [ Links ]
24. Bowd C, Zangwill LM, Berry CC, Blumenthal EZ, Vasile C, Sanchez-Galeana C et al. Detecting early glaucoma by assessment of retinal nerve fiber layer thickness and visual function. Invest Ophthalmol Vis Sci 2001; 42: 1993-2003. [ Links ]
25. Polo V, Larrosa JM, Pinilla I, Pablo L, Honrubia FM. Optimum criteria for short-wavelength automated perimetry. Ophthalmology 2001; 108: 285-289. [ Links ]
26. Polo V, Larrosa JM, Pinilla I, Perez S, Gonzalvo F, Honrubia FM. Predictive value of short-wavelength automated perimetry: a 3-year follow-up study. Ophthalmology 2002; 109: 761-765. [ Links ]
27. Bayer AU, Erb C. Short wavelength automated perimetry, frequency doubling technology perimetry, and pattern electroretinography for prediction of progressive glaucomatous standard visual field defects. Ophthalmology 2002; 109: 1009-1017. [ Links ]
28. Wild JM, Hosking SL, Hutchings N, Flanagan JG, ODonoghue EP. Long-term fluctuation in short-wavelength automated perimetry. Invest Ophthalmol Vis Sci 1997; 38: S571. [ Links ]
29. Rosetti L, Miglior S, Invernizzi T, Orzalesi N. Evaluation of «learning effect» in blue-on-yellow perimetry. Invest Ophthalmol Vis Sci 1999; 40: S844. [ Links ]
30. Blumenthal EZ, Sample PA, Zangwill L, Lee AC, Kono Y, Weinreb RN. A comparison of long term variability in standard automated perimetry and short-wavelength automated perimetry in stable glaucoma patients. Invest Ophthalmol Vis Sci 1999; 40: S581. [ Links ]
31. Remky A, Arend O. Intra-individual variability of blue-yellow perimetry. Ophthalmologe 2000; 97: 774-780. [ Links ]
32. Blumenthal EZ, Sample PA, Zangwill L, Lee AC, Kono Y, Weinreb RN. Comparison of long-term variability for standard and short-wavelength automated perimetry in stable glaucoma patients. Am J Ophthalmol 2000; 129: 309-313. [ Links ]
33. Wild JM. Short wavelength automated perimetry. Acta Ophthalmol Scand 2001; 79: 546-559. [ Links ]
34. Hutchings N, Hosking SL, Wild JM, Flanagan JG. Long-term fluctuation in short-wavelength automated perimetry in glaucoma suspects and glaucoma patients. Invest Ophthalmol Vis Sci 2001; 42: 2332-2337. [ Links ]
35. Soliman MA, de Jong LA, Ismaeil AA, van den Berg TJ, de Smet MD. Standard achromatic perimetry, short wavelength automated perimetry, and frequency doubling technology for detection of glaucoma damage. Ophthalmology 2002; 109: 444-454. [ Links ]
36. Sample PA, Martinez GA, Weinreb RN. Short-wavelength automated perimetry without lens density testing. Am J Ophthalmol 1994; 118: 632-641. [ Links ]
37. Demirel S, Johnson CA. Incidence and prevalence of short wavelength automated perimetry deficits in ocular hypertensive patients. Am J Ophthalmol 2001; 131: 709-715. [ Links ]
38. Kondo Y, Inazumi K, Yamamoto Y, Kitazawa Y. Frequency doubling perimetry as a glaucoma screener. In: Wall M and Wild J Perimetry update 1998/1999. Amsterdam: Kugler Publ; 1999; 73-74. [ Links ]
39. Maddess T, Goldberg I, Dobinson J, Wine S, Welsh AH. Testing for glaucoma with the spatial frequency doubled illusion. Invest Ophthalmol Vis Sci 1998; 39: S26. [ Links ]
40. Johnson CA, Cioffi GA, Van Buskirk EM. Evaluation of two screening tests for Frequency Doubling Technology perimetry. In: Wall M and Wild J Perimetry update 1998/1999. Amsterdam: Kugler Publ; 1999; 103-109. [ Links ]
41. Van Coevorder RE, Mills RP, Wang L, Stanford DC. Efficacy of screening modes of FDT and Dicon perimeters. In: Wall M and Wild J Perimetry update 1998/1999. Amsterdam: Kugler Publ; 1999; 69-72. [ Links ]
42. May F, Renard JP, Rigal-Sastourné JC, Bidaux F, Maurin JF. Frequency-Doubling Perimetry. Evaluation of the C 20.5 screening test. Invest Ophthalmol Vis Sci 1999; 40: S69. [ Links ]
43. Paczka JA, Quigley HA, Friedman DS, Barron Y, Vitale S. Capabilities of Frequency-Doubling Technology, scanning laser polarimetry and nerve fiber layer photographs to distinguish glaucomatous damage. Invest Ophthalmol Vis Sci 1999; 40: S841. [ Links ]
44. Yamada N, Chen PP, Mills RP et al. Screening for glaucoma with frequency-doubling technology and Damato campimetry. Arch Ophthalmol 1999; 117: 1479-1484. [ Links ]
45. Trible JR, Schultz RO, Robinson JC, Rothe TL. Accuracy of glaucoma detection with frequency-doubling perimetry. Am J Ophthalmol 2000; 129: 740-745. [ Links ]
46. Cello KE, Nelson-Quigg JM, Johnson CA. Frequency doubling technology perimetry for detection of glaucomatous visual field loss. Am J Ophthalmol 2000; 129: 314-322. [ Links ]
47. Yamashiro H, Tanaka M, Saito M, Shirato S. The ability of frequency doubling technology to detect abnormality of visual function in early glaucoma. Nippon Ganka Gakkai Zasshi 2001; 105: 488-493. [ Links ]
48. Andrada MT, Bernaldo De Quiros P, Villegas RS, Anton A. Precision diagnostica de la perimetria de duplicacion de frecuencia. Arch Soc Esp Oftalmol 2001; 76: 711-718. [ Links ]
49. Gonzalez de la Rosa M. The Liverpool Delphi evaluation. Graefes Arch Clin Exp Ophthalmol 1999; 237: 259-261. [ Links ]
50. Horn FK, Velten IM, Junemann A, Korth M. The full-field flicker test in glaucomas: influence of intraocular pressure and pattern of visual field losses. Graefes Arch Clin Exp Ophthalmol 1999; 237: 621-628. [ Links ]
51. González de la Rosa M, Rodríguez J, Rodriguez M. Flicker-TOP perimetry in normals and patients with ocular hypertension and early glaucoma. In: Wall M and Wild J Perimetry update 1998/1999. Amsterdam: Kugler Publ; 1999; 59-66. [ Links ]
52. Rodriguez J, Cordobes L, Abreu A, Gonzalez de la Rosa M. TOP-Flicker fluctuation in ocular hipertension. In: Wall M and Mills R Perimetry update 2000/2001. Amsterdam: Kugler Publ; 2001; 149-153. [ Links ]
53. Gonzalez Hernandez M. Perimetrias de modulacion temporal y movimiento. Dependencias respecto a la percepcion del contraste y la resolucion espacial. Aplicacion al diagnostico precoz del glaucoma. Universidad de La Laguna. 2002. Thesis doctoralis. [ Links ]
54. Vidal Fernandez A, Garcia Feijoo J, Gonzalez-Hernandez M, Gonzalez De La Rosa M, Garcia Sanchez J. Primeros hallazgos con perimetria Pulsar en pacientes hipertensos oculares. Arch Soc Esp Oftalmol 2002; 77: 321-326. [ Links ]
55. Quigley HA, Miller NR, George T. Clinical evaluation of nerve fiber layer atrophy as an indicator of glaucomatous optic nerve damage. Arch Ophthalmol 1980; 98: 1564-1571. [ Links ]
56. Airaksinen PJ, Drance SM, Douglas GR, Mawson DK, Nieminen H. Diffuse and localized nerve fiber loss in glaucoma. Am J Ophthalmol 1984; 98: 566-571. [ Links ]
57. Sommer A, Quigley HA, Robin AL, Miller NR, Katz J, Arkell S. Evaluation of nerve fiber layer assessment. Arch Ophthalmol 1984; 102: 1766-1771. [ Links ]
58. Kremmer S, Ayertey HD, Selbach JM, Steuhl KP. Scanning laser polarimetry, retinal nerve fiber layer photography, and perimetry in the diagnosis of glaucomatous nerve fiber defects. Graefes Arch Clin Exp Ophthalmol 2000; 238: 922-926. [ Links ]
59. Greenfield DS. Optic nerve and retinal nerve fiber layer analyzers in glaucoma. Curr Opin Ophthalmol 2002; 13: 68-76. [ Links ]
60. Tjon-Fo-Sang MJ, Lemij HG. The sensitivity and specificity of nerve fiber layer measurements in glaucoma as determined with scanning laser polarimetry. Am J Ophthalmol 1997; 123: 62-69. [ Links ]
61. Choplin NT, Lundy DC, Dreher A. Differentiating patients with ocular hypertension or open angle glaucoma from normals by nerve fiber layer thickness measurement with scanning laser polarimetry. Invest Ophthalmol Vis Sci 1997; 38: S836. [ Links ]
62. Garcia Sanchez J, García Feijoó J, González de la Rosa MA, Arias Puente A. Análisis de la capa de fibras nerviosas de la retina. 2. Métodos objetivos de la exploración de la capa de fibras nerviosas. In: Honrubia López FM, García Sánchez J, Pastor Gimeno JC et al. Diagnóstico precoz del glaucoma. Madrid: Sociedad Española de Oftalmología; 1997; 113-138. [ Links ]
63. Weinreb RN, Zangwill L, Berry CC, Bathija R, Sample PA. Detection of glaucoma with scanning laser polarimetry. Arch Ophthalmol 1998; 116: 1583-1589. [ Links ]
64. Trible JR, Schultz RO, Robinson JC, Rothe TL. Accuracy of scanning laser polarimetry in the diagnosis of glaucoma. Arch Ophthalmol 1999; 117: 1298-1304. [ Links ]
65. Essock EA, Sinai MJ, Fechtner RD, Srinivasan N, Bryant FD. Fourier analysis of nerve fiber layer measurements from scanning laser polarimetry in glaucoma: emphasizing shape characteristics of the 'double-hump' pattern. J Glaucoma 2000; 9: 444-452. [ Links ]
66. Sanchez-Galeana C, Bowd C, Blumenthal EZ, Gokhale PA, Zangwill LM, Weinreb RN. Using optical imaging summary data to detect glaucoma. Ophthalmology 2001; 108: 1812-1818. [ Links ]
67. Zangwill LM, Bowd C, Berry CC, Williams J, Blumenthal EZ, Sanchez-Galeana CA et al. Discriminating between normal and glaucomatous eyes using the Heidelberg Retina Tomograph, GDx Nerve Fiber Analyzer, and Optical Coherence Tomograph. Arch Ophthalmol 2001; 119: 985-993. [ Links ]
68. Lauande-Pimentel R, Carvalho RA, Oliveira HC, Goncalves DC, Silva LM, Costa VP. Discrimination between normal and glaucomatous eyes with visual field and scanning laser polarimetry measurements. Br J Ophthalmol 2001; 85: 586-591. [ Links ]
69. Funaki S, Shirakashi M, Yaoeda K, Abe H, Kunimatsu S, Suzuki Y et al. Specificity and sensitivity of glaucoma detection in the Japanese population using scanning laser polarimetry. Br J Ophthalmol 2002; 86: 70-74. [ Links ]
70. Greaney MJ, Hoffman DC, Garway-Heath DF, Nakla M, Coleman AL, Caprioli J. Comparison of optic nerve imaging methods to distinguish normal eyes from those with glaucoma. Invest Ophthalmol Vis Sci 2002; 43: 140-145. [ Links ]
71. Bathija R, Zangwill L, Berry CC, Sample PA, Weinreb RN. Detection of early glaucomatous structural damage with confocal scanning laser tomography. J Glaucoma 1998; 7: 121-127. [ Links ]
72. Uchida H, Tomita G, Shibahara S, Sugiyama K, Kitazawa Y. Diagnostic capabilities of a classification program of the Heidelberg retina tomograph for early glaucomatous changes. Nippon Ganka Gakkai Zasshi 1998; 102: 333-339. [ Links ]
73. Wollstein G, Garway-Heath DF, Hitchings RA. Identification of early glaucoma cases with the scanning laser ophthalmoscope. Ophthalmology 1998; 105: 1557-1563. [ Links ]
74. Garway-Heath DF, Ruben ST, Viswanathan A, Hitchings RA. Vertical cup/disc ratio in relation to optic disc size: its value in the assessment of the glaucoma suspect. Br J Ophthalmol 1998; 82: 1118-1124. [ Links ]
75. Wollstein G, Garway-Heath DF, Fontana L, Hitchings RA. Identifying early glaucomatous changes. Comparison between expert clinical assessment of optic disc photographs and confocal scanning ophthalmoscopy. Ophthalmology 2000; 107: 2272-2277. [ Links ]
76. Jonas JB, Bergua A, Schmitz-Valckenberg P, Papastathopoulos KI, Budde WM. Ranking of optic disc variables for detection of glaucomatous optic nerve damage. Invest Ophthalmol Vis Sci 2000 ; 41: 1764-1773. [ Links ]
77. Ahn BS, Kee C. Ability of a confocal scanning laser ophthalmoscope (TopSS) to detect early glaucomatous visual field defect. Br J Ophthalmol 2000; 84: 852-855. [ Links ]
78. Liu X, Ling Y, Luo R, Ge J, Zheng X. Optical coherence tomography in measuring retinal nerve fiber layer thickness in normal subjects and patients with open-angle glaucoma. Chin Med J 2001; 114: 524-529. [ Links ]
79. Cullinane AB, Waldock A, Diamond JP, Sparrow JM. Optic disc cup slope and visual field indices in normal, ocular hypertensive and early glaucomatous eyes. Br J Ophthalmol 2002; 86: 555-559. [ Links ]
80. Pfeiffer N, Bach M. The pattern-electroretinogram in glaucoma and ocular hipertension. A cross-sectional and longitudinal study. Ger J Ophthalmol 1992; 1: 35-40. [ Links ]
81. Benitez del Castillo J. Los potenciales evocados visuales en la evaluacion diagnostica del glaucoma. Universidad de Cadiz, 1996. Thesis doctoralis. [ Links ]
82. Fernandez FJ, Almarcegui C, Honrubia FM. Las tecnicas electrofisiologicas en el diagnostico precoz del glaucoma. In: Honrubia Lopez FM, Garcia Sanchez J, Pastor Gimeno JC et al. Diagnostico precoz del glaucoma. Madrid: Sociedad Española de Oftalmología; 1997; 49-76. [ Links ]
83. Viswanathan S, Frishman LJ, Robson JG, Walters JW. The photopic negative response of the flash electroretinogram in primary open angle glaucoma. Invest Ophthalmol Vis Sci 2001; 42: 514-522. [ Links ]
84. Drasdo N, Aldebasi YH, Chiti Z, Mortlock KE, Morgan JE, North RV. The s-cone PHNR and pattern ERG in primary open angle glaucoma. Invest Ophthalmol Vis Sci 2001; 42: 1266-1272. [ Links ]
85. Bayer AU, Maag KP, Erb C. Detection of optic neuropathy in glaucomatous eyes with normal standard visual fields using a test battery of short-wavelength automated perimetry and pattern electroretinography. Ophthalmology 2002; 109: 1350-1361. [ Links ]
86. Sample PA, Bosworth CF, Blumenthal EZ, Girkin C, Weinreb RN. Visual function-specific perimetry for indirect comparison of different ganglion cell populations in glaucoma. Invest Ophthalmol Vis Sci 2000; 41: 1783-1790. [ Links ]
87. Zangwill LM, Bowd C, Berry CC, Williams J, Blumenthal EZ, Sanchez-Galeana CA, Vasile C, Weinreb RN. Discriminating between normal and glaucomatous eyes using the Heidelberg Retina Tomograph, GDx Nerve Fiber Analyzer, and Optical Coherence Tomograph. Arch Ophthalmol 2001; 119: 985-993. [ Links ]
88. Greaney MJ, Hoffman DC, Garway-Heath DF, Nakla M, Coleman AL, Caprioli J. Comparison of optic nerve imaging methods to distinguish normal eyes from those with glaucoma. Invest Ophthalmol Vis Sci 2002; 43: 140-145. [ Links ]
89. Gonzalez de la Rosa M, Gonzalez Hernandez M, Abraldes M, Azuara-Blanco A. Quantification of interpoint topographic correlations of threshold values in glaucomatous visual fields. J Glaucoma 2002; 11: 30-34. [ Links ]
90. Gonzalez de la Rosa M, Gonzalez Hernandez M, Aguilar Estevez J, Abreu Reyes A, Pareja Rios A. Clasificacion topografica del campo visual glaucomatoso. Arch Soc Esp Oftalmol 2002; 77: 87-94. [ Links ]
91. Gonzalez Hernandez M, Martinez Piñero A, Fariña FJ, Gonzalez de la Rosa M. Relation between the Mean Defect and the Loss Variance in TOP and Bracketing perimetric strategies. Invest Ophthalmol Vis Sci 1999; 40: S68. [ Links ]
92. Gonzalez de la Rosa M, Morales J, Dannheim F, Papst E, Papst N, Seiler TJ, Matsumoto C, Lachkar Y, Mermoud A, Prünte Ch. Multicenter evaluation of Tendency Oriented Perimetry (TOP) using the G1 grid. Eur J Ophthalmol 2003; 13: 32-41. [ Links ]
93. Gonzalez de la Rosa M, Pareja A. Influence of the «fatigue effect» on the mean deviation measurement in perimetry. Eur J Ophthalmol 1997; 7: 29-34. [ Links ]
94. Drasdo N, Aldebasi YH, Chiti Z, Mortlock KE, Morgan JE, North RV. The s-cone PHNR and pattern ERG in primary open angle glaucoma. Invest Ophthalmol Vis Sci 2001; 42: 1266-1272. [ Links ]
95. Lee AC, Sample PA, Blumenthal EZ, Berry C, Zangwill L, Weinreb RN. Infrequent confirmation of visual field progression. Ophthalmology 2002; 109: 1059-1065. [ Links ]
96. Viswanathan AC, Fitzke FW, Hitchings RA. Early detection of visual field progression in glaucoma: a comparison of PROGRESSOR and STATPAC 2. Br J Ophthalmol 1997; 81: 1037-1042. [ Links ]
97. Heijh A, Bengtsson B. Visual field progresión in glaucoma. Br J Ophthalmol 1997; 81: 1097-1098. [ Links ]
98. Viswanathan AC, Fitzke FW, Hitchings RA. Visual field progresión in glaucoma. Reply. Br J Ophthalmol 1997; 81: 1098. [ Links ]
99. Girkin CA, Emdadi A, Sample PA, Blumenthal EZ, Lee AC, Zangwill LM et al. Short-wavelength automated perimetry and standard perimetry in the detection of progressive optic disc cupping. Arch Ophthalmol 2000; 118: 1231-1236. [ Links ]
100. Polo V, Larrosa JM, Pinilla I, Perez S, Gonzalvo F, Honrubia FM. Predictive value of short-wavelength automated perimetry: a 3-year follow-up study. Ophthalmology 2002; 109: 761-765. [ Links ]
101. Chauhan BC, McCormick TA, Nicolela MT, LeBlanc RP. Optic disc and visual field changes in a prospective longitudinal study of patients with glaucoma: comparison of scanning laser tomography with conventional perimetry and optic disc photography. Arch Ophthalmol 2001; 119: 1492-1499. [ Links ]
102. Kamal DS, Garway-Heath DF, Hitchings RA, Fitzke FW. Use of sequential Heidelberg retina tomograph images to identify changes at the optic disc in ocular hypertensive patients at risk of developing glaucoma. Br J Ophthalmol 2000; 84: 993-998. [ Links ]
103. Mardin CY, Horn F, Budde WM, Jonas JB. Monitoring of morphometric changes of optic discs with morphologic progression of glaucomatous optic atrophy by means of laser scanner tomography. Klin Monatsbl Augenheilkd 2000; 217: 82-87. [ Links ]
104. Gonzalez de la Rosa M, Arias Puente A, Morales J, Garcia Sanchez J. Analisis del Campo Visual. In: Honrubia Lopez FM, Garcia Sanchez J, Pastor Gimeno JC et al. Diagnóstico precoz del glaucoma. Madrid: Sociedad Española de Oftalmología; 1997; 249-370. [ Links ]
105. Bengtsson B, Heijl A. False-negative responses in glaucoma perimetry: indicators of patient performance or test reliability? Invest Ophthalmol Vis Sci 2000; 41: 2201-2204. [ Links ]
106. Pareja Ríos A, Arteaga Hernández V, González Hernández M, González de la Rosa M. Efecto del uso de estímulos acústicos en perimetría. Arch Soc Can Oftalmol 2000; 11: 3-6. [ Links ]