Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.78 no.10 oct. 2003
REVISIÓN
TOXOPLASMOSIS OCULAR
OCULAR TOXOPLASMOSIS
DODDS EM1
| RESUMEN Propósito: Realizar una actualización sobre los aspectos más salientes de la toxoplasmosis ocular. Palabras clave: Toxoplasmosis, retinitis, toxoplasma gondii, transmisión, serología.
| SUMMARY Purpose: To update the current concepts in ocular toxoplasmosis. Key words: Toxoplasmosis, toxoplasma gondii, retinitis, transmission, serology.
|
Recibido:20/7/03. Aceptado: 9/10/03.
Consultores Oftalmológicos. Buenos Aires. Argentina.
1 Médico Oftalmólogo.
Correspondencia:
Emilio M. Dodds
Montevideo 1410
(1018) Buenos Aires
Argentina
E-mail: emdodds@consultoresoftalmologicos.com
DEFINICIÓN
La toxoplasmosis ocular es una enfermedad producida por el parásito Toxoplasma gondii, quien cumple su ciclo celular completo en su huésped definitivo, que es el gato. El término «toxon» deriva del griego y significa arco, debido a la forma de luna creciente que tiene el parásito; y gondii de un roedor africano donde el parásito fue identificado.
Su morfología varía de acuerdo al hábitat y al estadio evolutivo, adquiriendo diferentes formas durante su ciclo conocidas como taquizoíto, bradizoíto y ooquiste.
El taquizoíto recibe su nombre debido a la capacidad de multiplicarse en forma rápida dentro del citoplasma celular. Es la forma proliferativa que se encuentra presente durante la fase aguda de la infección y es susceptible a los jugos gástricos y a una diversidad de drogas antiparasitarias.
El bradizoíto es la forma crónica que se localiza en la retina y en otros tejidos como el cerebro, músculo esquelético y corazón tras la primoinfección. Se denomina de esta manera por su lenta multiplicación y su capacidad de permanecer inactivo por largos períodos de tiempo. Cada bradizoíto puede contener más de 3000 organismos en su interior y debido a que forman una cápsula, son muy resistentes y pueden persistir por años en los tejidos.
El ooquiste es la forma que libera el gato por la materia fecal. Es altamente resistente al medio ambiente y es el responsable de contaminar a otros animales incluyendo al hombre a través de diferentes vectores (1).
TRANSMISIÓN
Es bien sabido que el huésped definitivo del Toxoplasma gondii es el gato, donde se cumple la fase sexuada y asexuada del ciclo evolutivo del parásito. El contagio del gato se puede producir por la ingestión de quistes en los tejidos de pájaros y roedores, como también por la ingestión de ooquistes esporulados presentes en el suelo. En el gato joven no inmunizado, al ser ingerido el parásito se aloja y reproduce en el epitelio del intestino delgado. A partir de allí es que el gato elimina al parásito por la materia fecal. Los ooquistes son eliminados por el gato por aproximadamente un mes en un número que puede llegar a los 10 millones diarios. Son la forma de resistencia al medio ambiente y pueden mantenerse infectantes por 12 a 18 meses en condiciones adecuadas de calor y humedad.
Una vez eliminado por la materia fecal, el parásito puede contaminar el medio ambiente y a otros animales.
Modos de transmisión
La vía por la cual el parásito llega al hombre es variable, no del todo conocida y puede tener variaciones geográficas de acuerdo a los hábitos y costumbres de cada región del planeta.
Probablemente la ingestión de quistes de tejidos que se encuentran en la carne cruda o mal cocida de diferentes animales sea la principal vía de contagio.
Existe una amplia variación de la prevalencia de serología positiva en diferentes animales de acuerdo a las regiones estudiadas. Una muestra en Brasil mostró que tenían serología positiva para toxoplasmosis el 29% de las cabras, el 19% de las ovejas, y el 1% del ganado vacuno, mientras que un trabajo similar realizado en otra región como Vietnam mostraba que el 10% del ganado vacuno era positivo. Otra muestra realizada en Serbia encontró un 87% del ganado vacuno positivo, un 85% de ovejas y sólo un 15% en cerdos (2-4).
La carne de cerdo es la que históricamente se consideraba más comúnmente responsable de esta vía de contagio. Un estudio en Massachusetts mostró que, al alimentar gatos con serología negativa con carne de cerdo destinada a consumo humano, 51 de 55 cerdos estaban contaminados con T. Gondii (93%) (5).
En Brasil, la carne de pollo es también considerada una forma de transmisión, habiéndose encontrado resultados positivos en el 20-40% de las muestras testeadas (6).
Existen recomendaciones para poder eliminar el parásito de los tejidos para que sean viables para el consumo. Congelar la carne a –12 grados C durante más de tres días, o cocinar la carne a 67 grados C de temperatura interna pueden matar a los quistes que se encuentran en los tejidos (7).
A pesar de estas recomendaciones, también ha sido demostrada la presencia de toxoplasma gondii en carne lista para ser consumida. La utilización de la reacción en cadena de la polimerasa (PCR) ha dado resultados positivos para T. gondii en el 1,5% (1/67) de las muestras en un estudio y en el 38% de las muestras en otra serie (27/71) (8,9).
Además de la carne de diferentes animales, las frutas y verduras pueden actuar como vectores para llevar el parásito hasta el hombre y provocar el contagio de la enfermedad. Esta contaminación puede ser hecha directamente por el gato o por medio de otros vectores que llevan los ooquistes, como pueden ser las moscas o cucarachas.
Los ooquistes presentes en el suelo, pueden también ser inhalados y está descrita una epidemia de toxoplasmosis en un establo donde se presume, de acuerdo a estudios realizados por el Center for Disease Control (CDC), que fue producida por inhalación de ooquistes, donde 37 personas adquirieron la enfermedad en forma aguda, de las cuales una sola (2,7%) desarrolló toxoplasmosis ocular en un período de seguimiento de 4 años (10).
Un factor anteriormente poco considerado como es la transmisión del parásito a través del agua, ha surgido en los últimos años como una forma de contagio de la enfermedad, y tal vez sea de una magnitud que hasta el momento no ha sido correctamente valorada. Han sido descritas zonas endémicas y dos grandes epidemias de toxoplasmosis provocadas por la contaminación de agua potable. Una de ellas ha sido en British Columbia, Canadá y la otra en el estado de Paraná, Brasil (6,11,12).
En Greater Victoria, un área de British Columbia en Canadá, cien personas cumplieron los criterios diagnósticos de toxoplasmosis adquirida. Las edades variaron entre 6 a 83 años, 19 personas tuvieron retinitis y 51 linfadenopatía. De los otros pacientes, algunos presentaron síntomas inespecíficos mientras que otros fueron asintomáticos. La fuente probable del parásito estaba en un reservorio de agua municipal no filtrada que había adquirido un aspecto turbio como consecuencia de un exceso de lluvias.
En Santa Isabel do Ivaí en Brasil, ocurrió una epidemia en diciembre de 2001. Más de 600 personas se presentaron con síntomas de fiebre, dolores musculares, astenia, ganglios, lesiones cutáneas y amigdalitis. La fuente de infección fue un reservorio de agua que abastecía la ciudad, donde se pudo aislar al Toxoplasma gondii. Al igual que en el caso de Canadá, esto ocurrió después de un período de lluvias intensas. De los 561 pacientes seguidos por más de dos años, el 13,2% tuvieron manifestaciones oculares: un 6,8% lesiones de retinitis típicas de toxoplasmosis y el resto de los pacientes (36/561) lesiones blanquecinas retinales evanescentes, vasculitis, uveítis anterior y vitreítis.
Una de las primeras formas de contagio conocidas fue la vía transplacentaria, en la cual la madre en período de gestación contrae la enfermedad y transmite el parásito al feto a través de la placenta. Esta forma es la responsable de las manifestaciones características de toxoplasmosis congénita. Aunque existen variaciones regionales, y de acuerdo a los distintos programas de screening pre-natal y tratamiento ante-natal y post-natal, la sero-conversión de las mujeres en período de embarazo permite que el parásito pase al feto en aproximadamente un 30-40% de los casos, dependiendo de varios factores como puede ser el período del embarazo en el que se produzca el contagio y la carga de parásito asociada a la forma de contagio. De los fetos que tienen un contagio, aproximadamente el 60% serán totalmente asintomáticos y el 40% restante tendrán síntomas de gravedad variable.
Un estudio utilizó PCR cuantitativa para ver la influencia de la carga parasitaria en la enfermedad congénita y mostró que cuanto más precoz en la edad gestacional había sido el contagio mayor era la carga parasitaria y cuanto mayor la carga parasitaria, eran mayores las manifestaciones de toxoplasmosis congénita. (13)
Los transplantes de órganos y la leche no pasteurizada también han sido referidos como causa de contagio de la toxoplasmosis ocular (14,15).
CARACTERÍSTICAS OCULARES
Antiguamente se pensaba que la toxoplasmosis ocular era una enfermedad adquirida en forma congénita y que posteriormente podía tener reactivaciones tardías.
Actualmente sin embargo, este concepto ha variado con nuevos datos epidemiológicos donde se han demostrado formas adquiridas mediante el contagio por alimentos, agua, y aire. Las cicatrices de las cuales se produce la reactivación ocular que es la forma que más comúnmente observamos en los pacientes, probablemente se trate de una infección adquirida anteriormente pero no de una lesión congénita. En la mayoría de los casos esta primera lesión pasa desapercibida y es en la reactivación donde se producen los síntomas de la enfermedad ocular.
La toxoplasmosis ocular es una entidad cuyo diagnóstico se basa en los hallazgos oculares, ya que las muestras de laboratorio solamente comprueban que la persona ha tenido con anterioridad contacto con el parásito, pero no confirman el diagnóstico de la enfermedad. Menos importancia aún tienen estas pruebas serológicas en países donde la prevalencia de anticuerpos en la población general es elevada. Basándonos nuevamente en la hipótesis anterior donde las formas adquiridas con reactivaciones tardías son las más comunes de encontrar entre los pacientes que concurren a la consulta, entonces los hallazgos serológicos serán de IgM negativa y valores positivos variables de IgG.
Básicamente se debe considerar que el parásito se aloja en la retina en la forma de bradizoítos enquistados y al romperse este quiste por motivos que aún se desconocen, se desarrolla una retinitis, ya que éste es el órgano inicialmente comprometido. Es importante considerar a la toxoplasmosis ocular como una retinitis y de esta forma de pensamiento surge que las retinitis serán las entidades a tener en cuenta entre los diagnósticos diferenciales de la enfermedad.
En la presentación más común de toxoplasmosis ocular, la forma recurrente, esta retinitis se localiza adyacente a una cicatriz coriorretiniana previa. Un estudio sobre recurrencias de la toxoplasmosis ocular mostró que un 75% de los pacientes en su primera consulta ya tenían una cicatriz previa que había pasado desapercibida (16). El resultado de esta retinitis previa combinada con la reacción inflamatoria que compromete al epitelio pigmentario y la coroides, es la que le da el nombre inexacto de coriorretinitis a la toxoplasmosis ocular.
La retinitis ocasionada por el parásito se asocia con manifestaciones inflamatorias de magnitud variable que pueden involucrar distintas partes del ojo produciendo vasculitis, vitritis, coroiditis y uveítis anterior (17) (fig. 1).

Fig. 1. Uveítis anterior asociada a toxoplasmosis ocular.
La vasculitis puede afectar tanto a las arterias como a las venas y afectar no sólo a los vasos adyacentes a la lesión activa sino también a toda la circulación retinal simulando el cuadro de «frosted branch angiitis».
El compromiso del humor vítreo también es sumamente variable y no está claro de qué depende. Algunos pacientes que no son tratados nunca desarrollan vitritis y otros pacientes que demoran un poco el tratamiento llegan a tener vitritis tan severas como para requerir una vitrectomía.
Cuando se produce un desprendimiento del vítreo posterior inducido por la inflamación es posible ver precipitados inflamatorios por detrás de la hialoides y esto es un hallazgo común en la toxoplasmosis ocular.
La uveítis anterior aparece en aproximadamente el 50% de los pacientes con toxoplasmosis ocular. Cuando las células en la cámara anterior ascienden a 2+ o mayor, la presión intraocular suele estar elevada y característicamente responde muy bien a los corticoides tópicos, por lo que el mecanismo más probable sea el de trabeculitis. Por otro lado, cabe destacar, que la uveítis anterior no se produce por un fenómeno de rebasamiento, ya que aún pacientes con poca inflamación en el vítreo pueden tener inflamación intensa de la cámara anterior (18).
FORMAS CLÍNICAS DE PRESENTACIÓN
Toxoplasmosis congénita
Se produce cuando la infección materna ocurre durante el embarazo. La incidencia de infección congénita es menor en el primer trimestre, pero suele ser más severa. Si la infección es adquirida durante el tercer trimestre, la transmisión al feto ocurre casi en el 60% de los casos, probablemente debido a una mayor vascularización de la placenta. La retinocoroiditis es la manifestación más común (fig. 2). Es bilateral en el 85% de los pacientes, y afecta la mácula en el 58% de ellos. Las lesiones oculares no necesariamente están presentes en el momento del nacimiento ya que pueden ir apareciendo en los meses posteriores. Es por eso que en algunos países se realiza tratamiento antibiótico durante el primer año de vida, aunque su beneficio real aún no ha sido definitivamente demostrado. Otras lesiones que pueden asociarse a la toxoplasmosis congénita son hidrocefalia, microcefalia, convulsiones, calcificaciones cerebrales, organomegalia, rash y fiebre (19,20).

Fig. 2. Lesión central típica de toxoplasmosis congénita.
Es la forma clínica más común de toxoplasmosis ocular que típicamente se presenta como un foco de retinitis adyacente a una cicatriz coriorretiniana que se produjo como resultado de una infección adquirida previamente (fig. 3). Afecta a adultos jóvenes de ambos sexos, generalmente en forma unilateral, a pesar que ambos ojos pueden tener cicatrices coriorretinianas. Los títulos de anticuerpos suelen ser bajos debido al lapso transcurrido entre la primoinfección adquirida tempranamente en la vida y la retinocoroiditis que se manifiesta tardíamente (75% entre los 10 y 35 años de edad) (1,17).

Fig. 3. Reactivación de retinitis asociada a cicatriz previa en toxoplasmosis
recurrente.
Siempre se consideró, siguiendo las enseñanzas de Perkins, que la toxoplasmosis ocular era una secuela de una infección congénita. Sin embargo, en 1988 se encontraron mas de 150 familias en Erexim (Brasil) donde múltiples hermanos tenían toxoplasmosis ocular, lo que indicaba que muchos casos eran adquiridos. Actualmente se considera que hasta la mayor parte de los casos de toxoplasmosis ocular podrían ser adquiridos en forma postnatal. Un valor positivo de IgM confirma una toxoplasmosis adquirida, pero valores elevados de IgG en un joven o en un adulto sugiere fuertemente una toxoplasmosis adquirida (6,11,12,21-25) (fig. 4).

Fig. 4. Retinitis sin cicatriz previa en un caso de toxoplasmosis adquirida.
Algunos pocos casos de toxoplasmosis ocular han sido descritos en pacientes con SIDA. A diferencia de la toxoplasmosis ocular tradicional, las lesiones pueden no originarse de cicatrices coriorretinianas previas, pueden ser bilaterales, difusas y multifocales (fig. 5). Estudios histológicos mostraron escasa reacción inflamatoria en la retina, pero pudo encontrarse el parásito en el humor vítreo y hasta en el iris. Diferentes mecanismos patogénicos ocurren en pacientes sanos comparados con inmunosuprimidos. La toxoplasmosis intracraneal es común en pacientes con SIDA. Un estudio mostró que entre los pacientes con SIDA y trastornos neurológicos, el 33% tenían toxoplasmosis. La toxoplasmosis ocular en pacientes con SIDA probablemente sea secundaria a una infección adquirida o a diseminación de otros órganos. Los pacientes deberán recibir tratamiento de mantenimiento, luego de resuelta la retinitis activa (26-30).

Fig. 5. Retinitis difusa en un paciente con SIDA.
Toxoplasmosis relacionada con corticoides
Casos atípicos de retinitis muy extensas han sido descritos en la literatura en pacientes tratados con corticoides durante largos períodos (fig. 6). Estos pacientes inmunocompetentes en los que el tratamiento antiparasitario no es implementado y a su vez reciben corticoides locales de depósito o sistémicos, pueden desarrollar lesiones extensas que pueden semejar una necrosis aguda de retina (31,32).

Fig. 6. Retinitis extensa en un paciente tratado solamente con corticoides
por dos meses.
Hay pacientes que por su enfermedad de base deben ser tratados con drogas inmunosupresoras. Esto no constituye una inmunosupresión total como la que podemos observar en el SIDA, sin embargo la toxoplasmosis ocular puede presentarse de manera diferente a lo que habitualmente observamos, con la consiguiente dificultad para reconocerla. Extensas zonas de necrosis retiniana pueden ser observadas en estos pacientes, a pesar del tratamiento adecuado (33-35).
Toxoplasmosis relacionada a la edad
La edad por sí misma constituye un factor de riesgo para tener formas extensas y difusas de toxoplasmosis ocular similar a la que se observa en los pacientes tratados con corticoides o en inmunosuprimidos (fig. 7). Las lesiones agudas pueden ser multifocales y difusas y típicamente no están asociadas con una cicatriz previa, lo que hace posible que sean formas adquiridas que cursan con títulos elevados de IgG o inclusive IgM presente en algunos casos. El tratamiento debe ser prolongado para lograr la resolución de estos cuadros y las recurrencias son mayores al 50% al suspender el tratamiento (36).

Fig. 7. Lesión extensa en un paciente de 70 años sin otros factores de
riesgo.
La perivasculitis es un hallazgo frecuente en toxoplasmosis ocular. Este envainamiento puede ocurrir adyacente a un foco de coriorretinitis o puede ocurrir a distancia. No hay evidencia angiográfica que estas placas puedan bloquear la arteria. Su origen sería debido a una reacción antígeno-anticuerpo que se manifiesta en la pared de los vasos. Por otro lado puede producirse una vasculitis más severa con obstrucción vascular en los lugares de retinitis activa, probablemente por la necrosis retinal que allí se genera (fig. 8). Tanto obstrucciones arteriales como venosas han sido observadas. Es importante reconocer estos cuadros ya que modifican el aspecto típico de la toxoplasmosis ocular (37).

Fig. 8. Obstrucción venosa asociada a cicatriz por toxoplasmosis.
Se trata de un edema de papila unilateral que se manifiesta como una masa blanquecina inflamatoria adyacente al nervio óptico (figs. 9 a y b). Conserva buena agudeza visual si la mácula no está comprometida. Esta inflamación del nervio óptico puede asociarse con una estrella macular simulando una neurorretinitis de otras causas (neurorretinitis idiopática estrellada de Leber, enfermedad por arañazo de gato) (38).

Fig. 9a. Neurorretinitis por toxoplasmosis.
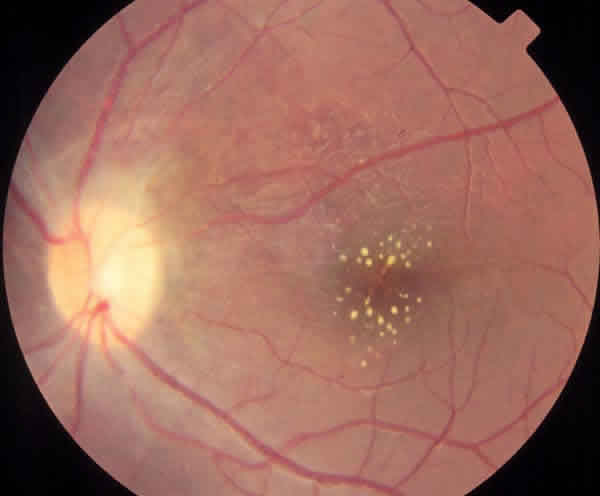
Fig. 9b. Resuelta tras el tratamiento para toxoplasmosis.
DIAGNÓSTICO
La toxoplasmosis ocular se diagnostica clínicamente. Como es la forma de uveítis posterior más común en muchos países es bueno considerar que cuando un paciente adulto joven inmunocompetente se presenta con una retinitis focal asociada o no a una cicatriz coriorretiniana, deberá considerarse que la toxoplasmosis ocular es el diagnóstico más probable.
La IgM aparece en la primera semana de la infección y a pesar de que desaparece en el transcurso de varios meses, es un marcador de fase aguda de la enfermedad. La IgG se eleva en la primera semana de la infección y alcanza su pico alrededor de las 8 semanas. A partir de allí comienzan un lento descenso que puede llevar hasta dos años, donde alcanza sus valores bajos que van a persistir durante toda la vida.
La serología puede ayudar al diagnóstico porque confirma exposición al parásito Toxoplasma gondii, pero no se puede realizar un diagnóstico de toxoplasmosis ocular basándose en la presencia de anticuerpos. Recordemos que la presentación más común de toxoplasmosis ocular es la forma recurrente que se manifiesta con una retinitis asociada una cicatriz previa, por lo tanto los títulos de IgG anti toxoplasmosis pueden ser bajos, ya que la primoinfección fue adquirida tempranamente en la vida y la reactivación ocular no es suficiente para elevar la respuesta inmune sistémica.
Títulos positivos de IgM anti toxoplasmosis confirman una infección adquirida en los últimos meses, y títulos elevados de IgG en jóvenes y adultos sugieren también una forma adquirida en el pasado próximo. Se considera una serología negativa a aquélla en la que aún en suero no diluído (1:1), no se detectan anticuerpos para toxoplamosis.
Dentro de las pruebas de laboratorio para detectar anticuerpos se encuentra la reacción de Sabin-Feldman, que es poco utilizada, ya que se necesitan parásitos vivos para realizarla. Es la técnica de referencia para todas las demás. Las pruebas que más se utilizan son el test de ELISA o la inmunofluorescencia indirecta (IFI).
El test de ELISA tiene ventajas para detectar IgM mientras que para IgG es similar a la IFI. Tiene mayor sensibilidad y especificidad y no se ve modificada por la presencia de anticuerpos antinucleares o factor reumatoideo. Es capaz de detectar anticuerpos IgM por muchos meses posteriores a la infección (1). Recientemente se ha introducido una nueva variedad de este estudio que mide la avidez de los anticuerpos. Esta afinidad por los anticuerpos varía de acuerdo con el grado de maduración que tenga, o sea es indicador del tiempo que este anticuerpo tiene. Anticuerpos maduros tienen alta avidez mientras que los anticuerpos recientes tienen baja avidez (40).
La IFI es un excelente método y sus resultados son similares al test de Sabin y Feldman para detectar IgG. La IgM puede tener falsos positivos con factor reumatoideo, anticuerpos antinucleares, reacciones cruzadas con anticuerpos para citomegalovirus, Epstein Bar, hepatitis A y sífilis.
El western blot es otro método que puede utilizarse para el diagnóstico de toxoplasmosis congénita, aunque no es muy popular. Tiene alta sensibilidad y permite el diagnóstico más precoz (1).
En Europa es utilizado el coeficiente de Witmer-Desmonts, en el que se mide: la IgG antitoxoplasmosis en el ojo x IgG total en suero ÷ IgG antitoxoplasmosis en el suero x IgG total en ojo. Valores mayores de 1 indican producción local de anticuerpo en el ojo, pero en la práctica valores mayores de 8 pueden considerarse positivos para toxoplasmosis ocular (40).
La reacción en cadena de la polimerasa (PCR) ha permitido identificar antígenos del parásito en fluídos oculares sin embargo su sensibilidad y especificidad aún es baja en muestras de humor acuoso. Por lo tanto su utilidad en el diagnóstico de toxoplasmosis ocular es limitado (41,42).
TRATAMIENTO
La toxoplasmosis ocular es una enfermedad en la que se produce necrosis retiniana por proliferación del parásito asociada a inflamación en toda la cavidad ocular por reacción de hipersensibilidad. Los objetivos del tratamiento en la toxoplasmosis ocular se dirijen a eliminar rápidamente el parásito y reducir el proceso inflamatorio para limitar el daño retiniano, además de prevenir futuras recidivas y evitar la diseminación del parásito en pacientes inmunosuprimidos. Hasta el momento no se cuenta con tal tratamiento ideal.
Las drogas utilizadas actualmente actúan sobre el parásito que se replica, pero no sobre los quistes tisulares.
Si bien son múltiples drogas las que se utilizan para el tratamiento de la toxoplasmosis ocular, ninguna ha demostrado superioridad sobre el tratamiento clásico que fue descripto en 1953 y hasta el momento continúa siendo el tratamiento más económico.
Como puede ser una enfermedad autolimitada, algunas lesiones probablemente no requieran tratamiento: lesiones pequeñas, periféricas, sin inflamación asociada que perturben la agudeza visual.
Tratamiento clásico
Una de las grandes ventajas que tiene el tratamiento clásico es que con este tratamiento se logra obtener una cicatriz de menor tamaño comparado con otros tratamientos o con la simple observación (43). Se utiliza pirimetamina en dosis de 25 mg diarios asociado con sulfadiacina en dosis de 500 mg a 1 gramo cada 6 horas. Esta asociación actúa sobre diferentes enzimas en la síntesis de ADN del parásito resultando en un efecto sinérgico.
Para evitar los efectos tóxicos de la pirimetamina sobre las células sanguíneas del humano se utiliza ácido folínico en dosis de 5-15 mg 3 veces por semana.
A este tratamiento clásico se le agrega el tratamiento antiinflamatorio con metilprednisona por vía oral, comenzando con dosis de 1 mg/kg/día y reduciendo gradualmente la dosis para completar un tratamiento de 15 a 20 días de acuerdo a la magnitud del cuadro inflamatorio y de la respuesta clínica. Siempre se debe terminar el tratamiento con corticoides antes de suspender la pirimetamina y sulfadiazina. Por los potenciales efectos colaterales deben monitorizarse los leucocitos y plaquetas cada 7-10 días mientras dure el tratamiento con pirimetamina (43-45).
Otras drogas
Otros tratamientos propuestos son la utilización de clindamicina en dosis de 300 mg c/6 horas asociado al tratamiento clásico, o también puede administrarse junto con la combinación de trimetoprima-sulfametoxazol en dosis de 1 comprimido c/12 hs. Esta asociación tiene la ventaja de no requerir controles hematológicos pero la desventaja de ser más caro que el tratamiento clásico.
Una droga que inicialmente se pensaba que podía tener un efecto sobre los quistes tisulares es el atovaquone. Sin embargo, clínicamente no ha demostrado disminución en las recurrencias de la enfermedad y por otro lado es un tratamiento largo y costoso (46).
Otras drogas utilizadas son la espiramicina, azitromicina, claritomicina y tetraciclinas (44).
Otros tratamientos
La fotocoagulación con láser es una alternativa que sólo debe utilizarse cuando hay formas resistentes de toxoplasmosis ocular. También podría utilizarse cuando hay intolerancia o complicaciones severas por el tratamiento médico. El tratamiento con láser no previene recurrencias y aumenta el tamaño de la cicatriz.
Existen indicaciones para vitrectomía en los pacientes con toxoplasmosis ocular y es cuando hay persistencia de vítreo turbio con visión reducida durante más de 6 meses. Otra indicación sería la vitrectomía diagnóstica cuando no hay visión del fondo de ojo o cuando se presenta un vítreo turbio asociado a un desprendimiento de retina.
PROFILAXIS DE LA TOXOPLASMOSIS
Esto se indica especialmente en personas de alto riesgo como son las personas inmunocomprometidas y las mujeres embarazadas seronegativas.
Se recomienda cocinar bien la carne de cualquier tipo que sea ya que por encima de 66 grados los quistes tisulares son destruidos. También es una buena medida congelar la carne ya que por debajo de 20 grados los quistes no sobreviven. Es importante lavar bien las frutas y verduras y no consumir huevos crudos o leche que no sea pasteurizada.
Definitivamente deberán evitar la exposición a las heces de gatos. En las mujeres embarazadas se recomienda hacer serologías cada un mes para detectar seroconversión.
BIBLIOGRAFÍA
1. Holland GN, O’Connor GR, Belfort R Jr, Remington JS. Toxoplasmosis. In: Pepose JS, Holland GN, Wilhelmus KR. Ocular infection & immunity. St Louis: Mosby 1996; 1183. [ Links ]
2. Pita Gondim LF, Barbosa HV Jr, Ribeiro Filho CH, Saeki H. Serological survey of antibodies to Toxoplasma gondii in goats, sheep, cattle and water buffaloes in Bahia State, Brazil. Vet Parasitol 1993; 82: 273-276. [ Links ]
3. Huong, LT, Ljungstrom BL, Uggla A, Bjorkman C. Prevalence of antibodies to Neospora caninum and Toxoplasma gondii in cattle and water buffaloes in southern Vietnam. Vet Parasitol 1998; 75: 53-57. [ Links ]
4. Klun I, Nikolic A, Katic-Radivojevic S et al. Prevalence in toxoplasma gondii in meat animals in Serbia. International Conference on Toxoplasmosis, Copenhagen, June 2003. [ Links ]
5. Dubey JP, Gamble HR, Hill D, Sreekumar C, Romand S, Thuilliez P. High prevalence of viable Toxoplasma gondii infection in market weight pigs from a farm in Massachusetts. J Parasitol 2002; 88: 1234-1238. [ Links ]
6. Bahia-Oliveira LM, Jones JL, Azevedo-Silva J, Alves CC, Orefice F, Addiss DG. Highly endemic, waterborne toxoplasmosis in north Rio de Janeiro state, Brazil. Emerg Infect Dis 2003; 9: 55-62. [ Links ]
7. Dubey JP. Strategies to reduce transmission of Toxoplasma gondii to animals and humans. Vet Parasitol 1996; 64: 65-70. [ Links ]
8. Warnekulasuriya MR, Johnson JD, Holliman RE. Detection of Toxoplasma gondii in cured meats. Int J Food Microbiol 1998; 45: 211-215. [ Links ]
9. Aspinall TV, Marlee D, Hyde JE, Sims PF. Prevalence of Toxoplasma gondii in commercial meat products as monitored by polymerase chain reaction-food for thought? Int J Parasitol 2002; 32: 1193-1199. [ Links ]
10. Akstein RB, Wilson LA, Teutscde SM. Acquired toxoplasmosis. Ophthalmology 1982; 89: 1299-1302. [ Links ]
11. Bowie WR, King AS, Werker DH et al. Outbreak of toxoplasmosis associated with municipal drinking water. Lancet 1997; 350: 173-177. [ Links ]
12. Magalhães Silveira CA. A maior epidemia do mundo. Magalhães Silveira CA. Toxoplasmose: Duvidas e Contrvérsias. Erechim RS: Edifapes 2002; 79-82. [ Links ]
13. Chosson M, Romand S, Franck J et al. Quantitative PCR in amniotic fluid as prognostic marker of congenital toxoplasmosis. International Conference on Toxoplasmosis, Copenhagen, June 2003 [ Links ]
14. Tenter AM, Heckeroth AR, Weiss LM. Toxoplasma gondii: from animals to humans. Int J Parasitol 2000; 30: 1217-1258. [ Links ]
15. Sacks JJ, Roberto RR, Brooks NF. Toxoplasmosis infection associated with raw goat's milk. JAMA 1982; 248: 1728-1732. [ Links ]
16. Rothova. Reactivations in ocular toxoplasmosis. International Conference on Toxoplasmosis, Copenhagen, June 2003. [ Links ]
17. Friedmann CT, Knox DL.Variations in recurrent active toxoplasmic retinochoroiditis. Arch Ophthalmol 1969; 81: 481-493. [ Links ]
18. Dodds EM, Shah KH, Holland GN et al. Inflammatory reactions associated with ocular toxoplasmois. International Conference on Toxoplasmosis, Copenhagen, June 2003. [ Links ]
19. Desmonts G, Couvreur J. Congenital toxoplasmosis: a prospective study of 378 pregnancies. N Engl J Med 1974; 290: 1110-1116. [ Links ]
20. Wong SY, Remington JS. Toxoplasmosis in pregnancy. Clin Infect Dis 1994; 18: 853-862. [ Links ]
21. Perkins ES. Ocular toxoplasmosis. Br J Ophthalmol 1973; 57: 1. [ Links ]
22. Saari M, Vuorre I, Neiminen H, Raisanen S. Acquired toxoplasmic chorioretinitis. Arch Ophthalmol 1976; 94: 1485-1488. [ Links ]
23. Masur H, Jones TC, Lempert JA, Cherubini TD. Outbreak of toxoplasmosis in a family and documentation of acquired retinochoroiditis. Am J Med 1978, 64: 396-402. [ Links ]
24. Glasner PD, Silveira C, Kruszon-Moran D, Martins MC, Burnier Junior M, Silveira S et al. An unusually high prevalence of ocular toxoplasmosis in southern Brazil. Am J Ophthalmol 1992; 114: 136-144. [ Links ]
25. Silveira C, Belfort R Jr, Burnier M Jr, Nussenblatt R. Acquired toxoplasmic infection as the cause of toxoplasmic retinochoroiditis in families. Am J Ophthalmol 1988; 106: 362-364. [ Links ]
26. Weiss A, Margo CE, Ledford DK, Lockey RF, Brisner JH. Toxoplasmic retinochoroiditis as an initial manifestation of the acquired immune deficiency syndrome. Am J Ophthalmol 1986; 101: 248-249. [ Links ]
27. Heineman MH, Gold JM, Maisel J. Bilateral toxoplasma retinochoroiditis in a patient with the acquired immune deficiency syndrome. Retina 1986; 6: 224-227. [ Links ]
28. Parke DW 2nd, Font RL. Diffuse toxoplasmic retinochoroiditis in a patient with AIDS. Arch Ophthalmol 1986; 104: 571-575. [ Links ]
29. Holland GN, Engstrom RE Jr, Glasgow BJ, Berger BB, Daniels SA, Sidikaro Y et al. Ocular toxoplasmosis in patients with the acquired immunodeficiency syndrome. Am J Ophthalmol 1988; 106: 653-667. [ Links ]
30. Levy RM, Bredesen DE, Rosenblum ML. Neurological manifestations of the acquired immunodeficiency syndrome (AIDS): experience at UCSF and review of the literature. J Neurosurg 1985; 62: 475-495. [ Links ]
31. Nicholson DH, Wolchok EB. Ocular toxoplasmosis in an adult receiving long-term corticosteroid therapy. Arch Ophthalmol 1976; 94: 248-254. [ Links ]
32. O'Connor GR, Frenkel JK. Dangers of steroid treatment in toxoplasmosis. Periocular injections and systemic therapy. Arch Ophthalmol 1976; 94: 213. [ Links ]
33. Cohen SN. Toxoplasmosis in patients receiving immunosuppressive therapy. JAMA 1970; 211: 657-660. [ Links ]
34. Sabates R, Pruett RC, Brockhurst RJ. Fulminant ocular toxoplasmosis. Am J Ophthalmol 1981; 92: 497-503. [ Links ]
35. Benson MT, Parsons MA, Talbot JF, Rennie IG. Aggressive toxoplasma retinitis. Acta Ophthalmol (Copenh) 1992; 70: 795-800. [ Links ]
36. Johnson MW, Greven GM, Jaffe GJ, Sudhalkar H, Vine AK. Atypical, severe toxoplasmic retinochoroiditis in elderly patients. Ophthalmol 1997; 104: 48-57. [ Links ]
37. Braunstein RA, Gass JD. Branch artery obstruccion caused by acute toxoplasmosis. Arch Ophthalmol 1980; 98: 512-513. [ Links ]
38. Folk JC, Lobes LA. Presumed toxoplasmic papillitis. Ophthalmol 1984; 91: 64-67. [ Links ]
39. Lecolier B, Pucheu B. Value of the study of IgG avidity for the diagnosis of toxoplasmosis. Pathol Biol (Paris) 1993; 41: 155-158. [ Links ]
40. Desmonts G. Definitive serological diagnosis of ocular toxoplasmosis. Arch Ophthalmol 1966; 76: 839-851. [ Links ]
41. Brezin AP, Egwagu CE, Burnier M Jr, Silveira C, Mahdi RM, Grazzinelli RT et al. Identification of toxoplasma gondii in paraffin-embedded sections by the polymerase chain reaction. Am J Ophthalmol 1990; 110: 599-604. [ Links ]
42. Bou G, Figueroa MS, Marti-Belda P, Navas E, Guerrero A. Value of PCR for detection of Toxoplasma gondii in aqueous humor and blood samples from immunocompetent patients with ocular toxoplasmosis. J Clin Microbiol 1999; 37: 3465-3468. [ Links ]
43. Rothova A, Meenken C, Buitenhuis HJ, Brinkman CJ, Baarsma GS, Boen-Tan TN et al. Therapy for ocular toxoplasmosis. Am J Ophthalmol 1993; 115: 517-523. [ Links ]
44. Engstrom RE Jr, Holland GN, Nussenblatt RB, Jabs DA. Current practices in the management of ocular toxoplasmosis. Am J Ophthalmol 1991; 111: 601-610. [ Links ]
45. Lam S, Tessler HH. Quadruple therapy for ocular toxoplasmosis. Can J Ophthalmol 1993; 28: 58-61. [ Links ]
46. Pearson PA, Piracha AR, Sen HA, Jaffe GJ. Atovaquone for the treatment of toxoplasma retinochoroiditis in immunocompetent patients. Ophthalmology 1999; 106: 148-153. [ Links ]














