My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Archivos de la Sociedad Española de Oftalmología
Print version ISSN 0365-6691
Arch Soc Esp Oftalmol vol.79 n.2 Feb. 2004
ARTÍCULO ORIGINAL
CONTRIBUCIÓN DE LA CITOLOGÍA DE IMPRESIÓN AL
DIAGNÓSTICO DEL PENFIGOIDE CICATRICIAL OCULAR
EN SUS PRIMERAS FASES
THE CONTRIBUTION OF IMPRESSION CYTOLOGY TOWARDS
THE DIAGNOSIS OF CICATRICIAL OCULAR PEMPHIGOID IN ITS
PRIMARY STAGES
RIVAS L1, MURUBE J2, RIVAS A1, SHALABY O3
| RESUMEN Objetivos: Estudiar el epitelio de la superficie ocular mediante citología de impresión en el penfigoide cicatricial ocular (PCO), buscando la posible relación entre la metaplasia escamosa y la severidad clínica de la enfermedad, para facilitar el diagnóstico más temprano posible. Palabras claves: Penfigoide cicatricial ocular, metaplasia escamosa, citología de impresión, inmunofluorescencia directa. | SUMMARY Purpose: To study the conjunctival epithelium by means of impression cytology in the cicatricial ocular pemphigoid (COP) in search of a possible relation between the degree of squamous metaplasia and clinical severity of the disease, in order to facilitate the earliest possible diagnosis. Key words: Cicatricial ocular pemphigoid, squamous metaplasia, impression cytology, direct immunofluorescence. |
Recibido 10//3/03. Aceptado: 3/2/04.
Servicio de Oftalmología. Hospital Universitario Ramón y Cajal. Madrid.
1 Doctor en Medicina.
2 Doctor en Medicina. Departamento de Oftalmología. Facultad de Medicina. Universidad de Alcalá de Henares.
3 Licenciada en Medicina. Servicio de Oftalmología. Hospital Universitario La Paz. Madrid.
4 Doctor en Medicina. Departamento de Oftalmología. Facultad de Medicina. Universidad de Tanta. Tanta. Egipto.
Correspondencia:
Luis Rivas Jara
Unidad del Ojo Seco. Servicio de Oftalmología. Planta 9.ª D
Hospital Ramón y Cajal
Ctra. de Colmenar, Km 9,100
28034 Madrid
España
INTRODUCCIÓN
El penfigoide cicatricial ocular (PCO) o penfigoide mucoso benigno es un tipo de penfigoide que suele iniciarse y afectar principalmente a la conjuntiva. También pueden verse implicadas otras mucosas corporales, aunque es poco frecuente que ocurra en la piel (1). Es una enfermedad autoinmune crónica, más frecuente en las mujeres a partir de los 50 años. Sus primeras fases no tienen síntomas clínicos claros, caracterizándose por brotes sucesivos de conjuntivitis, seguidos por ampollas y erosiones conjuntivales, destacando la presencia de fibrosis subepitelial (2). En el PCO, las ampollas conjuntivales suelen dejar cicatrices que progresan hasta la queratinización total del epitelio córneo-conjuntival. La consecuencia más grave de esta enfermedad, a nivel ocular, es la ceguera (3), pero a nivel sistémico puede ser una enfermedad grave (4). El diagnóstico diferencial entre el PCO y otras enfermedades etiológicamente próximas se realiza actualmente mediante la técnica de inmunofluorescencia directa (IFd) (5), lo que muchas veces no es suficiente para su diagnóstico diferencial en las primeras fases de la enfermedad, ya que como las demás enfermedades ampollosas autoinmunológicas tienen un primer diagnóstico basado en un criterio clínico (1).
Para la mayoría de los autores, el primer signo clínico es la desaparición de células caliciformes, seguido de una fibrosis de la mucosa que hace que ésta se atrofie y se retraiga (3). La citología de impresión que permite una descripción exacta del epitelio de la superficie ocular, mostrando las posibles alteraciones de las células caliciformes. Además, la citología de impresión permite confirmar la existencia de una enfermedad sistémica (6).
La citología de impresión, al ser una técnica histopatológica, si está correctamente realizada tiene una sensibilidad y especificidad máxima, con falsos positivos y falsos negativos que apenas llegan al 3%. Ello permite que los resultados obtenidos mediante esta prueba sean la manifestación máxima de una enfermedad sistémica sobre la superficie ocular (6).
Debido a que en la mayoría de los pacientes el inicio del PCO pasa desapercibido, las alteraciones clínicas son difíciles de observar y la técnica de IFd es la única que sirve como diagnóstico diferencial, aunque haya veces que la IFd no sea un factor de exclusión u ofrece resultados negativos a pesar de que la clínica indique la presencia de la enfermedad. Por ello, la finalidad del presente trabajo es realizar un protocolo donde la citología de impresión pueda contribuir al diagnóstico clínico temprano de enfermedades sistémicas que se expresan en la superficie ocular mediante un ojo seco mucodeficiente, como ocurren con el PCO.
MATERIAL Y MÉTODOS
Para la clasificación del estado clínico de la enfermedad de nuestros pacientes se ha seguido el sistema de graduación de Foster (7):
Grado I: cicatrización y fibrosis suconjuntival.
Grado II: acortamiento, en cualquier grado, del fórnix.
Grado III: presencia, en cualquier grado, de simbléfaron.
Grado IV: presencia de anquilobléfaron y queratinización corneal.
Se han estudiado 20 pacientes (8 hombres y 12 mujeres) con una edad media de 63,7 años DE 12,1, que presentaron distintos grados de PCO. Según el criterio de Foster (7), 6 pacientes tuvieron un grado I de la enfermedad; 8, un grado II; 4, un grado III y; 2, un grado IV. Los pacientes incluidos en el presente trabajo fueron estudiados durante los años 1995 y 1999 en el Servicio de Oftalmología, en estrecha colaboración con el Servicio de Dermatología y el de Anatomía Patológica. Todos ellos tuvieron una historia clínica multidisciplinar que incluyó los órganos afectados, la evolución de la enfermedad y la terapia seguida. A todos los pacientes se les realizó un estudio clínico consistente en la observación directa mediante lámpara de hendidura, junto a la prueba de Schirmer, el tiempo de ruptura de la película lagrimal y la tinción vital con rosa de bengala. El diagnóstico sistémico de la enfermedad se realizó mediante la citología de impresión, la biopsia conjuntival y el estudio de la IFd e IFi. A pesar de que el criterio de clasificación sólo acepta a pacientes que presenten IFd positiva al menos para un anticuerpo, en el presente estudio hemos incluido dos casos con IFd negativa en la conjuntiva, ya que los signos clínicos indicaron claramente un PCO.
De todos estos pacientes, doce no seguían ningún tratamiento médico en el momento de realizarles las distintas pruebas, cuatro estaban siendo tratados con esteroides tópicos y cuatro, con esteroides vía sistémica.
La citología de impresión permite recoger 1 ó 2 capas superficiales de células de la superficie ocular. Para la obtención de las muestras se anestesió el ojo tópicamente con tetracaína y bupropicaína, anestésico doble de ColirCusí (Laboratorios Cusí SA). Se aplicaron tiras de papel de filtro de acetato de celulosa (Millipore HAWP304) sobre la conjuntiva, según la siguiente distribución: en la zona bulbar superior, en la interpalpebral, en la bulbar inferior y en la palpebral inferior. El material fue fijado en etanol al 96%, teñido con PAS-hematoxilina, deshidratado en una serie ascendente de alcohol y xilol, y montado permanentemente.
La clasificación de metaplasia escamosa se dividió en 5 grados de severidad (6).
Las muestras para la determinación de la inmunofluorescencia directa fueron embebidas en el medio OCT (Lab-Tek, Stoke Pages, UK), congeladas en nitrógeno líquido y almacenadas a –80º C. Las secciones fueron cortadas en un criostato con un tamaño de 10 micras. En ellas se estudió la presencia de IgG, IgA, IgM y C3, usando anticuerpos antihumanos de oveja conjugados con fluoresceína (Dako Ltd.High Wycombe, Bucks UK).
RESULTADOS
Los síntomas subjetivos descritos por la mayoría de los pacientes consistieron en sensación de cuerpos extraños, de quemazón, de sequedad, de dolor y de fotofobia. De todos éstos, como signo clínico más severo, seis pacientes presentaron una irritación conjuntival crónica, ocho pacientes tuvieron el fórnix inferior acortado, cuatro pacientes presentaron simbléfaron inferior y dos sufrieron queratinización con neovascularización corneal (1 con anquilobléfaron completo). Salvo cuatro de los pacientes con grado clínico I, el resto presentaron el PCO de forma bilateral.
Los pacientes con grados clínicos III y IV fueron los que poseyeron el mayor número de mucosas alteradas, aunque dos enfermos con grado clínico II también presentaron varias. La única mucosa alterada en la totalidad de los pacientes estudiados fue la conjuntiva.
De los 6 pacientes con grado I de PCO, dos presentaron alteraciones orales, mientras que los 8 pacientes con grado clínico II mostraron alteraciones orales. Sólo dos pacientes con PCO grado II tuvieron alteraciones faríngeas o nasales. Ningún individuo control presentó alteraciones en las mucosas (tabla I).
Los resultados de los pacientes mediante el estudio de la citología de impresión se muestran en la tabla II.
Las conjuntivas de los pacientes con PCO presentaron, de forma general, un grado de metaplasia escamosa diferente en las células epiteliales no secretoras que en las células caliciformes. Las células epiteliales no secretoras presentaron una progresiva hipertrofia celular con aumento de la separación celular. La disminución de la densidad de células caliciformes fue muy marcada, con respecto a las personas controles, desde las primeras fases de la enfermedad. Además, el tamaño celular varió mucho, observándose células normales con un diámetro de 20 µm junto a otras que iban desde las 10 µm de diámetro hasta las 100 µm. El contenido en mucina fue disminuyendo drásticamente.
Así, los pacientes con PCO grado I presentaron un epitelio no secretor de células pequeñas y unidas y una disminución media de células caliciformes entre el 80% y el 85%, con un contenido en mucina moderadamente menor que en los controles (fig. 1). Los pacientes con grado clínico II tuvieron un epitelio no secretor formado por células algo mayores y ligeramente separadas. Las células caliciformes sufrieron una disminución entre el 85% y 90%, con una marcada disminución del contenido en mucina respecto al grado I (fig. 2). En los pacientes con grado clínico III, a pesar del acortamiento del fórnix inferior, hubo suficiente espacio en las áreas bulbar y palpebral inferior para realizar la citología de impresión. Presentaban un epitelio no secretor formado por células grandes y alteradas, bastante separadas entre sí. La densidad de células caliciformes fue muy pequeña, observándose una disminución entre el 95% y el 99%, con una pérdida total del contenido en mucina (fig. 3). En los pacientes con PCO grado IV sólo se pudo estudiar, mediante citología de impresión, las áreas bulbar superior e interpalpebral, gracias a que el acortamiento del fórnix superior no fue total, presentando un epitelio no secretor formado por células muy grandes, generalmente con signos de queratinización, y aisladas entre sí. Las células caliciformes estuvieron prácticamente ausentes (fig. 4).
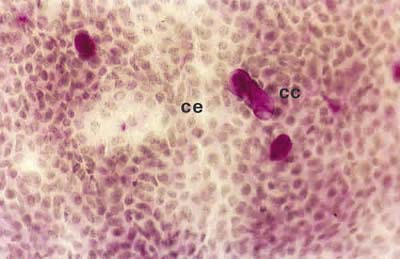
Fig. 1. Citología de impresión del área bulbar inferior central de un
paciente con PCO grado I, donde se observan células epiteliales
normales (CE) y escaso número de células caliciformes (CC).
Tinción PAS-hematoxilina (x40).
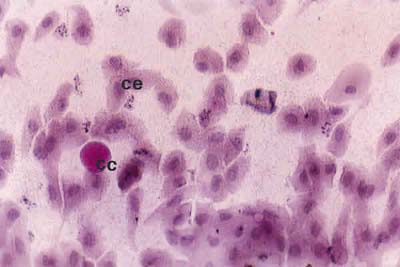
Fig. 2. Citología de impresión del área bulbar inferior central de un
paciente con PCO grado II, donde se observan células epiteliales
ligeramente hipertróficas (CE) y escaso número de células caliciformes (CC).
Tinción PAS-hematoxilina (x40).
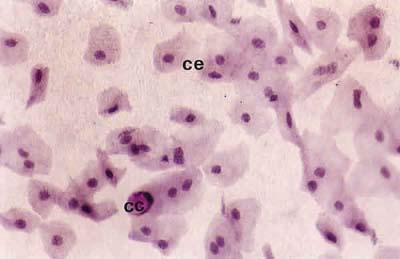
Fig. 3. Citología de impresión del área bulbar inferior central de un
paciente con PCO grado III, donde se observan células
moderadamente metaplásicas (CE) y escasas células caliciformes (CC).
Tinción PAS-hematoxilina (x40).

Fig. 4. Citología de impresión del área interpalpebral de un
paciente con PCO grado IV. Las células epiteliales no secretoras
están muy alteradas y aisladas (CE). No se observan células caliciformes.
Tinción PAS-hematoxilina (x40).
Los individuos sanos controles presentaron gran número de células caliciformes y células epiteliales no secretoras pequeñas y unidas (Fig. 5).

Fig. 5. Citología de impresión del área bulbar inferior central de una
persona sana control. Se pueden observar células epiteliales
pequeñas y juntas (CE), así como gran densidad de células
caliciformes (CC). Tinción PAS-hematoxilina (x40).
Los pacientes con PCO grado I tuvieron reacción positiva al menos para una de las inmunoglobulinas estudiadas. Dos de los 8 pacientes con grado clínico II, que mostraron claros signos clínicos de acortamiento del fórnix inferior y de ojo seco, no presentaron reacción positiva de depósitos de inmunoglobulinas y complemento en la membrana basal de las conjuntivas. Todos los pacientes con los grados clínicos III y IV tuvieron reacción positiva frente, al menos, a 2 inmunoreactantes y frente al complemento C3.
La IFi para los anticuerpos circulantes sólo fue positiva en cuatro pacientes, dos con grado clínico III y dos con grado IV.
DISCUSIÓN
El PCO evoluciona clínicamente de forma muy variable. Unas veces, es limitado, lento y produce cicatrices leves; y otras, es intenso, evoluciona rápidamente y produce cicatrices graves. La severidad de las lesiones en un epitelio no se suele correlacionar con la de otros epitelios (8).
Según la clasificación de Foster (7), los grados clínicos III y IV son fácilmente diagnosticables. El grado II tampoco debería presentar ningún problema oftalmológico para su diagnóstico. En cambio, el grado I suele pasar desapercibido por sus signos clínicos inespecíficos.
El diagnóstico temprano del PCO es muy importante dada la naturaleza de la enfermedad y de la toxicidad de los productos utilizados como terapia, siendo estos productos más agresivos conforme más grave es la enfermedad. Además, existe gran confusión en el diagnóstico diferencial con respecto a otras enfermedades que cursan con conjuntivitis cicatrizante (9). Por eso, diagnosticar la enfermedad en las fases más tempranas posibles permite ofrecer un mejor y más rápido tratamiento, lo que repercutiría en la calidad de vida del paciente.
La existencia de depósitos de inmunoglobulinas en la membrana basal confirma el diagnóstico de PCO, aunque su ausencia no es un factor de exclusión. No obstante, los diferentes autores describen resultados dispares acerca de una IFd positiva en el PCO. Como hay que suponer que la realización de la técnica es correcta en todos los casos, se debe sospechar que ciertas alteraciones acaecidas en la membrana basal y sus alrededores, ampollas, pueden influir en un resultado negativo de la IFd. Así, Fine et al (10) encontraron IFd positiva en el 80% de las mucosas de pacientes con PC, destacando la presencia de los depósitos de IgG y C3. En el otro extremo, Venning et al (11) describieron valores positivos sólo en el 57% de los pacientes con PC, observando también la predominancia de la IgG y del C3. Leonard et al (12) también hallaron valores positivos moderados (59%) en sus pacientes; en cambio, citaron a la IgA (80%) como el depósito más frecuente, seguido de la IgG (60%) y del C3 (50%). Frieth et al (13) encontraron el mayor porcentaje de IFd positiva en la conjuntiva de pacientes con PC (46%), aunque con valores en los depósitos de IgG (38%), IgA (8%) y C3 (23%), mucho menores que los descritos por otros autores.
A pesar de estos valores tan dispares e incluso contradictorios, la mayoría de los autores no describen ninguna correlación entre la severidad de la enfermedad y los depósitos de inmunorreactantes en la membrana basal. Nosotros pensamos que sí existe. Es posible que la inflamación y la cicatrización progresiva destruyan los antígenos de la membrana basal, impidiendo el depósito de inmunoglobulinas. A pesar de ello, aunque la IFd es una técnica imprescindible, cuando ésta sea negativa en la mucosa estudiada, por cualquier problema, debería ir acompañada de otras técnicas que permitiesen poner de manifiesto la posibilidad de un error en la manifestación de los inmunorreactantes, evitando que el diagnóstico de la enfermedad quede pospuesto, con el consecuente perjuicio para el paciente. En este sentido hay que destacar que los estudios morfológicos nos han ayudado a diagnosticar 6 pacientes, cuya única característica clínica fue una conjuntivitis catarral subaguda o crónica, simultánea a una severa hiperemia ocular conjuntival. La confirmación de un ojo seco mucodeficiente, mediante la citología de impresión, y la posterior biopsia conjuntival sirvieron como ayuda al diagnóstico inicial de PCO. Los estudios de IFd terminaron por confirmar el diagnóstico diferencial, pero se había ganado tiempo en el diagnóstico.
En nuestros resultados no se ha observado correlación entre las alteraciones de las células epiteliales y caliciformes, mediante la citología de impresión, ya que desde las primeras fases de la enfermedad, al evaluarse la metaplasia escamosa, esta graduación sólo pudo ser aplicado a las células no secretoras de la superficie ocular, ya que las células caliciformes, al disminuir tan rápidamente su densidad celular y al perder su contenido de mucina en los primeros estadios, no se correspondieron con ningún grado de metaplasia establecido. Esta discrepancia entre las células epiteliales no secretoras y las células caliciformes permite que el patrón morfológico de la superficie ocular indique la presencia de una enfermedad sistémica y mucodeficiente. Por ello, coincidimos con Rye y Webb (14) en que las pruebas histológicas e inmunohistoquímicas son necesarias para el diagnóstico definitivo del PCO. En primer lugar, porque no todas las mucosas corporales se manifiestan en la enfermedad y las que lo hacen presentan distinta gravedad ante la enfermedad, pudiendo elegirse una mucosa sin afección para el estudio de la IFd. Y en segundo lugar, porque la evolución del PCO debe ser realizado conjuntamente por varias disciplinas clínicas apoyados por expertos en las enfermedades autoinmunes ampollosas.
Por último, a pesar de que la IFi para anticuerpos circulantes, pueda ser una prueba idónea para la determinación de inmunoglobulinas, descartamos su utilización debido a que los resultados fueron negativos en la mayoría de los casos. Sólo hemos observado valores positivos en dos de los veinte pacientes, y en los grados más severos.
En conclusión, pensamos que cuando exista la sospecha de un posible PCO se debería realizar una evaluación mediante un criterio de tres puntos:
1. Estudio de las manifestaciones oculares clínicas.
2. Estudio de sequedad de la superficie ocular mediante el examen de la citología de impresión y si procede una posterior biopsia conjuntival.
3. Estudio de los depósitos de inmunorreactantes de la conjuntiva mediante IFd.
BIBLIOGRAFÍA
1. Anhalt GJ. Bullous skin diseases. In: Frank MM, Austen KF, Claman HN, Unane ER. Samters Immunologic Diseases. Boston: Little, Brown and Company. 1995; 2: 1179-1191. [ Links ]
2. Kanski JK. Penfigoide cicatrizal. In: Oftalmología Clínica. Barcelona: Mosby/Doyma Libros SA. 1996; 68-72. [ Links ]
3. Sanz A. Ojo seco asociado a dermopatías ampollosas y mucosinequiales. In: Murube J. Ojo Seco - Dry Eye. Madrid: Tecnimedia Editorial. 1997; 61-65. [ Links ]
4. Sanz AI, Rivas L, Shalaby O, Oroza MA, Pérez-Esteban A, Murube J. Estudio histopatológico e inmunohistoquímico en el penfigoide cicatricial ocular. Arch Soc Esp Oftalmol 2001; 76: 417-424. [ Links ]
5. Thorne J, Anhalt G, Jabs D. Ocular mucous membrane pemphigoid. Derm Ther 2002; 15: 389-396. [ Links ]
6. Rivas L. Diagnosis through other assays. In: Murube J y Rolando M. Dry Eye. A Systematic Approach to Therapy. Suiza: CibaVision. 1999; 101-114. [ Links ]
7. Foster CS. Cicatricial pemphigoid. Trans Am Ophthalmol Soc 1986; 84: 527-663. [ Links ]
8. Messmer EM, Hintschich CR, Partsch K, Messer G, Kampik A. Ocular cicatricial pemphigoid. Retrospective analysis of risk factors and complications. Ophthalmologe 2000; 97: 113-120. [ Links ]
9. Foster CS. The eye in skin and mucous membrane disorders. In: Clinical Ophthalmolgy. Philadelphia: Lippincott-Raven. 1997; 5: 1-41. [ Links ]
10. Fine JD, Neises GR, Katz SI. Immunofluorescence and immunoelectron microscopic studies in cicatricial pemphigoid. J Invest Dermatol 1984; 82: 39-43. [ Links ]
11. Venning VA, Frith PA, Bron AJ, Millard PR, Wojnarowska F. Mucosal involvement in bullous and cicatricial pemphigoid. A clinical and immunopathological study. Br J Dermatol 1988; 118: 7-15. [ Links ]
12. Leonard JN, Hobday CM, Haffenden GP, Griffths CF, Powles AV, Wright P, et al. Immunofluorescent studies in ocular cicatricial pemphigoid. Br J Dermatol 1988; 118: 209-217. [ Links ]
13. Frith PA, Venning VA, Wojnarowska F, Millard PR, Bron AJ. Conjunctival involvement in cicatricial and bullous pemphigoid: a clinical study and immunopathological study. Br J Ophthalmol 1989; 73: 52-56. [ Links ]
14. Rye B, Webb JM. Autoimmune bullous diseases. Am Fam Physician 1997; 55: 2709-2718. [ Links ]
















