Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.79 no.5 Mai. 2004
ARTÍCULO ORIGINAL
ESTUDIO EXPERIMENTAL SOBRE LA UTILIDAD DEL ACEITE
DE COPOLÍMERO DE SILICONA-FLUORSILICONA (SiFO)
EN LA CIRUGÍA VITREORRETINIANA
EXPERIMENTAL STUDY ON USEFULNESS OF SILICONE-FLUORSILICONE
COPOLYMER OIL (SiFO) IN VITREORETINAL SURGERY
BAÍLEZ FIDALGO C1, PASTOR JIMENO JC2, SAORNIL ÁLVAREZ MA3, MÉNDEZ DÍAZ MC4,
MARTÍN APARICIO F5, RODRÍGUEZ DE LA RÚA FRANCH E2, SANABRIA RUIZ-COLMENARES RM1,
DE LA FUENTE SALINERO MA6, MAYO ÍSCAR A6
| RESUMEN Objetivo: Valorar la utilidad del aceite de copolímero de silicona-fluorsilicona (SiFO) como herramienta intraoperatoria y como sustitutivo vítreo en la cirugía vitreorretiniana. Palabras clave: Cirugía vitreorretiniana, manipulador retiniano, sustitutivo vítreo, tolerancia ocular. | SUMMARY Purpose: To evaluate the usefulness of silicone-fluorsilicone copolymer oil (SiFO) as an intraoperative tool and a vitreous substitute in vitreoretinal surgery. Key words: .Vitreoretinal surgery, intraoperative tool, vitreous substitute, ocular tolerance.
|
Recibido: 4/12/03. Aceptado: 12/5/04.
Instituto Universitario de Oftalmobiología Aplicada (IOBA). Universidad de Valladolid. Valladolid. España.
1 Licenciado en Medicina. Unidad de Retina-Vítreo.
2 Doctor en Medicina. Unidad de Retina-Vítreo.
3 Doctora en Medicina. Unidad de Patología Ocular.
4 Licenciada en Medicina. Unidad de Patología Ocular.
5 Licenciado en Biología. Unidad de Retina-Vítreo.
6 Doctor en Matemáticas. Departamento de Bioestadística. Facultad de Medicina. Universidad de Valladolid.
Correspondencia:
Celestino Baílez Fidalgo
Instituto Universitario de Oftalmobiología Aplicada (IOBA)
Edificio de Ciencias de la Salud
Avda. Ramón y Cajal, 7
47005 Valladolid
España
E-mail: cbailez@ioba.med.uva.es
INTRODUCCIÓN
Durante la cirugía vitreorretiniana son necesarias sustancias que faciliten la manipulación de los tejidos y la realización de las distintas maniobras (1,2). En la actualidad, los compuestos más ampliamente usados como «manipuladores retinianos» son los líquidos perfluorocarbonados (PFCL), ya que sus propiedades físicas los hacen ideales como herramientas intraoperatorias en esta cirugía (2). Sin embargo, uno de sus principales inconvenientes es su elevado coste. Además, en determinados procesos patológicos intraoculares como la vitreorretinopatía proliferativa (VRP), con frecuencia es necesario un taponamiento inferior de la retina, que debe mantenerse durante varias semanas; en estos casos el aceite de silicona no es eficaz debido a que su densidad es menor que la del agua (3), y aunque algunos autores han propuesto el uso de determinados PFCL y otras sustancias pesadas como taponadores retinianos y sustitutivos vítreos a corto (4) y largo plazo (5,6), existen evidencias en la literatura de su toxicidad intraocular (6-10).
En 1993 Refojo y col. propusieron el uso de una nueva sustancia, el aceite de copolímero de silicona-fluorsilicona (SiFO) como manipulador retiniano y como sustitutivo vítreo de corta duración (11), que tendría las ventajas de una mejor tolerancia ocular que los PFCL, debido a su menor densidad (12), y un menor coste. Esta sustancia fue evaluada comparándola con el aceite de silicona (12,13) y con el PFCL perfluorotetradecahidrofenantreno (12).
El objetivo de este trabajo ha sido valorar las características físicas y de manipulación quirúrgica y la tolerancia intraocular a corto plazo del SiFO, y compararlas con las de otro PFCL, el de uso más extendido en la actualidad por ser el que reúne la mejor combinación de propiedades, el perfluorooctano (PFO).
MATERIAL Y MÉTODO
SiFO y Perfluorooctano
El aceite de copolímero de silicona-fluorsilicona (SiFO: copolímero en bloque de 50% polimetil-3,3,3-trifluorpropilsiloxano y 50% polidimetilsiloxano), purificado según una técnica descrita previamente (13), fue cedido por el Prof. Miguel F. Refojo del Schepens Eye Research Institute, Boston, USA.
El perfluorooctano (C8 F18) utilizado fue F-Octane® (Fluoron GmbH, Neu-Ulm, Alemania).
Las propiedades del SiFO purificado y del PFO utilizados se reflejan en la tabla I.
Estudio de las características físicas y de manipulación quirúrgica
La transparencia de ambas sustancias se estudió mediante espectrofotometría (HITACHI Model 100-60 spectrophotometer, Hitachi Ltd, Tokyo, Japan) en el rango de longitudes de onda de la luz visible (400-700 nm), con mediciones a intervalos de 20 nm, utilizando solución salina fisiológica como referencia. Además se valoró subjetivamente la visibilidad de un objeto (regla milimetrada) colocado detrás de un frasco de cristal transparente que contenía cada una de las sustancias. También se comparó la visibilidad de la interfase producida entre las mismas y la solución salina balanceada (BSS).
Para valorar la tendencia a la dispersión en gotitas, se realizó la inyección de cada una de las sustancias en un tubo abierto conteniendo BSS a través de una cánula metálica de 21 G sumergida en el BSS, anotando la aparición o no de dispersión y su grado. Además se realizó una mezcla a partes iguales de SiFO y PFO con BSS en un frasco con tapón de rosca que se llenó por completo para simular la condición hidrodinámica de la sustancia en el ojo durante la cirugía vitreorretinana. Dichas mezclas fueron agitadas en un vórtex (modelo D-051, DINKO) a velocidad máxima durante 1 minuto, y manualmente 20 veces en dirección perpendicular a la superficie de la interfase formada con el BSS, observando y fotografiando el resultado tras un minuto de reposo.
Se estudió la facilidad de inyección de ambas sustancias mediante una encuesta de valoración subjetiva de la fuerza necesaria para la inyección de las mismas a través de una cánula de 21 G sumergida en BSS, en una escala de 0 a 3, que fue realizada por cuatro cirujanos especialistas en cirugía vitreorretiniana.
Finalmente se valoró la facilidad de aspiración y su grado (total/parcial) utilizando un sistema de aspiración mecánico (SITE TXR®, SITE Microsurgical Systems, Horsham, Pennsylvania, USA) con un terminal de 20 G, para aspirar 5 cc de SiFO y PFO de un recipiente relleno de BSS.
Estudio de la tolerancia ocular
Se utilizaron conejos albinos de 1,7 a 2,5 kg de peso; se utilizó únicamente el ojo derecho de cada animal.
Fueron divididos en 4 grupos de 5 animales cada uno según la sustancia utilizada y el tiempo de permanencia de la misma en el ojo (tabla II).
Todos los experimentos se realizaron conforme a las Recomendaciones de la Declaración de Helsinki y a la Declaración para el Uso de Animales en Investigación Oftalmológica de ARVO (Association for Research in Vision and Ophthalmology).
Para crear un espacio intravítreo para la inyección de las sustancias, se realizó una compresión del gel vítreo con gas (15). Cada animal fue anestesiado con una dosis intramuscular de 25 mg/kg de ketamina (Ketolar®, Parke-Davis, Barcelona, España) y de 5 mg/kg de xilacina (Rompún®, Bayer, Barcelona, España), y con tetracaína tópica (Colircusí Anestésico® 0,5%, AlconCusí, Barcelona, España). Se dilató la pupila con ciclopentolato al 1% (Colircusí Ciclopléjico®, AlconCusí, Barcelona, España) y con fenilefrina al 10% (Colircusí Fenilefrina®, AlconCusí, Barcelona, España). Se inyectó 0,1 ml de hexafluoruro de azufre (SF6) al 100% con una aguja de 25 G a 4 mm del limbo en uno de los cuadrantes inferiores. Postoperatoriamente se aplicó clorotetraciclina tópica en pomada (Oftalmolosa Cusí Aureomicina®, AlconCusí, Barcelona, España) y se inyectararon 2 mg/kg de gentamicina (Gevramycin® 20 inyectable, Schering-Plough, Madrid, España) por vía intramuscular.
A las 48 horas se aplicó de nuevo la anestesia descrita y se realizó un intercambio fluido-gas colocando una aguja de 25 G a 4 mm del limbo en uno de los cuadrantes superiores, y otra en uno de los cuadrantes inferiores, a través de la cual se inyectaron 0,1-0,2 ml de SiFO o PFO en la cavidad vítrea, que desplazaron al vítreo fluido y al gas, los cuales drenaron a través de la aguja superior. Durante esta maniobra se valoró también la facilidad de inyección de las sustancias.
Se realizaron exploraciones los días 2, 4, 7 y 14 tras la inyección. En cada una de ellas, y bajo anestesia con tetracaína tópica, se midió la presión intraocular (PIO) mediante tonometría de aplanación manual (Kowa Applanation Tonometer HA-2, Kowa, Japan). Se evaluó la respuesta inflamatoria en el segmento anterior del ojo valorando la hiperemia conjuntival, quemosis, edema palpebral, edema corneal y presencia de hipopion o turbidez de la cámara anterior en una escala de 0 (ausencia de respuesta) a 4 (máxima respuesta). Bajo midriasis farmacológica y mediante oftalmoscopía indirecta, se valoró el grado de dispersión de la sustancia en la cavidad vítrea (escala: 0-4), el grado de turbidez vítrea (escala: 0-4), así como otros posibles hallazgos.
Los animales fueron sacrificados a los 7 y 14 días mediante inyección intravenosa, en la vena marginal de la oreja, de 2 cc de un anestésico tópico (Colircusí Anestésico® 0,5%, AlconCusí, Barcelona, España). Inmediatamente los ojos fueron enucleados y fijados en formol tamponado al 10% para su posterior procesamiento, estudio macroscópico e infiltración en parafina en un procesador automático de tejidos (modelo TISSUE-TEK® VIP-100, Miles Scientific, Naperville, Illinois, USA). Posteriormente se realizaron cortes de 5 µm de espesor de los globos oculares en un microtomo (modelo HM 340-E, MICROM, Walldorf, Alemania), y la tinción de las preparaciones con hematoxilina-eosina para su estudio al microscopio óptico, comparando las hemirretinas superior e inferior.
Análisis estadístico
Se ha utilizado el intervalo de Bland-Altman (BA) (16) para calcular un intervalo que con mucha seguridad (Intervalo de Confianza al 95%) contiene el 95% de las diferencias de absorbancia entre ambas sustancias medidas mediante espectrofotometría. Para el estudio de los valores de PIO a lo largo del tiempo en los ojos con SiFO y PFO se utilizó el análisis multivariante de la varianza y el método de comparaciones múltiples de Scheffe para estudiar entre qué niveles de un factor hubo diferencias significativas (SAS STATISTICAL PACKAGE 8.01, SAS Institute Inc., Cary, North Carolina, USA).
RESULTADOS
Características físicas y de manipulación
Se ha encontrado que la diferencia entre los valores de absorbancia del SiFO y del PFO medidos mediante espectrofotometría en el rango de longitudes de onda del espectro visible (400-700 nm) es inferior en un 95% de los casos a 0.036 (con una confianza del 95% dada por el procedimiento de BA); además, la visibilidad de un objeto colocado detrás de un frasco de cristal transparente conteniendo cada sustancia fue similar para ambas (fig. 1).

Fig. 1. Visibilidad de un objeto colocado detrás de un frasco
de cristal transparente conteniendo SiFO (izquierda) y PFO (derecha).
Ninguna de las dos sustancias sufrió dispersión en gotitas cuando fue inyectada a través de una cánula de 21 G sumergida en BSS, manteniendo el extremo de la cánula dentro de la burbuja inicial.
Tras agitar un tubo cerrado conteniendo una mezcla a partes iguales de BSS con SiFO y otro con PFO en un vórtex durante 1 minuto, el SiFO no dispersó, pero sí el PFO, dispersión que se resolvió tras 1 minuto de reposo.
Sin embargo, cuando estas mezclas fueron agitadas manualmente 20 veces en dirección perpendicular a la superficie de la interfase formada con el BSS, el SiFO dispersó en múltiples gotitas de tamaño medio, que posteriormente se fueron reduciendo, permaneciendo en este estado durante más de 15 minutos, no ocurriendo así con el PFO, cuya dispersión desapareció en 1 minuto (fig. 2).

Fig. 2. Estado del SiFO (izquierda) y PFO (derecha) inmediatamente
después de haber sido agitados manualmente (arriba), y tras 1 minuto
de reposo (abajo). Apréciese también la visibilidad de la interfase
entre ambas sustancias y el BSS (abajo).
La fuerza subjetiva necesaria para la inyección de SiFO en BSS en un tubo abierto, a través de una cánula de 21 G, fue valorada como 3 [escala de 0 (ninguna fuerza) a 4 (máxima fuerza)] por cuatro especialistas en cirugía vitreorretiniana, mientras que para el PFO fue 1; todos encontraron una clara y significativa diferencia en la facilidad de inyección de ambas sustancias, a favor del PFO.
Además, para la aspiración de 5 cc de SiFO de un tubo abierto con un sistema mecánico con un terminal de 20 G, se precisaron 5 minutos, siendo necesario menos de 1 minuto para aspirar la misma cantidad de PFO.
Finalmente, la interfase producida entre el SiFO- BSS y PFO-BSS era bien visible en ambos casos (fig. 2).
Estudio in vivo
De los 20 animales iniciales, 4 se perdieron durante el seguimiento: 2 del grupo 1, uno del grupo 2 y otro del grupo 4.
Se produjo un descenso significativo de la PIO tras la vitrectomía-gas y la inyección intravítrea de las sustancias en los 4 grupos (p<0,05), que posteriormente se fue recuperando hasta valores similares a los basales (gráfico 1), no apreciándose diferencias significativas entre los ojos con SiFO y PFO.
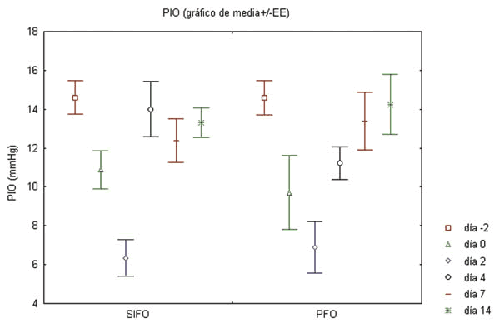
Gráfico. 1. Valores de PIO media+error estándar en mmHg de los ojos portadores de SiFO y PFO
en los distintos momentos del estudio. PIO: presión intraocular; EE: error estándar; Día -2: vitrectomía-gas:
Día 0: inyección de las sustancias; Día 2, 4, 7, 14: exploraciones postoperatorias.
La inflamación detectada en el segmento anterior como hiperemia conjuntival, quemosis y edema palpebral fue valorada como 1-2 (escala de 0 a 4) al día siguiente de la inyección de ambas sustancias, pero cedió posteriormente. En ningún caso se apreció edema corneal, hipopion ni turbidez vítrea.
El hallazgo más significativo fue la dispersión de las sustancias: el SiFO permaneció como una burbuja única en todos los conejos durante los 14 días del estudio, mientras que el PFO sufrió una dispersión en «huevos de pez» que comenzó a los 2 días de la inyección intraocular y fue aumentando progresivamente a lo largo del seguimiento (fig. 3).
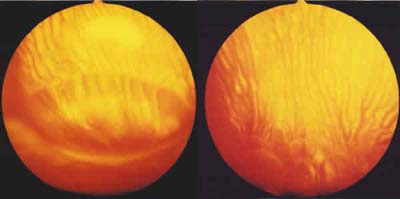
Fig. 3. Estado del SiFO (izquierda) y del PFO (derecha) en la cavidad vítrea
del concejo a los 14 días del estudio.
Hallazgos histopatológicos
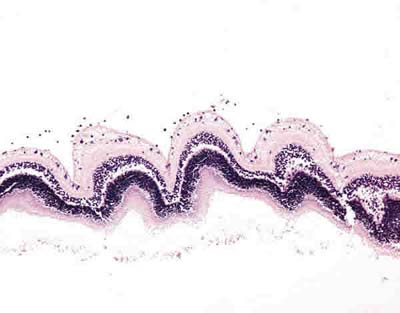
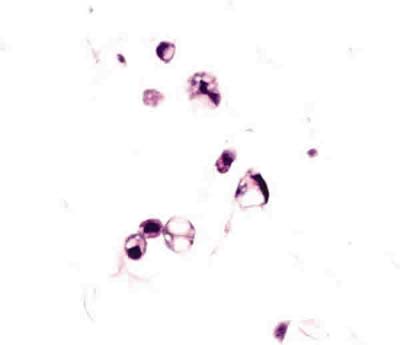
Se ha detectado una respuesta inflamatoria a nivel del vítreo, sobre la superficie interna de la retina inferior, de grado leve-moderado, consistente en la presencia de linfocitos y monocitos (fig. 4), histiocitos multivacuolados o células espumosas (fig. 5), y células gigantes multinucleadas de cuerpo extraño, en ocasiones formando sincitios histiocitarios (fig. 6), en todos los ojos que contenían tanto SiFO como PFO. El grado de inflamación fue mayor en los ojos con mayor tiempo de evolución, pero similar en los ojos con SiFO y PFO; la única diferencia reseñable entre los ojos con SiFO y con PFO fue que las células gigantes y sincitios histiocitarios eran de mayor tamaño en los ojos portadores de SiFO que fueron enucleados a los 14 días (fig. 6).
Fig. 4. Respuesta inflamatoria moderada sobre la retina inferior de un ojo portador de
PFO a los 7 días (microscopia óptica, hematoxilina-eosina x31,5).
Fig. 5. Macrófagos microvacuolados en un ojo portador de PFO a los 7 días
(microscopia óptica, hematoxilina-eosina, x252).
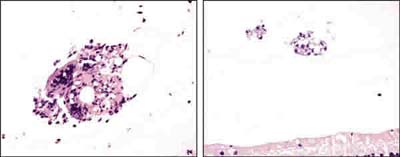
Fig. 6. Presencia de células gigantes y sincitios histiocitarios en un ojo portador de SiFO
(izquierda) y PFO (derecha), ambos a los 14 días (microscopia óptica, hematoxilina-eosina, x252).
No se observaron alteraciones estructurales retinianas secundarias en ninguno de los globos oculares analizados (fig. 7).
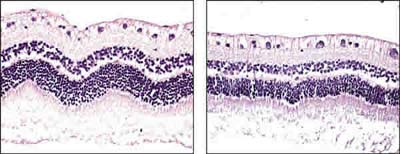
Fig. 7. Retina inferior de un ojo portador de SiFO (izquierda) y PFO (derecha)
a los 14 días (microscopia óptica, hematoxilina-eosina, x63).
DISCUSIÓN
Cualquier sustancia utilizada en la cirugía vitreorretiniana, como herramienta intraoperatoria o como sustitutivo vítreo, tiene que reunir una serie de características (1,17-19): debe ser inerte desde el punto de vista biológico, transparente, más pesada que el agua para aplanar la retina sobre el epitelio pigmentario y desplazar el fluido subrretiniano, de baja viscosidad para ser fácilmente inyectada y aspirada a través de los instrumentos de pequeño calibre utilizados en la microcirugía ocular, inmiscible con agua, sangre o silicona, y con baja tendencia a la dispersión y emulsificación para facilitar la visualización y evitar su paso al espacio subrretiniano. Y está claro que en estos momentos no hay ninguna que cumpla satisfactoriamente con todas ellas.
En el presente estudio se ha analizado la utilidad del SiFO como herramienta intraoperatoria en la cirugía vitreorretiniana y como sustitutivo vitreo de corta duración (2 semanas), y se ha comparado con el PFCL de uso más extendido en la actualidad por ser el que posee la mejor combinación de propiedades físicas (20), el PFO.
Aunque se ha detectado una diferencia en la absorbancia de ambas sustancias medida por espectrofotometría, es posible que no tenga relevancia clínica.
La diferencia más notable entre los dos compuestos, en cuanto a propiedades físicas y de manipulación quirúrgica, es la mayor dificultad de inyección y aspiración del SiFO en relación al PFO, que viene determinada por su mayor viscosidad (tabla I), lo que puede suponer una limitación para el uso del SiFO si lo único que se pretende es utilizarlo como manipulador retiniano.
En el estudio in vivo ambas sustancias han sido bien toleradas por los ojos de conejo durante las dos semanas del estudio, no habiéndose detectado aumentos notables de la PIO ni observado una reacción inflamatoria importante.
Además durante todo el tiempo de seguimiento, el SiFO permaneció como una burbuja única en el interior de la cavidad vítrea; sin embargo el PFO sufrió una dispersión «en huevos de pez» progresiva desde el segundo día tras la inyección intraocular. Esta menor tendencia del SiFO a la dispersión y emulsificación parece debida a su mayor viscosidad, su mayor tensión superficial y a una menor diferencia de densidad con el fluido intraocular (21), y supondría una ventaja para su utilización como sustitutivo vítreo de corta duración, pues permitiría una mejor visualización de la retina y un taponamiento retiniano más eficaz, al mantenerse en la cavidad vítrea como una única burbuja. Sin embargo, cuando se ha utilizado en ojos humanos como sustitutivo vítreo de corta-media duración, el SiFO ha producido cuadros de hipertensión ocular aguda postoperatoria, inflamación moderada a severa, catarata, y ha sufrido una dispersión y emulsificación hasta en un 87% de los casos (22-24), hechos que limitarían su uso (22). Esta emulsificación en ojos humanos con patología podría deberse a la existencia de una mayor concentración de factores emulsificadores como proteínas y fosfolípidos (21), que probablemente no están presentes a tan altas concentraciones en los ojos de conejo utilizados en los experimentos.
Aunque los PFCL y el aceite de silicona son sustancias inertes desde el punto de vista biológico, tanto el PFO como el SiFO han inducido una reacción inflamatoria sobre la superficie interna de la retina inferior, con la que contactan debido a que su densidad es mayor que la del agua; esta reacción inflamatoria observada en este trabajo a base de linfocitos, monocitos, macrófagos microvacuolados y células gigantes, ya ha sido descrita previamente por otros autores en estudios experimentales con PFCL (7-10), siliconas fluoradas (25) y SiFO (13), y podría estar relacionada con la existencia de impurezas (9) y de componentes de bajo peso molecular (25) en la sustancias inyectadas intraocularmente.
En el presente estudio, sin embargo, no se han observado alteraciones retinianas manifiestas, tales como adelgazamiento o desaparición de la plexiforme externa, desplazamiento de los núcleos de los fotorreceptores a la capa de segmentos externos, desorganización de los segmentos externos o internos de los fotorreceptores, y alteraciones de las células de Müller, que han sido descritas con el uso experimental de PFCL (7-10), siliconas fluoradas (25,26) y SiFO (12,13). Esto podría explicarse por la menor cantidad de sustancia inyectada en la cavidad vítrea en este trabajo (0.1-0.2 ml) en relación a otros estudios en los que se han inyectado 1-1,5 ml (7,12), y por el menor tiempo de permanencia de las sustancias en el ojo (2 semanas), ya que la mayoría de estos cambios retinianos están descritos a partir de las 2 semanas para los PFCL (7,9), tardando más en aparecer en el caso del SiFO, entre 6 y 8 semanas (12,13). Estas alteraciones retinianas se atribuyen al efecto mecánico gravitacional de las sustancias sobre la retina inferior por su elevada densidad (1,7,8,10,12,13,26), efecto que también ha sido demostrado en cultivos de retina de rata (27). En este sentido, el SiFO por su menor densidad, tendría una mejor tolerancia que el PFO como sustitutivo vítreo a corto plazo (12).
Por sus propiedades (transparencia, baja tendencia a la dispersión, densidad mayor que el agua, etc.) el SiFO podría ser útil como sustitutivo vítreo a corto plazo, ya que ha sido bien tolerado y no ha dispersado en los ojos analizados en este trabajo; sin embargo serían necesarios estudios clínicos más extensos para valorar su utilidad y tolerancia en este aspecto.
BIBLIOGRAFÍA
1. Peyman GA, Schulman JA, Sullivan B. Perfluorocarbon liquids in ophthalmology. Surv Ophthalmol 1995; 39: 375-395. [ Links ]
2. Chang S. Low viscosity liquid fluorochemicals in vitreous surgery. Am J Ophthalmol 1987; 103: 38-43. [ Links ]
3. Haut J, Larricat JP, Van Effenterre G, Pinon-Pignero Fl. Some of the most important properties of silicone oil to explain its action. Ophthalmologica 1985; 191: 150-153. [ Links ]
4. Bottoni F, Sborgia M , Arpa P, De Casa N, Bertazzi E, Monticelli M et al. Perfluorocarbon liquids as postoperative short-term vitreous substitutes in complicated retinal detachment . Graefes Arch Clin Exp Ophthalmol 1993; 231: 619-628. [ Links ]
5. Kirchhof B, Wong D, Van Meurs J, Hilgers RD, Macek M, Lois N, et al. Use of perfluorohexyloctane as a long-term internal tamponade agent in complicated retinal detachment surgery. Am J Ophthalmol 2002; 133: 95-101. [ Links ]
6. Roider J, Hoerauf H, Kobuch K, Gabel VP. Clinical findings on the use of long-term heavy tamponades (semifluorinated alkanes and their oligomers) in complicated retinal detachment surgery. Graefes Arch Clin Exp Ophthalmol 2002; 240: 965-971. [ Links ]
7. Chang S, Sparrow JR, Iwamoto T, Gershbein A, Ross R, Ortiz R. Experimental studies of tolerance to intravitreal perfluoro-n-octane liquid. Retina 1991; 11: 367-374. [ Links ]
8. Eckardt C, Nicolai U, Winter M, Knop E. Experimental intraocular tolerance to liquid perfluorooctane and perfluoropolyether. Retina 1991; 11: 375-384. [ Links ]
9. Velikay M, Stolba U, Wedrich A, Li Y, Datlinger P, Binder S. The effect of chemical stability and purification of perfluorocarbon liquids in experimental extended-term vitreous substitution. Graefes Arch Clin Exp Ophthalmol 1995; 233: 26-30. [ Links ]
10. Orzalesi N, Migliavacca L, Bottoni F, Miglior S. Experimental short-term tolerance to perfluorodecalin in the rabbit eye: a histopathological study. Curr Eye Res 1998; 17: 828-835. [ Links ]
11. Refojo MF, Araiz JJ, Arroyo M, Leong FL, Tolentino FI. Silicone-fluorsilicone copolymer oil for retinal tamponade in complicated retinal detachment surgery. Invest Ophthalmol Vis Sci 1993; 34 (Suppl): 952. [ Links ]
12. Doi M, Refojo MF. Histopathology of rabbit eyes with intravitreous silicone-fluorsilicone copolymer oil. Exp Eye Res 1994; 59: 737-746. [ Links ]
13. Doi M, Refojo MF. Histopathology of rabbit eyes with silicone-fluorsilicone copolymer oil as a six months internal retinal tamponade. Exp Eye Res 1995; 61: 469-478. [ Links ]
14. Miyamoto K, Refojo MF, Tolentino FI, Fournier GA, Albert DM. Fluorinated oils as experimental vitreous substitutes. Arch Ophthalmol 1986; 104: 1053-1056. [ Links ]
15. Thresher RJ, Ehrenberg M, Machemer R. Gas-mediated vitreous compression: an experimental alternative to mechanized vitrectomy. Graefes Arch Clin Exp Ophthalmol 1984; 221: 192-198. [ Links ]
16. Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. Lancet 1986; 1: 307-310. [ Links ]
17. Chan IM, Tolentino FI, Refojo MF, Fournier G, Albert DM. Vitreous substitute. Experimental studies and review. Retina 1984; 4: 51-59. [ Links ]
18. Chang S. Low viscosity fluorochemicals in vitreous surgery. Am J Ohthalmol 1987; 103: 38-43. [ Links ]
19. Chang S, Ozmert E, Zimmerman NJ. Intraoperative perfluorocarbon liquids in the management of proliferative vitreoretinopathy. Am J Ophthalmol 1988; 106: 668-674. [ Links ]
20. Thompson JT. Use of perfluorocarbon liquids in vitreoretinal surgery. In: Ryan SJ. Retina. 2nd edition. St Louis: Mosby; 1994; 3: 2191-2201. [ Links ]
21. Nakamura K, Refojo MF, Crabtree DV. Factors contributing to the emulsification of intraocular silicone and fluorsilicone oils. Invest Ophthalmol Vis Sci 1990; 31: 647-656. [ Links ]
22. Pastor JC, Gomez S, Refojo MF, Mora J. Complications on the use of SiFO as a short term retinal tamponade in retinal detachment surgery. Invest Ophthalmol Vis Sci 1995; 36: S617. [ Links ]
23. Giordano GG, Magnasco A, Bernardini F, Zingirian M. Silicone-fluorsilicone oil (SiFO) as intraoperative tool and permanent tamponade in vitreo-retinal surgery. Invest Ophthalmol Vis Sci 1996; 37: S401. [ Links ]
24. Kadrmas EF, Veloso A, Tolentino FI, Refojo MF, Arroyo M, Serfass MS. A new silicone-fluorsilicone copolymer oil as an adjunct to complicated retinal detachment surgery. Invest Ophthalmol Vis Sci 1996; 37: S1149. [ Links ]
25. Pastor JC, Lopez MI, Saornil MA, Refojo MF. Intravitreal silicone and fluorsilicone oils: pathologic findings in rabbit eyes. Acta Ophthalmol (Copenh) 1992; 70: 651-658. [ Links ]
26. Doi M, Ning M, Ida H, Uji Y, Refojo MF. Histopathologic retinal changes with intravitreous fluorsilicone oil in rabbit eyes. Retina 2000; 20: 532-536. [ Links ]
27. Malchiodi-Albedi F, Morgillo A, Formisano G, Paradisi S, Perilli R, Scalzo GC, et al. Biocompatibility assessment of silicone oil and perfluorocarbon liquids used in retinal reattachment surgery in rat retinal cultures. J Biomed Mater Res 2002; 60: 548-555. [ Links ]