Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.80 no.3 mar. 2005
ARTÍCULO ORIGINAL
TRATAMIENTO PRIMARIO DEL MELANOMA DE COROIDES MEDIANTE
TERMOTERAPIA TRANSPUPILAR
TRANSPUPILLARY THERMOTHERAPY IN THE PRIMARY MANAGEMENT
OF CHOROIDAL MELANOMA
CAJIGAL-MORALES C1, VALVERDE-ALMOHALLA S1, ENCINAS-MARTÍN JL1
| RESUMEN Objetivo: Comprobar si la termoterapia transpupilar, como tratamiento primario, es capaz de conseguir la remisión local del melanoma de coroides. Otros objetivos secundarios se refieren a la seguridad del tratamiento: agudeza visual y complicaciones. El objetivo a largo plazo es conocer la supervivencia, libre de metástasis. Palabras clave: Hipertermia inducida, neoplasia uveal.
| SUMMARY Objective: To determine if primary transpupillary thermotherapy can achieve local remission of choroidal melanoma. Secondary objectives were to determine safety of treatment, visual acuity and evaluate complications. The long term objective was to evaluate the impact of treatment on survival without metastatic disease. Key words: Induced hyperthermia, uveal neoplasms.
|
Recibido: 1/3/04. Aceptado: 15/3/05.
Hospital Universitario Puerta de Hierro. Madrid.
1 Doctor en Medicina. Universidad Autónoma de Madrid.
Este trabajo ha sido presentado, por la autora principal del mismo, como Tesis Doctoral en la Universidad Autónoma de Madrid, el día 21 de febrero de 2002.
Correspondencia:
C. Cajigal Morales
Hospital Universitario Puerta de Hierro
Servicio de Oftalmología
C/. San Martín de Porres, 4
28035 Madrid
España
INTRODUCCIÓN
El melanoma de coroides es el tumor intraocular primario más frecuente en adultos, constituyendo aproximadamente el 75% de los tumores intraoculares (1-7).
Para establecer el diagnóstico es especialmente importante la oftalmoscopía indirecta ya que nos permite lo permite en más del 90% de los casos (8,9). La ecografía ocular, es, junto con la oftalmoscopía indirecta, un procedimiento muy útil en el diagnóstico de los melanomas coroideos así como en su diferenciación con otras lesiones simuladoras (8-10). La fotografía del fondo de ojo nos permite evaluar y documentar cualquier crecimiento sutil de un nevus o un melanoma coroideo pequeño que mantenemos en observación periódica (9).
Aunque la angiografía fluoresceínica no presenta un patrón patognomónico de melanoma coroideo, puede ayudarnos en el diagnóstico diferencial entre un melanoma coroideo y ciertos pseudomelanomas (9,10).
Tanto la R.N.M. como el T.A.C. son útiles para valorar la extensión extraocular y la invasión del nervio óptico (7).
La biopsia intraocular se debe reservar para casos en los que el diagnóstico sea difícil y la decisión terapéutica dependa de los hallazgos citológicos (9,10).
Una vez que se establece el diagnóstico de melanoma de coroides, se debe determinar qué tratamiento es el mejor en cada paciente afectado. El objetivo del oftalmólogo será controlar el tumor y salvar la visión del paciente cuando esto pueda conseguirse sin perjudicar su salud y supervivencia (8,11,12).
El manejo de pacientes con un melanoma coroideo pequeño es controvertido. Una razón importante para esta controversia es que se desconoce su curso natural, incluyendo, el tiempo que transcurre desde que se establece el diagnóstico hasta que se produce el crecimiento tumoral y el estadio o tamaño tumoral a partir del cual se desarrollan las metástasis (fundamentalmente en el hígado) (2,7,8,11,13-16).
Debido a que se ha observado que la mortalidad tras la enucleación aumenta con el aumento del tamaño del tumor, pasando de un 3-10% a los 5 años en tumores pequeños hasta un 30-50% en los pacientes con tumores medianos o grandes, parecería lógico tratar precozmente las lesiones coroideas pequeñas con alto riesgo de crecimiento y/o de enfermedad metastásica, mejorando, de este modo, la supervivencia de los pacientes (2,6,13,16,17).
La combinación de varios factores aumenta el riesgo de crecimiento tumoral de manera que un paciente sin ningún factor de riesgo identificado sólo tiene un 4% de riesgo de que la lesión crezca siendo mayor del 50% cuando la lesión presenta 3 o más factores de riesgo (18).
Una vez identificadas estas lesiones coroideas de alto riesgo de crecimiento y/o de enfermedad metastásica el otro problema que se plantea es cuál sería el manejo más adecuado de los pacientes con estas lesiones.
Los tratamientos conservadores del melanoma de coroides, como la radioterapia y la resección local, implican, en muchos casos, unas complicaciones oculares, como la maculopatía y/o papilopatía post-radiación, que justifican la búsqueda de otras alternativas en el caso de tumores pequeños, de localización posterior, sobre todo cuando éstos se sitúan próximos a zonas vitales para la función visual, como la mácula o el disco óptico (13,18,19).
La utilización desde el año 1995, de un método innovador de tratamiento conservador para ciertos melanomas coroideos de tamaño pequeño-mediano: la termoterapia transpupilar, nos ha hecho plantearnos si este método de tratamiento podría ser una alternativa eficaz y segura en determinados melanomas coroideos pequeños-medianos seleccionados.
En diciembre de 1997 comenzamos un estudio prospectivo y no controlado sobre la eficacia y seguridad de la termoterapia transpupilar como tratamiento primario en melanomas coroideos de tamaño pequeño o mediano.
PACIENTES Y MÉTODOS
El objetivo principal de nuestro estudio es comprobar si la termoterapia transpupilar, como tratamiento primario, es capaz de conseguir la remisión del tumor definida por los siguientes criterios (16,19-22):
1) Evolución hacia una cicatriz corio-retiniana atrófica residual, de aspecto plano, sin signos de actividad (figs. 1 y 2).
Fig. 1. Pre-tratamiento.
Fig. 2. Cicatriz corio-retiniana post-tratamiento.
2) Disminución de la altura tumoral ≥ 0,5 mm con respecto a la exploración inicial, en la ecografía ocular.
Basándonos en los estudios publicados por otros autores (18,23), al aplicar el tratamiento, se establecieron entre 1 y 5 sesiones de termoterapia transpupilar por cada paciente separadas por un intervalo de 3-4 meses (tiempo que se consideró suficiente para observar el efecto de la sesión de termoterapia transpupilar previa) (18,19).
Una circunstancia distinta a la «ausencia de respuesta al tratamiento» (el tumor no presenta los criterios de remisión tumoral) sería la recidiva local del tumor: consideramos que un tumor presenta una recidiva local cuando tras conseguir una remisión tumoral inicial, se produce un crecimiento tumoral, bien del espesor tumoral (denominándola recidiva apical) o en el margen tumoral (denominándola recidiva marginal).
Otros objetivos secundarios de nuestro estudio se refieren a la seguridad del tratamiento. Cualquier tratamiento conservador pretende no sólo conservar el globo ocular sino también su función. En este sentido, uno de los objetivos secundarios de nuestro estudio es valorar cómo influye éste sobre la agudeza visual y la conservación de la visión útil. Es difícil establecer cuál es la visión útil de un ojo pues ésta también depende de la visión del ojo contralateral. Hemos considerado visión útil a la que es ≥ 0,1 en la escala de Snellen.
La variable principal es el intervalo libre de recidiva local y, por lo tanto, de indicación de tratamientos secundarios (enucleación o radioterapia).
El objetivo a largo plazo es conocer la supervivencia, libre de metástasis.
El estudio se inició el 1 de diciembre de 1997 y los resultados publicados en este artículo son los obtenidos de la base de datos a fecha 15 de junio de 2002.
De los 31 tumores tratados hasta el día 15 de junio de 2002, 22 tumores (aproximadamente el 70%) han recibido su primera sesión de tratamiento antes del 15 de octubre de 2000, es decir, tienen un seguimiento mayor de 20 meses, equivalente a 5 sesiones de tratamiento separadas por un máximo de 4 meses. Los otros 9 tumores (aproximadamente el 30%) tienen un seguimiento inferior a 20 meses.
De los 31 tumores tratados son evaluables para este estudio 26 tumores: 21 tumores con un seguimiento mayor de 20 meses y 5 tumores que, a pesar de tener un seguimiento inferior a 20 meses, presentan, en el momento de la evaluación, una remisión o un crecimiento tumoral.
En la SELECCIÓN DE PACIENTES, se establecieron los siguientes criterios:
1. Criterios de inclusión en función de:
1.1. Tamaño tumoral, incluyendo a pacientes que presentaran un melanoma coroideo cuya altura fuera inferior a 4 mm y su diámetro basal mayor no superara los 15 mm.
1.2. Características clínicas de alto riesgo de crecimiento y/o de enfermedad metastásica, considerando que para ser candidatos a este tratamiento debieran presentar al menos 2 de los siguientes factores de riesgo:
1.2. A Altura tumoral ≥ 2 mm y/o un diámetro basal mayor ≥ 10 mm.
1.2. B Presencia de síntomas visuales relacionados con el tumor.
1.2. C Margen tumoral posterior localizado a ≤ 1,5 diámetros papilares del disco óptico.
1.2. D Presencia de líquido sub-retiniano asociado.
1.2. E Presencia de pigmento naranja sobre la superficie tumoral.
1.2. F Rotura de la membrana de Bruch acompañada de pigmentación tumoral intensa.
2. Como criterios de exclusión se consideraron:
2.1. Pacientes tratados previamente con otras técnicas.
2.2. Tumores pequeños sin crecimiento documentado ni al menos 2 factores de riesgo de crecimiento y/o de enfermedad metastásica.
2.3. Presencia de líquido sub-retiniano asociado con una altura > 3 mm sobre la superficie tumoral.
2.4. Extensión extraescleral, opacidad de medios y/o mala dilatación pupilar.
2.5. Pacientes incapaces de prestar su consentimiento una vez informados.
La recogida de datos incluyó datos demográficos: edad del paciente, sexo y lateralidad; y una evaluación oftalmológica que incluía una evaluación clínica: agudeza visual inicial, medida en la escala de Snellen con la corrección óptica del paciente y el estenopéico; la agudeza visual final; la presencia de síntomas visuales y cuáles eran estos síntomas.
También se valoraron datos del tumor:
1) Altura tumoral.
2) Diámetro tumoral transversal y longitudinal.
3) Proximidad del margen tumoral al disco óptico y a la foveola.
4) Localización meridional del tumor.
5) Evidencia fotográfica y/o ecográfica de crecimiento tumoral previo.
Y características asociadas al tumor:
1) Grado de pigmentación del melanoma.
2) Morfología tumoral.
3) Presencia de líquido sub-retiniano asociado.
4) Presencia de pigmento naranja sobre la superficie tumoral.
5) Presencia de drusas del epitelio pigmentario retiniano, asociadas al tumor.
Tras el diagnóstico y antes de realizar el tratamiento se hizo una evaluación sistémica para excluir la posibilidad de un tumor metastásico en la úvea así como detectar cualquier metástasis a distancia desde un melanoma uveal primario.
En cuanto a la técnica de tratamiento, hemos utilizado el sistema de emisión de termoterapia transpupilar adaptado al microscopio quirúrgico que permite un tamaño del impacto entre 0,3 y 2 mm, aplicando el tratamiento a través de una lente de contacto de Mainster estándar.
Para realizar el tratamiento necesitamos una buena dilatación pupilar lo cual se conseguía mediante la aplicación de un colirio de ciclopentolato al 1% y colirio de fenilefrina al 10%, previo al tratamiento. Antes del tratamiento se realizaba una anestesia retrobulbar mediante una inyección de 2 ml de Lidocaína al 2% sin adrenalina y 1 ml de Bupivacaína al 0,5%. Además, se aplicaba un colirio de anestésico antes de apoyar la lente de contacto.
En general, se utilizaron impactos de 2 mm para cubrir porciones grandes de la superficie tumoral. Los impactos eran confluentes sobre la superficie del tumor y en cada sesión se intentó cubrir toda la superficie tumoral con un margen alrededor de la misma de aproximadamente 1 mm. Los impactos comenzaban a aplicarse en la periferia tumoral y en el punto más alejado del disco óptico y/o de la fóvea. La duración de cada impacto era de 1 minuto, variando la potencia de cada impacto entre 250 y 800 mW. Esta variación depende de la pigmentación de la lesión y de que se trate de la primera sesión de tratamiento o de las sesiones sucesivas.
Después de realizar el tratamiento se aplicaba una pomada antibiótica y se ocluía el ojo durante 24 horas. Al destapar el ojo se iniciaba un tratamiento tópico con anti-inflamatorios no esteroideos, durante 1 semana.
Después del tratamiento se revisaba al paciente a las 24 horas, a la semana del tratamiento y mensualmente hasta conseguir la remisión tumoral. A partir de entonces se realizaban revisiones sucesivas cada 3-6 meses.
El estudio estadístico comprendía una parte descriptiva donde se analizaban datos cualitativos como el sexo, la lateralidad, la localización , tabulándolos con valor absoluto y porcentaje. Los datos cuantitativos se analizaron utilizando la media, la desviación estándar y el rango de la muestra. Se estudió la relación entre la respuesta al tratamiento y las complicaciones o los factores de riesgo utilizando el test de independencia de Pearson y el test exacto de Fischer. Para contrastar la hipótesis de normalidad de las variables continuas se utilizó el test de Kolmogorov. La comparación de los datos cuantitativos referidos al fracaso o la remisión del tratamiento se realizó mediante el test de la t de student para datos independientes. La probabilidad de remisión tumoral se calculó mediante la curva de Kaplan-Meier. El análisis estadístico de los datos se realizó mediante el programa SPSS para Windows, versión 10.0. (SPSS for Windows, SPSS Inc, Chicago, USA).
RESULTADOS
Excepto en los datos demográficos (edad de paciente, sexo y lateralidad), los resultados aquí presentados se refieren a los 26 pacientes evaluables.
El intervalo de edad de los 31 pacientes tratados se encontraba entre los 28 y los 77 años, con una edad media de 54 años. En la serie existía un ligero predominio de varones y en cuanto a la lateralidad, en más del 70% de los pacientes el tumor se localizaba en el ojo derecho aunque esta diferencia no era estadísticamente significativa.
La agudeza visual media antes de aplicar el tratamiento era de 0,33 (D.E.: 0,22) y si se consideran sólo los 20 pacientes (76,9% de los pacientes evaluables) que tenían una visión útil (≥ 0,1) ésta era ligeramente mayor: 0,35 (D.E.: 0,21). La agudeza visual final de los 12 pacientes que conservaron una visión útil después del tratamiento era de 0,42 (D.E.: 0,25).
La mayoría de los pacientes (96,1%) presentaban síntomas en el momento del diagnóstico.
Al valorar los datos del tumor antes de realizar el tratamiento, se observó que la altura tumoral media era de 2,72 mm (D.E.: 0,69), el diámetro transversal de 8,36 mm (D.E.: 2,10) y el diámetro longitudinal de 9,01 mm (D.E.: 2,12).
Casi el 85% de los tumores tenían una altura ≥ 2 mm o bien un diámetro mayor > 10 mm, lo cual fue considerado factor de riesgo.
17 (65,4%) de los 26 tumores estaban localizados a ≤ 1,5 diámetros papilares del disco óptico, que también fue considerado factor de riesgo.
Más del 88% de los tumores estaban localizados a ≤ 1,5 diámetros papilares de la foveola, de los cuales más del 50% presentaban afectación foveolar.
En cuanto a la localización meridional, 5 tumores presentaban una localización inferotemporal, 7 eran maculares, 6 superotemporales, 4 superiores y 4 temporales.
La evidencia fotográfica de crecimiento tumoral sólo se consideró en los casos previamente sometidos a observación, en los que el criterio determinante de malignidad fue el crecimiento. El crecimiento de la altura tumoral no puede determinarse mediante retinografía siendo la ecografía ocular la prueba auxiliar adecuada para determinar el crecimiento. Según varios autores, en tumores pequeños, se puede considerar que existe un crecimiento tumoral cuando evidenciemos un aumento ≥ 0,5 mm con respecto a la exploración inicial (19,22). Sólo 2 de los pacientes evaluables presentaron un crecimiento tumoral documentado previo al tratamiento, observándose, además, otros factores de riesgo de crecimiento.
En cuanto a las características asociadas al tumor, la mayoría de los pacientes presentaban una pigmentación moderada (57,7%) y una morfología abovedada (76,9%). Nueve tumores (34,6%) presentaban asociado líquido sub-retiniano y 15 tumores (57,7%) presentaban pigmento naranja sobre la superficie tumoral.
En la evaluación del número de factores de riesgo se observó que la mayoría de los pacientes (80,6%) presentaban 3 ó 4 factores de riesgo.
En cuanto a qué número de pacientes presentaba cada uno de los factores de riesgo, se observó que más del 80% presentaban una lesión cuya altura era ≥ 2 mm y su diámetro > 10 mm. Casi todos los pacientes (96,1%) eran sintomáticos, más del 65% de los tumores se localizaban a una distancia ≤ 1,5 diámetros papilares del disco óptico. Casi el 60% presentaban pigmento naranja sobre la superficie tumoral, casi el 35% presentaban líquido sub-retiniano asociado y sólo 1 paciente presentaba un tumor con una configuración en «champiñón» asociada a una pigmentación intensa.
La mayoría de los pacientes (76,9%) recibieron 2 ó 3 sesiones de tratamiento.
En las revisiones oftalmológicas del seguimiento se valoró la agudeza visual, los efectos colaterales de la termoterapia transpupilar, las dimensiones del tumor y su grado de cicatrización, la regresión tumoral entre las sesiones de tratamiento y el crecimiento o la recidiva tumoral, si es que existía. Se registró el estado final del paciente en cuanto a metástasis del melanoma.
Al considerar la eficacia del tratamiento se excluyeron los pacientes con un seguimiento inferior a 20 meses (que corresponde a 5 sesiones de tratamiento separadas por 4 meses) que no hayan presentado una remisión o un crecimiento/recurrencia tumoral evidente (figs. 3 y 4).
Fig. 3. Pre-tratamiento.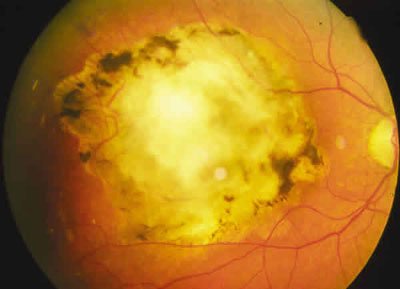
Fig. 4. Post-tratamiento (remisión tumoral).
En 13 pacientes (50%) se consiguió la remisión tumoral y en los otros 13 (50%) no se consiguió la remisión tumoral, de éstos, en 9 pacientes (70%) el fracaso se debió a un crecimiento tumoral a pesar del tratamiento y en 4 pacientes (30%) el fracaso se debió a una recidiva tumoral tras conseguirse una remisión tumoral inicial.
Sólo uno de los pacientes tratados presentó una extensión extraescleral. Se trataba de un paciente con un tumor placoide plano (2,3 mm de altura) y un diámetro de 12 x 12 mm localizado en el área macular que inicialmente presentó una remisión tumoral tras 2 sesiones de tratamiento. Cuatro meses después de la remisión tumoral presentó una recidiva marginal (nasal superior) que se trató, y respondió, con una sesión de termoterapia. Once meses después de la remisión tumoral presentó una segunda recidiva marginal, en otra localización distinta a la anterior (nasal inferior), que se trató, y también respondió, con dos sesiones de termoterapia. Un año y medio después de la remisión tumoral presentó una tercera recidiva marginal, de localización distinta a las anteriores (temporal superior) que debido a su localización periférica no era accesible al tratamiento mediante termoterapia por lo que se indicó tratamiento secundario mediante braquiterapia. La extensión extraescleral (diagnosticada ecográficamente) se observó durante las revisiones periódicas del tratamiento secundario, es decir, mucho tiempo después de la remisión tumoral.
La única complicación que se observó en el segmento anterior, tras el tratamiento, fue la lesión del borde pupilar la cual se observó en 10 pacientes que bien presentaban una mala dilatación pupilar y/o bien tenían una localización periférica.
La complicación que se presentó con mayor frecuencia en el segmento posterior fueron las hemorragias retinianas leves sobre la superficie tumoral, las cuales se observaban precozmente en relación con la aplicación del tratamiento. Otras complicaciones del segmento posterior relacionadas con el tratamiento fueron: la oclusión de alguno de los vasos de la superficie tumoral, la fibrosis premacular y el hemovítreo.
A lo largo del seguimiento (seguimiento máximo de 52,70 meses, seguimiento mínimo de 2,27 meses y seguimiento medio de 23,13 D. E.: 15 meses), ninguno de los pacientes tratados, tanto los que han respondido al tratamiento como los que han precisado un tratamiento secundario, ha fallecido ni ha presentado metástasis.
Al analizar la probabilidad de respuesta al tratamiento mediante la curva de Kaplan-Meier, se encontró que al año de seguimiento esta probabilidad es del 80% disminuyendo hasta el 58% a los 2 años y hasta el 51% a los 3 años de seguimiento.
DISCUSIÓN
De los 26 melanomas coroideos tratados, evaluables, se ha conseguido la remisión tumoral en 13 tumores, fracasando el tratamiento en los otros 13 tumores.
Nos hemos preguntado si existirían diferencias de determinadas características de los pacientes y de los tumores entre el grupo de pacientes que ha respondido y el que no ha respondido al tratamiento con el fin de obtener conclusiones relativas a posibles características del paciente y/o del tumor que lo hacen más «respondedor» al tratamiento.
En relación con las características de los pacientes, se comprobó que aunque la edad media del grupo que respondió al tratamiento era inferior a la del grupo en el que fracasó el tratamiento, esta diferencia no era significativa.
En cuanto a la agudeza visual media inicial de ambos grupos de pacientes se observó que la agudeza visual inicial era mejor en el grupo que respondió al tratamiento siendo esta diferencia significativa (P = 0,038). En principio podemos suponer que esto podría deberse a que los tumores que responden al tratamiento se localizan en un lugar más alejado de la fóvea o bien son más pequeños que los tumores que no responden al tratamiento.
En cuanto a la proximidad a la fóvea, no se han observado diferencias significativas entre los 2 grupos.
En cuanto al tamaño tumoral, se comprobó que los tumores que responden al tratamiento tienen una altura menor que los que no responden aunque esta diferencia no es significativa. Los tumores que responden al tratamiento también tienen una base transversal menor que los que no responden aunque la diferencia tampoco es significativa. Y, por último, los tumores que responden al tratamiento tienen una base longitudinal menor que los que no responden al tratamiento y, en este caso, la diferencia sí es significativa (P = 0,05). Observamos que solo existe una diferencia significativa, en cuanto a la respuesta o no al tratamiento, en relación con el diámetro tumoral longitudinal, una explicación posible de este hecho es que, con el método utilizado para aplicar la termoterapia transpupilar a través del microscopio quirúrgico con una lente de contacto de Mainster, que proporciona una visualización limitada de la retina media y periférica, el que un tumor presente una base longitudinal mayor puede estar asociado a una accesibilidad menor del láser diodo para tratar adecuadamente la zona más periférica de la base tumoral longitudinal.
Se analizó si habría algún punto de corte, en cuanto al tamaño de la base longitudinal, por encima o por debajo de la cual hubiera una diferencia significativa en la respuesta al tratamiento, comprobando que los tumores que presentan una base longitudinal ≤ 9 mm tienen una probabilidad significativamente (P = 0,05) mayor de responder a tratamiento que los que presentan una base longitudinal superior a 9 mm.
Al establecer una relación entre la mejor agudeza visual inicial de los pacientes que han respondido al tratamiento y el tamaño tumoral, se puede decir que los tumores que responden al tratamiento tienen un tamaño menor que los que no responden al tratamiento, aunque esta diferencia sólo sea significativa para 1 de las 3 dimensiones, pudiendo esto justificar la mejor agudeza visual de los tumores que responden al tratamiento.
En cuanto a la pigmentación y a la morfología tumoral, no se han observado diferencias significativas entre los 2 grupos.
Si analizamos las diferencias relacionadas con los factores de riesgo, observamos que, el único factor de riesgo que supone una diferencia significativa (P = 0,04) en la respuesta al tratamiento es la proximidad del tumor al disco óptico. El resto de los factores de riesgo se presentan con menos frecuencia en el grupo de remisión tumoral, aunque no de manera estadísticamente significativa.
Los objetivos secundarios de este estudio se refieren a la seguridad del tratamiento. Al igual que se hizo con las características de los pacientes, los tumores y los factores de riesgo, también en el caso del resultado funcional y las complicaciones, hemos comparado los 2 grupos de pacientes («respondedores» y «no respondedores» al tratamiento), para establecer diferencias.
En cuanto a la agudeza visual final, se observó que la agudeza visual final es significativamente (p = 0,004) mejor en el grupo de remisión tumoral. También la conservación de la visión útil es significativamente (p = 0,018) mejor en el grupo que respondió al tratamiento.
Al valorar si existía alguna diferencia en cuanto a la función visual relacionada con la localización tumoral, se comprobó que los tumores de localización macular e inferotemporal presentan una función visual significativamente (p = 0,005) menor que los tumores que se presentan en otras localizaciones.
En cuanto a las complicaciones relacionadas con la aplicación del tratamiento no se han observado diferencias significativas entre los 2 grupos de pacientes.
Tras analizar los resultados de este trabajo inicial, se modificaron los criterios de inclusión referidos al tamaño tumoral, incluyendo pacientes que presenten un melanoma de coroides cuya altura sea menor o igual a 3,5 mm y cuyo diámetro basal longitudinal no supere los 9 mm. En cuanto a las características clínicas de alto riesgo de crecimiento y/o de enfermedad metastásica hemos excluido a los pacientes que presenten un melanoma coroideo tangente al disco óptico. Con la modificación de estos criterios de inclusión/exclusión se han conseguido mejorar los resultados del tratamiento.
BIBLIOGRAFÍA
1. Brady LW, Shields JA, Augsburger JJ, Day JL. Malignant intraocular tumors. Cancer 1982; 49: 578-585. [ Links ]
2. Mortality in patients with small choroidal melanoma. COMS report no. 4. The Collaborative Ocular Melanoma Study Group. Arch Ophthalmol 1997; 115: 886-893. [ Links ]
3. The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radiation of large choroidal melanoma II: initial mortality findings. COMS report no. 10. Am J Ophthalmol 1998; 125: 779-796. [ Links ]
4. Diener-West M, Earle JD, Fine SL, Hawkins BS, Moy CS, Reynolds SM, et al. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma, II: characteristics of patients enrolled and not enrolled. COMS report no. 17. Arch Ophthalmol 2001; 119: 951-965. [ Links ]
5. Sieving PA. Fifteen years of work: the COMS outcomes for medium-sized choroidal melanoma. Arch Ophthalmol 2001; 119: 1067-1068. [ Links ]
6. Murray TG. Small choroidal melanoma. Arch Ophthalmol 1977; 115: 1577-1578. [ Links ]
7. Valcárcel F, Valverde S, Cardenes H, Cajigal C, de la Torre A, Magallón R, et al. Epiescleral iridium-192 wire therapy for choroidal melanomas. Int J Radiat Oncol Biol Phys 1994; 30: 1091-1097. [ Links ]
8. Char DH. The management of small choroidal melanomas. Surv Ophthalmol 1978; 22: 377-386. [ Links ]
9. Shields CL, Shields JA, Kiratli H, De Potter P, Cater JR. Risk factors for growth and metastasis of small choroidal melanocytic lesions. Ophthalmology 1995; 102: 1351-1361. [ Links ]
10. Shields JA, Shields CL, Donoso LA. Management of posterior uveal melanoma. Surv Ophthalmol 1991; 36: 161-195. [ Links ]
11. Char DH. Therapeutic options in uveal melanomas. Am J Ophthalmol 1984; 98: 796-799. [ Links ]
12. Shields CL, Shields JA, De Potter P, Kherterpal S. Transpupillary thermotherapy in the management of choroidal melanoma. Ophthalmology 1996; 103: 1642-1650. [ Links ]
13. Factors predictive of growth and treatment of small choroidal melanoma: COMS Report no. 5. The Collaborative Ocular Melanoma Study Group. Arch Ophthalmol 1997; 115: 1537-1544. [ Links ]
14. Gass JD. Problems in the differential diagnosis of choroidal nevi and malignant melanomas. XXXIII Edward Jackson Memorial Lecture. Am J Ophthalmol 1977; 83: 299-323. [ Links ]
15. McLean MJ, Foster WD, Zimmerman LE. Prognostic factors in small malignant melanomas of choroid and ciliary body. Arch Ophthalmol 1977; 95: 48-58. [ Links ]
16. Shields CL, Shields JA, Carter J, Lois N, Edelstein C, Gunduz K et al. Transpupillary thermotherapy for choroidal melanoma: tumor control and visual results in 100 consecutive cases. Ophthalmology 1998; 105: 581-590. [ Links ]
17. Robertson DM, Buettner H, Bennett SR. Transpupillary thermotherapy as primary treatment for small choroidal melanomas. Arch Ophthalmol 1999; 117: 1512-1519. [ Links ]
18. Shields CL, Cater J, Shields JA, Singh AD, Santos MC, Carvalho C. Combination of clinical factors predictive of growth of small choroidal melanocytic tumors. Arch Ophthalmol 2000; 118: 360-364. [ Links ]
19. Oosterhuis JA, Journee-de Korver HG, Kadebeeke-Kemme HM, Bleeker JC. Transpupillary thermotherapy in choroidal melanomas. Arch Ophthalmol 1995; 113: 315-321. [ Links ]
20. Gragoudas ES, Seddon JM, Egan K, Glynn R, Munzenrider J, Austin-Seymour M et al. Long-term results of proton beam irradiated uveal melanomas. Ophthalmology 1987; 94: 349-353. [ Links ]
21. Shields CL, Shields JA, Perez N, Singh AD, Cater J. Primary transpupillary thermotherapy for small choroidal melanoma in 256 consecutive cases: outcomes and limitations. Ophthalmology 2002; 109: 225-234. [ Links ]
22. Keunen JE, Journee-de Korver JG, Oosterhuis JA. Transpupillary thermotherapy of choroidal melanoma with or without brachitherapy: a dilema. Br J Ophthalmol 1999; 83: 1212-1213. [ Links ]
23. Shields CL, Shields JA. Transpupillary thermotherapy for choroidal melanoma. Curr Opin Ophthalmol 1999; 10: 197-203. [ Links ]

















