Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.80 no.9 sep. 2005
REVISIÓN
MICROSCOPÍA CONFOCAL DE LA CÓRNEA
EN LA CIRUGÍA FOTORREFRACTIVA
CONFOCAL MICROSCOPY OF THE CORNEA
IN PHOTOREFRACTIVE SURGERY
JAVALOY J1, VIDAL MT1, RUIZ-MORENO JM1, ALIÓ JL1
| RESUMEN Objetivo: La cirugía corneal refractiva comprende una serie de técnicas cuyo empleo ha experimentado un auge creciente en los últimos años. La rapidez con la que los diferentes métodos se han extendido por todo el mundo, junto a la edad media precoz de la gran mayoría de los pacientes operados, limita considerablemente nuestro conocimiento acerca de los cambios que a nivel histológico se producen en el interior de las córneas intervenidas. Por ello, resultan de gran valor todas aquellas pruebas diagnósticas que puedan acercarnos a un conocimiento sobre los cambios patogénicos que acontecen en las córneas operadas y en proceso de reparación. Palabras clave: Córnea, microscopía confocal, PRK-LASIK, cicatrización. | ABSTRACT Objective: Corneal refractive surgery involves a range of techniques which have assumed a growing importance during the last few years. The advances of very different surgical methods and the early age of the majority of the patients subjected to surgery, limits our knowledge of the histopathologic changes in the operated corneas. For this reason, the development of any diagnostic tool which can permit us to improve our knowledge of the wound healing process would be of significant value. Key words: Cornea, confocal microscopy, PRK-LASIK, wound healing.
|
Recibido: 21/4/04. Aceptado: 20/9/05.
VISSUM. Instituto Oftalmológico de Alicante. España.
1 Doctor en Medicina.
Correspondencia:
Jaime Javaloy Estañ
VISSUM (Instituto Oftalmológico de Alicante)
Avda. Denia, s/n (El Pinar de Vistahermosa)
03016 Alicante
España
E-mail: jjavaloy@coma.es
INTRODUCCIÓN
La microscopía confocal (MC) es una nueva ciencia. Aunque la idea de un microscopio confocal fue patentada por Minsky en 1957 y el primer dispositivo mecánico similar a un microscopio confocal fue diseñado y producido por Eggar y Petran en la década siguiente, no fue hasta la década de los setenta, con la llegada de los ordenadores, el láser y el procesamiento digital de las imágenes, cuando el primer microscopio confocal láser de haz simple fue utilizado en un gran número de laboratorios para el estudio de muestras biológicas (1). A partir de este momento la MC ha sido utilizada en el terreno de la investigación, siendo incorporada a ella un buen número de técnicas previamente usadas en la exploración con métodos convencionales de microscopía óptica tales como la inmunofluorescencia y la construcción de imágenes tridimensionales.
La microscopía óptica confocal es una técnica de uso reciente que presenta varias ventajas con respecto a la microscopía óptica convencional. La más importante de ellas deriva del hecho de que el «emborronamiento de las imágenes fuera de foco» está esencialmente ausente de las imágenes confocales, ofreciendo la capacidad de obtener cortes ópticos seriados de forma no invasiva en especímenes intactos e incluso en organismos vivos.
En la «epi-iluminación» del microscopio óptico convencional, la iluminación simultánea de todo el campo de visión en una pieza producirá siempre reflexión de luz en todo el espesor de la misma además de en el plano de enfoque. Gran parte de la luz recogida por las lentes del objetivo para formar la imagen procederá de las regiones superiores e inferiores al plano focal seleccionado, contribuyendo al emborronamiento de la imagen final y degradándola de forma importante al reducir su contraste y definición de las formas (fig. 1).

Fig. 1. Microscopio óptico convencional. Existe dispersión de
la luz proveniente de toda la pieza a estudiar.
Pero se sabe que casi toda la luz que emana de las zonas superior e inferior al plano de enfoque puede ser eliminada físicamente restringiendo la iluminación de la pieza a un solo punto. Para ello basta con introducir en el sistema óptico una apertura de imagen confocal (fig. 2) y para obtener una imagen completa que contendrá únicamente la información del tejido «en foco».
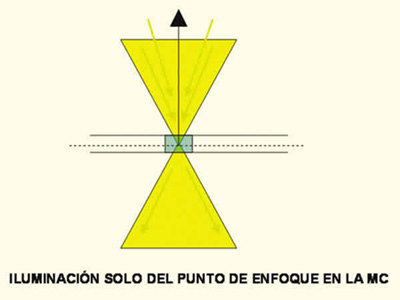
Fig. 2 Microscopio Confocal. Se enfoca un solo punto en
el interior la pieza de tejido a estudio.
La MC tiene otras ventajas adicionales con respecto a la convencional, tales como un ligero aunque significativo incremento en la resolución lateral. También es compatible con el procesado mediante ordenador de imágenes de alta resolución digitalizadas, permitiendo la reconstrucción de imágenes tridimensionales o la topografía de superficies (1-3).
La capacidad de obtener cortes ópticos seriados permite obtener imágenes de diferentes profundidades dentro del espesor de una pieza de tejido, eliminando de esta forma la necesidad de realizar procedimientos de seccionado y procesado de muestras. Por eso la MC es única como técnica para la valoración de tejidos intactos en organismos vivos.
SISTEMAS ACTUALES DE IMAGEN CONFOCAL
En la actualidad existen cuatro tipos de microscopios confocales para uso oftalmológico: el Tandem Scanning (TSCM), el Confoscan, el Koester (4,5) y el Heidelberg (HRT II).
El primer microscopio confocal usado para ver la córnea fue el TSCM, que usa un sistema fuente-detector con un agujero que minimiza la cantidad de luz dispersada arriba y debajo del plano de enfoque. El resultado es un marcado incremento en la resolución lateral (X,Y) y axial (Z) comparado con la microscopía óptica convencional (1). Los orificios están dispuestos en un disco giratorio, lo que permite incluso un «scanning» del tejido en tiempo real. Las imágenes pueden ser observadas y registradas utilizando un sistema de vídeo conectado a un ordenador (fig. 3).

Fig. 3. Microscopio Confocal Tandem Scaning. La existencia de un diagrama
confocal giratorio con aperturas de diámetros diferentes junto con el desplazamiento
vertical de la lente, permite el enfoque de un solo punto a diferentes profundidades.
El Koester y el Confoscan usan dos haces de luz conjugados ópticamente para la fuente y detección en lugar de la apertura de orificios.
El microscopio Koester tiene un único sistema de apertura óptica dividida y un sistema de trabajo a distancia con una lente cónica de inmersión que permite obtener imágenes de todas las capas celulares de la córnea. Una ventaja de este sistema es su bajo coste, pues puede ser usado un sistema de fotografía con flash evitando la necesidad de un sistema computarizado de análisis de imagen (6).
En el microscopio Confoscan, dos haces de luz de anchura ajustable se encuentran en planos ópticos conjugados (fuente y detector) y un módulo de «scanning» mueve la imagen del haz a lo largo de la córnea en tiempo real. Las secciones ópticas son conseguidas sincronizando la frecuencia y la fase de un scanner óptico con una videocámara CCD (7).
El Tomógrafo Heidelberg es el único que emplea tecnología láser (láser de diodo de 670 nm) y con su nueva aplicación corneal es utilizado como un microscopio confocal. La principal ventaja de este sistema de exploración confocal es que la aberración cromática es eliminada al ser utilizada luz láser, de modo que puede ser conseguida una mejor definición de las imágenes.
En general se puede afirmar que para una determinada apertura numérica del objetivo, el TSCM proporciona mejor resolución axial y lateral que los sistemas de haces de barrido. En cambio, la capacidad de estos últimos para variar la profundidad del haz les convierte en técnicas más flexibles que el TSCM. Está claro que los cuatro sistemas tienen ventajas e inconvenientes, y la elección del mismo debe ser individualizada según la necesidad concreta del investigador (4,5).
In vivo, la MC ha sido utilizada en animales de experimentación con diferentes aplicaciones, tales como la cuantificación de cambios en la morfología epitelial por el porte de lentes de contacto, cicatrización corneal y medida de los efectos de la irritación ocular (4,5).
Recientemente se ha producido a una gran expansión del uso de la MC en pacientes humanos ya que se ha demostrado como una herramienta eficaz para el diagnóstico de infecciones corneales poco frecuentes, destacando entre ellas la queratitis por Acantamoeba, donde los quistes pueden ser visualizados y por lo tanto diagnosticada sin necesidad de técnicas histológicas invasivas (5,7-13). Algunas distrofias corneales también pueden ser identificadas precozmente y puede ayudar al estudio evolutivo de las mismas, siendo especialmente útil en los síndromes irido-corneales donde incluso puede llegar a ser diagnóstica (14-19). También puede ayudar a diferenciar en casos de trasplantes de córnea y edema del botón, entre una causa de descompensación endotelial crónica o un rechazo agudo (20).
Se han estudiado también los cambios corneales en los portadores de lentes de contacto e incluso en pacientes con enfermedades sistémicas tales como los diabéticos (21,22). Pero ha sido el gran auge que ha tomado la cirugía refractiva corneal en los últimos años, la que ha fomentado el uso de esta herramienta tan importante ante la necesidad de conocer lo que realmente está sucediendo a nivel microscópico en el tejido corneal ablacionado. Así, con la MC se puede estudiar el epitelio corneal, el estroma y sus procesos cicatriciales, el endotelio, la inervación y, mediante el análisis de enfoque completo de la córnea («Confocal Microscopy Through Focusing o CMTF»), que luego se explicará con detalle, determinar con gran precisión el espesor de la córnea y sus diferentes subcapas, así como la cuantificación objetiva del grado de opacidad (haze) en caso de que éste existiera.
MICROSCOPÍA CONFOCAL CUANTITATIVA DE ENFOQUE COMPLETO
(CMTF: Confocal Microscopy Through Focusing)
Con esta técnica, basada en la observación de que las diferentes subcapas de la córnea generan distintas intensidades reflectivas, se realiza un barrido continuo de todo el espesor de la córnea y en un punto concreto del plano sagital, comenzando en el epitelio y llegando hasta la monocapa endotelial. Mediante la aplicación de un software, se crea una gráfica bidimensional en la que el eje horizontal representa el espesor corneal en micras (el eje z del barrido) y el vertical la intensidad luminosa reflectiva calculada para cada punto (fig. 4). Como el plano de enfoque avanza a una velocidad de 64 mm/seg, se pueden obtener hasta 300 imágenes de la córnea en los 10 segundos que dura el barrido. Tales imágenes son grabadas en vídeo para conocer cuál es el punto exacto estudiado y la correspondiente reflectividad luminosa en dicho punto.

Fig. 4. Estudio CMTF de una córnea normal donde se aprecian tres picos. El pico epitelial, el correspondiente
al plexo subepitelial y queratocitos del estroma anterior, y un tercero que refleja el endotelio.
Este método ha sido utilizado en varios estudios y tiene un elevado grado de confiabilidad (23).
Aplicaciones del estudio CMTF
Paquimetría de alta precisión
Como todos los puntos de la curva CTMF se correlacionan directamente con imágenes que se ven simultáneamente en la pantalla del ordenador, la posición exacta en el eje Z de estructuras concretas como la superficie epitelial, el plexo nervioso subepitelial y el endotelio, pueden ser utilizadas para calcular la distancia entre subcapas corneales de forma precisa. Se ha utilizado para la medición del grosor corneal dando unas medidas muy reproducibles (24,25). También para medir el grosor del flap en cualquier momento del postoperatorio (26-29). Y en casos de retratamientos por haze intenso o por la existencia de leucomas cicatriciales, para medir tanto el grosor de los mismos como para planear la técnica quirúrgica más correcta ,ya sea la queratectomía fototerapéutica o una queratectomía lamelar superficial (30).
En el perfil de la curva, los dos picos mayores corresponden al epitelio superficial y al endotelio. En córneas normales se aprecian también entre uno y dos pequeños picos correspondientes al plexo nervioso subepitelial y a la capa anterior de queratocitos (fig. 4).
La resolución estimada para el microscopio confocal en el plano X-Y (sagital) es de 0,5-1 mm y en el Z (en profundidad) de hasta 9 mm, sensiblemente superior a la ofrecida por el paquímetro ultrasónico convencional estimada en 12 mm corneales (31,32).
Cuantificación objetiva del haze o leucomas corneales
La técnica permite obtener medidas de la profundidad y espesor del haze que puede aparecer tras la cirugía refractiva, de los leucomas corneales o cualquier estructura en el espesor corneal que cause un cambio en la reflectividad luminosa normal, así como cuantificar su densidad hallando el área del pico generado en la gráfica del análisis CTMF. La cifra obtenida combina información correspondiente al espesor de la zona de haze (anchura del pico) y su intensidad (altura del pico) y es expresada de forma arbitraria en unidades (U=mm x intensidad luminosa en pixels) cuya magnitud será proporcional al área englobada en dicho pico.
El cálculo del área del pico estromal anterior que aparece en la curva CMTF ha sido validado como un método objetivo, eficaz y reproducible a la hora de evaluar la opacidad corneal en ojos operados de cirugía fotorrefractiva y sus implicaciones clínicas (24,33-36) (fig. 5).

Fig. 5. Curva CMTF en paciente intervenido de LASIK. Se marca el área correspondiente al índice WHO
(opacidad ligada a la cicatrización) en estroma anterior de una córnea con haze.
Nuestro grupo de trabajo ha acuñado el término «índice W.H.O.» (del inglés «Wound Healing Opacification» cuya traducción sería el índice de opacidad ligada a la cicatrización) para expresar la clara relación existente entre la reflectividad óptica analizada en la porción anterior del estroma y los procesos de reparación corneal en la cirugía fotorrefractiva (29,37).
MORFOLOGÍA CORNEAL NORMAL CON EL MICROSCOPIO CONFOCAL
Epitelio
Con el microscopio confocal es posible distinguir tres tipos celulares diferentes: las células superficiales, las basales y las intermedias.
Las células superficiales aparecen con bordes poligonales, bien definidos y con núcleos evidentes. Estos núcleos son brillantes, con un halo hiporreflectivo que destaca sobre un citoplasma homogéneo. Las células basales son más pequeñas, poligonales, sin núcleo hiperrefringente y con citoplasma más denso. También se encuentran en mayor número y sus bordes están muy marcados. Las células intermedias son también poligonales, sin núcleo y con características de densidad intermedias entre las dos anteriores (38) (fig. 6).
Se debe conocer que la membrana basal epitelial y la membrana de Bowman no pueden ser identificadas en corneas normales.
Plexo nervioso subbasal y subepitelial
Las fibras nerviosas de los plexos subbasal y subepitelial son claramente visibles en córneas normales, ya que contrastan sobre un fondo oscuro.
Son fibras nerviosas finas, brillantes, distribuidas de manera paralela u oblicuas y con diversas bifurcaciones que se conectan entre sí (fig. 6). El grosor medio de cada fibra subbasal esta entre 2 y 4 mm y el de las fibras subepiteliales entre 3 y 7 mm (39).

Fig. 6. Imágenes obtenidas con el microscopio confocal
del epitelio corneal (arriba-izquierda); plexo basal
subepitelial (arriba-derecha); estroma anterior (bajo-izquierda);
endotelio (bajo-derecha).
Estroma
La imagen típica del estroma corneal muestra numerosos cuerpos ovales brillantes que representan los núcleos de los queratocitos, repartidos en una matriz extracelular de color grisáceo, casi transparente. En ausencia de patología estromal, la matriz extracelular, sustancia fundamental y las lamelas corneales son imposibles de diferenciar por la transparencia intrínseca de estas estructuras (38,40-47) (fig. 6).
En cuanto a la morfología de los queratocitos, en el estroma anterior (100-150 micras tras la membrana de Bowman) son abundantes y de morfología irregular, de aspecto algo alargado y con numerosos procesos. En el estroma medio (150-350 micras centrales) se encuentran queratocitos triangulares con finos procesos, mientras en estroma profundo (100 micras anteriores a la membrana de Descemet), estas células son grandes, irregulares y ovales. La diferencia en su reflectividad se cree debida al distinto grado de activación metabólica (44).
El tamaño celular es mayor en el estroma profundo (14,4 µm3), seguido de los queratocitos del estroma anterior (5,4 µm3), siendo los queratocitos del estroma medio los que tienen un menor tamaño (5,0 mm3).
En cuanto al número de queratocitos, existe un mayor número en el estroma anterior que va disminuyendo paulatinamente hasta el estroma profundo, con un aumento significativo en la zona adyacente a la membrana de Descemet (41-47).
En el estroma anterior y medio, es posible visualizar fibras nerviosas procedentes del plexo corneal profundo de 3 a 5 veces mas gruesas que la fibras del plexo subepitelial y que habitualmente aparecen aisladas, viéndose en ocasiones sus bifurcaciones en forma de «Y». Suelen medir entre 8 a 20 mm y suelen estar ausentes en el estroma profundo (39).
Endotelio
Es fácilmente identificable pues aparece como una monocapa compuesta por células hexagonales o poligonales homogéneamente brillantes y sin núcleo visible (fig. 6). Los bordes celulares se aprecian bien definidos, finos y sin reflectividad (38).
No es posible identificar la membrana de Descemet en córneas normales aunque sí se puede ver en determinadas patologías como la distrofia polimorfa posterior o en el glaucoma congénito primario (18-20).
USO DE LA MICROSCOPÍA CONFOCAL EN EL ESTUDIO DE
LA CICATRIZACIÓN CORNEAL TRAS LA CIRUGÍA REFRACTIVA MEDIANTE PRK Y LASIK
Microscopía confocal y PRK
Evaluación preoperatoria
La MC puede ser utilizada en el preoperatorio como técnica para descartar algún tipo de patología microscópica que no puede ser valorada con la exploración oftalmológica habitual. En ocasiones se pueden diagnosticar patologías corneales en estados incipientes como una cornea guttata, distrofias, disminución en la densidad de queratocitos, alteraciones en la inervación, en la matriz colágena, que pueden hacer que determinadas técnicas de cirugía refractiva sean contraindicadas ante la posibilidad de complicaciones postquirúrgicas evitables. Pero al tratarse de una técnica costosa, su generalización como técnica exploratoria de rutina es prácticamente inviable.
Cicatrización corneal
Reparación epitelial
Durante la PRK el epitelio corneal es eliminado de manera mecánica, química o mediante ablación con el propio láser. Tras esto, la membrana de Bowman y parte del estroma anterior son ablacionados mediante el láser excimer. Unas horas más tarde, la córnea comienza a reepitelizarse a partir de la periferia, completándose el proceso en 3 ó 4 días (48,49).
Regeneración nerviosa
Durante la PRK el plexo nervioso subepitelial y los nervios estromales anteriores son ablacionados. Una semana después ya comienzan a aparecer visibles a la MC las primeras fibras nerviosas subepiteliales (50) aunque otros autores las observan al mes de la cirugía (51) o incluso dos meses (52).
La reinervación comienza desde la perifería corneal en forma de finas ramas y se cree que el plexo subepitelial está más o menos formado alrededor de los 6 8 meses (52) pero ramas anormales siempre son visibles (fig. 7). En cualquier caso, la regeneración nerviosa tras la PRK es rápida, posiblemente debido a la denominada inflamación neurogénica y a la interacción de las fibras seccionadas con los factores neurotróficos liberados por el epitelio en regeneración.

Fig. 7. Fibras nerviosas anómalas 7 años tras PRK.
Como consecuencia de la perdida inicial de las fibras nerviosas aparece una disminución de la sensibilidad corneal en el área tratada entre el primer mes y el tercero, para luego recuperarse a niveles normales (53). Hay autores que no aprecian diferencias en la sensibilidad corneal central ya en el primer mes tras la cirugía (54).
Cicatrización estromal
El proceso de reparación tisular estromal es el responsable del aspecto final anatómico de la córnea y en gran medida del resultado refractivo, proceso en el cual están implicados varios mecanismos.
Tras la cirugía fotorrefractiva aparece una capa acelular en el lecho corneal, que dependiendo de la ablación se extiende entre 25 y 100 micras en el estroma anterior causada por la muerte de los queratocitos. Esta desaparición queratocitaria en el lecho no ablacionado se cree debida a un fenómeno de apoptosis (55). El estroma anterior comienza a regenerarse días más tarde a partir de los queratocitos activados subyacentes que migran hacia el lecho estromal ablacionado en las primeras tres semanas tras la cirugía. Estos queratocitos activados se trasforman en miofibroblastos y se asocian a un aumento de la matriz extracelular al ser responsables de la formación de nuevo colágeno. En general se cree que la apoptosis inducida quirúrgicamente, la proliferación queratocitaria, la activación y la posterior transformación en miofibroblastos, son fenómenos que regulan tanto el proceso normal de cicatrización como la aparición de haze (33,52).
Generalmente estos procesos de cicatrización tienen lugar más intensamente en las 30-50 micras del estroma anterior entre el primer mes y el tercero, apareciendo el estroma medio y posterior inalterado. Incluso en pacientes con córneas claras, este proceso de cicatrización, con aparición de queratocitos activados, alteraciones en las fibrillas de colágeno y aumento de la matriz extracelular, también es visible hasta más allá de 30 meses (50), aunque existe una disminución de estos procesos a partir de los 6-10 meses (49).
En presencia de una cicatrización inadecuada, con gran cantidad de queratocitos activados, y una producción exagerada de matriz extracelular, estamos ante lo que habitualmente llamamos haze.
Haze
El haze forma parte del proceso de cicatrización corneal que ocurre tras los procesos de cirugía refractiva mediante láser excímer. Se describe como una opacidad a nivel subepitelial y en estroma anterior de diferente intensidad y profundidad, que como manifestaciones clínicas da lugar a halos, deslumbramiento, alteración de la sensibilidad al contraste y en casos severos, disminución de la agudeza visual.
En procesos refractivos como la PRK, la existencia de trazas de haze es un proceso bastante frecuente, pero sólo pacientes con una cicatrización corneal agresiva, presentan un haze clínicamente significativo (56).
En diferentes estudios se ha visto que el haze es mayor a los seis meses tras la fotoablación (56) y que comienza a disminuir en los siguientes 12-24 meses (49) aunque en determinados casos puede ser visto como una modificación permanente. Su evolución puede ser modificada mediante tratamiento médico tópico con corticoides (57,58) aunque diferentes fármacos siguen hoy en estudio.
Con la MC se ha evidenciado que el proceso de cicatrización normal y la aparición de haze, son fenómenos que coexisten en el tiempo y que su intensidad depende de cada caso en particular, del tipo de cicatrización individual, la refracción previa, el tratamiento medico empleado y el postoperatorio en general (fig. 8).

Fig. 8. Haze al mes de la cirugía mediante PRK.
Haze y reepitelización
Como ya se ha comentado, la reepitelización corneal tarda en completarse unos 3 ó 4 días tras la PRK. Diversos autores han manifestado la importancia de la interrelación entre el epitelio y la superficie estromal ablacionada (33,35,49). Cuando esta reepitelización se retrasa, se ha comprobado que la existencia de haze subepitelial es mucho más frecuente (48).
Con la MC y ayudada del análisis CMTF, se pueden estudiar varios parámetros del haze.
Profundidad
En la mayoría de casos de haze tras PRK, éste se localiza entre las 60 a 150 micras de profundidad desde la superficie corneal. Con la función CMTF, se puede medir tanto su profundidad como su grosor en micras. Esto es de crucial importancia si se pretende tratarlo mediante una queratectomía fototerapeútica.
Densidad
Su densidad es medida indirectamente calculando el área del pico de reflectividad luminosa (índice W.H.O.) que se obtiene mediante el estudio de enfoque completo de la cornea (CMTF). En 1997, Moller-Pedersen y colaboradores, correlacionaron y midieron por primera vez el grado de haze a nivel clínico y microscópico utilizando la MC (34).
Fisiopatología
Los elementos microscópicos que dan lugar a este fenómeno no se conocen del todo, pero la presencia de queratocitos activados y la síntesis de nuevo colágeno del tipo III y IV que anatómicamente se estructura de manera anómala, está claramente documentado.
Seguimiento
Mediante el estudio CMTF se puede hacer un seguimiento del haze a lo largo del tiempo, apreciándose una disminución del mismo a medida que pasan los meses, ya sea de manera natural o en casos de haze moderado-severo tras la instauración de tratamiento médico.
Microscopía confocal y LASIK
A pesar de que el proceso cicatricial corneal por sí mismo es similar para PRK y LASIK, las diferencias en la ejecución de ambas técnicas determinan claramente la intensidad, la localización y los procesos de reparación tisular.
Al crear una lamela de tejido corneal donde se incluye el epitelio y parte del estroma anterior, y al hacer la ablación a partir de una determinada profundidad dentro del estroma, se está creando una nueva arquitectura que debe ser tenida en cuenta a la hora de estudiar los procesos cicatriciales y reparadores en esta técnica.
Así con la MC se puede estudiar, en cualquier momento del postoperatorio la interfase quirúrgica, el lecho estromal, la regeneración nerviosa y medir las diferentes capas corneales incluyendo el grosor del flap (59).
Medición del flap
El grosor del flap se puede medir fácilmente y de manera muy fiable con el microscopio confocal ya que la interfase se distingue perfectamente. Para una buena medida, son realizados un promedio de seis barridos de epitelio a endotelio y viceversa, así el error de los movimientos oculares puede ser minimizado. También se conoce que sus resultados pueden ser reproducibles, ya que pueden ser comparados a los medidos con otras técnicas, como los paquímetros ultrasónicos, la tomografía de coherencia óptica, o el analizador corneal ORBSCAN II (27,29,60,61).
La medición «in vivo» del grosor del flap tiene gran importancia para entender la biomecánica y la cicatrización corneal tras esta técnica refractiva. Es conocido que flaps finos tienen mayores riesgos de complicaciones, tales como desplazamiento del mismo, pliegues, roturas y cortes incompletos e irregulares. También que flaps gruesos, tras los cuales se realizan ablaciones extensas, pueden dejar un lecho estromal más delgado de lo aconsejable, pudiendo precipitar la aparición de una de las complicaciones más temidas tras LASIK: como es la ectasia posterior.
Hay que destacar también que flaps más finos se acompañan de una mayor reflectividad del estroma anterior en el estudio CMTF debido a la existencia de un mayor número de queratocitos activados y que el depósito de matriz extracelular es mas frecuente en estos casos (28,29,36). Las hipótesis sugeridas hasta la fecha para explicar este fenómeno son variadas. Es bien conocido que en el estroma anterior la densidad queratocitaria es mayor (42-47) y también la posibilidad de que sean liberadas en él citokinas y mediadores inflamatorios en cantidades significativas (33,55). De esta forma, si el corte lamelar es realizado en la zona más superficial del estroma cornal, es más probable encontrar una importante activación queratocitaria.
En un estudio realizado por nuestro grupo de investigación en el que eran analizados diferentes microqueratomos (29,37), aquellos que realizaban flaps de espesores mayores de 120µ medidos con MC no inducían por sí mismos opacidad corneal (haze), ni clínica ni subclínica. En cambio, en cortes inferiores a las 90µ la aparición de haze subclínico que puede ser cuantificado de forma reproducible mediante MC, era casi constante.
Aún así, no en todos los pacientes con flaps finos se observaba un aumento de esta opacidad, por lo que cierta susceptibilidad individual debe de existir en lo referente a la presencia de este fenómeno en el estroma anterior. Por ello, nosotros aconsejamos realizar cortes algo más profundos, en torno a las 120µ si se quieren evitar la aparición de haze, pero a su vez no mucho mayores para dejar un lecho estromal residual seguro.
No obstante, múltiples estudios demuestran que los microqueratomos no siempre crean flaps de la medida deseada, sino que habitualmente crean flaps más finos de lo planeado y sólo en ocasiones más gruesos, dependiendo del microqueratomo empleado, queratometría y paquimetría previas (62). Incluso diferentes unidades de microqueratomos de similares características dan lugar a cortes diferentes (27). La razón para esta discrepancia no se conoce, pero se sugiere que el edema corneal que ocurre durante la succión corneal por el microqueratomo, los procesos cicatriciales posteriores, la propia tecnología de la unidad de corte y el uso que se hace del mismo entre otros posibles factores, pueden afectar a la profundidad de corte realmente obtenida (26-29).
Estudio del estroma
La medición del estroma residual cobra una gran importancia sobre todo a la hora de los retratamientos, y se mide desde la interfase hasta el endotelio. Varios estudios coinciden en que este lecho estromal no debería medir nunca menos de 250 micras (63-69) para mantener la arquitectura corneal y evitar la aparición de ectasia, aunque hay autores que propugnan lechos residuales mayores del 50% y otros no menores del 75% del grosor corneal inicial junto con un porcentaje de ablación máximo del 10%-20% del grosor preoperatorio (70-72).
Se sabe que la activación queratocitaria en el lecho estromal es mayor en los primeros días tras el LASIK. También que en los 2-6 meses siguientes, la densidad queratocitaria en el estroma anterior (dentro del flap) es menor que en la cornea antes de la cirugía (hasta un 40% menos). Esto se cree debido a un proceso de apoptosis o de necrosis relacionada con la acumulación de células inflamatorias y a la pérdida de comunicación entre los queratocitos anteriores y las terminaciones nerviosas seccionadas (36,55,73,74).
Este fenómeno de muerte celular ha podido ser cuantificado mediante el estudio con MC al comprobar que el pico que aparece en el estroma anterior en la curva CMTF (índice WHO) de los pacientes sanos es mayor que en los pacientes intervenidos de LASIK que no han dado lugar a haze (29,37). Mitooka et al (75) han contado manualmente esta población queratocitaria con el microscopio confocal al año de la intervención y refieren que la densidad celular existente en la zona justamente anterior y posterior al flap, y en la zona del estroma más anterior, permanecen disminuidas más allá de los doce meses sin experimentar recuperación alguna, sino al contrario, un progresivo descenso a lo largo del tiempo. Descenso que ha sido confirmado por Erie et al (76) y que continúa más allá de los tres años.
El efecto que esta disminución queratocitaria va a provocar con el paso de los años en las corneas intervenidas es aún incierto, pero el conocimiento de que el patrón morfológico de la inervación permanece alterado de forma permanente (aunque la sensibilidad vuelva a valores normales o casi normales) (54,77), y la aparición en los últimos tiempos de casos con ectasia posterior varios años después de la cirugía en corneas con lechos residuales teóricamente suficientes para evitarlas (71), hacen sospechar que esta apoptosis pueda continuar durante toda la vida causando alteraciones en la biomecánica corneal.
Todos estos cambios en estroma anterior y en la zona contigua a la interfase, contrastan con la población queratocitaria más posterior donde no se aprecia alteración alguna (28,76,77).
Regeneración nerviosa
A pesar de que los primeros signos de regeneración nerviosa en la herida del LASIK pueden apreciarse mediante MC ya en la primera semana en la zona de la bisagra, el epitelio no es reinervado por completo hasta los 6-8 meses (52), y la morfología normal de los nervios subepiteliales y estromales, en cambio, puede no ser alcanzada nunca (77). Esto se acompaña de una disminución de la sensibilidad corneal clínicamente significativa hasta los tres meses, a partir del cual comienza a mejorar dicha sensibilidad, para alcanzar niveles normales en más de un 82,1% de los pacientes a los 12 meses tras la cirugía (54).
Es un hecho bien conocido que la restauración anatómica tras el LASIK es más rápida que con la PRK, pero esto contrasta con la recuperación de la sensibilidad que es mucho más lenta.
Estudio de la interfase
La morfología de la interfase, así como los procesos cicatriciales estromales implicados tanto en la regresión refractiva como en el haze, son factores importantísimos para el resultado final de la cirugía LASIK.
Con esta técnica, tanto el epitelio como parte del estroma anterior corneal son respetados, lo cual hace que los procesos de cicatrización corneal y regeneración sean menos agresivos que en la PRK. Es precisamente la interfase un punto imprescindible de estudio para entender bien los cambios morfológicos que acontecen tras la cirugía.
Las alteraciones que aparecen en la interfase en casos no complicados, generalmente comprenden unas 15-50 micras de espesor. Se aprecia una disminución de los queratocitos a este nivel por apoptosis de los mismos, así como partículas hiperrefringentes en el 100% de los casos. En el 96,8% de los pacientes se observan micropliegues a nivel de la membrana de Bowman (28,77) (fig. 9).
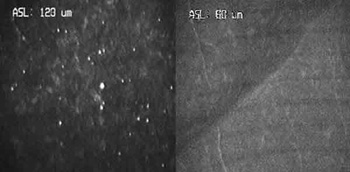
Fig. 9. Partículas en la interfase (izquierda) y micropliegue (derecha).
Las partículas son probablemente de origen exógeno y provenientes en su mayoría de la cuchilla del microqueratomo. Hasta ahora se ha creído que estas partículas eran mayoritariamente metálicas y que provenían del filo de la cuchilla. En un estudio reciente se ha demostrado mediante espectrofotometría que gran cantidad de ellas son de origen plástico y provocadas por la fricción existente entre la cuchilla y la zona del microqueratomo en contacto con la misma (78). No obstante, también aparecen otras que se creen orgánicas y que desaparecen a lo largo de los tres primeros meses tras la cirugía (28,29,36,37).
En la actualidad y con los medios que tenemos a nuestro alcance, no parecen tener significación clínica la mayoría de ellas pero serán estudios a más largo plazo los que confirmen esta apreciación.
Microscopía confocal y LASEK
En cuanto a la cicatrización corneal y la técnica denominada LASEK, aunque no hay grandes series que estudien desde el punto de vista de la MC esta técnica refractiva, algunos autores sugieren como un problema asociado la aparición de haze a pesar de obtener flaps epiteliales perfectos. La explicación a este fenómeno ya ha sido apuntada a lo largo de este artículo (28,29,33-37,55,56): toda ablación corneal realizada en el estroma más anterior va a condicionar una mayor agresividad de los procesos cicatriciales existentes.
La córnea es un tejido vivo en continuo cambio, con procesos reparadores ante agresiones y un envejecimiento fisiológico. Hasta que no sea posible modular estos procesos corneales con medidas farmacológicas, y desarrollar tecnologías absolutamente «perfectas», difícilmente se podrá alcanzar el sueño de cualquier cirujano refractivo, la denominada «supervisión».
En el futuro, el uso de la MC debería ayudarnos a crear controles de calidad a nivel microscópico de nuestra cirugía al poder conocer cada cirujano la profundidad y calidad de corte que realiza el microqueratomo que usa, así como el efecto de la unidad de láser excímer que utiliza o cualquier otro elemento que intervenga en el proceso. Podría de este modo constituir una herramienta más a la hora de crear un concepto global de calidad para la cirugía refractiva corneal.
BIBLIOGRAFÍA
1. Sheppard CJR, Shotton DM. Confocal Laser Scanning Microscopy. Microscopy Handbook Series N.º 38. New York: BIOS Scientific Publishers Ltd; 1997. [ Links ]
2. Boyde A, Petran M, Hadravsky, M. Tandem scanning reflected light microscopy of internal features in whole bone and tooth samples. J Microsc 1983; 132: 1-7. [ Links ]
3. Boyde A. Applications of tandem scanning reflected light microscopy and three-dimensional imaging. Ann N Y Acad Sci 1986; 483: 428-439. [ Links ]
4. Petroll MW, Cavanagh D, Jester JV. Clinical confocal microscopy. Curr Opin Ophthalmol 1998; 9: 59-65. [ Links ]
5. Kaufman SC, Musch DC, Belin MW, Cohen EJ, Meisler DM, Reinhart WJ, et al. Confocal microscopy: a report by the American Academy of Ophthalmology. Ophthalmology 2004; 111: 396-406. [ Links ]
6. Koester CJ, Auran JD, Rosskothen HD, Flokaris GJ, Tackaberry RB. Clinical microscopy of the cornea utilizing optical sectioning and a high-numerical-aperture objective. J Opt Soc Am A 1993; 10: 1670-1679. [ Links ]
7. Wiegand W, Thaer AA, Kroll P, Geyer OC, García AJ. Optical sectioning of the cornea with a new confocal in vivo slit-scanning videomicroscope. Ophthalmology 1995; 102: 568-575. [ Links ]
8. Winchester K, Mathers WD, Sutphin JE, Daley TE. Diagnosis of Acanthamoeba keratitis in vivo with confocal microscopy. Cornea 1995; 14: 10-17. [ Links ]
9. Pfister DR, Cameron JD, Krachmer JH, Holland EJ. Confocal microscopy findings of Acanthamoeba keratitis. Am J Ophthalmol 1996; 121: 119-128. [ Links ]
10. Mathers WD, Goldberg MA, Sutphin JE, Ditkoff JW, Folberg R. Coexistent Acanthamoeba keratitis and herpetic keratitis. Arch Ophthalmol 1997; 115: 714-718. [ Links ]
11. Florakis GJ, Moazami G, Schubert H, Koester CJ, Auran JD. Scanning slit confocal microscopy of fungal keratitis. Arch Ophthalmol 1997; 115: 1461-1463. [ Links ]
12. Winchester K, Mathers WD, Sutphin JE. Diagnosis of Aspergillus keratitis in vivo with confocal microscopy. Cornea 1997; 16: 27-31. [ Links ]
13. Sutphin JE, Kantor AL, Mathers WD, Mehaffey MG. Evaluation of infectious crystalline keratitis with confocal microscopy in a case series. Cornea 1997; 16: 21-26. [ Links ]
14. Hernandez-Quintela E, Mayer F, Dighiero P, Briat B, Savoldelli M, Legeais JM, et al. Confocal microscopy of cystic disorders of the corneal epithelium. Ophthalmology 1998; 105: 631-636. [ Links ]
15. Werner LP, Werner L, Dighiero P, Legeais JM, Renard G. Confocal microscopy in Bowman and stromal corneal dystrophies. Ophthalmology 1999; 106: 1697-1704. [ Links ]
16. Rosenberg ME, Tervo MT, Petroll WM, Vesaluoma MH. In vivo confocal microscopy of patients with corneal recurrent erosion syndrome or epithelial basement membrane dystrophy. Ophthalmology 2000; 107: 565-573. [ Links ]
17. Vesaluoma MH, Linna TU, Sankila EM, Weiss JS, Tervo TM. In vivo confocal microscopy of a family with Schnyder crystalline corneal dystrophy. Ophthalmology 1999; 106: 944-951. [ Links ]
18. Chiou AG, Kaufman SC, Beuerman RW, Ohta T, Soliman H, Kaufman HE. Confocal microscopy in cornea guttata and Fuchs´ endothelial dystrophy. Br J Ophthalmol 1999; 83: 185-189. [ Links ]
19. Chiou AG, Kaufman SC, Beuerman RW, Ohta T, Yaylali V, Kaufman HE. Confocal microscopy in the iridocorneal endothelial syndrome. Br J Ophthalmol 1999; 83: 697-702. [ Links ]
20. Kaufman SC, Beuerman RW, Kaufman HE. Diagnosis of advanced Fuch´s endothelial dystrophy with the confocal microscope. Am J Ophthalmol 1993; 116: 652-653. [ Links ]
21. Kaufman SC, Hamano H, Beuerman RW, Laird JA, Thompson HW. Transient corneal stromal and endothelial changes following soft contact lens wear: a study with confocal microscopy. CLAO J 1996; 22: 127-132. [ Links ]
22. Rosemberg ME, Tervo TM, Immonen IJ, Muller LJ, Gronhagen-Riska C, Vesaluoma MH. Corneal structure and sensitivity in type 1 diabetes mellitus. Invest Ophthalmol Vis Sci 2000; 41: 2915-2921. [ Links ]
23. Ivarsen A, Stultiens BA, Moller-Pedersen T. Validation of confocal microscopy through focusing for corneal sublayer pachymetry. Cornea 2002; 21: 700-704. [ Links ]
24. Li HF, Petroll WM, Moller-Pedersen T, Maurer JK, Cavanagh HD, Jester JV. Epithelial and corneal thickness measurements by in vivo confocal microscopy through focusing (CMTF). Curr Eye Res 1997; 16: 214-221. [ Links ]
25. Javaloy J, Vidal MT, Villada JR, Artola A, Alio JL. Comparison of four corneal pachymetry technique´s in corneal refractive surgery. J Refract Surg 2004; 20: 29-34. [ Links ]
26. Yildirim R, Aras C, Ozdamar A, Bahcecioglu H, Ozkan S. Reproductibility of corneal flap thickness in laser in situ keratomileusis using the Hansatome microkeratome. J Cataract Refract Surg 2000; 26: 1729-1732. [ Links ]
27. Durairaj VD, Balentine J, Kouyoumdjian G, Tooze JA, Young D, Spivack L, et al. The predictability of corneal flap thickness and tissue laser ablation in laser in situ keratomileusis. Ophthalmology 2000; 107: 2140-2143. [ Links ]
28. Vesaluoma M, Perez-Santonja J, Petroll M, Linna T, Alio J, Tervo T. Corneal stromal changes induced by myopic LASIK. Invest Ophthalmol Vis Sci 2000; 41: 369-376. [ Links ]
29. Javaloy J, Vidal MT, De Rojas V, Alió JL. A quality assessment model of three different microkeratomes through confocal microscopy. J Cataract Refract Surg. 2004; 30: 1300-1309. [ Links ]
30. Rasheed K, Rabinowitz YS. Superficial lamellar keratectomy using an automated microkeratome to excise corneal scarring caused by photorefractive keratectomy. J Cataract Refract Surg 1999; 25: 1184-1187. [ Links ]
31. Wheeler NC, Morantes CM, Kristensen RM, Pettit TH, Lee DA. Reliability coefficients of three corneal pachymeters. Am J Ophthalmol 1992; 113: 645-651. [ Links ]
32. Cavanagh HD, El-Agha MS, Petroll WM, Jester JV. Specular microscopy, confocal microscopy, and ultrasound biomicroscopy: diagnostic tools of the past quarter century. Cornea 2000; 19: 712-722. [ Links ]
33. Moller-Pedersen T, Li HF, Petroll WM, Cavanagh HD, Jester JV. Confocal microscopic characterization of wound repair after photorrefractive keratectomy. Invest Ophthalmol Vis Sci 1998; 39: 487-501. [ Links ]
34. Moller-Pedersen T, Vogel M, Li HF, Petroll WM, Cavanagh HD, Jester JV. Cuantification of stromal thinning, epithelial thickness, and corneal haze after photorrefractive keratectomy using in vivo confocal microscopy. Ophthalmology 1997; 104: 360-368. [ Links ]
35. Moller-Pedersen T, Cavanagh HD, Petroll M, Jester JV. Stromal wound healing explains refractive instability an haze development after photorrefractive keratectomy: a 1-year confocal microscopy study. Ophthalmology 2000; 107: 1235-1245. [ Links ]
36. Pisella PJ, Auzerie O, Bokobza Y, Debbasch C, Baudouin C. Evaluation of corneal stromal changes in vivo after in situ keratomileusis with confocal microscopy. Ophthalmology 2001; 108: 1744-1750. [ Links ]
37. Vidal Candela MT. Estudio sobre los parámetros que afectan a la calidad de la cirugía en pacientes intervenidos de Queratomileusis In Situ asistida mediante Láser Excímer (LASIK). Elche: Universidad Miguel Hernández. 2003; 272. Thesis doctoralis. [ Links ]
38. Mustonen RK, McDonald MB, Srivannaboon S, Tan AL, Doubrava MW, Kim CK. Normal human corneal cell populations evaluated by in vivo scanning slit confocal microscopy. Cornea 1998; 17: 485-492. [ Links ]
39. Oliveira-Soto L, Efron N. Morphology of corneal nerves using confocal microscopy. Cornea 2001; 20: 374-384. [ Links ]
40. Moller-Pedersen T. A comparative study of human corneal keratocyte and endothelial cell density during aging. Cornea 1997; 16: 333-338. [ Links ]
41. Prydal JI, Franc F, Dilly PN, Kerr Muir MG, Corbett MC, Marshall J. Keratocyte density and size in conscious humans by digital image analysis of confocal images. Eye 1998; 12: 337-342. [ Links ]
42. Patel SV, McLaren JW, Camp JJ, Nelson LR, Bourne WM. Automated quantification of keratocyte density by using confocal microscopy in vivo. Invest Ophthalmol Vis Sci 1999; 40: 320-326. [ Links ]
43. Patel SV, McLaren JW, Hodge DO, Bourne W. Normal human keratocyte density and corneal thickness measurement by using confocal microscopy in vivo. Invest Ophthalmol Vis Sci 2001; 42: 333-339. [ Links ]
44. Hahnel C, Somodi S, Weiss DG, Guthoff R. The keratocite network of human cornea: a three-dimensional study using confocal laser scanning fluorescence microscopy. Cornea 2000; 19: 185-193. [ Links ]
45. Li J, Jester JV, Cavanagh HD, Black TD, Petroll WM. On-line 3-dimensional confocal imaging in vivo. Invest Ophthalmol Vis Sci 2000; 41: 2945-2953. [ Links ]
46. Prydal JI, Franc F, Dilly PN, Kerr Muir MG, Corbett MC, Marshall J. Keratocyte density and size in conscious humans by digital image analysis of confocal images. Eye 1998; 12: 337-342. [ Links ]
47. Berlau J, Becker HH, Stave J, Oriwol C, Guthoff RF. Depth and age-dependent distribution of keratocytes in healthy human corneas: a study using scanning-slit confocal microscopy in vivo. J Cataract Refract Surg 2002; 28: 611-616. [ Links ]
48. Kourenkov VV, Mytiagina ON, Kasparov AA, Pavluk AG. Stimulating re-epithelization after photorefractive keratectomy. J Refract Surg 1999; 15: S234 -S237. [ Links ]
49. Fagerholm P. Wound healing after photorefractive keratectomy. J Cataract Refract Surg 2000; 26: 432-447. [ Links ]
50. Linna T, Tervo T. Real-time confocal microscopic observations on human corneal nerves and wound healing after excimer laser photorefractive keratectomy. Curr Eye Res 1997; 16: 640-649. [ Links ]
51. Frueh BE, Cadez R, Bohnke M. In vivo confocal microscopy after photorefractive keratectomy in humans. A prospective, long-term study. Arch Ophthalmol 1998; 116: 1425-1431. [ Links ]
52. Kauffmann T, Bodanowitz S, Hesse L, Kroll P. Corneal reinnervation after photorrefractive keratectomy and laser in situ keratomileusis: an in vivo study with confocal videomicroscope. Ger J Ophthamol 1996; 5: 508-512. [ Links ]
53. Tervo K, Latvala TM, Tervo TM. Recovery of corneal innervation following photorefractive keratoablation. Arch Ophthalmol 1994; 112: 1466-1470. [ Links ]
54. Kumano Y, Matsui H, Zushi I, Mawatari A, Matsui T, Nishida T, Miyazaki M. Recovery of corneal sensation after myopic correction by laser in situ keratomileusis whit a nasal or superior hinge. J Cataract Refract Surg 2003; 29: 757-761. [ Links ]
55. Wilson SE, Kim WJ. Keratocyte apoptosis: implications on corneal wound healing, tissue organization, and disease. Invest Ophthalmol Vis Sci 1998; 39: 220-226. [ Links ]
56. Durrie DS, Lesher MP, Cavanaugh TB. Classification of variable clinical response after photorefractive keratectomy for myopia. J Refract Surg 1995; 11: 341-347. [ Links ]
57. Arshinoff SA, Mills MD, Haber S. Pharmacotherapy of photorefractive keratectomy. J Cataract Refract Surg 1996; 22: 1037-1044. [ Links ]
58. Baek SH, Chang JH, Choi SY, Kim WJ, Lee JH. The effect of topical corticosteroids on refractive outcome and corneal haze after photorefractive keratectomy. J Refract Surg 1997; 13: 644-652. [ Links ]
59. Alio JL, Perez-Santonja JJ, Tervo T, Tabbara KF, Vesaluoma M, Smith RJ, et al. Postoperative inflamation, microbial complications, and wound healing following laser in situ keratomileusis. J Refract Surg 2000; 16: 523-538. [ Links ]
60. Maldonado MJ, Ruiz-Oblitas L, Munuera JM, Aliseda D, Garcia-Layana A, Moreno-Montañes J. Optical coherence tomography evaluation of the corneal cap and stromal bed features after laser in situ keratomileusis for high myopia and astigmatism. Ophthalmology 2000; 107: 81-87. [ Links ]
61. Reinstein DZ, Silverman RH, Raevsky T, Simoni GJ, Lloyd HO, Najafi DJ, et al. Arc-scanning very high-frequency digital ultrasound for 3D pachymetric mapping of the corneal epithelium and stroma in laser in situ keratomileusis. J Refract Surg 2000; 16: 414-430. [ Links ]
62. Gailitis RP, Lagzdins M. Factors that affect corneal flap thickness with the Hansatome microkeratome. J Refract Surg 2002; 18: 439-443. [ Links ]
63. Seiler T, Koufala K, Richter G. Iatrogenic keratectasia after laser in situ keratomileusis. J Refract Surg 1998; 14: 312–317. [ Links ]
64. Geggel HS, Talley AR. Delayed onset keratectasia following laser in situ keratomileusis. J Cataract Refract Surg 1999; 25: 582-586. [ Links ]
65. Buratto L, Brint S. Preoperative surgical preparation In: Burrato L, Brint S. LASIK, Técnicas quirúrgicas y complicaciones. 2nd edition, Thorofare: SLACK incorporated; 1999; 2: 15-40.
66. Naroo SA, Charman WN. Changes in posterior corneal curvature after photorefractive keratectomy. J Cataract Refract Surg 2000; 26: 872-878. [ Links ]
67. Iskander NG, Peters NT, Penno EA, Gimbel HV. Postoperative complications in laser in situ keratomileusis. Curr Opin Ophthalmol 2000; 11: 273-279. [ Links ]
68. Iskander NG, Penno EA, Peters NT, Gimbel HV, Ferensowicz M. Accuracy of Orbscan pachymetry measurements and DHG ultrasound pachymetry in primary laser in situ keratomileusis and LASIK enhancement procedures. J Cataract Refract Surg 2001; 27: 681-685. [ Links ]
69. Menezo JL, Guell JL. Corrección quirúrgica de la alta miopía. Barcelona: Espaxs Publicaciones Médicas S.A. 2001. [ Links ]
70. Wang Z, Chen J, Yang B. Posterior corneal surface topographic changes after laser in situ keratomileusis are related to residual corneal bed thickness. Ophthalmology 1999; 106: 406-410. [ Links ]
71. Lee DH, Seo S, Jeong KW, Shin SC, Vukich JA. Early spatial changes in the posterior corneal surface after laser in situ keratomileusis. J Cataract Refract Surg 2003; 29: 778-784. [ Links ]
72. Alfonso Sánchez JF. Importancia del espesor de la lamela corneal para determinar los límites del LASIK. In: Guell Villanueva JL. Complicaciones en LASIK: etiología y manejo terapéutico. Monografía de la Sociedad Española de Cirugía Ocular Implanto-Refractiva. Madrid: Tecnimedia editorial, SL; 2001; 175-181. [ Links ]
73. Wilson SE, Hong JW. Bowman´s layer structure and function: critical or dispensable to corneal function? A hypothesis. Cornea 2000; 19: 417-420. [ Links ]
74. Helena MC, Baerveldt F, Kim WJ, Wilson SE. Keratocyte apoptosis after corneal surgery. Invest Ophthalmol Vis Sci 1998; 39: 276-283. [ Links ]
75. Mitooka K, Ramirez M, Maguire LJ, Erie JC, Patel SV, McLaren JW, et al. Keratocyte density of central human cornea after laser in situ keratomileusis. Am J Ophthalmol 2002; 133: 307-314. [ Links ]
76. Erie JC, Nau CB, McLaren JW, Hodge DO, Bourne WM. Long-term keratocyte deficits in the corneal stroma after LASIK. Ophthalmology 2004; 111: 1356-1361. [ Links ]
77. Linna TU, Vesaluoma MH, Perez-Santonja JJ, Petroll WM, Alio JL, Tervo TM. Effect of myopic LASIK on corneal sensitivity and morphology of subbasal nerves. Invest Ophthalmol Vis Sci 2000; 41: 393-397. [ Links ]
78. Ivarsen A, Thogersen J, Keiding SR, Hjortdal J, Moller-Pedersen T. Plastic particles at the LASIK interface. Ophthalmology 2004; 111: 18-23. [ Links ]














