Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.80 no.10 Out. 2005
ARTÍCULO ORIGINAL
COMPARACIÓN DE TRES MÉTODOS DE INDUCCIÓN DEL INCREMENTO CRÓNICO
DE LA PRESIÓN INTRAOCULAR EN EL CERDO (GLAUCOMA EXPERIMENTAL)
COMPARISON OF THREE METHODS OF INDUCING CHRONIC ELEVATION OF INTRAOCULAR PRESSURE
IN THE PIG (EXPERIMENTAL GLAUCOMA)
RUIZ-EDERRA J1, GARCÍA M2, MARTÍN F3, URCOLA H4, HERNÁNDEZ M5,
ARAIZ J6, DURÁN J6, VECINO E7
| RESUMEN Objetivo: Comparar tres métodos de inducción de glaucoma experimental en el cerdo adulto, basados en el aumento crónico de la presión intraocular (PIO). Palabras clave: Glaucoma, células ganglionares de la retina, presión intraocular, muerte celular. | ABSTRACT Purpose: To compare three methods of inducing experimental glaucoma in the adult pig, based on achieving chronic elevation of the intraocular pressure (IOP). Key words: Glaucoma, retinal ganglion cells, porcine, intraocular pressure, cell dead.
|
Recibido: 9/12/04. Aceptado: 4/10/05.
Departamento de Biología Celular e Histología. Facultad de Medicina y Odontología. Universidad del País Vasco. Vizcaya. España.
1 Doctor en Biología. Fundación Gangoiti Barrera.
2 Doctora en Biología.
3 Técnico de Laboratorio. Universidad de Salamanca.
4 Licenciado en Medicina.
5 Licenciada en Biología. Ministerio de Ciencia y Tecnología.
6 Doctor en Medicina.
7 Doctora en Biología.
Proyecto subvencionado por ONCE (III Convocatoria I+D), Fundaluce 1.er premio 2005 (Fundación Lucha Contra la Ceguera), The American Glaucoma Foundation (TGF); Ministerio de Ciencia y Tecnología (BFi 2003-07177); Universidad del País Vasco (15350/2003).
Correspondencia:
Elena Vecino
Dpto. Biología Celular e Histología
Facultad de Medicina. Universidad del País Vasco
48940 Leioa (Vizcaya)
España
E-mail: elena.vecino@ehu.es
INTRODUCCIÓN
El estudio de los mecanismos implicados en la muerte de las células ganglionares de la retina (CGR) durante patologías como el glaucoma requiere el uso de modelos animales adecuados. Los animales pequeños, como la rata, han sido los más utilizados para la investigación en oftalmología debido a las ventajas metodológicas que presentan, sin embargo, las características de estos animales se alejan demasiado de las del ser humano. En cuanto a los mamíferos de gran tamaño, el mono, que representa el modelo filogenéticamente más cercano al hombre, tiene un uso limitado en el laboratorio debido a que presenta una serie de inconvenientes éticos y económicos. En los últimos años, el cerdo ha sido utilizado en investigación oftalmológica como modelo de estudio de enfermedades que afectan a la superficie ocular o en enfermedades como la retinitis pigmentosa (1,2).
En el presente trabajo se ha empleado el cerdo para el desarrollo de un modelo de glaucoma experimental porque reúne una serie de ventajas entre las que destacan: 1) La anatomía del ojo y la estructura de la retina de cerdo son muy similares a la del ojo humano, permitiendo el uso de herramientas utilizadas hoy en día en el diagnóstico en oftalmología (3-9). 2) Su uso en el laboratorio presenta menos problemas de tipo ético y económico que el uso de otros animales como los primates. 3) El sistema de salida del humor acuoso del ojo de cerdo es similar al humano (5).
Estudios previos de nuestro grupo de investigación han demostrado una similar distribución de las CGR de cerdo y humano (10,18: García et al., 2005). Esta información permitirá analizar los mecanismos implicados en la muerte selectiva de las CGR en el transcurso del glaucoma, ya que se ha descrito una mayor susceptibilidad de las CGR de gran tamaño como consecuencia de esta patología (11-13).
Los modelos de glaucoma experimental más utilizados se basan en el aumento crónico de la presión intraocular (PIO). Este aumento se induce mediante la interrupción del drenaje de humor acuoso por sellado de la malla trabecular mediante fotocoagulación con láser (14), la inyección intraocular de sustancias obturadoras de la malla trabecular (15), la microinyección de solución hiperosmótica en las venas limbares (16) y la cauterización de las venas epiesclerares (17).
El objetivo del presente trabajo es establecer un modelo de glaucoma en cerdo, a través de la inducción del aumento de la PIO, que mimetice la progresión de esta patología ocular en humanos.
SUJETOS, MATERIAL Y MÉTODOS
Inducción de glaucoma
En el presente estudio se emplearon 16 cerdos adultos de 6 meses de edad. Toda la experimentación se llevó a cabo siguiendo la normativa de ARVO para el uso de animales en la investigación. Las distintas intervenciones fueron realizadas en los animales bajo condiciones de anestesia general [inyección intramuscular de hidrocloruro de ketamina (Ketolar®, Parke-Davis, Barcelona, España) y Diazepam (Valium Sol. Iny.; Roche Farma, S. A.; Madrid, España) (20 mg/kg cada uno)], ventilación asistida y control de las constantes vitales.
Los animales se dividieron en cuatro grupos experimentales, utilizándose en todos los casos los ojos izquierdos como tratados y los derechos como control:
1) Epiescleral: Tres animales a los que se les cauterizaron tres de las venas epiesclerales de los ojos izquierdos, siguiendo el método descrito por Shareef et al (17). Los animales se mantuvieron con vida durante 21 semanas tras la intervención.
2) Fluoroesferas: Seis animales a los que se les inyectó en la cámara anterior del ojo, una solución de fluoroesferas de látex de 10 µm de diámetro (Molecular Probes. Invitrogen, S. A.; Barcelona, España) disueltas en medio acuoso estéril con NaCl 0,15M y 0,02% Tween-20 (Sigma-Aldrich, Madrid, España), siguiendo el método descrito en mono (15). El volumen de cada inyección fue de unos 100 µl, con un total de 2-4x105 fluoroesferas. La inyección de fluoroesferas se realizó a razón de una vez por semana a un subgrupo de animales (n=3) y dos inyecciones por semana a otro subgrupo (n=3), a lo largo de 11 semanas.
3) Fluoroesferas + metil-celulosa: Cuatro animales recibieron inyecciones de una mezcla de fluoroesferas y metil-celulosa al 2% (Methocel) en la cámara anterior del ojo. El volumen de cada inyección fue de unos 100 µl (50 µl de metil-celulosa y 50 µl de solución de fluoroesferas), el cual contenía un total de 1-2 x 105 fluoroesferas. Las inyecciones se repitieron semanalmente a lo largo de 11 semanas. Los animales se mantuvieron con vida durante 11 semanas tras la primera inyección.
4) Vehículo tamponado: Tres animales recibieron inyecciones de 100 µl o vehículo tamponado (solución salina), carente de sustancias obturadoras, en la cámara anterior del ojo a lo largo de 11 semanas.
Análisis de la presión intraocular
La PIO se midió semanalmente en todos los animales utilizando un tonómetro de aplanación manual (Tono-Pen, TM, XL). Las medidas se realizaron siempre a la misma hora del día (11:00 horas) tras instilar unas gotas de anestésico tópico en la superficie ocular. Se tomaron 10 medidas en los ojos controles (derechos) y tratados, cada una de las cuales es el valor medio de 4 medidas calculado de manera automática por el tonómetro. Se descartaron los valores que ofrecían varianzas superiores al 5%, y se calculó la media de las medidas de PIO válidas para cada ojo.
Análisis de la distribución de las CGR tras el aumento de la PIO
Las CGR fueron trazadas mediante 3-4 inyecciones de Fluorogold al 3% (Molecular Probes. Invitrogen, S. A.; Barcelona, España) en solución salina con DMSO al 0,1% que fueron aplicadas con una aguja de 30 g en las zonas dorsal, temporal y ventral del nervio óptico una vez disecado el mismo bajo condiciones de anestesia general. Transcurridas 36 horas el animal fue sacrificado, las retinas fueron aisladas, fijadas en paraformaldehido al 4% y montadas en plano con la capa de las CGR hacia arriba (9). Para visualizar las CGR se empleó un microscopio de fluorescencia y las imágenes fueron capturadas con una cámara digital. Se captaron imágenes correspondientes al 1,4% del área total de la retina y se capturaron un total de 100 campos/retina distribuidos de forma homogénea por toda la retina. Las imágenes fueron tomadas de forma sistemática, sirviéndonos del disco óptico como punto de referencia.
Se analizó el número de CGR presentes por campo, así como el área y la longitud del eje mayor del soma de cada célula. A partir de estos valores, se calcularon la densidad de CGR, el área media del soma y el porcentaje de los grupos de tamaños.
La comparación de los distintos parámetros entre los ojos tratados y los controles se realizó mediante el test de la t de Student para muestras relacionadas, utilizando el programa informático SPSS v.8.0 para Windows (SPSS Inc. Chicago, Illinois, USA). El nivel de significación se consideró p <0,05.
RESULTADOS
Incremento de la presión intraocular
La cauterización de las venas epiesclerales fue el método que produjo un incremento de la PIO más duradero y significativo. El aumento de la PIO fue aparente a la 3.ª semana tras la cauterización de las venas epiesclerales, siendo significativo las semanas 3, 16 y 21. Así, la PIO media y la desviación estándar de la media (D.E.) en los ojos control fue de 15,0 D.E. 2,4 mmHg mientras que en los ojos tratados este valor fue significativamente mayor (20,1 D.E. 1,8). Las diferencias llegaron a tener un valor máximo en la semana 16 (13,1 D.E. 4,1 mmHg en los ojos control y 20,9 D.E. 1,3 mmHg en los ojos cauterizados, p<0,05). El aumento de la PIO en los ojos cauterizados se mantuvo a lo largo de la mayor parte del período experimental (fig. 1). Un estudio más amplio referente al método de cauterización de las venas epiesclerales ha sido publicado (18).
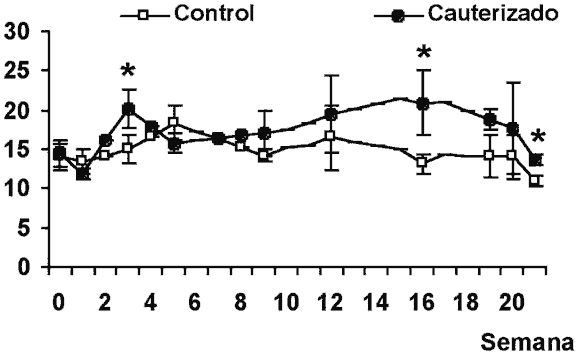
Fig. 1. Presión intraocular (PIO) media a lo largo de las distintas semanas de estudio. Se muestran la PIO media de los ojos controles
y de los ojos sometidos a la cauterización de las venas epiesclerales en las distintas semanas de estudio. Los valores se expresan en mmHg
y son la media y la desviación estándar de la media (D.E.). Los resultados del análisis estadístico están representados
por * p<0,05 diferencias significativas con respecto al control.
La inyección de una solución tamponada, carente de sustancias obturadoras en la cámara anterior no produjo modificaciones apreciables en la PIO (fig. 2A).
Asimismo, tampoco se observaron incrementos en la PIO tras la inyección semanal de fluoroesferas en la cámara anterior del ojo y, aunque la aplicación de dos inyecciones por semana produjo incrementos ligeramente superiores de la PIO, no se observaron diferencias significativas con respecto a los valores obtenidos para los ojos inyectados con vehículo tamponado (figs. 2 B y C).
Por último, la inyección conjunta de fluoroesferas y metil-celulosa en la cámara anterior del ojo produjo un mayor incremento de la PIO que la inyección de fluoroesferas. Además, la máxima PIO alcanzada con este método fue superior a la observada en el grupo epiescleral. Este valor máximo de la PIO (28 D.E. 0,1 mmHg) se alcanza en la semana 3 de estudio. A pesar de este aumento, la inyección de fluoroesferas y metil-celulosa no produce una elevación mantenida de la PIO, ya que a partir de la semana 4 de tratamiento la PIO de los ojos tratados disminuyó drásticamente (fig. 2D).

Fig. 2. Presión intraocular (PIO) media a lo largo de las distintas semanas de estudio. Se muestran la PIO media de los ojos controles
y de los ojos sometidos a inyecciones repetidas de vehículo tamponado, carente de sustancias obturadoras de la malla trabecular en la cámara anterior.
A. Inyección de vehículo tamponado, carente de sustancias obturadoras. B. Inyecciones semanales de fluoresferas. C. Inyecciones de fluoresferas a razón
de 2 inyecciones por semana. D. Inyección semanas de fluoroesferas y metil-celulosa en la cámara anterior. Los valores se expresan en mmHg y son la media
y la desviación estándar de la media (D.E.).
Alteración en la distribución de CGR
El análisis de la distribución de CGR en los ojos controles de cerdo muestra que la densidad y el tamaño de dichas células varía en función de la excentricidad. Así, se pueden distinguir tres grandes regiones en la retina: en la zona dorsal al disco óptico encontramos una banda, denominada banda visual, en la que se concentra el mayor número de CGR de la retina, con una densidad media de 4.276 D.E. 148 CGR/mm2. Además, en esta banda se encuentran principalmente células con un tamaño del soma pequeño y mediano. A medida que nos desplazamos hacia la periferia de la retina, la densidad de CGR disminuye y aumenta el área media del soma de dichas células. Así, se encontró una zona extensa de la retina, la retina media, con una densidad de CGR de 838 D.E. 34 CGR/mm2 y una zona más periférica con valores de densidad de 239 D.E. 28 CGR/mm2.
La cauterización de las venas epiesclerales provocó una pérdida media del 18,8 D.E. 8% de CGR. Esta pérdida fue más acusada en las zonas de la retina media, con un 13 D.E. 7,1% de pérdida de CGR y en la retina periférica, con un 21 D.E. 5,3% (tabla I, fig. 3). Además, se observó que tras la cauterización de las venas epiesclerales se produce un aumento en el área media del soma de las CGR. Este aumento fue mayor en aquellas zonas con mayor pérdida de CGR, es decir, en las regiones media, donde se observó un aumento del 4% en el área media del soma de las CGR, y en la periférica donde el aumento del área media del soma es del 10% (tabla II).
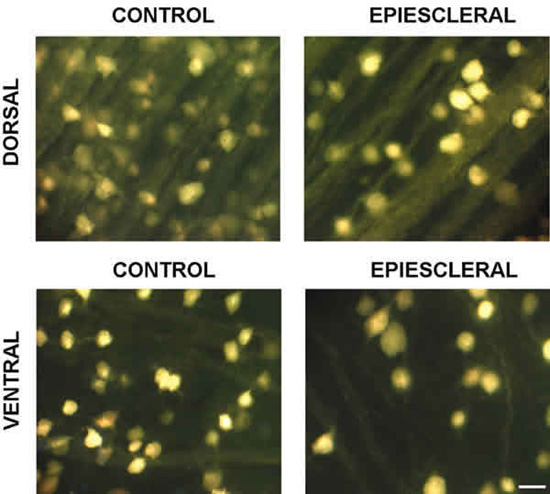
Fig. 3. Imágenes representativas de la retina media de cerdo control (izquierda) y sometido a glaucoma experimental mediante
la cauterización de las venas epiesclerales (derecha). Las imágenes de ambos lados corresponden a zonas equivalentes de la retina.
Las células ganglionares fueron trazadas de forma retrógrada con Fluoro-Gold in vivo. La barra de escala representa 25 mm.
La inyección de fluoroesferas en la cámara anterior del ojo no produjo cambios significativos en la densidad de CGR en las retinas tratadas (tabla I), sin embargo, se observó una disminución del área media del soma de las CGR en este grupo. Este descenso fue significativo en las zonas de la banda visual, con un 37% de disminución y en la retina media, con un 24% de disminución (tabla II).
En cuanto a los ojos tratados con inyecciones conjuntas de fluoroesferas y metil-celulosa, los resultados muestran que este tratamiento no produce cambios significativos ni en la densidad ni en el tamaño de las CGR (tabla I y II).
DISCUSIÓN
La cauterización de las venas epiesclerales fue el único de los métodos ensayados que produjo un incremento mantenido de la PIO. El incremento de la PIO alcanzado en los ojos tratados con este método es del orden de 1,6 veces sobre control. Este aumento es similar al descrito por otros autores en rata (17). En cuanto a los otros métodos analizados, observamos que la inyección de fluoroesferas no produce cambios significativos de la PIO. Sin embargo, se ha descrito que este método de inducción de glaucoma produce un aumento significativo de la PIO en el mono (15). Es posible que las diferencias entre nuestros resultados y los observados en mono se deban, al menos en parte, a la anatomía del canal de Schlemm. A diferencia del de los primates, el canal de Schlemm de cerdo, denominado plexo angular, está compuesto por múltiples canalículos (fig. 4 y 5), y es posible que parte de los canalículos no se obstruyan por las fluoroesferas, lo que compensaría la pérdida de drenaje de los canales obturados. Otra posible explicación es que el pequeño diámetro de estos canalículos no permita la correcta inserción de las fluoroesferas, ya que se ha descrito que éstas tienden a formar agregados (15) cuyo tamaño podría ser superior al de los canalículos del plexo angular del cerdo.

Fig. 4. Imágenes correspondientes a secciones de la malla trabecular
de los ojos de cerdo (imagen superior) y humano (imagen inferior),
en las que se ve en detalle el canal de Schlemm (asteriscos).
Nótese que el canal de Schlemm en el ojo de cerdo está constituido
por múltiples canalículos,en contraste con el humano que está constituido por un único canal.
La barra representa 50 mm.

Fig. 5. Fotomontaje donde se muestra una sección del ángulo iridocorneal del ojo de cerdo que fue sometido
a glaucoma experimental mediante inyección de fluoresferas en la cámara anterior.
Se aprecia como las fluoroesferas (verde fluorescente) se localizan principalmente en torno a la entrada
de los canalículos del plexo angular del canal de Schlemm (PA) donde forman agregados.
También se observan fluoresferas en la zona del iris (I). Abreviaturas: C: córnea; CC: cuerpo ciliar.
En cuanto a la inyección simultánea de fluoroesferas de látex y metil-celulosa, este método produjo el mayor aumento de la PIO durante las primeras semanas de tratamiento. Es posible que la metil-celulosa sea capaz, en fases iniciales, de obstruir de manera eficaz los canalículos del plexo angular, ya que no forma agregados como las fluoroesferas. Sin embargo, la bajada brusca de la PIO de los ojos tratados a partir de la semana 4 sugiere que la solución de fluoroesferas y metil-celulosa puede producir un ensanchamiento de los canales del plexo angular de manera similar a lo propuesto por otros autores. Éstos sugirieron que el aumento de la PIO producido inicialmente tras la inyección de fluoroesferas, forzaba a éstas hacia el interior de la trabécula, ensanchando los canalículos y haciendo que aumentara el flujo de humor acuoso, siendo necesarias sucesivas inyecciones para conseguir taponar de nuevo los canalículos ensanchados (15). Otra posible explicación es que en las inyecciones de la mezcla de fluoroesferas y metil-celulosa, la concentración de fluoroesferas es la mitad que la empleada en las inyecciones con sólo fluoroesferas, y que a dicha concentración las fluoroesferas no logren obturar los canalículos del plexo angular.
Con respecto a la alteración en la distribución de CGR observada con los diferentes modelos experimentales, la cauterización de las venas epiesclerales fue el único de los métodos empleados que produjo una pérdida de CGR. Los otros dos métodos no produjeron una disminución significativa de la densidad de CGR, lo que se correlaciona con la ausencia de un aumento en la PIO observada para ambos métodos.
La cauterización de las venas epiesclerales produce un patrón de pérdida de CGR semejante al observado en pacientes con glaucoma y en modelos de glaucoma experimental, en los que se ha descrito una mayor pérdida de visión o una mayor muerte de CGR en la zona correspondiente a la retina periférica (19).
Con respecto a este método se observó un aumento del área media del soma de las CGR en las regiones más periféricas de la retina, donde la pérdida de CGR es mayor. Otros autores, utilizando el método de cauterización de las venas epiesclerales en la rata observaron también un aumento del área del soma de las CGR (20). Se ha sugerido que las CGR que sobreviven a la subida de presión, podrían verse estimuladas a ocupar la pérdida de cobertura retiniana, aumentando el área del soma y/o del campo dendrítico (20-22). De forma alternativa, el aumento del volumen del soma de las CGR previo a la muerte podría representar una pérdida de la regulación osmótica, secundaria al daño celular (23).
En cuanto a la inyección de sustancias obturadoras en la cámara anterior, este método no produjo cambios en la densidad de CGR. Sin embargo, sí hemos observado una disminución significativa en el área media del soma de las CGR tras la inyección de fluoroesferas en la cámara anterior. Este resultado, que es contrario a lo observado en las CGR de las retinas cauterizadas, podría explicarse por el estado del daño en el que se encuentra la CGR en el momento de realizar el análisis. Así, teniendo en cuenta que en el caso de la inyección de fluoroesferas no hemos encontrado una pérdida de CGR, la disminución del área media del soma de estas células podría estar indicando una fase temprana del daño glaucomatoso. Esta posibilidad ha sido propuesta por otros autores utilizando un modelo de glaucoma basado en la fotocoagulación con láser en mono (23).
Se puede concluir que la cauterización de las venas epiesclerales es el mejor de los 3 métodos empleados en este estudio para producir un aumento de la PIO en el cerdo. Siguiendo este método se produce una pérdida de CGR, así como un aumento en el área media del soma de las mismas, principalmente en la zona más periférica de la retina.
BIBLIOGRAFÍA
1. Muller B, Boeck T, Hartmann C. Effect of excimer laser beam delivery and beam shaping on corneal sphericity in photorefractive keratectomy. J Cataract Refract Surg 2004; 30: 464-470. [ Links ]
2. Li ZY, Wong F, Chang JH, Possin DE, Hao Y, Petters RM, et al. Rhodopsin transgenic pigs as a model for human retinitis pigmentosa. Invest Ophthalmol Vis Sci 1998; 39: 808-819. [ Links ]
3. Prince JH, Diesem CD, Eglitis I, Ruskell GL. Anatomy and histology the eye and orbit in domestic animals. In: Thomas CC. The pig. Springfield: Charles C Thomas Publisher; 1960; 210-230. [ Links ]
4. Beauchemin ML. The fine structure of the pig´s retina. Albrecht Von Graefes Arch Klin Exp Ophthalmol 1974; 190: 27-45. [ Links ]
5. McMenamin PG, Steptoe RJ. Normal anatomy of the aqueous humour outflow system in the domestic pig eye. J Anat 1991; 178: 65-77. [ Links ]
6. Olsen TW, Sanderson S, Feng X, Hubbard WC. Porcine sclera: thickness and surface area. Invest Ophthalmol Vis Sci 2002; 43: 2529-2532. [ Links ]
7. Hendrickson A, Hicks D. Distribution and density of medium- and short-wavelength selective cones in the domestic pig retina. Exp Eye Res 2002; 74: 435-444. [ Links ]
8. Ruiz-Ederra J, Hitchcock PF, Vecino E. Two classes of astrocytes in the adult human and pig retina in terms of their expression of high affinity NGF receptor (TrkA). Neurosci Lett 2003; 337: 127-130. [ Links ]
9. Ruiz-Ederra J, Garcia M, Hicks D, Vecino E. Comparative study of the three neurofilament subunits within pig and human retinal ganglion cells. Mol Vis 2004; 10: 83-92. [ Links ]
10. García M, Ruiz-Ederra J, Hernandez-Barbachano H, Vecino E. Topography of pig retinal ganglion cells. J Comp Neurol. 2005; 486: 361-372. [ Links ]
11. Glovinsky Y, Quigley HA, Pease ME. Foveal ganglion cell loss is size dependent in experimental glaucoma. Invest Ophthalmol Vis Sci 1993; 34: 395-400. [ Links ]
12. Vickers JC, Schumer RA, Podos SM, Wang RF, Riederer BM, Morrison JH. Differential vulnerability of neurochemically identified subpopulations of retinal neuron in a monkey model of glaucoma. Brain Res 1995; 680: 23-35. [ Links ]
13. Shou T, Liu J, Wang W, Zhou Y, Zhao K. Differential dendritic shrinkage of alpha and beta retinal ganglion cells in cats with chronic glaucoma. Invest Ophthalmol Vis Sci 2003; 44: 3005-3010. [ Links ]
14. Quigley HA, Hohman RM. Laser energy levels for trabecular meshwork damage in the primate eye. Invest Ophthalmol Vis Sci 1983; 24: 1305-1317. [ Links ]
15. Weber AJ, Zelenak D. Experimental glaucoma in the primate induced by latex microspheres. J Neurosci Methods 2001; 111: 39-48. [ Links ]
16. Morrison JC, Moore CG, Deppmeier LM, Gold BG, Meshul CK, Johnson EC. A rat model of chronic pressure-induced optic nerve damage. Exp Eye Res 1997; 64: 85-96. [ Links ]
17. Shareef SR, Garcia-Valenzuela E, Salierno A, Walsh J, Sharma SC. Chronic ocular hypertension following episcleral venous occlusion in rats. Exp Eye Res 1995; 61: 379-382. [ Links ]
18. Ruiz-Ederra J, Garcia M, Hernandez M, Urcola H, Hernandez-Barbachano E, Araiz J, et al. The pig eye as a novel model of glaucoma. Exp Eye Res 2005; Jun 8 [Epub ahead of print]. [ Links ]
19. Garway-Heath DF, Holder GE, Fitzke FW, Hitchings RA. Relationship between electrophysiological, psychophysical, and anatomical measurements in glaucoma. Invest Ophthalmol Vis Sci 2002; 43: 2213-2220. [ Links ]
20. Ahmed FA, Chaudhary P, Sharma SC. Effects of increased intraocular pressure on rat retinal ganglion cells. Int J Dev Neurosci 2001; 19: 209-218. [ Links ]
21. Kirby MA, Chalupa LM. Retinal crowding alters the morphology of alpha ganglion cells. J Comp Neurol 1986; 251: 532-541. [ Links ]
22. Perry VH, Linden R. Evidence for dendritic competition in the developing retina. Nature 1982; 297: 683-685. [ Links ]
23. Morgan JE, Uchida H, Caprioli J. Retinal ganglion cell death in experimental glaucoma. Br J Ophthalmol 2000; 84: 303-310. [ Links ]
















