Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.85 no.4 abr. 2010
Tomografía por emisión de positrones (PET): fundamentos y limitaciones tecnológicas
Positron emission tomography (PET): fundamentals and technological limitations
J. Borrajo-Sánchez y F. J. Cabrero-Fraile
Departamento de Física, Ingeniería y Radiología Médica, Universidad de Salamanca, Salamanca, España
Dirección para correspondencia
La tomografía por emisión de positrones (PET) es una técnica de imagen molecular no invasiva, basada en el empleo de radiofármacos para la obtención de imágenes in vivo de procesos biológicos y bioquímicos. Permite, asimismo, la realización de estudios en el modo dinámico y realizar medidas de actividad metabólica celular a lo largo del tiempo. Se fundamenta en la captación de la radiación emitida por un radionucleido ligado a una molécula de interés. A partir de esta información se pueden llevar a cabo medidas cuantitativas precisas de diferentes parámetros fisiológicos de gran interés desde el punto de vista diagnóstico o de investigación, además de poder realizar reconstrucciones tridimensionales de la distribución del radionúclido en el organismo1.
La evolución de la tomografía PET ha estado marcada por el desarrollo tecnológico. En 1974 se fabricó el primer tomógrafo de este tipo para empleo con humanos2.
La función visual, por lo tanto, podrá ser cuantificada de forma no invasiva y objetiva, con una gran resolución. Mientras que la resonancia magnética funcional detecta flujo sanguíneo en la zona estudiada (medida indirecta de la función), el PET puede detectar la actividad metabólica celular en dicha zona.
El desarrollo de la biología molecular, la genética, así como el uso de modelos transgénicos, ha impulsado el desarrollo de sistemas no invasivos de imagen para animales pequeños; así se pueden realizar experimentos en los que es necesaria su supervivencia3. La técnica que posee mayor futuro para el análisis in vivo de procesos biológicos en animales de laboratorio es el micro PET, que permite mediciones funcionales y cuantitativas de forma no invasiva4, por lo que pueden llevarse a cabo estudios longitudinales.
En el ámbito de la investigación, los dispositivos PET para pequeños animales de laboratorio se desarrollaron a partir de la década de los 90, fundamentalmente para la determinación de los niveles de actividad en diferentes zonas anatómicas5. Estos dispositivos permiten la obtención de imágenes, imposibles de conseguir con la instrumentación diseñada para humanos debido a las limitaciones técnicas que explicaremos más adelante.
Esta técnica presenta grandes posibilidades de desarrollo, ya que disponemos de distintos radionúclidos emisores de positrones (11C, 18F, 15O, 13N) con los que podemos marcar diferentes moléculas metabolizables que serán inyectadas en el individuo objeto de estudio. Un ejemplo es la 2-deoxi-2-[18F] fluoro-d-glucosa (18F-FDG). El metabolismo celular emplea ampliamente la glucosa. Al inyectar glucosa marcada podremos localizar mediante PET aquellos lugares donde está siendo utilizada. El sistema será capaz de detectar concentraciones mínimas de estas sustancias en el organismo1.
La imagen obtenida mediante el tomógrafo PET se basa en captar la emisión de radiación electromagnética resultante de la reacción de aniquilación de los positrones emitidos por los radionúclidos, con los electrones de la materia. Al producirse la aniquilación de ambos, electrón y positrón, se dará lugar a dos fotones que viajarán en la misma dirección, pero en sentidos opuestos (con un ángulo de 180o). Dos cristales de centelleo se utilizan como detectores, que han de estar colocados en coincidencia, es decir, también con un ángulo de 180o. La señal es captada y procesada y se obtiene una imagen tridimensional que nos informa de la distribución del radionúclido emisor2 en el organismo del paciente o del animal de experimentación.
El PET es mucho más sensible que las gammacámaras empleadas en medicina nuclear, a pesar de que el sistema de detección es prácticamente idéntico (cristales de centelleo acoplados a tubos fotomultiplicadores, capaces de transformar los fotones de radiación en señales eléctricas). Mientras que el PET es capaz de detectar la señal emitida en un punto preciso, las gammacámaras necesitan dispositivos externos (colimadores) para filtrar la señal que llega al sistema de detección.
Por otra parte, al referirnos a cualquier técnica de imagen, su resolución espacial, es decir, la capacidad para detectar dos puntos próximos como distintos, es fundamental. En el caso de los tomógrafos PET va a depender de varios factores: del tamaño de los cristales de centelleo6, del recorrido medio que realiza el positrón antes de producirse su aniquilación (por ejemplo, para el 18F es de aproximadamente 2,3 mm)2 y de la distancia entre el cristal de centelleo y el lugar de la aniquilación (cuanto más próximo esté, como en los PET para animales pequeños, menos emborronamiento). Por todo esto, la resolución espacial es de aproximadamente unos milímetros en aparatos de diagnóstico en humanos, y se aproxima al milímetro al hablar de PET para animales pequeños7. En la actualidad es imposible obtener imágenes con una resolución mayor.
Otra de las limitaciones importantes que presentan las imágenes obtenidas a partir de un tomógrafo PET es la dificultad para determinar la localización anatómica exacta de una estructura o una lesión, por lo que éstas deberían complementarse con imágenes morfológicas obtenidas por algún otro método, habitualmente tomografía computarizada (TC) o resonancia magnética nuclear (RMN).
En la mayor parte de las ocasiones se emplean imágenes de TC, pero si los estudios se llevan a cabo mediante dispositivos diferentes, surgen problemas de desalineamiento al tener que recolocar al animal en los dispositivos para la obtención de ambas imágenes PET y TC. Con el fin de evitar este inconveniente, para el estudio con animales de laboratorio se están comenzando a fabricar aparatos con un diseño coplanar, con un gantry común que se emplea como soporte para los detectores PET y el sistema TC (fig. 1), similares a los que se están empleando para los estudios en humanos. Ambos sistemas comparten el eje de rotación y el centro, por lo que no es necesario el reposicionamiento del individuo o del animal8 (fig. 2).

Figura 1 - Imágenes de TC (sagital, coronal y axial, parte superior)
y de tomografía por emisión de positrones (parte inferior)
correspondientes a los mismos cortes de la cabeza de una rata.
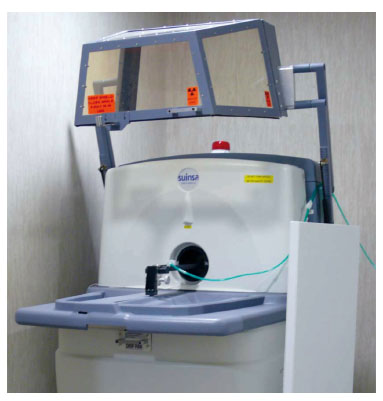
Figura 2 - Equipo de tomografía por emisión de positrones y
tomografía computarizada para pequeños animales de laboratorio.
Bibliografía
1. Ruiz JA. Tomografía por emisión de positrones (PET): evolución y futuro. Radiobiología. 2007;7:148-56. [ Links ]
2. Cantero M. Tomografía por emisión de positrones (PET): aspectos técnicos. Radiobiología. 2003;3:47-58. [ Links ]
3. Massoud TF, Gambhir SS. Molecular imaging in living subjects: seeing fundamental biological processes in a new light. Gene Dev. 2003;17:545-80. [ Links ]
4. Vaquero JJ, Desco M. Limitaciones tecnológicas de la tomografía por emisión de positrones (PET) para pequeños animales de laboratorio. Rev Esp Med Nucl. 2005;24(5):334-47. [ Links ]
5. Soto-Montenegro ML, Vaquero JJ, Pascau J, Gispert JD, García-Barreno P, Desco M. Detection of visual activation in the rat brain using 2-deoxi-2[18F]fluoro-D-glucose and statistical parametric mapping (SPM). Mol Imaging Biol. 2009;11:94-9. [ Links ]
6. Brix G, Zaers J, Adam LE, Belleman ME, Ostertag H, Trojan H, et al. Performance evaluation of a whole-body PET scanner using the NEMA protocol. J Nucl Med. 1997;38:1614-23. [ Links ]
7. Yu AS, Ling HD, Huang SC, Phelps ME, Wu HM. Quantification of cerebral glucose metabolic rate in mice using 18F-FDG and small-animal PET. J Nucl Med. 2009;50(6):966-73. [ Links ]
8. Sisniega A, Vaquero E, Lage E, Abella M, Rodríguez A, García V, et al. XXV Congreso Anual de la Sociedad Española de Ingeniería Biomédica. Cartagena. Noviembre 2007. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: borrajo@usal.es
(J. Borrajo-Sánchez)














