Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de la Sociedad Española de Oftalmología
versión impresa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.86 no.8 ago. 2011
Tratamiento de la degeneración macular asociada a la edad exudativa con ranibizumab en la práctica clínica. Resultados y factores pronósticos
Treatment of wet age-related macular degeneration with ranibizumab in clinical practice: results and prognostic factors
M.A. Muriela, B. Fatelab, A. Valdiviac y F. Clementb
aEspecialista en Oftalmología, Hospital Universitario La Princesa, Madrid, España
bServicio de Oftalmología, Hospital Universitario La Princesa, Madrid, España
cServicio de Medicina Preventiva, Hospital Universitario La Princesa, Madrid, España
Dirección para correspondencia
RESUMEN
Objetivos: Evaluar la eficacia del tratamiento con ranibizumab en la degeneración macular asociada a la edad (DMAE) exudativa e identificar los factores pronósticos.
Método: Estudio longitudinal retrospectivo de 79 ojos, tratados con ranibizumab intravítreo en nuestro centro por DMAE exudativa, con una pauta inicial de 3 inyecciones consecutivas mensuales, seguidas de inyecciones a demanda en función de los hallazgos exploratorios. Se realizó un estudio descriptivo de la exploración basal (n=79), y a los 3 (n=79), 6 (n=67) y 12 meses (n=49) del inicio del tratamiento. Mediante análisis univariante y multivariante se correlacionaron las características de la exploración basal y anual con los resultados visuales.
Resultados: Después de las 3 inyecciones iniciales, el 93,67% de los casos pierde menos de 15 letras, y un 19% gana 15 letras o más. Este resultado es similar al año (83,67 y 20,40%, respectivamente). Tras un año de tratamiento mantiene una agudeza visual (AV) > 0,3 el 40,82%, y un 22,45% tiene una AV < 0,1. Se ha utilizado una mediana de 5 inyecciones/año. La AV elevada al inicio y la persistencia de quistes intrarretinianos grandes a los 3 meses (p=0,0013), así como la aparición de fibrosis durante la evolución (p=0,0005) se asocian con un empeoramiento visual.
Conclusiones: La pauta utilizada permite una estabilización o mejoría de la AV en la mayor parte de los pacientes. Los casos más favorables inicialmente son aquellos que presentan una AV más baja o quistes intrarretinianos grandes resueltos tras la fase de carga. La aparición de fibrosis implica un mal pronóstico visual a largo plazo.
Palabras clave: Ranibizumab. Degeneración macular asociada a la edad. Proliferación angiomatosa retiniana. Neovascularización coroidea. Estudio retrospectivo.
ABSTRACT
Objectives: To evaluate the efficacy of ranibizumab in wet age-related macular degeneration (ARMD), and to identify prognostic factors.
Methods: A retrospective longitudinal study of 79 eyes treated with intravitreal Ranibizumab in our hospital due to wet ARMD, with an initial regimen of three consecutive monthly injections, followed by injections on demand based on the exploratory findings. We conducted a descriptive study of the baseline examination (n=79), and 3 (n=79), 6 (n=67) and 12 months (n=49) after starting treatment. The characteristics of the baseline examination and annual examination results were compared using univariate and multivariate analysis.
Results: After the three initial injections, the 93.67% of patients lost fewer than 15 letters, and 19% gained 15 points or more. This result remained similar at 1 year (83.67% and 20.40%, respectively). After 1 year of treatment 40.82% had a VA > 0.3 and 22´45% had a VA < 0.1. We used a median of 5 injections per year. The increased AV at the beginning and the persistence of large intraretinal cysts at 3 months (P=.0013), as well as the development of fibrosis during evolution (P=.0005), are associated with visual deterioration.
Conclusions: The guidelines used here stabilised or improved visual acuity in most patients. The most favourable cases are those with initially lower VA or large intraretinal cysts resolved after the loading phase. The appearance of fibrosis implies a poor long-term visual prognosis.
Key words: Ranibizumab. Age-related macular degeneration. Retinal angiomatous proliferation. Choroidal neovascularisation. Retrospective study.
Introducción
La degeneración macular asociada a la edad (DMAE) exudativa es la causa más frecuente de pérdida visual irreversible en pacientes de edad avanzada en nuestro medio. Hasta el momento, el tratamiento más eficaz para esta enfermedad es el ranibizumab (Lucentis®)1,2. Los esfuerzos actuales van dirigidos a encontrar pautas de tratamiento más eficientes y con un menor riesgo de efectos secundarios3-5.
Hemos querido conocer los resultados visuales en un grupo de pacientes tratados en nuestro centro con Lucentis® utilizando una pauta inicial de 3 inyecciones mensuales, seguida de revisiones mensuales con retratamiento a demanda. Asimismo, buscamos hallazgos que se asocien con empeoramiento, estabilización o mejoría de la visión y que permitan identificar qué pacientes tendrán más posibilidades de beneficiarse del tratamiento.
Sujeto, material y método
Se ha realizado un estudio longitudinal retrospectivo, valorando las historias clínicas de todos los pacientes que iniciaron tratamiento con ranibizumab (Lucentis®) en nuestro centro hospitalario entre agosto de 2007 y enero de 2010. Con el fin de obtener un grupo lo más homogéneo posible, se incluyeron los pacientes diagnosticados de DMAE exudativa, con neovascularización coroidea (NVC) de cualquier tipo y localización, que no hubieran recibido ningún otro tratamiento previo con terapia fotodinámica (TFD) o con otros fármacos antiangiogénicos.
Se realizó una valoración inicial en nuestro centro que incluía agudeza visual corregida con estenopeico (AV), y exploración de fondo de ojo (FO), con especial atención a la presencia de hemorragias, exudados duros y fibrosis. Los valores absolutos de AV están expresados en escala decimal, y las diferencias de AV en número de letras según la escala logMAR a 2 m. Como pruebas complementarias, se realizaron una tomografía de coherencia óptica (OCT) en todos los casos, y una angiografía fluoresceínica (AFG) a los pacientes que dieron consentimiento para su realización (n=68). Las AFG se realizaron con un angiógrafo, FF450plusIR (Carl Zeiss Meditec®) Software VISUPAC, y se valoraron el tipo, la localización y el tamaño de la NVC, que se ha expresado en áreas de disco (AD), considerando una medida estándar de 1AD=2,54mm2. Se completó el estudio con verde indocianina (ICG) para diagnosticar vasculopatía polipoidea o proliferación angiomatosa retiniana (RAP) cuando se consideró necesario. Para las OCT se utilizó el modelo Stratus OCT versión 4.0.7 (Carl Zeiss Meditec®), y se valoraron los siguientes parámetros: presencia de desprendimiento neurosensorial (DNS), presencia y tipo de desprendimiento de epitelio pigmentario (DEP), presencia y tamaño de los quistes intrarretinianos, grosores retinianos macular máximo y foveal medio (medida manual con protocolo de análisis Retinal Thickness). Por último, se buscó atrofia foveal (definida como un grosor foveal inferior a 100 micras en alguno de los cortes), rotura de epitelio pigmentario de la retina (EPR) o signos de tracción vítreo-macular.
Se inició el tratamiento con 3 dosis mensuales de Lucentis® intravítreo según la técnica habitual. A partir del tercer mes tras el inicio del tratamiento se repitió la exploración de AV, FO y OCT mensualmente, indicando retratamiento en los siguientes casos: empeoramiento de AV atribuible a la NVC, aparición de nuevas hemorragias en el FO y/o empeoramiento de los parámetros OCT como aparición de nuevos quistes o DNS, o no resolución de quistes o DNS previos. Se han recogido los datos de las visitas a los 3, 6 y 12 meses desde el inicio del tratamiento.
El tamaño de la muestra final ha sido de 79 ojos de 71 pacientes al inicio y 3 meses, 67 ojos a los 6 meses y 49 ojos al año.
En el estudio descriptivo se han expresado los datos como mediana y rango intercuartílico (RIC) en el caso de variables cuantitativas, y como porcentajes en las variables cualitativas. En el análisis bivariante se han utilizado el test de Mann-Whitney o Kruskal-Wallis para las variables cuantitativas, y ji al cuadrado de Pearson o test exacto de Fisher para las cualitativas. El análisis estadístico se ha realizado con el programa (Stata 9.1).
Resultados
La muestra inicial (79 ojos) correspondía a 22 varones y 57 mujeres con una mediana de edad de 81 años (RIC 75-85) en el momento del diagnóstico.
La mediana de AV en la exploración inicial fue de 0,2 (RIC 0,1-0,4), a los 3 meses de 0,25 (RIC 0,125-0,5) y a los 12 meses de 0,25 (RIC 0,125-0,4). En la figura 1 se expresa el porcentaje de ojos que alcanza la AV por encima o por debajo de los límites que se consideran funcionalmente relevantes. Tras las 3 primeras inyecciones se apreció una mejoría de 3 letras (RIC - 5 a+10) con respecto a la AV inicial, y una mejoría de 3 letras (RIC - 6 a + 10) a los 12 meses. La figura 2 muestra el grado de respuesta al tratamiento.
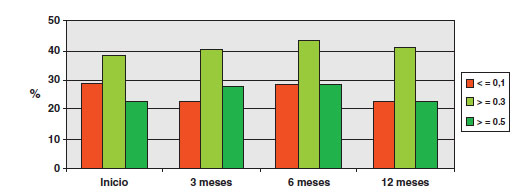
Fig. 1. Agudeza visual (porcentaje de ojos).

Fig. 2. Cambios en la agudeza visual (porcentaje de ojos).
Los hallazgos en el FO se muestran en la figura 3, y los de OCT en las figuras 4 a 6. Se realizó AFG en 68 ojos. Las figuras 7 y 8 resumen la distribución en tipo y localización de la NVC. En cuanto al tamaño, la mediana es de 2,805 AD (RIC 1,55-5,96).

Fig. 3. Hallazgos en el fondo de ojo (porcentaje de ojos).
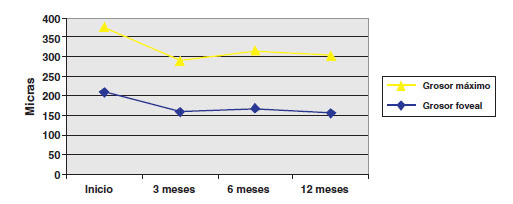
Fig. 4. OCT: grosores máximo y foveal medio retinianos.

Fig. 5. OCT: quistes intrarretinianos, presencia y tamaño.
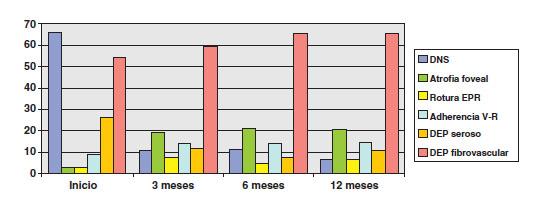
Fig. 6. Otros hallazgos en OCT.
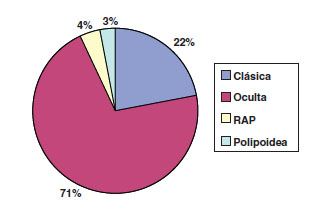
Fig. 7. AFG: tipo de membrana (n=68).
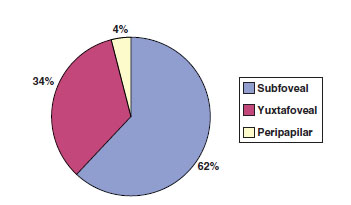
Fig. 8. AFG: localización de membrana (n=68).
Se ha utilizado una mediana de 5 inyecciones por ojo en el primer año de tratamiento (RIC 4-7). En la figura 9 se expresa la distribución en función del número de inyecciones recibidas, en el grupo que ha alcanzado seguimiento al año (n=49).
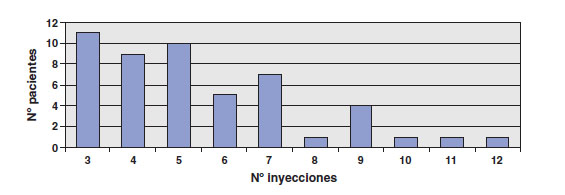
Fig. 9. Número total de inyecciones administradas en los primeros 12 meses
de tratamiento (n=49).
En el estudio analítico se ha buscado una asociación entre los parámetros de la exploración -tanto inicial como a los 12 meses- y el resultado favorable al tratamiento, entendido como estabilidad o mejoría de la AV con respecto a la AV en el momento del diagnóstico. En primer lugar, se realizó un análisis bivariante, cuyos resultados se resumen en la tabla 1. Las variables en las que se ha demostrado una significación estadística han sido, en primer lugar, la AV inicial, que muestra una asociación inversa, de modo que cuanto mayor sea la AV al inicio, menos probable es que la AV mejore o se mantenga estable tras la fase de carga del tratamiento, mientras que los casos que parten con AV más bajas tienen mayor probabilidad de estabilizarse o mejorar. Este hallazgo se mantiene al cabo de un año de tratamiento. Los exudados muestran una asociación directa con la respuesta inicial al tratamiento, aunque podría tratarse de un factor de confusión, ya que están directamente asociados a su vez con AV iniciales más bajas (p=0,0056). La presencia de quistes intrarretinianos grandes al inicio se relaciona con una probabilidad mayor de respuesta favorable a las 3 primeras inyecciones. Aunque no se ha alcanzado significación estadística, se aprecia una tendencia a obtener peor respuesta inicial al tratamiento en los pacientes de mayor edad, con lesiones angiográficas grandes (> 4 AD), o con DEP fibrovascular en la exploración inicial.
Se realizó un análisis multivariante con las variables que alcanzaron significación estadística en el análisis bivariante, así como aquellas en las que apreciamos tendencias clínicamente relevantes aunque no fueran estadísticamente significativas, como es el caso de la creciente aparición de fibrosis y atrofia macular en la evolución. Hemos obtenido 2 modelos significativos. El primero se refiere al empeoramiento de la AV a los 3 meses con respecto a la inicial, que se asocia a la persistencia de quistes intrarretinianos grandes tras las 3 primeras inyecciones, a la AV inicial mayor, y a la presencia de fibrosis a los 3 meses (p=0,0013). El segundo modelo muestra, al año de seguimiento, que los ojos que partieron con AV iniciales mayores y aquellos que presentan fibrosis tienen menos probabilidades de mantener o mejorar la AV (p=0,0191).
Discusión
Hasta el momento, el tratamiento que se ha mostrado más eficaz para la DMAE exudativa es el ranibizumab intravítreo (Lucentis®). Se trata de un fragmento de un anticuerpo monoclonal recombinante, que neutraliza todas las isoformas del factor de crecimiento de endotelio vascular A (VEGF-A). Gracias a este tratamiento no sólo se ha conseguido evitar la pérdida visual severa en un elevado número de casos, sino que algunos pacientes obtienen incluso una mejoría de su visión. En los grandes ensayos clínicos que demostraron su eficacia frente a placebo en el caso de MNVC ocultas1, y frente a TFD en las MNVC clásicas2, se utilizó una pauta fija de inyecciones mensuales. Sin embargo, su aplicación en la práctica clínica no parece viable, por los costes económicos que conlleva, y los riesgos asociados tanto al fármaco como a su vía de administración intravítrea. De este modo, se han propuesto otras pautas5-8 que, con mayor o menor eficacia, han conseguido mantener los buenos resultados de este tratamiento en la prevención de pérdida severa de AV asociada a la DMAE exudativa, y las sociedades oftalmológicas están desarrollando guías clínicas actualizadas que favorezcan la aplicación de la evidencia científica disponible en la práctica habitual9,10.
Los resultados de respuesta al tratamiento en términos de AV en nuestra serie son muy buenos tras las 3 primeras inyecciones (el 94,3% de los pacientes pierden menos de 15 letras), y se mantienen elevados al año (83,87%). Sin embargo, son algo inferiores a los de los grandes ensayos (MARINA 94,6%, ANCHOR 96,4%)1,2, y a los del estudio PrONTO3, a pesar de que seguimos una metodología similar. Hemos encontrado una discreta mejoría en la AV con respecto a la inicial, pero no tan marcada como en los otros estudios (+ 3 letras mediana, vs + 7,2 letras de media en MARINA, + 11,3 letras de media en ANCHOR y + 11 letras mediana en PrONTO)1-3. Ocurre algo parecido al considerar valores absolutos de AV (partiendo de AV iniciales similares, al año tenemos mayor porcentaje de pacientes con AV igual o inferior a 0,1, y menor porcentaje de pacientes con AV igual o superior a 0,5). La primera posibilidad que se plantea para explicar esta diferencia es que se haya administrado un número de inyecciones inferior al necesario, sin embargo, al comparar nuestros resultados con los del estudio PrONTO3, así como con otras series de casos6-8, el número de inyecciones empleadas en el primer año no difiere tanto como para justificarla. En nuestra serie, se ha utilizado una mediana de 5 inyecciones/ojo/año, y el 75% de los pacientes que han alcanzado el año de seguimiento han precisado 7 inyecciones o menos en dicho periodo.
Otra posible explicación es el aumento progresivo de fibrosis y atrofia macular que hemos encontrado en nuestros pacientes, y que justificaría (de forma significativa en el caso de la fibrosis) los peores resultados a los 12 meses. Estos hallazgos también han sido mencionados por Rothenbuehler et al6, y su aparición es considerada un criterio para la interrupción del tratamiento en las guías más recientes10.
En cuanto a la identificación de factores predictivos, estamos limitados por el tamaño de la muestra, sobre todo al analizar subgrupos, sin embargo, se confirman como factores predictivos de buena respuesta la AV inicial baja, y la presencia de quistes intrarretinianos grandes en la OCT inicial, como ya se había presentado en los congresos XIII y XIV de la Sociedad Española de Retina y Vítreo. Los resultados que no han alcanzado significación estadística -edad y tamaño de la NVC- son congruentes con los presentados en otros estudios11,12. La aparición de fibrosis a lo largo de la evolución implica un mal pronóstico visual a largo plazo.
Aunque no hemos encontrado valor pronóstico en el tipo, localización ni tamaño de la NVC definida angiográficamente, sí pensamos que es interesante realizar AFG +/- ICG para diagnosticar los casos de RAP y vasculopatía polipoidea, por las implicaciones pronósticas que puedan tener13,14. Probablemente, en esta serie están infradiagnosticadas, y el reducido tamaño de estos subgrupos no ha permitido obtener conclusiones al respecto.
Las principales limitaciones de nuestro estudio son su carácter retrospectivo, la participación de múltiples observadores, y el reducido tamaño de la muestra. El estudio de otros aspectos de la función visual, como la AV para visión cercana, la sensibilidad al contraste, la microperimetría y la valoración con cuestionarios de calidad de vida15-17 podrán aportar información complementaria sobre el impacto que este tratamiento tiene en nuestros pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
A todo el personal del Servicio de Oftalmología del Hospital Universitario La Princesa, que de forma directa o indirecta han colaborado en la realización de este trabajo.
Bibliografía
1. Rosenfeld PJ, Brown DM, Heier JS, Boyer DS, Kaiser PK, Chung CY, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006; 355:1419-31. [ Links ]
2. Brown DM, Kaiser PK, Michels M, Soubrane G, Heier JS, Kim RY, et al. Ranibizumab versus Verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006; 355:1432-44. [ Links ]
3. Fung AE, Lalwani GA, Rosenfeld PJ, Duboby SR, Michels S, Feuer WJ, et al. An optical coherence tomography-guided, variable dosing regimen with intravitreal ranibizumab (Lucentis®) for neovascular age-related macular degeneration. Am J Opthtalmol. 2007; 143:566-83. [ Links ]
4. Regillo CD, Brown DM, Abraham P, Yue H, Ianchulev T, Scheneider S, et al. Randomized, double-masked, sham-controllede trial of ranibizumab for neovascular age-related macular degeneration: PIER study year 1. Am J Ophthalmol. 2008; 145:239-48. [ Links ]
5. Mitchell P, Korobelnik JF, Lanzetta P, Holz FG, Prünte C, Schmidt-Erfurth U, et al. Ranibizumab (Lucentis) in neovascular age-related macular degeneration: evidence from clinical trials. Br J Opthalmol. 2010; 94:2-13. [ Links ]
6. Rothenbuehler SP, Waeber D, Brinkmann CK, Wolf S, Wolf-Schnurrbusch UE. Effects of ranibizumab in patients with subfoveal choroidal neovascularization attributable to age-related macular degeneration. Am J Ophthalmol. 2009; 147:831-7. [ Links ]
7. Dadgostar H, Ventura AA, Ghung JY, Sharma S, Kaiser PK. Evaluation of injection frequency and visual acuity outcomes for ranibizumab monotheraphy in exudative age-related macular degeneration. Ophthalmology. 2009; 116:1740-7. [ Links ]
8. Cohen SY, Dubois L, Taddayoni R, Fajnkuchen F, Nghiem-Buffet S, Delahaye-Mazza C, et al. Results of one-year´s treatment with ranibizumab for exudative age-related macular degeneration in a clinical setting. Am J Ophthalmol. 2009; 148:409-13. [ Links ]
9. Ruiz-Moreno JM, Arias-Barquet L, Armadá-Maresca F, Boixadera-Espax A, García-Layana A, Gómez-Ulla-de-Irazazábal F, et al, Sociedad Española de Retina y Vítreo. Tratamiento de la degeneración macular asociada a la edad (DMAE) exudativa. Guías de Práctica Clínica de la SERV. 2009; 84:333-44. [ Links ]
10. Harding SP. Neovascular age-related macular degeneration: decision making and optimal management. Eye. 2010; 24:497-505. [ Links ]
11. Boyer DS, Antoszyk AN, Awh CC, Bhisitkul RB, Shapiro H, Acharya NR, et al. Subgroup analysis of the MARINA study of ranibizumab in neovascular age-related macular degeneration. Ophthalmology. 2007; 114:246-52. [ Links ]
12. Kaiser PK, Brown DM, Zhang K, Hudson HL, Holz FG, Shapiro H, et al. Ranibizumab for predominantly classic neovascular age-related macular degeneration: subgroup analysis of first-year ANCHOR results. Am J Ophthalmol. 2007; 144:850-7. [ Links ]
13. Konstantinidis L, Mameletzi E, Mantel I, Pournaras JA, Zografos L, Ambresin A. Intravitreal ranibizumab (Lucentis®) in the treatment of retinal angiomatous proliferation (RAP). Graefes Arch Clin Exp Ophthalmol. 2009; 247:1165-71. [ Links ]
14. Cho M, Barbazetto IA, Freund KB. Refractory neovascular age-related macular degeneration secondary to polypoidal choroidal vasculopathy. Am J Ophthalmol. 2009; 148:70-8. [ Links ]
15. Chang TS, Bressler NM, Fine JT, Dolan CM, Ward J. Improved vision-related function after ranibizumab treatment of neovascular age-related macular degeneration: results of a randomized clinical trial. Arch Ophthalmol. 2007; 125:1460-9. [ Links ]
16. Chang TS, Bressler NM, Fine JT, Dolan CM, Ward J, Klesert TR. Improved vision-related function after ranibizumab vs photodynamic therapy: a randomized clinical trial. Arch Ophthalmol. 2009; 127:13-21. [ Links ]
17. Squirrell DM, Mawer NP, Mody CH, Brand CS. Visual outcome after intravitreal ranibizumab for wet age-related macular degeneration. A comparison between best-corrected visual acuity and microperimetry. Retina. 2010; 30:436-42. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: mara_murielh@yahoo.es
(M.A. Muriel)
Recibido el 25 de octubre de 2010
Aceptado el 4 de abril de 2011















