My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos de la Sociedad Española de Oftalmología
Print version ISSN 0365-6691
Arch Soc Esp Oftalmol vol.87 n.12 Dec. 2012
https://dx.doi.org/10.1016/j.oftal.2011.09.025
Bevacizumab (Avastin®) intracamerular en el manejo quirúrgico del glaucoma neovascular
Intracameral bevacizumab (Avastin®) in the management of neovascular glaucoma surgery
H. Fernández Jiménez-Ortiz, S. Perucho Martinez, N. Toledano Fernández y E. Martin Giral
Servicio de Oftalmología, Hospital Universitario de Fuenlabrada, Madrid, España
Este trabajo fue expuesto en el VI Congreso Iberoamericano Internacional en La Habana, mayo de 2009.
Dirección para correspondencia
RESUMEN
Propósito: Describir una serie de casos con glaucoma neovascular que fueron tratados con bevacizumab intracamerular previo a la cirugía filtrante.
Diseño: Descriptivo, retrospectivo, tipo serie de casos.
Métodos: Cinco ojos de cinco pacientes con glaucoma neovascular de cualquier causa candidatos a cirugía filtrante recibieron previamente una inyección de bevacizumab (1,25mg/0,05ml) intracamerular como tratamiento de la neovascularización angular. Se describen los resultados observados a la semana y a las 4 semanas poscirugía.
Resultados: Bevacizumab produjo una regresión importante de los neovasos y de la presión intraocular. Se detectó un único caso de sangrado postoperatorio.
Conclusiones: Bevacizumab intracamerular previo a cirugía filtrante de glaucoma disminuyó la neovascularización del segmento anterior y la presión intraocular a las 4 semanas de su administración y resultó eficaz en impedir el sangrado intra- y postoperatorio. También constituye una prometedora vía de investigación para prevenir las complicaciones quirúrgicas.
Palabras clave: Bevacizumab. Glaucoma neovascular. Cirugía filtrante. Antiangiogénicos. Inyección intraocular.
ABSTRACT
Purpose: To describe a case series of neovascular glaucoma treated with intracameral bevacizumab prior to filtering surgery.
Design: Descriptive, retrospective case series.
Methods: Five eyes of 5 patients with neovascular glaucoma due to any cause candidates to filtering surgery who had previously received an injection of intracameral bevacizumab (1.25mg/0.05ml) as treatment for neovascularization of anterior chamber. Results observed one week and 4 weeks postsurgery are reported.
Results: Bevacizumab produced regression of the angle neovascularization and the intraocular pressure. Only one case of postoperative bleeding was detected.
Conclusions: Intracameral bevacizumab prior to filtering surgery of neovascular glaucoma diminished the neovascularization and intraocular pressure after 4 weeks of its administration and was effective in preventing intraoperative and postoperative bleeding. It also constitutes a promising way of investigation to prevent surgical complications.
Key words: Bevacizumab. Glaucoma neovascular. Filtering surgery. Angiogenesis inhibitors. Injections intraocular.
Introducción
Bevacizumab ([BVI]: Avastin®, Genentech, Inc., South San Francisco, CA) es un anticuerpo monoclonal recombinante con especificidad para todas las isoformas activas del factor de crecimiento vascular endotelial A (VEGF-A)1. Fue diseñado para uso intravenoso y aprobado en 2004 para cáncer colorrectal metastásico en combinación con quimioterapia. Hasta la fecha no está aprobada su administración intraocular2. Sin embargo numerosos estudios sugieren un papel beneficioso para uso oftálmico.
Tripathi et al.3 documentaron en 1998 el incremento del VEGF-A en humor acuoso de pacientes con glaucoma neovascular (GNV). Mason et al.4 propusieron BVI intravítreo para pacientes con GNV, hemorragias recurrentes de los neovasos iridianos y para aquellos con neovasos a pesar de panfotocoagulación (PFC). Jonas et al.5 documentan en dos casos la normalización de la presión intraocular (PIO) en los que se empleó BVI intravítreo concomitantemente a la cirugía filtrante en GNV. Andreoli et al.6 han propuesto utilizar el BVI intravítreo en los pacientes a los que se les realiza panfotocoagulación para evitar el cierre completo del ángulo mientras esta hace su efecto.
La administración de BVI en procesos de neovascularización del segmento posterior está ampliamente documentada5,7,8. Sin embargo su administración intracamerular puede constituir una ayuda también en procesos de neovascularización del segmento anterior (Figura 1)6,8-12. Wakabayashi et al.13 observaron un control adecuado de la PIO en pacientes con GNV sin cierre del ángulo si se administraba en estadios precoces. Recientemente se ha publicado una serie de 6 casos14 con glaucoma neovascular e inyección de BVI previa a panfotocoagulación o cirugía filtrante en la que se sugiere el efecto coadyuvante de esta técnica en un uso previo a la cirugía. En estadios avanzados no parece haber control de PIO pero sí mejoría de resultados quirúrgicos cuando se emplea BVI como adyuvante.

Figura 1. Rubeosis iridis y sinequias iridianas
en midriasis farmacológica.
El único estudio comparativo que los autores hemos encontrado es una serie de casos retrospectiva en la que Chen et al.15 encuentran una mejor agudeza visual a los 6 meses de seguimiento en pacientes con GNV tratados con BVI intravítreo más trabeculectomía comparados con trabeculectomía sola.
El objetivo del presente estudio es describir una serie de casos con glaucoma neovascular tratados con BVI intracamerular previo a la cirugía filtrante del glaucoma.
Sujetos, material y métodos
Se realizó una búsqueda en la base de datos informática del Hospital Universitario de Fuenlabrada y se seleccionaron las historias clínicas con los siguientes criterios de inclusión:
- GNV de cualquier causa. Se consideró GNV una PIO mantenida de > 21mmHg como consecuencia de un proceso isquémico ocular y presencia de neovascularización en segmento anterior o ángulo irido-corneal.
- Ser candidato para tratamiento quirúrgico del GNV con cirugía filtrante y administración de BVI (única dosis de1,25mg/0,05ml) intracamerular 24h antes de dicha cirugía.
En todas las cirugías se había implantado la válvula de Ahmed por ser con la que mayor experiencia cuenta nuestro centro. La indicación de cirugía se estableció en caso de fracaso de control tensional y sintomático a pesar de haber recibido PFC y al menos dos fármacos hipotensores oculares.
Se excluyeron los casos que hubieran recibido alguna dosis de antiangiogénico (BVI, ranibizumab o pegaptanib) intraocular o sistémico previa.
Se consideró que con la administración intracamerular se sorteaban algunos de los riesgos propios de la intravítrea como catarata iatrogénica, lesiones regmatógenas retinianas, difusión subconjuntival del fármaco... Puesto que el objetivo es actuar sobre la neovascularización de iris y ángulo, la vía intracamerular podría permitir la actuación del BVI sobre los neovasos del GNV asumiendo menos riesgos para el ojo.
La inyección de BVI en cámara anterior se realizó con aguja 30g y ayuda de microscopio quirúrgico.
Los pacientes fueron informados verbalmente y por escrito de que la indicación de BVI intracamerular corresponde a uso compasivo y que no hay evidencia actualmente que recomiende su administración. Todos firmaron el consentimiento informado correspondiente.
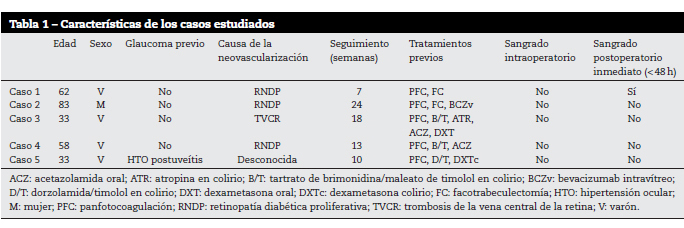
Se investigaron todas las variables que se consideraron relevantes para describir el efecto de BVI intracamerular en la cirugía filtrante (Tabla 1 y Tabla 2). La variable principal fue el sangrado en cámara anterior, bien intraoperatorio o postoperatorio. Los datos analizados fueron los recogidos 24-48h antes de la inyección, una semana después y a las 4 semanas.
Para el análisis de los datos se utilizó el programa estadístico SPSS versión 11.5 (SPSS Inc. Chicago, Illinois). Tras comprobar que la distribución de las variables no se ajustaba a la normalidad por la prueba de Kolmogorov-Smirnov se aplicaron test no paramétricos. La t de Student para datos apareados, para comparar los resultados de PIO antes y después de la intervención. La variable principal se estudió mediante el porcentaje y su intervalo de confianza (IC) del 95%.
Resultados
La muestra se compone de cinco ojos de cinco pacientes, cuatro mujeres (80%) y un varón (20%). La edad media es de 53,8±21,23 años (IC 95%). El tiempo de seguimiento medio fue de 14,4±6,7 semanas (IC 95%). Las causas de la neovascularización fueron diversas: en 3, retinopatía diabética; uno, trombosis de la vena central de la retina y un último caso de etiología desconocida, posiblemente síndrome isquémico ocular. En todos los casos se había realizado PFC retiniana previa (Tabla 1).
La PIO inicial se consideró la última registrada antes de la inyección de BVI, tomada entre 24 y 48h antes. Su valor medio es 37,2±4,9 (IC 95%). Se registraron las PIO a la semana y a las 4 semanas tras la inyección (Tabla 2). La gonioscopia reveló cierre angular en grado variable por neovascularización en todos ellos (Figura 1 y Tabla 3).
La comparación de medias antes y a las 4 semanas se realizó mediante prueba de t de Student para datos apareados. En esta se observan diferencias estadísticamente significativas (Figura 2); la PIO inicial oscila entre 42,1-32,3mmHg y PIO a las 4 semanas oscila entre 26,00-13,00mmHg con una p=0,043 (Tabla 2).

Figura 2. Comparación de medias de presión intraocular inicial,
una semana después de bevacizumab y a las 4 semanas del bevacizumab.
Respecto a la variable principal, que es el sangrado intra- y postoperatorio inmediato (<24h) y que se consideró positiva en caso de presentarse hifema, hemovítreo o hemorragia coroidea, no se dio ningún caso en el acto quirúrgico y un caso en el postoperatorio inmediato (Tabla 1, Figura 3 y Figura 4).

Figura 3. Hifema en postoperatorio de cirugía
filtrante con válvula de Ahmed.

Figura 4. Frecuencia de sangrado postoperatorio.
Otras variables registradas fueron la neovascularización angular y la máxima agudeza visual corregida (MAVC) (Tabla 3). Respecto a esta última observamos que en la revisión de la primera semana, el caso 5 se encontraba igual y todos los demás habían empeorado. A las 4 semanas dos habían empeorado respecto al principio (casos 1 y 2) y los demás se encontraban igual. La rubeosis iridis mejoró en tres pacientes a las 4 semanas (casos 3, 4 y 5), permaneció igual en un caso (caso 1) y empeoró en otro (caso 2) (Tabla 3). Estos datos no son discordantes con los observados en la serie de Wakabayashi et al. para los pacientes con GNV y ángulo cerrado12. Ningún caso precisó retratamiento con BVI debido a que el control tensional y sintomático fue satisfactorio.
Discusión
Sobre la variable principal del estudio podemos decir que ningún paciente sufrió sangrado intraoperatorio y solo uno postoperatorio (caso 1: Tabla 1 y Figura 3). En nuestra experiencia, sin el empleo de BVI el sangrado intra- y postoperatorio es considerablemente más frecuente que en la muestra, que es el 0 y el 20% respectivamente.
Los datos publicados sobre este tema refieren frecuencias de hifema en torno al 11,4% en el primer mes en una muestra de 70 ojos de Montañez et al.16 y en torno al 5% en una muestra de 22 ojos de Luttrull y Avery17. No es posible analizar un contraste de hipótesis puesto que todos los pacientes recibieron el mismo tratamiento. Tampoco podemos comparar nuestros datos con los estudios citados por ser muestras no análogas.
El efecto sobre la PIO se debe también a la cirugía filtrante, por lo que no podemos evaluar la magnitud ni el sentido del efecto del BVI intracamerular.
Con una muestra tan pequeña no se pueden identificar factores de riesgo para la mejoría o empeoramiento de la agudeza visual o rubeosis iridis, sin embargo cabe resaltar que el único caso que empeoró presentaba como característica diferencial que había recibido previamente BVI intravítreo 5 semanas antes.
Los riesgos de la administración de BVI intracamerular son endoftalmitis, desprendimiento de retina, cataratas y uveítis. En nuestra muestra no se observó ninguno de estos efectos. En la administración intravenosa se ha observado hipertensión, aumento de riesgo tromboembólico, perforación gastrointestinal, infarto de miocardio y hasta la muerte1.
Los niveles séricos de BVI tras administración intravítrea son muy inferiores a los que se alcanzan tras administración intravenosa18, y en el estudio VISION19 que recoge los datos de de seguridad farmacológica durante 2 años no se observó incremento de enfermedad cardiovascular asociada a la administración sistémica. La vida media del BVI intravenoso es de 17-21 días2, pero todavía está por determinar por cuánto tiempo se mantiene el efecto antiangiogénico tras su administración, y si hay algún tipo de efecto permanente.
En nuestra muestra el BVI intracamerular 24h antes del implante de válvula de Ahmed resultó en una escasa frecuencia de sangrado en cámara anterior y un buen control tensional y sintomático a las 4 semanas.
Estos datos nos permiten sospechar un efecto beneficioso de BVI intracamerular para prevenir estas complicaciones. Asimismo, consideramos que la vía intracamerular representa algunas ventajas respecto a la intravítrea: disminuye el riesgo de catarata iatrogénica puesto que podemos visualizar la punta de la aguja en todo momento y desaparecen el riesgo de lesión regmatógena o difusión subconjuntival de antiangiogénico. Además la concentración de BVI en cámara anterior será probablemente mayor que en la administración intravítrea, sobre todo en pacientes fáquicos, aumentando así el efecto del fármaco sobre los neovasos del segmento anterior. Los posibles efectos tóxicos sobre la córnea no parecen clínicamente significativos según otros estudios realizados con inyección intracamerular de BVI14.
En estos momentos disponemos de varios estudios que corroboran la rápida respuesta de la neovascularización del segmento anterior a BVI y su utilidad en el control tensional, sintomatología y pronóstico del GNV14,19. Al igual que en el polo posterior el efecto antiangiogénico es limitado en el tiempo y sabemos que el BVI no permite por sí solo controlar el estímulo angiogénico, siendo necesaria la vigilancia estricta y el tratamiento de la causa subyacente20,21.
Dada la ausencia de ensayos clínicos aleatorizados sobre el uso intraocular de BVI hay muchas incógnitas que permanecen sin resolver. A saber; su eficacia absoluta y comparada con otros antiangiogénicos, su posología (dosis, número e intervalo entre inyecciones) y efectos secundarios intraoculares y sistémicos10,13.
El BVI intracamerular para tratar la neovascularización del segmento anterior y prevenir complicaciones quirúrgicas constituye una prometedora vía de investigación.
Bibliografía
1. Miller KD, Chap LI, Holmes FA, Cobleigh MA, Marcom PK, Fehrenbacher L, et al. Randomized phase III trial of capecitabine compared with bevacizumab plus. J Clin Oncol. 2005; 23:792-9. [ Links ]
2. Hudson PJ, Souriau C. Engineered antibodies. Nat Med. 2003; 9:129-34. [ Links ]
3. Tripathi RC, Li J, Tripathi BJ, Chalam KV, Adamis AP. Increased level of vascular endothelial growth factor in aqueous humor of patients with neovascular glaucoma. Ophthalmology. 1998; 105:232-7. [ Links ]
4. Mason JO, Albert MA, Mays A, Vail R. Regression of neovascular iris vessels by intravitreal injection of bevacizumab. Retina. 2006; 26:839-41. [ Links ]
5. Jonas JB, Spandau UH, Schlichtenbrede F. Intravitreal bevacizumab for filtering surgery. Ophthalmic Res. 2007; 39:121-2. [ Links ]
6. Andreoli CM, Miller JW. Anti-vascular endothelial growth factor therapy for ocular neovascular disease. Curr Opin Ophthalmol. 2007; 18:502-8. [ Links ]
7. Yazdani S, Hendi K, Pakravan M. Intravitreal bevacizumab (Avastin) injection for neovascular glaucoma. J Glaucoma. 2007; 16:437-9. [ Links ]
8. Kotecha A, Spratt A, Ogunbowale L, Dell'Omo R, Kulkarni A, Bunce C, et al. Intravitreal bevacizumab in refractory neovascular glaucoma: a prospective, observational case series. Arch Ophthalmol. 2011; 129:145-50. [ Links ]
9. Cheng JY, Wong DW, Ang CL. Intraocular avastin (bevacizumab) for neovascularisation of the iris and neovascular glaucoma. Ann Acad Med Singapore. 2008; 37:72-4. [ Links ]
10. Gheith ME, Siam GA, de Barros DS, Garg SJ, Moster MR. Role of intravitreal bevacizumab in neovascular glaucoma. J Ocul Pharmacol. 2007; 23:487-91. [ Links ]
11. Grisanti S, Biester S, Peters S, Tatar O, Ziemssen F, Bartz-Schmidt KU, et al. Intracameral bevacizumab for iris rubeosis. Am J Ophthalmol. 2006; 142:158-60. [ Links ]
12. Ichhpujani P, Ramasubramanian A, Kaushik S, Pandav SS. Bevacizumab in glaucoma: a review. Can J Ophthalmol. 2007; 42:812-5. [ Links ]
13. Wakabayashi T, Oshima Y, Sakaguchi H, Ikuno Y, Miki A, Gomi F, et al. Intravitreal bevacizumab to treat iris neovascularization and neovascular glaucoma secondary to ischemic retinal diseases in 41 consecutive cases. Ophthalmology. 2008; 115:1571-80. [ Links ]
14. Duch S, Buchacra O, Milla E, Andreu D, Tellez J. Intracameral bevacizumab (Avastin) for neovascular glaucoma: a pilot study in 6 patients. J Glaucoma. 2009; 18:140-3. [ Links ]
15. Chen CH, Lai IC, Wu PC, Chen YJ, Chen YH, Lee JJ, et al. Adjunctive intravitreal bevacizumab-combined trabeculectomy versus trabeculectomy alone in the treatment of neovascular glaucoma. J Ocul Pharmacol Ther. 2010; 26:111-8. [ Links ]
16. Montañez FJ, Laso E, Suñer M, Amaya C. Implante de válvula de Ahmed. Nuestra experiencia 1995-2003. Arch Soc Esp Oftalmol. 2005; 80:239-44. [ Links ]
17. Luttrull JK, Avery RL. Pars plana implant and vitrectomy for treatment of neovascular glaucoma. Retina. 1995; 15:379-87. [ Links ]
18. Siddiqui MA, Keating GM. Pegaptanib: in exudative age-related macular degeneration. Drugs. 2005; 65:1571-7. discussion 1578-1579. [ Links ]
19. D'Amico DJ, Masonson HN, Patel M, Adamis AP, Cunningham ET, et al. Pegaptanib sodium for neovascular age-related macular degeneration: two-year safety results of the two prospective, multicenter, controlled clinical trials. VEGF Inhibition Study in Ocular Neovascularization (V.I.S.I.O.N.) Clinical Trial Group. Ophthalmology. 2006; 113:992-1001. [ Links ]
20. Ghosh S, Singh D, Ruddle JB, Shiu M, Coote MA, Crowston JG. Combined diode laser cyclophotocoagulation and intravitreal bevacizumab (Avastin) in neovascular glaucoma. Clin Experiment Ophthalmol. 2010; 38:353-7. [ Links ]
21. Saito Y, Higashide T, Takeda H, Murotani E, Ohkubo S, Sugiyama K. Clinical factors related to recurrence of anterior segment neovascularization after treatment including intravitreal bevacizumab. Am J Ophthalmol. 2010; 149:964-72. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
hector_fernan@hotmail.com
(H. Fernández Jiménez-Ortiz).
Recibido 21 Enero 2011
Aceptado 11 Septiembre 2011