Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.34 no.3 Madrid jul./sep. 2008
| Estudio anatómico de la transferencia de los nervios accesorio y toracodorsal al nervio cubital en el gato Anatomic study of spinal accesory and thoracodorsal nerves transfer to ulnar nerve in cats |
|
| Martínez-Méndez, J.R.*, Isla Guerrero, A.**, Pérez Conde, C.***, Morales, C.****, Casado Pérez, C.***** |
| Resumen Las lesiones del plexo braquial son una de las patologías más graves y con mayor número de secuelas del miembro superior. En el momento actual las transferencias nerviosas se encuentran en primera línea del armamento terapéutico para reconstruir funciones proximales del miembro superior. En el estudio que presentamos se realizaron 20 transferencias nerviosas al nervio cubital del gato común, tomando bien el nervio accesorio del espinal (10 casos) o bien el nervio toracodorsal (10 casos). Como grupo control se utilizó el lado contralateral al intervenido. Durante el año siguiente, se evaluó la reinervación mediante estudios electromiográficos, histológicos de nervio y músculo, así como histoquímicos de médula espinal. Tras el análisis de los resultados encontramos que las motoneuronas de ambos nervios donantes son capaces de conseguir reinervaciones parciales del territorio cubital.
| Abstract A brachial plexus injury is one of the most severe pathologies of the upper limb, and also has severe sequels. In the actual state of the art, nerve transfers are being used as first line of therapeutic approach in the reconstruction of proximal functions of the upper limb. In this study 20 nerve transfers were made to the ulnar nerve of the cat, using the spinal accessory nerve (10 cases) or the thoracodorsal nerve (10 cases). The opposite side was used as control. During next year, reinnervation was assessed by electromyography, nerve and muscle histology and histochemical evaluation of the spinal cord. We found that motoneurons of both donor nerves are able to make partial reinervation of the ulnar nerve territory.
|
|
|
|
* Médico Adjunto. Servicio de Cirugía Plástica.
** Médico Adjunto. Servicio de Neurocirugía.
*** Médico Adjunto. Servicio de Neurofisiología.
**** Jefe de Servicio. Servicio de Anatomía Patológica.
***** Jefe de Servicio. Servicio de Cirugía Plástica. Hospital Universitario La Paz. Madrid. España.
Trabajo galardonado con el Premio Mentor de Residentes del XLI Congreso de la Sociedad Española de Cirugía Plástica, Reparadora y Estética (SECPRE), Pamplona, España, junio de 2007, y con el Primer Premio del Concurso de Residentes del XVII Congreso de la Federación Iberolatinoamericana de Cirugía Plástica (FILACP), Quito, Ecuador, junio de 2008.
Introducción
Las lesiones del plexo braquial constituyen una de las patologías más lesivas para el miembro superior, con una alta tasa de secuelas. Desde su descripción han constituido un problema de salud importante debido a las graves deficiencias funcionales, tanto motoras como sensitivas, que las caracterizan. Además, en el momento actual suponen un problema epidemiológico muy serio; tal y como describen numerosos autores afectan a pacientes jóvenes, más frecuentemente varones, en los que dejan secuelas muy incapacitantes para las actividades laborales y de relación. Todos los autores han relacionado sus casos con accidentes de tráfico, alcanzando cifras del 90%, siendo los accidentes de motocicleta los más frecuentemente asociados (1,2). En España muy pocos autores han recogido la incidencia de estas lesiones, en concreto, León (3) en 1990 recogía todas las lesiones secundarias a traumatismos de alta energía tras accidente de motocicleta, encontrando una incidencia de lesiones en el miembro superior del 20%, de las que las lesiones del plexo braquial eran un 0,2%. Se estima que en España existen unos 160 a 320 adultos al año con lesión del plexo braquial (4).
Los mecanismos para explicar la lesión del plexo braquial son variados. En el año 1993 Coene (5) estableció su clasificación en tres tipos fundamentales: en primer lugar los traumatismos directos sobre el cuello y el miembro superior; en segundo lugar la tracción del miembro superior, que se suele acompañar de la flexión del cuello hacia el lado contralateral y es el mecanismo más frecuentemente implicado en los accidentes de motocicleta y en los relacionados con el deporte; en último lugar, la compresión del plexo mediante elementos del tejido adyacente al mismo. Todos estos mecanismos descritos pueden coexistir, teniendo la lesión en ese caso peor pronóstico.
En algunas ocasiones la tensión ejercida sobre el miembro superior es de tal magnitud que provoca la lesión más devastadora sobre el plexo braquial: la avulsión radicular. Esta patología supone el arrancamiento de las raíces de la médula espinal y se clasifica en dos grupos en función de la localización del ganglio espinal con relación al extremo distal de la lesión: pre o postganglionar, siendo más frecuente la primera (6).
La reparación del nervio periférico se basa en la reparación de su continuidad mediante la aproximación de ambos cabos, y cuando esto no es posible, mediante la interposición de un injerto. Pero estos métodos de reparación son inadecuados cuando la lesión implica la desconexión de las raíces nerviosas de la médula espinal. Para resolver estas situaciones Carlstedt publicó sus resultados con la reconexión de las raicillas (7,8), sin embargo a día de hoy sus técnicas no han encontrado un lugar en el armamento terapéutico para la reconstrucción del plexo braquial.
Las lesiones del plexo por avulsión son situaciones complejas, que requieren exploración y en muchas ocasiones, la fibrosis instaurada durante el tiempo que transcurre desde la lesión hasta la cirugía hace especialmente difícil la reparación. Por tanto, en aquellos casos en los que se produce la avulsión de las raíces espinales se considera de primera elección la reconstrucción de la función del miembro superior mediante la transferencia nerviosa, utilizando nervios que proceden de niveles no afectados por el mecanismo que causó la lesión, bien pertenecientes al plexo (intraplexuales) o bien ajenos a él (extraplexuales).
En el tratamiento de las avulsiones del plexo braquial se establecen una serie de prioridades. En el caso de las lesiones totales del plexo, el primer objetivo es la restauración de la estabilización del hombro, abducción del hombro y flexión del codo (9). Tal y como recoge Merrel en el único metanálisis publicado hasta el momento sobre plexo braquial, existe una gran variabilidad en la presentación clínica de las lesiones de plexo, así como en los abordajes terapéuticos. Sin embargo encuentra que los resultados publicados hasta el año 2001 son mejores utilizando intercostales para la flexión del codo y el nervio accesorio del espinal para la abducción del hombro (10).
Se ha trabajado mucho con lesiones del plexo braquial de origen obstétrico. En estos casos las lesiones son más frecuentes en las raíces altas, sin embargo en torno al 15% de las mismas afectan a la mano por implicación de las raíces bajas (11). Las lesiones provocadas son similares a las que se observan en los adultos, sin embargo el potencial regenerativo de los niños así como la menor distancia que deben recorrer los axones, ha provocado que algunos autores hayan realizado técnicas para la reconstrucción de la mano en estos casos. Gilbert sugiere que siempre se debe intentar restaurar la función de la mano (12), puesto que se alcanzan buenos resultados en un 76% de los casos en la mejor de las series (13). Posteriormente, se han publicado otros resultados como los de Pondaag (14) en 2006, que alcanza unos resultados de grado 3 de Raimondi para la función de la mano en el 69% de los casos con injerto entre los cabos de las raíces y en el 33% de los casos con neurotización extraplexual. Sus resultados son tan alentadores que entre sus conclusiones dice que en los casos de lesión braquial obstétrica la mano debe ser el primer objetivo. Sin embargo los resultados en los casos de adultos son muy pobres. Los mejores resultados publicados son los de Terzis, que alcanza un 35% de pacientes en los que consigue flexión de dedos tras la cirugía sobre el plexo y técnicas quirúrgicas paliativas (15). Los métodos descritos hasta el momento que obtienen buenos resultados son fundamentalmente técnicas basadas en las transferencias tendinosas que palian el déficit motor distal, utilizando unidades músculo-tendinosas funcionales prescindibles, bien sean axiales o libres.
Existen diferentes métodos para valorar la reinervación motora, como son: la electromiografía, la valoración clínica o los estudios histológicos de biopsias musculares o incluso nerviosas. Se han descrito otros métodos que se pueden utilizar en el campo experimental, como es el uso de la peroxidasa de rábano o fluorocromos. Estos métodos son muy efectivos para valorar la regeneración a través de conexiones nerviosas en animales de experimentación gracias a su transporte retrógrado desde el Sistema Nervioso Periférico hacia la médula espinal (16,17), lo que pondría de manifiesto las neuronas implicadas en la inervación de un territorio, diferenciándolas de las que inervan otros miotomos dentro del total de motoneuronas que se encuentran en el asta anterior.
El objetivo de nuestro trabajo es el evaluar la reinervación anatómica del territorio cubital mediante la transferencia directa infraclavicular del nervio accesorio del espinal o el toracodorsal en el gato, comparando ambos. Para ello nos apoyamos en la electromiografía (EMG), en el estudio anatomopatológico de la biopsia de nervio y músculo del territorio reinervado y en el estudio del asta anterior medular tras el transporte retrógrado de la peroxidasa de rábano (HRP).
Material y método
Previamente al estudio experimental confirmamos mediante disección en cadáver, que la transferencia diseñada en el gato era técnicamente posible en humano en condiciones similares y realizamos el mismo protocolo quirúrgico en 3 cadáveres frescos en el Servicio de Anatomía Patológica, confirmando la viabilidad anatómica del diseño.
Diseño y técnica quirúrgica
El estudio experimental se realizó con 20 gatos (felis domesticae) de ambos sexos y con pesos de 2 a 4 Kg. Se dividieron los gatos en 2 grupos de características similares y de forma controlada para evitar sesgos, que constituirían los grupos experimentales. Los grupos control se formaron con los lados contralaterales a los operados. Todas las intervenciones quirúrgicas se realizaron bajo anestesia general, reuniendo las condiciones de asepsia quirúrgica necesarias y bajo la ayuda de un microscopio quirúrgico (Leyca ®). Se realizó una premedicación anestésica con Ketamina (10 mg/Kg), Diazepán (1 mg/Kg) y Atropina (0,05 mg/Kg). La inducción se realizó mediante Isofluorano al 3% vaporizado junto con oxígeno y protóxido en proporción 1:1. Tras intubación orotraqueal, se mantuvo al animal bajo respiración artificial controlada por presión (7-8 cm de agua), con un cociente de inspiración-espiración de 0,75:3 segundos y mantenida con Isofluorano al 2,5%. En el período postoperatorio se utilizaron analgésicos (Ketorolaco 0,25 mg/Kg dos veces al día) y antibióticos (Cefazolina 30 mg/Kg tres veces al día) durante las primeras 24 horas. Los gatos se mantuvieron en jaulas individuales con acceso libre a la comida y al agua (18).
El grupo I se creó con 10 gatos a los que se realizó la anastomosis quirúrgica entre el nervio accesorio del espinal y el nervio cubital. El grupo II se constituyó con 10 gatos en los que se realizó la transferencia del nervio toracodorsal al nervio cubital, en el mismo punto que en el grupo anterior. Para ello se practicó la neurolisis externa del nervio cubital utilizando el acceso que describe Ploncard en su técnica (19). La identificación del nervio se confirmó mediante estimulación intraoperatoria seccionándose el cubital en su origen del fascículo medial.
Para localizar el nervio accesorio se realizó una incisión paralela al borde medial del músculo esternocleidomastoideo, se seccionó el músculo platisma y se separó, identificándose a continuación las fibras motoras del nervio accesorio mediante estimulación intraoperatoria. Seguidamente, se realizó la disección de la rama nerviosa para el músculo trapecio del nervio accesorio llegando lo más distal posible sobre la grasa supraescapular y posteriormente se llevó esta rama a la región axilar. La localización del nervio toracodorsal se realizó utilizando el mismo abordaje que para el nervio cubital. Se disecó el tejido linfograso de la región axilar, abordando la inserción del tendón conjunto dorsal ancho-redondo mayor sobre el húmero. En la cara anterior de este tendón se localizaba el paquete vasculonervioso toracodorsal, permitiendo su identificación precisa mediante electroestimulación directa.
Utilizando un microscopio quirúrgico, realizamos la neurolisis de los nervios identificados previamente. Se seccionó el nervio cubital justo en su salida del fascículo medial, el nervio accesorio del espinal en su punto de entrada al músculo trapecio (Fig. 1), y el nervio toracodorsal a 4 cm de su salida del cordón medial (Fig. 2). Se realizaron dos suturas epineurales con Nylon 10-0 entre ambos cabos para mantener la tensión, y se rodeó la sutura con gel de fibrina (Tissucol ®). La inmovilización postquirúrgica no fue necesaria puesto que la sutura se realizó en abducción máxima y la movilidad pasiva del miembro superior no producía tensión excesiva en la sutura. Todos los pasos en la cirugía se realizaron tras una cuidadosa hemostasia utilizando electrocauterización bipolar y monopolar.
Fig. 1. Esquema de la anastomosis del nervio accesorio del espinal y el nervio cubital
en el Grupo I.Fotografía durante la intervención en un animal del grupo experimental,
tras la realización de la anastomosis entre ambos nervios, previa al uso de gel de fibrina.
Fig. 2. Esquema de la anastomosis directa del nervio toracodorsal al nervio cubital
en la región axilar. Fotografía de la anastomosis previa al uso de gel de fibrina.
Estudio neurofisiológico
Realizamos registros electromiográficos convencionales cada dos meses en cada uno de los gatos del grupo experimental. Para ello colocamos un electrodo de aguja concéntrico en la musculatura intrínseca medial de la garra y en el flexor carpi ulnaris, dependiente del nervio cubital. Registramos en reposo la actividad anormal espontánea (fibrilaciones y ondas positivas en más de 3 puntos) y los potenciales de unidades motoras tras movimientos reflejos bajo sedación suave (Isofluorano 1,5% vaporizado en una mezcla de oxígeno y aire 1:1) a estímulos nociceptivos sobre la pata ipsilateral. El electromiograma se monitorizó entre 7 y 12 meses. Los gatos del grupo control recibieron al menos dos registros de electromiografía. Los niveles de alteración se graduaron utilizando la versión modificada de la escala de Dumitru y Wilbourn (20) en tres grados: leve, medio y grave. Para el análisis estadístico agrupamos los valores de denervación medio y grave dentro de una misma categoría.
Estudio histológico
Durante la última intervención obtuvimos las muestras para el estudio histológico; todas fueron enviadas al Servicio de Anatomía Patológica y codificadas con un número propio del Departamento, sin relación alguna con el del estudio. De este modo el estudio de las biopsias se podía realizar de forma ciega.
Las muestras musculares se obtuvieron en fresco, de 1 cm de grosor, tomadas de la musculatura epitroclear y fueron procesadas en Isopentano enfriado con Nitrógeno líquido. Estas muestras se cortaron en un criostato en secciones transversales de 10 mm de grosor que se procesaron posteriormente para tinción de Hematoxilina-Eosina y estudio de la actividad histoquímica de Adenosina Trifosfatasa miofribrilar (ATPasa) tras incubación a pH de 9,4; 4,6 y 4,3. El criterio histológico para asumir la reinervación fue la presencia de grupos de fibras del mismo tipo (21).
La biopsia del nervio cubital (1 cm de longitud) se tomó distal a la anastomosis. Los nervios se distendían suavemente sobre un soporte de madera, para después ser fijados sobre una solución de formol tamponada. Se realizaron secciones transversas de 10 mm de grosor, que posteriormente fueron fijadas en parafina y teñidas mediante Hematoxilina-Eosina y Tricrómico de Masson. El grosor y la densidad subjetiva de fibras mielínicas eran comparados con el nervio contralateral de forma ciega.
Estudio neuroanatómico
Un año después de ser intervenidos inicialmente y bajo las mismas condiciones de anestesia previamente descritas, se realizó el trazado neuronal con HRP en 4 gatos del grupo I y 4 gatos del grupo II, seleccionados al azar entre los que habían resultado positivos en el electromiograma. Para ello disecamos 2 cm. del nervio cubital, distales al punto de anastomosis microquirúrgica. Sobre el extremo proximal del nervio cortado previamente aplicamos durante una hora 6 mL de una solución en agua bidestilada de HRP al 25% (Tipo VI; Sigma Chemical Co., St Louis, MO) en el interior de un tubo de laboratorio. El extremo nervioso se disecó completamente del lecho y se retrajo el epineuro levemente, seccionándolo longitudinalmente unos milímetros.
El grupo control estaba compuesto por el lado contralateral al operado de 12 gatos seleccionados al azar, divididos en 3 grupos de 4: un grupo para control del cubital, otro para control del accesorio del espinal y finalmente el último para control del nervio toracodorsal. Sobre el extremo proximal del nervio seccionado, se aplicó una solución de Peroxidasa al 25% bajo las mismas condiciones anteriores.
Dejamos al gato en las condiciones habituales durante 72 horas. Para la perfusión y fijación de los tejidos escogimos un método de sacrificio compatible con el artículo 2 de la Directiva del Consejo Europeo del 24 de noviembre de 1986. Utilizamos la inducción a sueño profundo mediante la aplicación de Pentobarbital intraperitoneal. La fijación de los tejidos se consiguió mediante el método de Karnovsky modificado por Llamas, Reinoso y Martínez-Moreno (22) que consistió en la perfusión con 500 ml. de suero salino a través de un catéter introducido en el ventrículo izquierdo para exanguinar al animal y lavar los vasos, continuando con 3 l. de una mezcla de Paraformaldehido 1% y Glutaraldehido 1,25%, en tampón fosfato 0,1M a 4ºC y pH 7,4 durante 45 minutos; la baja temperatura de fijación permite retrasar la degradación enzimática de la Peroxidasa. Para finalizar la perfusión y dar crioprotección al tejido medular, lavamos el exceso de solución de fijación mediante disoluciones de sacarosa a 5% (1L en 15 minutos), 10% (1L en 15 minutos) y 20% (500mL en 15 minutos) bajo las mismas condiciones de pH y temperatura. La impulsión de las soluciones se realizó mediante una bomba peristáltica de flujo variable (Cole-Palmer Mod. 7521-00) con cabeza Masterflex.
Posteriormente se expuso la médula espinal mediante laminectomía e incisión de la duramadre por vía dorsal y tomamos 12 cm. de médula rostrales a T1. Para evitar la desnaturalización enzimática, mantuvimos el fragmento en una disolución de sacarosa 30% y pH 7,4 durante 48 horas a 4º. A continuación realizamos cortes longitudinales de 50 µm. de grosor mediante un microtomo de deslizamiento (Reichert ®). Uno de cada tres cortes se preparó para el análisis histoquímico utilizando Tetrametilbenzidina (TMB, Sigma ®) como sustrato. Otro corte de cada tres se utilizó para la tinción de Nissl utilizando Cresil Violeta al 0,5%. La última serie se mantuvo en reserva para el estudio de una zona determinada.
Los cortes teñidos se estudiaron al microscopio de luz convencional, campo oscuro y luz polarizada (Leitz Dialux 22; Leica Microsistemas, S.A. Barcelona, España). El contorno de las secciones y la localización de cada neurona marcada se introdujo en un sistema de digitalización (MD2 ®; Minnesota Datametrics, St. Paul, MN) y se imprimió en papel. Posteriormente se realizó el recuente de cuerpos neuronales marcados en los cortes medulares.
Estudio estadístico
Para la realización del estudio estadístico utilizamos el programa informático SPSS 14.0 para Windows (SPSS Inc., Chicago, Illinois). Para la comparación de los resultados electromiográficos empleamos el test de chi de Pearson corregido y el test exacto de Fisher. Para el estudio del recuento neuronal, debido al bajo número de individuos en cada grupo, utilizamos tests no paramétricos para la comparación de sus medias (U de Mann Whitney). Las diferencias estadísticas fueron consideradas como significativas cuando la p fue menor de 0,05.
Resultados
Electrofisiológicos
La reinervación de la musculatura cubital en el grupo I se alcanzó entre los meses quinto a noveno (7,3 meses de media), mientras que en el grupo II ocurrió entre los meses cuarto a octavo (6,8 meses de media). La reinervación fue objetivada mediante electromiografía en 8 de los 10 casos del grupo I y en 9 de los 10 casos del grupo II (Fig. 3). Al estratificar el resultado de acuerdo a la escala de Dumitru, encontramos denervaciones leves en el 10% de los gatos del grupo I frente a un 70% en el grupo II. El análisis estadístico de los resultados neurofisiológicos muestra que existen diferencias significativas a favor de la reinervación lograda con la transferencia del nervio toracodorsal, frente al grupo I (p=0,022).
Fig. 3. Registro EMG en la musculatura intrínseca de la mano. Arriba: trazado
originado por la contracción refleja del músculo en reinervación formado por un
potencial de unidad motora que bate a alta frecuencia. Abajo: actividad de
denervación en reposo (fibrilaciones y ondas positivas).
Histológicos
El estudio de la biopsia del nervio cubital en el grupo experimental mostró una densidad de fibras mielínicas muy variable, aunque encontramos paso de axones en 8 de cada 10 casos del grupo I y en todas las muestras del grupo II.
El estudio histológico de las muestras musculares encontró claramente agrupaciones de fibras musculares, con escasas fibras atróficas en 8 de cada 10 casos del grupo I y en 9 de cada 10 casos del grupo II. Estos casos coinciden con los obtenidos en la electromiografía y en el estudio histológico de las muestras de nervio cubital (Fig. 4). En las muestras de los controles se encontró una distribución aleatoria de las fibras tipo I y II. No se calculó la proporción de fibras tipo I y II, puesto que este caso no constituye un criterio de reinervación.
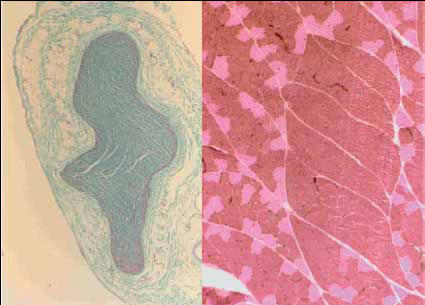
Fig. 4. Imagen histológica del paso de axones procedentes de
motoneuronas del nervio accesorio del espinal por una sección del
nervio cubital (derecha). Imagen histológica 25X de una sección
transversal de la biopsia de la musculatura epitroclear del gato, teñida
mediante las técnicas descritas en Material y Método (izquierda).
En los casos en los que no se encontró evidencia de reinervación ni electromiográfica ni histológica, realizamos revisión de la zona de la anastomosis. En los casos del grupo I encontramos una ruptura de la anastomosis y la separación de ambos cabos. En el caso del grupo II encontramos un neuroma en continuidad.
Trazado neuronal
Las motoneuronas que enviaban sus axones a través del nervio cubital se concentraban en la mitad lateral del asta anterior de los segmentos C7 a T1. La media de motoneuronas que se tiñeron mediante marcaje retrógrado con HRP en el grupo control del nervio Cubital fue 511,75 ± 162,6. En cambio aquellas motoneuronas cuyos axones formaban la rama para el músculo trapecio del nervio accesorio del espinal se localizaban en los segmentos C5 a C7, en un número medio de 144,3 ± 24,8 y en posición más dorsal que en el grupo anterior. En el grupo I tras 12 meses de evolución, al aplicar la HRP en el extremo del nervio cubital 2-3 cm distal a la anastomosis, se marcaron abundantes neuronas (48,5 ± 14,3) en el segmento cervical de la médula espinal (Tabla I, Fig. 5-7). Su localización coincide en su distribución tridimensional con la del grupo control del nervio accesorio del espinal.
Fig. 5. Imagen obtenida por microscopía en campo oscuro
40X de las motoneuronas marcadas mediante la aplicación de HRP
en el nervio cubital y correspondientes al nervio accesorio del espinal.

Fig. 6. Esquema de las motoneuronas que aparecen marcadas en los cortes
de la médula espinal. 1. Neuronas marcadas del nervio cubital en el
grupo control. Las motoneuronas se agrupan en los niveles bajos (C7-C8)
fundamentalmente y en las regiones más ventrales. 2. Neuronas marcadas del
Nervio accesorio del espinal en gatos del grupo control. Se observa que las
motoneuronas se localizan en cortes más dorsales del asta anterior y en
niveles algo más altos (C6- C7). 3. Neuronas marcadas tras la anastomosis
directa de ambos nervios en gatos del grupo experimental. La distribución
sigue el patrón del grupo anterior, con neuronas de niveles C6-C7, y en
cortes más dorsales, aunque en menor número que en el grupo control (p>0,05).
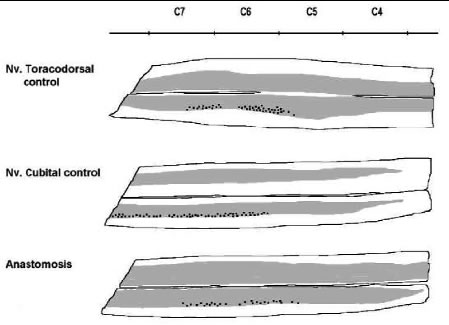
Fig. 7. Esquema del marcaje de motoneuronas en el asta anterior
mediante el transporte retrógrado de HRP inyectado distal a la
anastomosis en el nervio cubital. Las neuronas marcadas del nervio
cubital en el grupo control se agrupan en los niveles bajos (C7-C8)
fundamentalmente, mientras que las del grupo control del nervio toracodorsal se
localizan fundamentalmente en los niveles C6-7, pero algo más altas que las
del grupo cubital. Se observa como la distribución tras la anastomosis sigue el
mismo patrón que en el grupo control del nervio tóracodorsal.
Las motoneuronas marcadas con HRP en el grupo control del nervio Toracodorsal se situaban en los niveles metaméricos C6-C7, en su porción más dorsal y en número medio de 204,8 ± 43,3. En cambio el grupo II, tras 12 meses de evolución, marcaba 170,8 ± 37,9 motoneuronas, con la misma localización espacial en el asta anterior que en el grupo control Toracodorsal.
El estudio estadístico del recuento neuronal encontró diferencias significativas entre ambos grupos experimentales a favor del grupo II (p=0,29). Igualmente existían diferencias significativas entre el grupo I y los grupos controles cubital y accesorio del espinal (p=0,21 y p=0,29). En cambio no existían diferencias significativas entre el grupo II y el grupo control toracodorsal, aunque sí con respecto al grupo control cubital.
Discusión
Para el estudio de las lesiones del plexo braquial y de su reparación mediante neurotización, escogimos el gato doméstico como modelo experimental debido a su anatomía conocida, al tamaño de su plexo asequible a la manipulación quirúrgica y a su potencial de regeneración, similar al de otros mamíferos superiores (23); para evitar posibles sesgos en cuanto a edad, sexo o peso, homogeneizamos los grupos. Sin embargo, no hemos encontrado ningún estudio que indique la existencia de diferencias significativas en cuanto al número de motoneuronas o a la capacidad de reinervación motora en función de las variables citadas. Tampoco estudios acerca de la lateralidad hemisférica cerebral en el gato, que traduzcan dominancia y que por tanto indiquen la posible existencia de más fibras en un lado que en el otro. Este hecho además se confirma en el humano, gracias a la publicación de Malessy tras la transferencia de intercostales a musculocutáneo (24).
Cuando ocurre una lesión severa de las raíces cervicales, como es la avulsión de las raíces de la médula espinal, las opciones terapéuticas que se plantean son escasas y las posibilidades de reparación quirúrgica a nivel medular son mínimas. En estos casos es necesario encontrar otra fuente de axones motores que procedan de neuronas que no pertenezcan a los niveles implicados en la lesión. En este sentido la bibliografía muestra diferentes nervios que han sido utilizados como "donantes", tal es el caso de pequeñas ramas del plexo cervical, el nervio frénico, nervios intercostales y el nervio accesorio del espinal. La elección de cuál de esos nervios donantes es el más indicado para cada situación es hoy por hoy controvertida. Hattori (25) concluye que la selección depende de la función que se pretenda reconstruir, siendo el accesorio del espinal el idóneo para musculatura de gran potencia y rápida y los intercostales para musculatura postural y de gran resistencia a la fatiga. De igual modo debemos darle prioridad a las funciones proximales, sabiendo que algunas técnicas abandonaron ya el grupo de las cirugías experimentales para estar dentro del armamento terapéutico frente a este tipo de lesiones (10).
Sin embargo la elección del nervio donante no parece tan clara cuando la plexopatía es completa, puesto que muchos de esos nervios no están disponibles. La transferencia del nervio accesorio del espinal puede generar secuelas graves, puesto que el músculo trapecio podría ser uno de los pocos músculos útiles tras una lesión panplexual. Sin embargo, la transferencia del nervio accesorio del espinal se realiza utilizando la porción distal del nervio, de forma que la parte central del trapecio se conserva y la parte proximal del mismo tiene una inervación mixta con ramas del plexo cervical (26).
En el caso del nervio toracodorsal, su transferencia implica la denervación del músculo dorsal ancho, que en múltiples ocasiones se utiliza para la cirugía paliativa como transferencia muscular (24). Sin embargo, la transferencia de este nervio se ha realizado con éxito por diferentes autores; Novak lo utilizó para reconstruir 6 bíceps, con resultado de 1 caso de M5 y 4 casos de M4 sin secuelas de debilidad para la adducción o rotación interna del brazo (27). Posteriormente, Samardzic lo utilizó en casos similares para la reconstrucción del nervio musculocutáneo en 12 casos y del nervio axilar en 15 casos, consiguiendo un 94% de función útil (mayor de M3) (28). Por tanto su uso estaría justificado en los casos en los que la función a recuperar es más útil que la del músculo que inerva. Basándonos en estos principios el uso de estos nervios podría estar justificado si pretendemos recuperar funciones distales perdidas.
La efectividad de la anastomosis del nervio accesorio con ramas del plexo braquial ha sido cuestionada hasta hace pocos años. Nuestros resultados muestran que los axones motores del nervio donante pueden alcanzar el extremo distal de nervios tan largos como el cubital. En cualquier caso, la comparación del número de neuronas encontradas con HRP en los grupos control y los grupos experimentales, muestra que existen diferencias significativas entre ambos. Creemos que se deben a diferentes factores biológicos y técnicos que pueden afectar a la efectividad de la técnica.
En primer lugar, existen diferencias obvias en el tamaño entre los nervios donantes utilizados y el nervio cubital y por tanto, en el número de fibras. En el caso de los humanos, el nervio accesorio contiene aproximadamente 3.000 fibras motoras, frente a las 12.000-15.000 de los nervios musculocutáneo, mediano, radial o cubital. Aunque en el gato no se ha determinado esta proporción, el aspecto macroscópico ya apunta en la misma dirección. Además, la denervación provoca la pérdida progresiva de motoneuronas en el nervio dañado, empeorando el pronóstico (29). Por último, la atrofia y fibrosis muscular que se instauran en un período corto de tiempo, empeora en estos casos debido a la suma del tiempo pre-cirugía y el tiempo que tardan en crecer los axones, disminuyendo así de forma significativa las posibilidades de éxito de la cirugía (30, 31).
En segundo lugar, encontramos relación con la técnica quirúrgica. Teniendo en cuenta que la transferencia de un nervio donante a un nervio desconectado en el plexo braquial se ha descrito en la literatura de tres modos diferentes: la sutura del nervio donante a una rama del plexo braquial en la axila con un injerto de nervio sural (32); sutura directa del nervio donante a un tronco del plexo braquial dañado por encima de la clavícula (33) y la anastomosis por debajo de la clavícula (19), elegimos la última de ellas puesto que la conexión de ambos nervios a nivel de la axila implica una conexión más distal evitando la pérdida de axones por direcciones equivocadas y logrando una disminución en la distancia que deben recorrer los axones a través del nervio receptor.
En tercer lugar, la tensión en la sutura puede influir en el resultado. Driscoll encontró que sobre un nervio sano, sin suturas previas, la elongación de un 15% de su longitud provocaba la disminución del flujo microvascular y que tras una hora de relajación, se mantenía una reducción del 30% de la velocidad de conducción (34).Hoy sabemos que los efectos moderados de la tensión estimulan la secreción de factores de crecimiento neurotrópicos y que la tensión impide la regeneración a partir de un umbral de entre 0,39 a 0,56 Newtons. En nuestro estudio, encontramos una mayor tasa de denervaciones leves en el grupo II (70%) que en el grupo I (10%), con diferencias estadísticamente significativas. Estos resultados a su vez se corresponden de forma directa con los obtenidos en la histología; a pesar de que durante la cirugía la anastomosis no presentaba tensión alguna en el grupo I, el recuento neuronal bajo, estadísticamente significativo respecto al control del nervio accesorio, las diferencias electromiográficas, así como la presencia de dos dehiscencias de la anastomosis, hablan a favor de la presencia de fuerzas de distracción sobre los cabos de la anastomosis. En cambio en el grupo II el recuento neuronal no era estadísticamente diferente respecto al grupo control del nervio toracodorsal, lo que junto a la ausencia de dehiscencias de la sutura, nos reafirma acerca de las mejores condiciones anatómicas para la transferencia de este nervio al plexo braquial a nivel infraclavicular.
La técnica microquirúrgica en la sutura nerviosa ha de ser precisa para disminuir al mínimo la agresión sobre los tejidos, evitando el exceso de material de sutura. La aparición de los geles de fibrina ha supuesto una revolución en la sutura nerviosa puesto que carecen de efecto inhibitorio sobre la regeneración axonal (36), alcanzando resultados similares en menos tiempo (37, 38), hasta el punto de que consiguen menor fibrosis que las suturas, mejor regeneración axonal (39) y mayor velocidad de conducción y amplitud de onda en los estudios neurofisiológicos (40). Por estas razones utilizamos la sutura epineural con nylon 10-0 de aproximación, junto con el sellado de la anastomosis mediante gel de fibrina en todos los casos.
La técnica de tinción de motoneuronas mediante el transporte axonal retrógrado de Peroxidasa de rábano, es un método muy conocido y muy utilizado en los estudios neuroanatómicos. Existen múltiples factores que influyen en el transporte axonal, sin embargo sabemos que para nuestros casos eran necesarios 2-3 días para que se alcanzara el soma neuronal. El recuento manual de las motoneuronas marcadas en el asta anterior es un tema discutido; sólo se contaron aquellas neuronas en las que se visualizaba el soma y el núcleo de la misma, para evitar sobreestimar las neuronas marcadas al contar dendritas primarias de la misma neurona. El método subestima el recuento, puesto que se pueden visualizar neuronas cuyo núcleo quede en un corte que no se ha teñido con la técnica para el revelado del HRP, o bien que no se visualicen neuronas teóricamente marcadas. Esto implica que los resultados presentan cierto sesgo cuantitativo, sin embargo este sesgo es aceptable, puesto que el objetivo del estudio es evaluar el resultado de la técnica quirúrgica y no el de valorar la cantidad de motoneuronas que neurotizan un territorio.
En los cortes de médula espinal se evidencia como las neuronas que componen el nervio cubital neurotizado proceden de las regiones correspondientes al nervio donante. Además, estas motoneuronas del nervio accesorio del espinal se localizan en núcleos distintos a las del nervio cubital, por lo que podrían ser útiles en pacientes con lesiones de plexo braquial. Sin embargo se plantea un problema en el grupo experimental II que es la superposición del nivel C8 en ambos territorios. En nuestros casos encontramos que las fibras que componen el nervio toracodorsal en el gato, provienen de los niveles C7-C8 fundamentalmente, mientras que el nervio cubital se forma de los niveles C8-T1. Por tanto, en los casos de avulsión baja del plexo braquial el nervio toracodorsal ipsilateral estaría parcialmente lesionado, de forma que no contaríamos con todas sus motoneuronas.
La transferencia del nervio accesorio del espinal tal y como se plantea en el estudio aporta la décima parte de las neuronas necesarias para el nervio cubital, frente al toracodorsal que aporta entre el 33 y el 50%. Sin embargo potencialmente serían capaces de reinervar entre el 30 y el 60% del territorio. Aunque existen diferencias estadísticamente significativas en el número de neuronas, probablemente esta cantidad sería suficiente para conseguir restaurar la mayor parte de la movilidad del territorio. Ahora bien, para establecer la utilidad de esta reinervación sería necesario realizar estudios a más largo plazo, evaluando la habilidad y la fuerza con la que los sujetos utilizan la garra.
Conclusiones
Tras evaluar nuestros resultados, podemos concluir que las motoneuronas de los nervios accesorio del espinal y toracodorsal son capaces de alcanzar territorios distales, consiguiendo reinervaciones eficaces. Sin embargo, cuando se realizan transferencias a grandes nervios como el cubital, sólo son capaces de conseguir recuperaciones parciales, siendo los resultados mejores con el nervio toracodorsal.
Dirección del autor
Dr. José Ramón Martínez-Méndez
Servicio de Cirugía Plástica. Hospital Universitario La Paz
Paseo de la Castellana, 261
28046 Madrid
e-mail: josermartinez77@gmail.com
Bibliografía
1. Choi P. D., Novak C. B., Mackinnon S. E. and Kline D. G. "Quality of life and functional outcome following brachial plexus injury". J Hand Surg [Am]. 1997; 22 (4):605. [ Links ]
2. Midha R. "Epidemiology of brachial plexus injuries in a multitrauma population". Neurosurgery. 1997; 40 1182. [ Links ]
3. León C. "Análisis de las lesiones sufridas por motociclistas." Departamento de Cirugía. Universidad Complutense. Madrid. 1990 [ Links ]
4. García López A. and López-Durán L. "Tema de actualización SECOT: Cronología en el tratamiento de las lesiones del plexo braquial." Rev Ortop Traumatol. 2003; 47 : 73. [ Links ]
5. Coene L. N. "Mechanisms of brachial plexus lesions." Clin Neurol Neurosurg. 1993; 95 Suppl 24 [ Links ]
6. Chuang D. C. "Adult brachial plexus injuries".En Plastic Surgery. VII. Mathes S. J. Ed.Saunders Elsevier, Philadelphia, 2006. Pp: 515-538 [ Links ]
7. Carlstedt T., Grane P., Hallin R. G. and Noren G. "Return of function after spinal cord implantation of avulsed spinal nerve roots". Lancet. 1995; 346 (8986):1323. [ Links ]
8. Carlstedt T., Halin R., Hedström K. and Nilson-Rernahi I. A. M. "Functional recovery in primates with brachial plexus injury after spinal cord implantation of avulsed ventral roots". Journal of Neurology, Neurosurgery and Psychiatry. 1993; 56: 649. [ Links ]
9. Tung T. H. H. and Mackinnon S. E. "Brachial plexus injuries". Clinics in Plastic Surgery. 2003; 30: 269. [ Links ]
10. Merrell G. A., Barrie K. A., Katz D. L. and Wolfe S. W. "Results of nerve transfer techniques for restoration of shoulder and elbow function in the context of a meta-analysis of the English literature". Journal of Hand Surgery (Am). 2001; 26 (2):303. [ Links ]
11. Bager B. "Perinatally acquired brachial plexus palsy- a persisting challenge." Acta Paediatr. 1997; 86 1214. [ Links ]
12. Gilbert A. "Long-term evaluation of brachial plexus surgery in obstetrical palsy". Hand Clin. 1995; 11 (4):583; discussion 594. [ Links ]
13. Haerle M. and Gilbert A. "Management of complete obstetric brachial plexus lesions." J Pediatr Orthop. 2004; 24: 194. [ Links ]
14. Pondaag W. and Malessy M. J. A. "Recovery of hand function following nerve grafting and transfer in obstetric brachial plexus lesions." J Neurosurg (1 Suppl Pediatrics). 2006; 105: 33. [ Links ]
15. Terzis J. K., Vekris M. D. and Soucacos P. N. "Outcomes of brachial plexus reconstruction in 204 patients with devastating paralysis". Plast Reconstr Surg. 1999; 104: 1221. [ Links ]
16. Cheng H., Shoung H. M., Wu Z. A., Cheng K. C. and Lee L. S. "Functional connectivity of the transected brachial plexus after intercostal neurotization in monkeys". The Journal of Comparative Neurology. 1997; 380 (2):155. [ Links ]
17. Schieber M. H. and Deuel R. K. "Primary motor cortex reorganization in a long-term monkey amputee." Somatosensory and Motor Research. 1997; 14: 157. [ Links ]
18. Flecknell P. A. "Laboratory animal anesthesia: a practical introduction for research workers and technicians."Hardcover,1996. [ Links ]
19. Ploncard P. "A new approach to the intercosto-brachial anastomosis in the treatment of brachial plexus paralysis due to root avulsion: late results". Acta Neurochirurgica. 1982; 61: 281. [ Links ]
20. Tsai Y. A., Chuang T. Y., Yen Y. S., Huang M. C., Lin P. H. and Cheng H. "Electrophysiologic findings and muscle strength grading in brachioplexopathies." Microsurgery. 2002; 22 (1):11 [ Links ]
21. Dubowitz V. "Pathology of experimentally re-innervated skeletal muscle." J Neurol Neuosurg Psychiatry. 1967; 30 (2):99 [ Links ]
22. Llamas A., Reinoso-Suarez F. and Martínez-Moreno E. "Projections to the gyrus proreus from the brain stem tegmentum (locus coeruleus, raphe nuclei) in the cat, demostrated by retrograde transport of horseradish peroxidase." Brain Res. 1975; 89 (2):331. [ Links ]
23. Hoffmann C. F., Marani E., Van Dijk J. G., vd Kamp W. and Thomeer R. T. W. M. "Reinnervation of avulsed and reimplanted ventral rootlets in the cervical spinal cord of the cat." J Neurosurg. 1996; 84 (2):234. [ Links ]
24. Malessy M. J. and Thomeer R. T. W. M. "Evaluation of intercostal to musculocutaneous nerve transfer in reconstructive brachial plexus surgery." J Neurosurg. 1998; 88 (2):266. [ Links ]
25. Hattori Y., Doi K., Fuchigami Y., Abe Y. and Kawai S. "Experimental study on donor nerves for brachial plexus injury: comparison between the spinal accessory nerve and the intercostal nerve". Plastic and Reconstructive Surgery. 1997; 100: 900. [ Links ]
26. Samardzic M., Rasulic L., Grujicic D. and Milicic B. "Results of nerve transfers to the musculocutaneous and axillary nerves". Neurosurgery. 2000; 46: 93 [ Links ]
27. Novak C. B., Mackinnon S. E. and Tung T. H. H. "Patient outcome following a thoracodorsal to musculocutaneous nerve transfer for reconstruction of elbow flexion." Br J Plast Surg. 2002; 55 (5):416. [ Links ]
28. Samardzic M., Grujicic D., Rasulic L. and Milicic B. "The use of thoracodorsal nerve transfer in restoration of irreparable C5 and C6 spinal nerve lesions." Br J Plast Surg. 2005; 58 (4):541. [ Links ]
29. Madison R. D., Archibald S. J. and Brushart T. M. "Reinnervation accuracy of the rat femoral nerve by motor and sensory neurons". Journal of Neuroscience. 1996; 16: 5698. [ Links ]
30. Fu S. Y. and Gordon T. "Contributing factors to poor functional recovery after delayed nerve repair: Prolonged axotomy". Journal of Neuroscience. 1995; 15: 3876. [ Links ]
31. Fu S. Y. and Gordon T. "Contributing factor to poor functional recovery after delayed nerve repair: Prolonged denervation". Journal of Neuroscience. 1995; 15: 3886. [ Links ]
32. Millesi H. "Indications et traitement des lésions nerveuses dans les paralysis traumatiques du plexus brachial". Revue de Chirurgie Orthopédique. 1977; 63: 82. [ Links ]
33. Narakas A. "Neurotization or nerve transfer for brachial plexus lesions". Annales de Chirurgie de la Main. 1982; 1: 101. [ Links ]
34. Driscoll P. J., Glasby M. A. and Lawson G. M. "An in vivo study of peripheral nerves in continuity: biomechanical and physiological responses to elongation". J Orthop Res. 2002; 20 (2):370. [ Links ]
35. Sunderland I. R., Brenner M. J., Singham J., Rickman S. R., Hunter D. A. and Mackinnon S. E. "Effect of tension on nerve regeneration in rat sciatic nerve transection model." Ann Plast Surg. 2004; 53 (4):382. [ Links ]
36. Palazzi S., Vila-Torres J. and Lorenzo J. C. "Fibrin glue is a sealant and not a nerve barrier." J Reconstr Microsurg. 1995; 11: 135. [ Links ]
37. Gilbert A., Brockman R. and Carlioz H. "Surgical treatment of brachial plexus birth palsy." Clin Orthop. 1991; 264: 39. [ Links ]
38. Martins R. S., Siqueira M. G., Silva C. F., Godoy B. O. and Plese J. P. "Electrophysiologic assessment of regeneration in rat sciatic nerve repair using suture, fibrin glue or a combination of both techniques." Arq Neuropsiquiatr. 2005; 63 (3A):601. [ Links ]
39. Ornelas L., Padilla L., Di Silvio M., Schalch P., Esperante S., Infante R. L., Bustamante J. C., Avalos P., Varela D. and Lopez M. "Fibrin glue: an alternative technique for nerve coaptation- Part II. Nerve regeneration and histomorphometric assessment." J Reconstr Microsurg. 2006; 22 (2):123. [ Links ]
40. Ornelas L., Padilla L., Di Silvio M., Schalch P., Esperante S., Infante R. L., Bustamante J. C., Avalos P., Varela D. and Lopez M. "Fibrin glue: an alterantive technique for nerve coaptation- Part I. Wave amplitud, conduction velocity and plantar-lenght factors". J Reconstr Microsurg. 2006; 22 (2):119. [ Links ]