Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Cirugía Plástica Ibero-Latinoamericana
versão On-line ISSN 1989-2055versão impressa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.35 no.4 Madrid Out./Dez. 2009
Reconstrucción de defectos torácicos de espesor total. Presentación de 8 casos de especial complejidad
Reconstruction of full thickness defects on the chest wall. Presentation of 8 complex cases
Lasso J.M.*, Uceda M.**, Arenas L.***, Pérez Cano R.****
* Jefe de Sección de Microcirugía.
** Médico Adjunto
*** Médico Interno Residente
**** Jefe de Servicio
Servicio de Cirugía Plástica y Reparadora. Hospital Gregorio Marañón. Madrid. España
Dirección para correspondencia
RESUMEN
Las lesiones de gran tamaño en el tórax, requieren casi siempre para su reparación plastias complejas, que en algunos casos han de combinar el uso de tejidos autólogos y/o materiales sintéticos. Por tanto, la reconstrucción de la pared torácica supone un desafío desde el punto de vista reconstructivo en el que es fundamental el papel de los cirujanos plásticos.
Los grandes defectos torácicos suelen ser secundarios a exéresis tumoral (tumores parietales de origen primario o secundario), infecciones, radionecrosis, traumatismos y malformaciones congénitas.
Si bien los principios de la reconstrucción del tórax exigen una escisión amplia de la lesión, desbridamiento de los tejidos desvitalizados o irradiados y control de la infección local, dichas actuaciones no podrían abordarse con seguridad si no dispusiéramos de un amplio arsenal de técnicas reconstructivas, capaces de aportar tejidos sanos y bien vascularizados o voluminosos y amplios en superficie, junto con soportes rígidos mediante materiales aloplásticos. Gracias a estos avances, en la mayoría de los casos conseguimos el objetivo con sólo una intervención, cuando hace unos años necesitábamos varios procedimientos quirúrgicos.
Presentamos una muestra variada de la experiencia de nuestro Servicio en el tratamiento de grandes defectos del tórax, en el que resumimos las distintas posibilidades que podemos encontrar en la práctica clínica diaria, y las soluciones que mejor se adaptan a las mismas.
Palabras clave: Defectos torácicos, Reconstrucción pared torácica.
Código numérico: 5012.
ABSTRACT
Reconstruction of full thickness defects on the chest wall is controversial and require the use of complex techniques that combine autologous tissue and/or alloplastic materials. Thus it is a challenge for plastic surgeons since it needs a suitable and functional reconstruction. The aethiology for these defects include tumoral surgery (primary wall tumors, or recurrences or metastasis), infections, radiation injury, trauma and congenital defects. Otherwise, first surgical treatment require wide resection of the tumor or ischaemic or radiated tissue and control of the infection, but these principles could not be safely faced without the multiple reconstructive techniques that can afford the use of well vascularized, large or bulky tissues to reconstruct this anatomical area in combination with alloplastic materials, in order to give a solid stabilization. Thanks to these advances, we can actually perform our objectives in only one procedure.
We present a selection of complex chest wall defects that have been operated in the last years by our surgical team. We will describe the solutions and the results obtained by means of a variety of possible flaps and synthetic materials.
Key words: Thoracic defects, Chest wall reconstruction.
Numeral Code: 5012.
Introducción
La pared torácica es una estructura semirrígida destinada a dar protección como coraza a diversos órganos fundamentales de nuestro cuerpo, a la vez que permite los movimientos de inspiración-espiración gracias a la rotación de las costillas. Dicha rigidez es la causa de que en el caso de pérdidas de sustancia importantes, no se pueda realizar un cierre directo por aproximación de los bordes de la herida y sean precisas plastias complejas, que en algunos casos han de combinar el uso de tejidos autólogos y/o materiales sintéticos. Por tanto, la reconstrucción de la pared torácica supone un desafío desde el punto de vista reconstructivo en el que es fundamental el papel de los cirujanos plásticos, sobre todo cuando se trata de reparar grandes defectos con el fin de obtener una reparación funcional y anatómica correctas (1).
Los grandes defectos torácicos más frecuentes son los secundarios a exéresis tumoral (tumores parietales de origen primario o secundario), infecciones, radionecrosis, traumatismos y malformaciones congénitas. En nuestro hospital, son los producidos por recidivas de tumores mamarios, mediastinitis, tumores óseos y en último caso, traumatismos severos del tórax.
Aunque la mayoría de los defectos pueden ser reconstruidos mediante colgajos locales o regionales musculocutáneos, hay casos más complicados que requieren fórmulas reconstructivas más sofisticadas. Si bien los principios de la reconstrucción del tórax exigen una escisión amplia de la lesión, desbridamiento de los tejidos desvitalizados o irradiados y control de la infección local, dichas actuaciones no pueden abordarse con seguridad si no se dispone de un amplio arsenal de técnicas reconstructivas que aporten tejidos sanos y bien vascularizados, o tejidos voluminosos y amplios en superficie, junto con soporte rígido mediante materiales aloplásticos (2,3). Gracias a estos avances,en la actualidad podemos conseguir el objetivo con una sola intervención en la mayoría de los casos, mientras que hace unos años se necesitaban varios procedimientos. En cualquier caso, la reconstrucción de estos defectos dependerá de su tamaño y localización, así como de la necesidad de resecar tejido óseo y/o pulmonar.
Presentamos en este trabajo una muestra variada de la experiencia de nuestro Servicio en el tratamiento de grandes defectos del tórax. Trataremos de resumir las distintas posibilidades que podemos encontrar en la práctica clínica diaria y las soluciones que mejor se adaptan a las mismas.
Material y método
Presentamos una selección de 8 pacientes con grandes defectos torácicos producidos por diversas patologías, tratados en nuestro Servicio a lo largo de los últimos 3 años y medio (desde Enero de 2006 hasta Julio de 2009), escogidos por su complejidad. En ellos resumimos diversas opciones reconstructivas empleando tejidos autólogos y/o materiales sintéticos. Destacamos que este tipo de pacientes suelen presentar un estado general comprometido, puesto que vienen de ser intervenidos por problemas cardiológicos o presentan un proceso tumoral localmente avanzado, lo cual agudiza la dificultad reconstructiva y la gravedad del procedimiento quirúrgico. En los casos seleccionados, hemos optado por distintos métodos de reconstrucción en función del estado general del paciente, tipo de patología y disponibilidad de colgajos, por lo que presentamos una variedad de colgajos de uso habitual, que varían desde los de músculos pectorales hasta el colgajo de epiplon.
Antes de ser intervenidos, los sujetos fueron sometidos a un exhaustivo estudio para valorar su estado general y las posibilidades que presentaban para afrontar una intervención agresiva. En todos los casos, salvo en los de defectos mediastínicos, se realizaron espirometrías preoperatorias. En los pacientes oncológicos se descartó la presencia de procesos metastáticos mediante estudios de imagen.
La resección del área afectada y la reconstrucción fueron realizadas en el mismo acto quirúrgico salvo en los defectos mediastínicos, en los que las intervenciones fueron realizadas en un segundo tiempo, tras curas semioclusivas o mediante terapias de vacío.
Los pacientes fueron extubados sin presentar posteriormente respiración paradójica ni neumotórax. No se produjo ningún fallecimiento perioperatorio ni encontramos signos de rechazo del material protésico implantado a corto ni a largo plazo.
Caso 1
Mujer de 70 años, intervenida por el Servicio de Cirugía Cardíaca por un problema valvular complejo. Presentó múltiples complicaciones postquirúrgicas que agravaron su estado general por fallo de bomba. Tras dos semanas de ingreso, comenzó a desarrollar un cuadro séptico con origen en el mediastino. Se realizó apertura de la herida quirúrgica, con exposición del corazón, y curas diarias con suero fisiológico. El equipo de Cirugía Cardiaca realizó, a las dos semanas de la primera intervención, un colgajo de epiplon para reparar el defecto, sin éxito. A los 2 meses del ingreso, la paciente todavía permanecía en la Unidad de Cuidados Intensivos (UCI) con soporte ventilatorio asistido, coma inducido por fármacos y había desarrollado una polineuropatía generalizada; exposición amplia del corazón, con apertura de la pleura en ambos hemitórax y herniación de un lóbulo pulmonar izquierdo con los movimientos respiratorios (Fig. 1a). Se decidió realizar reconstrucción mediante colgajo de dorsal ancho y material aloplástico (Gore-tex®) para reparar el defecto central y la herniación pulmonar (Fig. 1b). Se empleó para cubrir el defecto parte del colgajo de epiplón efectuado previamente. La paciente evolucionó favorablemente (Fig. 1c), el cuadro neurológico mejoró paulatinamente y fue trasladada a planta 18 días más tarde, para ser dada de alta a su domicilio al mes de la intervención. La paciente falleció 6 meses más tarde por neumonía que afectó al pulmón derecho.
Caso 2
Varón de 65 años con mediastinitis producida por Stafilococcus aureus. Tras cirugía de reconstrucción aórtica con prótesis de Dacron®, presentó exposición de la misma a los 12 días de la intervención, con alto riesgo de diseminación de la infección local y posibilidad de rotura por desecación. Desde que se decidió la apertura de la herida quirúrgica, se hacían lavados con suero fisiológico cada 8 horas y curas con Sulfadiacina argéntica. El paciente precisó intubación continuada desde el día de la intervención, manteniendo estabilidad hemodinámica gracias al uso de drogas vasoactivas.
Se decidió realizar restitución de la pared torácica con colgajos de músculo pectoral. Tras legrado de esternón en la línea media, se elaboró una ventana en el extremo superior del mismo, (margen izquierdo), a la altura de las costillas 3a y 4a, para envolver con el músculo pectoral izquierdo la prótesis aórtica (Fig. 2 a y b). El músculo pectoral derecho se avanzó sobre el esternón una vez realizadas nuevas osteosíntesis con alambres y posteriormente cierre directo de los colgajos cutáneos. El paciente permaneció en la UCI durante 2 días con tratamiento antibiótico, y luego fue dado de alta a planta sin incidencias. Dos años después permanece asintomático.
Caso 3
Mujer de 50 años con obesidad mórbida y recidiva tumoral en cicatriz de mastectomía realizada 4 años antes. Había recibido radioterapia y quimioterapia en su momento y las revisiones periódicas habían sido normales, hasta que se detectó una lesión subcutánea en la propia cicatriz que fue creciendo a gran velocidad. Remitida a nuestro Servicio para valorar cirugía exerética y reconstrucción. El estudio de extensión resultó negativo. Se propuso resección del tumor con márgenes de 4 cm. Bajo anestesia general e intubación orotraqueal con tubo bilumen, se colapsó el pulmón izquierdo y se realizó resección de la segunda costilla desde margen esternal hasta línea axilar anterior, sin necesidad de resección de parénquima pulmonar (Fig. 3a y b). Reconstrucción de la pared, con sutura tipo loop directa entre primera y tercera costillas y sobre ella, se realizó cobertura con colgajo de músculo recto abdominal pediculado,con isla de piel horizontal (TRAM). El colgajo presentó un problema de retorno venoso desde que fue rotado al lecho receptor, por lo que se decidió realizar una microanastomosis de la vena epigástrica inferior superficial del mismo a la vena torácica lateral izquierda, que solucionó el problema inmediatamente. La paciente fue dada de alta 5 días más tarde sin incidencias y 2 años más tarde permanece libre de enfermedad y sin disfunción ventilatoria (Fig. 3c).
Caso 4
Mujer de 55 años con tumor parietal a nivel de costillas cuarta, quinta y sexta, en la línea media anterior del hemitórax izquierdo y lesión asociada bajo el margen izquierdo del esternón por recidiva de carcinoma de mama, 5 años después de mastectomía izquierda. El estudio de extensión fue negativo. Realizamos resección de las costillas afectadas con margen de seguridad de 4 cm (Fig. 4 a y b). Realizamos la restitución parietal con una membrana de Gore-tex® sobre la que se repusieron dos arcos costales realizados son tubos de Gore-tex® rellenos de Craneoplastic® (Fig. 4 c) para reconstrucción costal. Finalmente efectuamos la reconstrucción con un colgajo de músculo recto abdominal pediculado, contralateral.
La paciente fue dada de alta de la UCI a las 48 horas de la intervención, sin incidencias. Permanece asintomática 2 años después, sin signos de recidiva de la enfermedad.
Caso 5
Mujer de 60 años con antecedentes de carcinoma de tiroides. Tras ser tratada durante 6 años, acude a consulta por presentar una tumoración en esternón, de 5 cm de diámetro, con infiltración de la tabla externa y de la esponjosa del hueso, compatible con metástasis ósea a dicho nivel (Fig. 5a). El estudio de extensión fue negativo. Realizamos resección del esternón en sus dos tercios superiores, desde las articulaciones esterno-costales. Tras resecar la pieza, se produjo un arrancamiento de la arteria y vena mamarias derechas, que tuvieron que ser ligados, con lo que los vasos mamarios izquierdos quedaron expuestos y descolgados. Varios de los vasos perforantes originados en la arteria mamaria izquierda tuvieron que ser ligados también.
La reconstrucción se realizó con un colgajo de músculo recto abdominal izquierdo con isla de piel vertical (VRAM). Optamos por disecar los vasos epigástricos inferiores profundos para intentar reforzar la perfusión y el drenaje del colgajo mediante suturas a los vasos mamarios derechos. De esta manera, tras rotar el colgajo hasta ubicarlo en el defecto del tórax, se realizaron anastomosis microquirúrgicas términoterminales, desde la arteria epigástrica inferior profunda al muñón de la arteria mamaria derecha, e igualmente se procedió con las venas (Fig. 5b). El músculo recto abdominal se suturó a los arcos costales para cierre óseo. La paciente fue dada de alta a planta al día siguiente de la intervención y a su domicilio 7 días más tarde (Fig. 5c). Un año después de la intervención, la paciente evoluciona favorablemente.
Caso 6
Mujer de 64 años intervenida en nuestro centro 5 años antes por sarcoma esternal; se realizó esternectomía y reconstrucción con placa de metacrilato colocada entre los arcos costales mediante sutura tras labrar orificios en sus bordes. La paciente acude a consulta por presentar un cuadro de malestar general, con fiebre intermitente en los últimos 4 meses. La tomografía computerizada (TAC) mostró una colección de material líquido bajo la placa de metacrilato, compatible con empiema (Fig. 6a).
Decidimos intervenir y retirar la placa de material aloplástico. Bajo la misma encontramos abundante material purulento, en cuyo cultivo se aisló un microorganismo anaerobio. La reconstrucción se efectuó con colgajo de epiplon basado en los vasos gastroepiploicos derecho e izquierdo (Fig. 6b) cubierto con un injerto de piel mallada. La paciente evolucionó sin incidencias y fue dada de alta a los 6 días de la intervención. No hubo recidiva tumoral local y las biopsias de los bordes fueron negativas. Las revisiones son satisfactorias desde entonces (Fig. 6c), cumpliendo 18 meses de evolución en el momento de redactar este trabajo.
Caso 7
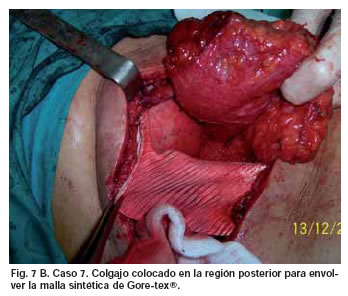
Mujer de 60 años con sarcoma osificante en la porción inferior de la región paraespinal derecha y afectación de 5 arcos costales, de 1 año de evolución. Se efectuó exéresis tumoral que originó un defecto de 10 por 15 cm, en la región posterior del tórax, que incluía la extirpación parcial de los arcos posteriores de 3 vértebras. La paciente recibió radioterapia intraoperatoria y a continuación se efectuó reconstrucción inmediata mediante plancha de Gore-tex® envuelta a modo de sandwich con colgajo de músculo recto abdominal, desepidermizado, con isla de piel horizontal, rotado intratorácicamente e introducido por una ventana realizada a nivel anterior de hemitórax derecho, sobre la octava costilla (Fig. 7a). La rotación permitió que el colgajo discurriera por encima del hemidiafragma derecho para cubrir sin incidencias la zona posteromedial (Fig. 7b y 7c). La paciente fue dada de alta a los 10 días de la intervención, sin incidencias. Tras 18 meses de postoperatorio, no hay signos de recidiva de la enfermedad y no hay alteraciones ventilatorias.
Caso 8
Mujer de 58 años que presentaba como enfermedad de base leucemia de 4 años de evolución, que precisaba de transfusiones de derivados hemáticos con cierta frecuencia. Tras presentar una síndrome constitucional en los últimos meses, se le había detectado una masa en pared costal derecha de 4 cm de diámetro, que fue diagnosticada de múcor (Fig. 8a).
Planteamos intervención quirúrgica para resecar la lesión con 3 cm de margen. Al estar situada en la proximidad de la línea axilar anterior, llevamos a cabo la reconstrucción con un colgajo de músculo dorsal ancho con isla de piel desepidermizada de 8 por 12 cm (Fig. 8b); se anclaron puntos de sutura desde los bordes costales hasta la dermis del colgajo, para así dar continuidad a la propia pared costal. La paciente recibió el alta hospitalaria una semana más tarde, sin problemas ventilatorios ni respiración paradójica. No han aparecido recidivas ni complicaciones tras 24 meses de seguimiento postoperatorio.
Discusión
La reparación torácica puede ser un proceso complejo desde el punto de vista reconstructivo y un desafío médico, pues exige en muchas ocasiones un abordaje multidisciplinar coordinado (1). Dada la rigidez de la pared torácica, los colgajos de gran tamaño son imprescindibles para aportar tejidos vascularizados que permitan reconstruir grandes defectos o rellenar espacios muertos. En muchos casos será necesario utilizar materiales aloplásticos para estabilizar la pared torácica y proteger las estructuras vitales contenidas en su interior (2-4).
La reconstrucción inmediata tras las grandes cirugía exeréticas del tórax se ha convertido en los últimos años en un procedimiento quirúrgico habitual, gracias a los avances en la ventilación mecánica y en el soporte vital de los pacientes, pero fundamentalmente, al desarrollo de técnicas de reconstrucción con colgajos y/o materiales sintéticos (4), contribuyendo así a prolongar su supervivencia.
En 1999 McCormak sentó tres principios básicos para el tratamiento de las lesiones torácicas de gran espesor: resección amplia de la lesión, restauración de la rigidez del tórax y cobertura del defecto con tejidos de buena calidad, independientemente del tamaño del defecto (5).
No obstante, antes de plantear una reconstrucción en estos pacientes, es necesario estudiarlos correctamente así como valorar su estado general y sus expectativas de curación, pues en la mayor parte de los casos hay que realizar intervenciones de gran complejidad, en las que se les somete a un fuerte estrés.
Las pérdidas de sustancia transfixiantes en tórax suelen tener como causa más frecuente resecciones tumorales amplias (2), tanto por tumores parietales primarios como por metástasis de otros procesos oncológicos, entre los que destaca el cáncer de mama. Normalmente estas resecciones afectan a todo el espesor de la pared torácica y requieren por tanto una restitución "ad integrum".
Otra de las causas principales de estos defectos mayores son los procesos infecciosos, generalmente en pacientes sometidos a cirugía cardíaca, por dehiscencia esternal con sobreinfección, o mediastinitis (6). Es muy habitual que ocurran en sujetos muy deteriorados, con patología de base importante. En todos ellos, la supervivencia es inversamente proporcional al número de días de ingreso en la unidad de reanimación.
El tercer grupo de pacientes lo forman los de origen traumático o como consecuencia de otras intervenciones torácicas.
En los casos de etiología tumoral, los márgenes de resección han de ser al menos de 4 cm en los tumores malignos y de 2 cm en las metástasis parietales o cuando se resecan tumoraciones benignas. El límite de resección en caso de infección estará determinado por la viabilidad de los tejidos al efectuar el desbridamiento.
Cuando resecamos menos de 3 arcos costales, en muchos casos es posible efectuar una aproximación directa de los bordes para reconstruir el defecto, pero cuando hace falta una reconstrucción esquelética, hemos de asegurar la estabilidad ósea y preservar los mecanismos que permiten la respiración, que son los que garantizan la recuperación a largo plazo (7).
Coincidiendo con otras series publicadas, denominamos defectos mayores a aquellos que comprenden una resección de más de 3 costillas o que tienen un diámetro mayor de 4-5 cm. No obstante, además del tamaño del defecto es importante su localización, porque la gravedad del problema de un defecto de 3 arcos costales es diferente si está en el mediastino, en la unión de los arcos costales con el diafragma o en la región posterior del tórax (8). Por esto, siempre se recomienda valorar la función respiratoria antes de intervenir.
La mayor parte de los defectos mayores requieren una reconstrucción mixta, mediante tejidos autólogos y materiales aloplásticos. Los materiales sintéticos son prioritarios en la actualidad para la reconstrucción del esqueleto torácico, pero durante muchos años se han empleado materiales autólogos como la fascia lata, el peroné o las costillas. Los ideales han de ser moldeables, maleables, inertes y radiotransparentes, además de proporcionar una rigidez capaz de estabilizar la pared torácica. Existen diversos tipos que se utilizan con asiduidad en la práctica quirúrgica; entre ellos destacan el Gore-tex®, el Marlex®, PTFE, Mersilene®, Vycril®, Prolene® o el metilmetacrilato. Este último se utiliza tanto en solitario como combinado con mallas de Marlex a modo de sandwich. Todos han demostrado ser efectivos (Casos 1, 4 y 7), y no parecen existir diferencias en el resultado reconstructivo final entre ellos (9, 10).
Como materiales aloplásticos utilizamos habitualmente láminas de Gore-tex®. En algunas ocasiones (Caso 4), hemos simulado la reconstrucción de los arcos costales con tubos de Dacron® rellenos de Craneoplastic®. Todos los pacientes fueron capaces de respirar espontáneamente tras la intervención.
En cuanto al empleo de colgajos, existe una amplia variedad que pueden ser empleados aisladamente o combinados para llevar a cabo la reconstrucción torácica tras una exéresis importante. La elección de los mismos dependerá de la localización del defecto, del tamaño, del arco de rotación del colgajo y de la posibilidad de efectuar colgajos libres, así como de la presencia de vasos receptores y/o del colgajo que sean seguros y que no se dañen en los procesos de radioterapia intraoperatoria o postoperatoria.
En nuestra experiencia, utilizamos habitualmente los colgajos presentados en las variantes clínicas descritas en el artículo. En los grandes defectos torácicos, el de primera elección en nuestras manos es el colgajo de músculo recto abdominal (11). Este colgajo puede ser disecado con una amplia isla de piel que puede ser utilizada con o sin epidermis. Permite además proporcionar un volumen amplio de tejido ricamente vascularizado, ideal para rellenar espacios muertos (Casos 3, 4, 5 y 7).
Galli et al. publicaron que el TRAM presenta propiedades adecuadas para la cobertura de tejidos sintéticos, y minimiza el riesgo de crear un tórax depresible con los movimientos respiratorios (12). No obstante, aunque este colgajo es ideal para reconstruir defectos centrales y laterales, presenta un arco de rotación menor que el que proporciona el colgajo de músculo dorsal ancho, ideal para la cobertura de defectos amplios en la región posterior del tórax.
Hemos presentado una variante innovadora del uso del TRAM; consiste en rotarlo por dentro de la cavidad torácica, para dar cobertura a defectos posteriores. La paciente presentada en esta serie (Caso 7), no presentaba signos de recidiva de la enfermedad ni alteraciones espirométricas 2 años después de la intervención (13).
En cuanto al músculo dorsal ancho, hemos presentado distintas alternativas, con y sin desepidermización del mismo (Casos 1 y 8). Aunque no proporciona un volumen amplio para relleno, la isla de piel proporciona una dermis fuerte, que permite realizar suturas entre ella y los márgenes quirúrgicos, con el fin de proporcionar un cierre hermético de la cavidad torácica, incluso sin emplear materiales sintéticos (14).
El colgajo de músculo pectoral (Caso 2) es una buena alternativa para reconstruir defectos centrales del tórax. Lo empleamos cuando queremos tratar dehiscencias esternales o mediastinitis de tamaño considerable, principalmente cuando hay que envolver estructuras orgánicas vitales para proporcionar una correcta cobertura antibiótica (15, 16). En el caso presentado (Caso 2), el éxito de la intervención radicó en el hecho de poder envolver el material protésico casi por completo.
Las infecciones del esternón suelen ocurrir entre un 0,5 y un 8,4 % de las intervenciones abiertas de corazón. Se trata de problemas complejos que tienen una tasa de mortalidad del 8,1 al 14,8 %. Por su parte, las heridas esternales suponen un problema complejo por su proximidad al corazón, los pulmones y la cavidad abdominal. Las estancias hospitalarias debido a estas complicaciones se sitúan alrededor de 30 días, aunque en ocasiones pueden ser mayores, con varias intervenciones sucesivas en pacientes cuyo estado general suele ser complicado y cuya edad es elevada. Por estas razones, el tratamiento y la detección precoz de las infecciones y dehiscencias esternales, supone un reto en el campo de la cirugía reconstructiva.
El colgajo de omento (Caso 6) no es de primera elección en este tipo de reconstrucciones, pero puede emplearse en caso de no disponer de otros recursos (17), o bien como colgajo de complemento, como se describe en el Caso 1. En nuestras manos, es de primera elección para defectos centrales del tórax, en infecciones esternales profundas. Su morbilidad asociada es uno de los principales inconvenientes, ya que incluso están descritas herniaciones del colon en el mediastino que han requerido resecciones segmentarias (18).
En último lugar nos gustaría destacar la utilidad e indicación de las técnicas microquirúrgicas en algunos de los casos presentados (Casos 3 y 5), como rescate en aquellas circunstancias en que la vascularización del colgajo pueda estar comprometida tanto por escaso aporte arterial como por insuficiente drenaje venoso (19, 20).
Al tratarse de pacientes con un importante deterioro y una elevada morbimortalidad asociadas, que precisan de reconstrucciones multidisciplinares en un solo tiempo quirúrgico para evitar al máximo complicaciones, en la mayoría de ocasiones recurrimos a colgajos pediculados regionales que permiten una reconstrucción estructural de calidad, inmediata y con un razonable tiempo quirúrgico. Los colgajos libres microquirúrgicos los emplearemos por tanto cuando los anteriores no estén disponibles, lo cual no impide que en ocasiones sea necesario recurrir a anastomosis microqurúrgicas en los colgajos regionales para garantizar el éxito de la cirugía.
Conclusiones
El tratamiento de los pacientes con defectos de gran complejidad en el tórax ha de ser personalizado, teniendo muy en cuenta su estado general y sus expectativas de vida. Los colgajos clásicos pediculados son fundamentales para proporcionar un tejido sano y bien vascularizado, que permita una restitución correcta de la zona dañada, y son ideales para recubrir zonas que requieran el uso de materiales aloplásticos de última generación.
Bibliografía
1. Losken A, VH. Thourani VH, Carlson GW et al.: "A reconstructivealgorithm for plastic surgery following extensive chest wall resection". Br J Plast Surg 2004;57: 295. [ Links ]
2. Arnold PG, Pairolero PC.: "Chest-wall reconstruction: an account of 500 consecutive patients". Plast Reconstr Surg 1996; 98: 804. [ Links ]
3. Cohen M, Ramasastry SS.: "Reconstruction of complex chest wall defects". Am J Surg 1996; 172:35. [ Links ]
4. Skoracki RJ, Chang DW.: "Reconstruction of the chest wall and thorax". J Surg Oncol 2006;94:455. [ Links ]
5. McCormack PM.: "Use of prosthetic material in chest wall reconstruction". Surg Clin North Am 1989; 69:96 [ Links ]
6. Immer FF, Durrer M, Mühlemann KS, et al.: "Deep sternal wound infection after cardiac surgery: modality of treatment and outcome". Ann Thorac Surg 2005;80:957. [ Links ]
7. Danino A, Saito S, Mamlouk K, et al.: "Reconstruction des pertes de substance totales transfixiantes du thorax par combinaison Gore Tex/Marlex/lambeau musculocutané. Étude rétrospective de 14 cas". Ann Chir Plast Esthet 2003;48:86. [ Links ]
8. Benzo L, Datta G, Pau S, Oliaro E, Mossetti C, Ruffini E, FilossoPL, Cristofori R, Oliaro A.: "Chest wall and hemidiaphragm reconstruction with Gore-Tex mesh and omolateral latissimus dorsi flap. A case report". Minerva Chir 2008;63:541. [ Links ]
9. Hameed A, Akhtar S, Naqvi A, Pervaiz Z.: "Reconstruction of complex chest wall defects by using polypropylene mesh and a pedicled latissimus dorsi flap: a 6-year experience". J Plast. Reconstr Aesthet Surg 2008;61:628. [ Links ]
10. Saour S, Shaaban H, McPhail J, McArthur P.: "Customized silicone prostheses for the reconstruction of chest wall defects: technique of manufacture and final outcome". J Plast Reconstr Aesthet Surg 2008;61:1205. [ Links ]
11. Miyamoto Y, Hattori T et al.: "Reconstruction of full-thicknesschest wall defects using rectus abdominis musculocutaneous flap: a report of fifteen cases". Ann Plast Surg 1986; 16: 90. [ Links ]
12. Galli A, Raposio E et al.: "Reconstruction of full-thickness defects of the thoracic wall by myocutaneous flap transfer: latissimus dorsi compared with transverse rectus abdominis". Scand J Plast Reconstr Surg Hand Surg 1995;29:39. [ Links ]
13. Seify H, Mansour K, Miller J, Douglas T, Burke R, Losken A, Culbertson J, Jones G, Nahai F, Hester TR.: "Single-stage muscle flap reconstruction of the postpneumonectomy empyema space: the Emory experience". Plast Reconstr Surg 2007;120:1886. [ Links ]
14. McGraw JB, Peniz JO y Baker JW.: "Repair of major defects of the chest wall and spine with the latissimus dorsi myocutaneous flap". Plast Reconstr Surg 1978; 62:197. [ Links ]
15. Arnold PG, Pairolero PC.: "Use of pectoralis major muscle flaps to repair defects of anterior chest wall". Plast Reconstr Surg 1979; 65:205. [ Links ]
16. Chang RR, Mehrara BJ, Hu QY, et al.: "Reconstruction of complex oncologic chest wall defects: a 10-year experience". Ann Plast Surg 2004 May;52:471. [ Links ]
17. Hultman CS, Culbertson JH, Jones GE. et al.: "Thoracic reconstruction with the omentum: indications, complications and results". Ann Plast Surg 2001; 46: 242. [ Links ]
18. Halldorsson A, Meyerrose G, Griswold J.: "Anterior mediastinal herniation of the transverse colon after an omental flap transposition". Am Surg 2007;73:367. [ Links ]
19. Li S, Mu L, Li Y, et al.: "Breast reconstruction with the free bipedicled inferior TRAM flap by anastomosis to the proximal and distal ends of the internal mammary vessels". J Reconstr Microsurg 2002;18:161. [ Links ]
20. Feng LJ.: "Recipient vessels in free-flap breast reconstruction: a study of the internal mammary and thoraco dorsal vessels" Plast Reconstr Surg 1997;99:405. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. José María Lasso.
Jefe de Sección de Microcirugía.
Cirugía Plástica y Reparadora.
Hospital Gregorio Marañón.
Área 3400. Dr Esquerdo 46, 28007 Madrid. España.