My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.36 n.2 Madrid Apr./Jun. 2010
"Doctor, tengo un bulto en la axila". Adenomegalia siliconomatosa postmamoplastia de aumento: a propósito de ocho casos
"Doctor I've a lump in the armpit". Silicone lymphadenopathy after breast augmentation: eight cases
Amorrortu, J.*, González de Vicente, R.**, Gallo, S.***, Folch, J.****, González Martínez, R.*****
* Profesor Asociado de Cirugía Plástica, Facultad de Medicina de la Universidad de Valencia. Cirujano Plástico del Consorcio Hospital General Universitario de Valencia. Cirujano Plástico Clínica Dual, Valencia (España).
** Cirujano Plástico. Clínica Dual, Valencia (España).
*** Profesor de Tecnología Sanitaria Instituto de Formación Profesional "Tierno Galván", Moncada, Valencia (España).
**** Especialista en Medicina Laboral. Medicina Estética Clínica Dual, Valencia (España).
***** Cirujano Plástico. Clínica Dr. González, Castellón (España).
Dirección para correspondencia
RESUMEN
La aparición de adenopatías axilares asociadas a mamoplastia de aumento mediante prótesis de silicona es un hecho infrecuente, no excepcional, y muy preocupante para paciente y cirujano. Hemos hecho una revisión de 1697 historias clínicas de pacientes sometidas a mamoplastia de aumento mediante prótesis de silicona al objeto de estudiar la relación entre roturas protésicas y adenopatías axilares
Las 1697 pacientes se dividieron en grupos que cumplían 1, 2, 3, 5 y 7 años de haber sido intervenidas. Revisamos sus historias clínicas y estudiamos las que con posterioridad a la cirugía habían consultado por sospecha de rotura protésica y adenopatías axilares.
No encontramos roturas protésicas antes de los 5 años de haber efectuado el implante. El porcentaje de roturas fue de 1,2% en el 5o año y el 2,3% a los 7 años. La aparición de adenopatías siliconomatosas se produjo en el 55% de las roturas detectadas en el 5o año y en el 61,6% de las roturas detectadas en el 7o año.
Diversos estudios han demostrado que los implantes mamarios se biodegradan con el paso del tiempo llevando, en un tiempo mas o menos largo, hacia su rotura. En algunos casos, la rotura de las prótesis mamarias rellenas de gel de silicona conduce a la aparición de adenopatías axilares. En ocasiones el síntoma primario de la rotura de la prótesis, especialmente cuando están rellenas de gel de alta cohesividad, es la aparición de adenopatías. Los cirujanos deberíamos pensar en mantener a nuestras pacientes bajo revisiones periódicas y en un programa de recambio de las prótesis.
Palabras clave: Mamoplastia, Prótesis de mama, Adenopatías axilares siliconomatosas.
Código numérico: 5211-525
ABSTRACT
Axillary lymphadenopathy associated with augmentation mammoplasty with silicone implants is a rare occurrence, not exceptional, and very worrying for patient and surgeon. We reviewed 1697 medical records of patients undergoing augmentation mammoplasty with silicone implants in order to study the relationship between implant rupture and axillary lymphadenopathy
The 1697 patients were divided into groups having 1, 2, 3, 5 and 7 years after surgery. We reviewed the medical records and studied those who consulted for suspected implant rupture and axillary lymph nodes
There were no implant rupture before 5 years after surgery. The percentage of rupture was 1.2% at 5 years and 2.3% at 7 years. Silicon lymphadenopathy occurred in 55% of the ruptures detected at 5 years and 61.6% of the ruptures detected at 7 years.
Several studies have shown that breast implants will biodegrade over time leading in a more or less long time to rupture. In some cases rupture of the mammary implant filled with silicone gel, leads to the appearance of axillary lymphadenopathy. Sometimes the primary symptom of rupture, specially when they are filled with high cohesiveness gel, is the appearance of lymphadenopathy. Surgeons should think about keeping patients under periodic reviews and in an implants exchange program.
Key words: Mammoplasty, Breast Implants, Axillary lymphadenopathy.
Numeral Code: 5211-525
Introducción
La Hiperplasia adenopática o adenomegalia, es una respuesta común del tejido ganglionar a la presencia, en una determinada área anatómica, de una gran variedad de materiales extraños para el organismo.
La adenomegalia siliconomatosa axilar es, por definición, un tipo de reacción tisular inducida por la presencia de silicona libre en el área anatómica tóracomamaria. No es en sí misma una enfermedad y sí una forma particular de reacción provocada por la actividad de las células inmunológicas, especialmente los monocitos, ante las partículas insolubles de silicona; debe por tanto considerarse como una respuesta biológica ante un cuerpo extraño. Adenomegalias de este tipo relacionadas con la migración de silicona desde diversos dispositivos protésicos, han sido consideradas a lo largo de los años como un hallazgo incidental de mínimas consecuencias (1).
La potencial aparición de alteraciones biológicas debidas a la fricción o rotura de las prótesis de mama con liberación de silicona provocó, a principio de los años 90, por parte de la Food and Drugs Administration (FDA) de los Estados Unidos, una moratoria a la utilización de prótesis mamarias por razones cosméticas (2). Esta situación de suspensión o moratoria se ha mantenido hasta hace muy poco tiempo (entre 1991 y 2006). En Europa el problema se visualizó de una manera diferente y los Ministerios de Sanidad tenían y tienen autorizado el uso de las prótesis de gel de silicona que utilizamos los cirujanos plásticos (Directiva 93/42/CEE del Consejo de junio de 1993).
En España y en toda la Unión Europea, desde el inicio de los años 90, existe la obligatoriedad de comunicar al Ministerio de Sanidad el número de prótesis implantadas, si bien este registro no es de dominio público y es difícil conocer las estadísticas oficiales del número de pacientes portadoras de implantes mamarios y mucho menos de la variedad, marca y fabricante de la que cada paciente es portadora. No existen referencias fiables del número de cirujanos que intervienen en la cirugía protésica de la mama y tampoco registro de las complicaciones relacionadas con las prótesis.
Las 2 empresas autorizadas en Estados Unidos para la fabricación y comercialización de prótesis mamarias reconocen (3,4) que entre las complicaciones del uso de las mismas se encuentra la posibilidad de rotura protésica y que esto ocurre en un porcentaje que se encuentra entre el 2 y el 6% en los 5 años siguientes a la implantación; por otra parte hay muchos autores como Peters et al (5), que refieren que la posibilidad de rotura de las prótesis se incrementa a lo largo del tiempo de vida útil de la misma, pudiendo alcanzar el 85 % después de los 12 años. La FDA, en su autorización del año 2006, exige a las empresas fabricantes que efectúen reuniones, cursos o simposios con los cirujanos que implantan prótesis de gel de silicona al objeto de explicarles el manejo y uso correctos de las prótesis que fabrican; al mismo tiempo, exige a los cirujanos que realicen control de la integridad de las prótesis mediante Resonancia Magnética (RM) a las pacientes a partir del tercer año de la cirugía y con una periodicidad posterior de 2 años durante todo el tiempo que sean portadoras de las mismas.
Material y método
Tomando como fecha de observación el 31 de Diciembre de 2007, revisamos 1697 historias clínicas de pacientes sometidas a mamoplastia de aumento entre el 1 de Enero de 1998 y el 31 de diciembre de 2006, de manera que completamos un periodo de 9 años de observación (Tabla I). Estudiamos las historias clínicas de cada año buscando las pacientes que hubieran sido reintervenidas por una rotura protésica, con y sin complicaciones añadidas (adenopatías axilares).
Las prótesis implantadas fueron en su práctica totalidad (94% = 1595 pacientes) redondas, rellenas de silicona cohesiva, con superficie texturada y volúmenes entre los 210 y los 430 cc.; habían sido implantadas por 4 cirujanos diferentes, de 3 grupos de trabajo y de 4 fabricantes también diferentes con especial predominancia de uno de ellos (75% = 1272 pacientes). Se buscó que las prótesis empleadas fueran lo más cercanas entre sí en cuanto a lote y número de serie.
La vía de abordaje para la implantación fue en el 75% (1271 pacientes) periareolar inferior; el plano de colocación fue en el 87% (1476 pacientes) submuscular, en el 10% (169 pacientes) submamario y en el 3% (51 pacientes) subfascial. En la revisión se incluyeron pacientes a quienes se les había efectuado mastopexia con cicatriz vertical corta complementada con aumento protésico (1% = 17 pacientes).
Exploración: las pacientes sospechosas de rotura protésica habían sido evaluadas, clínica e instrumentalmente, antes de la intervención de recambio. La exploración por imagen se hizo mediante ecografía en todas, que se complementó con RM en 6 pacientes en las que la ecografía no se consideró suficiente para establecer el diagnóstico.
Tratamiento Quirúrgico: las pacientes sospechosas de rotura protésica fueron reintervenidas quirúrgicamente para recambio protésico y extirpación de las adenopatías palpables. La intervención se efectuó bajo anestesia general y se utilizó para el recambio la misma vía de entrada empleada para el implante.
La extirpación de las adenopatías palpables se realizó mediante incisión axilar en la proximidad de las mismas y ligadura proximal y distal de los linfáticos. Las piezas extirpadas se remitieron para estudio a Anatomía Patológica (Fig. 1 y 2).

Fig. 1A: Mamoplastia de aumento, 7 años postoperatorio.
Pseudohipertrofia mamaria izquierda: rotura con líquido
periprotésico y adenomegalia axilar izquierda.

Fig. 1B: Mamografía (Izquierda y Derecha).
Adenopatía en la imagen superior.
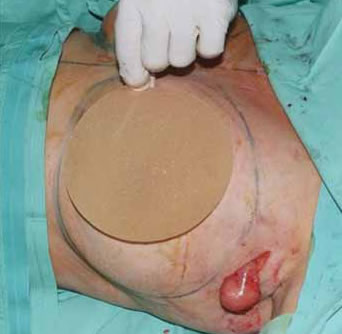
Fig. 1C: Extracción de prótesis y extirpación de la adenopatía axilar.

Fig. 1D: Punto de rotura protésica.

Fig. 2A: Mamoplastia de aumento, 5 años postoperatorio.
Sospecha de rotura protésica. Marcada con un círculo, adenopatía axilar.

Fig. 2B: Extirpación de adenopatía siliconomatosa.

Fig. 2C: Líquido periprotésico.

Fig. 2D: Línea de rotura del implante.
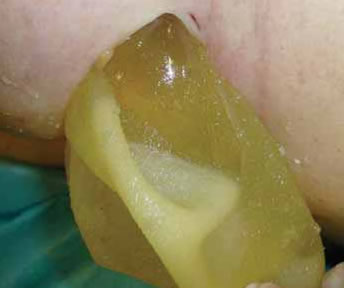
Fig. 2E: Extrusión del gel.

Fig. 2F: Gel cohesivo.

Fig. 2G: Prótesis derecha íntegra e izquierda rota:
prótesis PIP®, perfil alto, 310 cc.

Fig. 2H: Adenopatía extirpada.

Fig. 2I: Espacio periprotésico.

Fig. 2J: Sutura y drenaje.
Anatomía Patológica: el estudio microscópico de los ganglios linfáticos extirpados demostró una severa alteración de la arquitectura de los mismos con desaparición de la estructura germinal y gran ocupación del ganglio por células gigantes multinucleadas con vacuolas fagocíticas de silicona en su citoplasma. Gran parte de los ganglios se encontraban ocupados por múltiples vacuolas de aspecto vacío (Fig. 3).

Fig. 3A: Adenopatías fijadas. Imagen macroscópica.
Desestructuración ganglionar.

Fig. 3B: Corte histológico.

Fig. 3C: Vacuolas gigantes de silicona.
Tinción HE 20X.
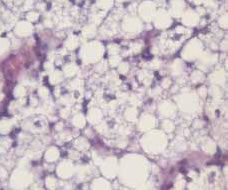
Fig. 3D: Células gigantes multinucleadas.
Vacuolas de silicona. Tinción HE 200X.
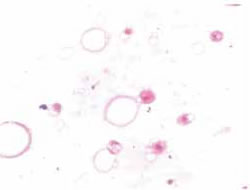
Fig. 3E: Frotis de liquido periprotésico; vacuolas de silicona
y células gigantes fagocitándola. Tinción HE 400X.
Resultados
Las pacientes con sospecha de rotura protésica, tenían cuando fueron intervenidas para mamoplastia de aumento, entre los 18 y los 45 años, con una edad media de 29 años (Tabla II).
De las 1697 historias clínicas revisadas, 543 pacientes habían cumplido 7 años con sus implantes puestos y 728 habían cumplido 5 años.
De las 543 pacientes con prótesis de 7 años, 17 habían consultado en el séptimo año por alteraciones en el área mamaria; 8 de ellas tenían adenopatías axilares palpables. Las 17 pacientes se diagnosticaron clínica y exploratoriamente (ecografía y/o RM) de deflagración o rotura protésica ( sospecha de rotura = 3,13% a los 7 años).
Estas 17 pacientes fueron intervenidas quirúrgicamente para recambiar la prótesis rota. Se confirmó la rotura en 13 de ellas y en 4, la prótesis no se encontraba rota (pacientes con rotura confirmada = 2,39% a los 7 años; falsos positivos = 0,73%). La rotura fue siempre unilateral.
Las adenopatías axilares palpables fueron extirpadas y analizadas histológicamente confirmándose la infiltración ganglionar por silicona. En cuanto a las adenopatías, las 8 se confirmaron en el grupo de 13 pacientes con confirmación de prótesis rota, por lo que la proporción de adenopatías en pacientes con rotura confirmada a los 7 años de ser portadoras de prótesis, fue del 61,5% (Tabla III).
De las 728 pacientes con prótesis de 5 años, 12 habían consultado en el quinto año por alteraciones en el área mamaria; 5 tenían adenopatías axilares palpables. Las 12 pacientes se diagnosticaron clínica y exploratoriamente (ecografía y/o RM) como deflagración o rotura protésica (sospecha de rotura = 1,6 % a los 5 años).
Las 12 pacientes fueron intervenidas quirúrgicamente para recambiar la prótesis rota. Se confirmó la rotura en 9 de las pacientes y en 3 no (pacientes con rotura confirmada = 1,2 % a los 5 años; falsos positivos = 0,8 %). La rotura fue siempre unilateral.
Las adenopatías axilares palpables fueron extirpadas y analizadas histológicamente confirmándose infiltración por silicona. En cuanto a las adenopatías, las 5 se confirmaron en el grupo de las 9 pacientes con confirmación de prótesis rota, por lo que la proporción de adenopatías en pacientes con rotura confirmada a los 5 años de ser portadoras de prótesis, fue de 55,5% (Tabla IV).
En todos los casos intervenidos se sustituyó la prótesis diagnosticada clínica y radiológícamente como rota, lo estuviera (positivo) o no (falso positivo).
Todas las pacientes sospechosas de rotura protésica tenían liquido periprotésico más o menos abundante, leucocitoclástico con contenido siliconomatoso en aquellas en las que la prótesis se confirmó como rota (Fig. 2C).
Una de las pacientes con rotura protésica a los 5 años sufrió rotura de la prótesis contralateral a los 7 años.
Doce de las 13 pacientes con rotura protésica y adenopatía axilar (8 del grupo 7 años y 5 del grupo 5 años), tenían colocada las prótesis en posición retropectoral y 1 en posición retroglandular.
Discusión
En general, la aparición de adenopatías axilares suele plantear en la paciente y en el médico un cierto grado de alarma por el riesgo de estar asociadas a patología tumoral mamaria. Cuando estas adenopatías aparecen en pacientes portadoras de implantes mamarios hay que establecer un diagnóstico diferencial con una entidad clínico-patológica conocida como adenopatía axilar siliconomatosa que se suele considerar una complicación indicadora de fallo en la integridad de las prótesis mamarias (rotura) (6).
El fallo en la integridad y las consecuencias del mismo fue en los Estados Unidos, la razón fundamental de la paralización entre los años 1991 y 2006, de la comercialización de las prótesis mamarias rellenas de gel de silicona (moratoria de la FDA) (2,7,8). Esta situación se interiorizó de una manera diferente en otros países y en la Comunidad Económica Europea y Canadá, los organismos reguladores de control de biomateriales (EQUAM en Europa, MHRA en Canadá) (9), continuaron autorizando al poco tiempo las prótesis mamarias (Canadá con restricciones) y apostando por una evolución de los biomateriales que de hecho ya estaba ocurriendo.
El tiempo trascurrido desde los años 60 ha hecho que las prótesis mamarias rellenas de silicona evolucionen mejorando el continente y contenido de las mismas (10). En la práctica hemos pasado de los 90 al 2007 de la 2a-3a generación de prótesis a la 6a-7a y hoy las prótesis son de una cubierta de silicona multicapa con mínima o nula capacidad de filtración, superficie lisa o rugosa, con un contenido de silicona en forma de gel más o menos cohesivo y con diseños más adaptables a la estructura anatómica.
En el momento actual, levantada la moratoria, la FDA exige a las compañías autorizadas para la comercialización en Estados Unidos (Mentor® e Inamed®), unos riesgos mínimos en el producto y un control exhaustivo en el seguimiento de las pacientes, de manera que se garantice un control de la rotura del producto y de la liberación de la silicona. Este organismo, como dijimos en la introducción, exige que el seguimiento de las prótesis se efectúe sometiendo a la paciente a una exploración mediante RM cada 2 años a partir del tercero de la implantación y a la obligatoriedad de explantación o recambio de la prótesis en el caso de rotura. También, la FDA pide que se explique al paciente que el diagnóstico de ruptura mediante RM tiene una fiabilidad del 89%. En Europa y Canadá el planteamiento es algo diferente y se recomienda, en caso de sospecha de rotura, la exploración del paciente mediante mamografía sin excluir la RM si el médico la considera necesaria.
Los estudios de los fabricantes, en los que se basa la autorización reciente de la FDA, indican que en los 3 años siguientes a haber recibido el implante (implante primario) se producirá un fallo en la integridad del mismo de entre 0,5% (Mentor®) y 2,02% (Inamed®). El porcentaje de fallo para implantes secundarios se encuentra entre el 3% (Inamed®) y 7,7% (Mentor®) (3,4).
Las prótesis utilizadas en las pacientes de nuestro estudio eran en un 75 % (1271 pacientes) de un fabricante y del mismo modelo, en un 25% (424 pacientes) de 3 fabricantes y modelos diferentes. Las roturas se han dado en todas las marcas usadas, sin embargo el número de pacientes e implantes colocados de cada marca y modelo no permite una comparación entre ellas.
El fallo en la integridad del implante, o rotura del mismo, puede ser intracapsular o extracapsular y producirá una liberación mayor o menor del contenido en los alrededores del implante. En la ruptura intracapsular, la silicona que sale de la prótesis quedará en el interior de la cápsula conjuntiva periprotésica y en la extracapsular se situará fuera del complejo prótesiscápsula en contacto directo con los tejidos del área mamaria o músculo-costal. Las roturas protésicas extracapsulares tienen un alto potencial de migración o captación linfática de la silicona pudiendo producirse granulomas en el área tóraco-mamaria y/o adenopatías axiliares siliconomatosas. Schnur et al.(1996) (9), encuentran que los niveles de silicona en el tejido capsular periprotésico son significativamente elevados en las pacientes portadoras de implantes mamarios rellenos de silicona aunque las prótesis se encuentren indemnes; si existe una rotura intracapsular los niveles de silicona están elevados también en el tejido mamario. Holmich y colaboradores (2001) (10), hallan que inicialmente 3 de cada 4 rupturas (75%) son intracapsulares y 1 de cada 4 (25%) son extracapsulares. Estos mismos autores, en un estudio posterior (2004) (11), observan que a lo largo de los 2 años siguientes al diagnóstico de rotura intracapsular, el 10% evolucionarán a extracapsulares y éstas conducirán a la aparición de linfadenopatías, granulomas o nódulos inflamatorios en los meses posteriores. Lo esperado sería que el porcentaje de roturas protésicas continúe aumentando conforme trascurren los años desde la intervención, pudiendo alcanzar según diversos estudios, a más del 80 % de las pacientes a los 12 años de haber sido colocados los implantes (12,13).
En nuestra revisión hemos encontrado que las pacientes con un seguimiento de 5años tienen roturas entre el 1,08 % y el 1,5 % (media 1,2%) y a los 7 años entre el 1,1 % y el 5,4 %. (media 2,3 %) (Tablas III y IV). Estos porcentajes son coincidentes con los estudios de rotura protésica hallados en la revisión bibliográfica. Es evidente que las roturas aumentarán conforme más tiempo se lleve con los implantes.
Desde el punto de vista de las causas de la rotura, los participantes en el grupo de expertos del Ministerio de Sanidad Canadiense afirman que "el daño producido a la prótesis durante el procedimiento quirúrgico es la causa principal del 75% de las roturas". En nuestra opinión, es probable que el factor procedimiento quirúrgico tenga mucha importancia si el cirujano no tiene entrenamiento en la técnica del manejo de prótesis, pero no podemos dejar de pensar que existen otros factores como la fricción y el rozamiento producidos durante la manipulación postinplantacional (masajes), la posición (retromamaria, retrofascial, retromuscular) en que se encuentra colocada la prótesis (mayor o menor contención) y la dinámica muscular o rozamiento interno que soporta la prótesis a lo largo de su vida útil (movimiento manual, laboral, deportivo, etc.).
Está demostrado, desde los años 70 a la actualidad (1, 11-13), que la rotura protésica intracapsular evolucionará a extracapsular y ésta a su vez producirá captación linfática, con la aparición de adenopatías axilares siliconomatosas (14-17). En nuestro grupo de pacientes con rotura protésica, entre el 50 y el 66% de ellas, cuando nos consultaron, tenían ya adenopatías y todas las pacientes superaban los 5 años de haber sido implantadas (Tablas III, IV y V). El que nos consulten o detectemos una adenitis siliconomatosa es, como dice Austad (18) "una cuestión de tiempo y número de pacientes intervenidos". Según el mismo autor, el cirujano plástico, una vez superada la curva de aprendizaje de la mamoplastia de aumento, necesita efectuar y controlar entre 400 y 600 pacientes con prótesis mamarias para casi tener la seguridad de que se encontrará con esta complicación. Efectuando mamoplastias de aumento con una técnica adecuada, practicando control regular de las pacientes y recomendando el recambio protésico con la periodicidad de la vida media de las prótesis que nos indica el fabricante y/o los organismos reguladores, es posible que transcurra toda nuestra vida profesional sin haber visto una adenitis siliconomatosa. También es posible que permaneciendo 20 años en ejercicio como cirujano plástico, con un promedio de 100 intervenciones de mamoplastia de aumento al año (2000 en 20 años o más), con generaciones diferentes de prótesis implantadas y bajo control de seguimiento de las pacientes, éste sea un problema al que nos enfrentemos en bastante más de 10-12 ocasiones si como ya hemos visto, estudios con RM ponen de manifiesto hasta un 95 % de roturas a los 10,8 años con un intervalo de confianza de 8,4 a 13,9 años (19), o como afirma McLaughlin (20) y colaboradores recientemente en 2007, hay que esperar una tasa de rotura del 2% a los 5 años y del 15-17% a los 10 años.
Es evidente que el bleding, sudoración o trasudación de la silicona desde la prótesis, ha ido siendo cada vez menos frecuente conforme han evolucionado las prótesis de la primera generación de los años 60-70, a la quinta o sexta generaciones de los años 2000 (cubierta multilaminar con barrera antifiltración, texturización de la superficie y silicona de mediana o alta cohesividad); también ha mejorado el riesgo de contractura capsular por la texturización de la superficie de las prótesis y el posicionamiento retromuscular de las mismas. Por el contrario, la demanda social y la cada vez mayor incorporación de la mujer a un mundo socio-laboral global, ha hecho aumentar por 200 ó 300 el número de procedimientos quirúrgicos de mamoplastia de aumento y también ha aumentado el tamaño de los implantes que les colocamos a nuestras pacientes; sin lugar a dudas, los implantes se ven obligados a soportar una dinámica de rozamiento mucho más intensa. Estos dos últimos hechos, tamaño y dinámica, producen un aumento en la fatiga del material con un mayor desgaste de la superficie de la prótesis (fricción dinámica) y liberación de partículas de silicona desde la superficie de la misma. Quienes han recambiado prótesis mamarias seguramente habrán observado, ocasionalmente, en algunas partes de la cubierta un mayor desgaste de la superficie de la misma con desaparición parcial de la texturixación, lo que es un indicador de microliberación de partículas de silicona (9). El rozamiento y la basculación de la prótesis producidos por el movimiento muscular (repetición y carga) pueden, además de suavizar la texturización y modificar el posicionamiento (giros en el eje vertical y horizontal de la prótesis), inducir un encapsulamiento más rígido, pliegues en la prótesis, seroma tardío, rotura protésica y adenitis siliconomatosa.
Las empresas fabricantes de prótesis mamarias, a lo largo de casi 50 años de experiencia y estimuladas por los organismos reguladores y de control de biomateriales, han modificado y mejorado progresivamente el diseño, continente y contenido de las prótesis. También estas mismas empresas, conocedoras de la vida media de su producto, han impulsado políticas comerciales tendentes a favorecer el recambio protésico en las pacientes trascurridos unos años de haberse efectuado el primer implante (implante primario); como ejemplo se puede citar la política, de en caso de rotura, sustituir la prótesis por otro dispositivo similar (mismo volumen) sin costo y proporcionar una cantidad de dinero a la paciente (1200 dólares - 1000 euros), como contribución para este segundo procedimiento, o el impulsar políticas de empresa que con un costo adicional, aseguran el recambio de las prótesis trascurridos 5, 8, ó 10 años. La visión del fabricante o comercial de las prótesis no es en la mayoría de las ocasiones coincidente con la visión del cirujano plástico; mientras que para los primeros el problema es el de una prótesis que se ha roto, para el cirujano plástico afecta a una paciente portadora de 2 prótesis a quien, en el mejor de los casos, se le ha roto una prótesis después de x años (rotura simple o de primer nivel) y en el peor, tiene además una complicación médica relacionada con la prótesis (rotura complicada o de segundo nivel). El fabricante o distribuidor está dispuesto a sustituir o negociar la sustitución de una prótesis, mientras que el cirujano se encuentra en la mayoría de las veces con la necesidad de sustituir ambas, para sincronizar el recambio y conseguir que la paciente sea portadora de prótesis de la misma generación y edad.
La aparición de adenopatías siliconomatosas como consecuencia de la filtración o rotura de una prótesis mamaria requiere un enfoque distinto al de una rotura simple y hay que considerarla como una rotura protésica complicada o de segundo nivel. Esta rotura, cuando se diagnostica, tiene una visión diferente tanto para la paciente como para el médico. La fuga o escape de silicona a áreas perimamarias o linfáticas necesita un tratamiento quirúrgico más complejo que el recambio de la prótesis. Además de recambiar la/s prótesis habrá que extirpar el área afectada por la filtración de silicona en el tejido periprotésico (granuloma o siliconoma) y /o efectuar una adenectomía siliconomatosa. El seguimiento clínico de una de estas situaciones es más complejo y hay que asumir la probabilidad de no haber resuelto el problema del todo; nos podemos encontrar unos meses más tarde con la aparición de algún acumulo de silicona residual o silicona en transito que requerirá un nuevo tratamiento quirúrgico.
En la relación fabricante de prótesis, distribuidor, cirujano y paciente, la rotura protésica complicada no está resuelta satisfactoriamente para todos los implicados, el fabricante y el distribuidor pretenden abordarla como una rotura protésica simple (sustitución de prótesis por rotura); el cirujano y la paciente tienen la necesidad de enfocarla como un problema que va más allá de la cirugía plástica estética de la mama.
Creemos que en caso de rotura de la/s prótesis de gel de alta cohesividad es posible que la forma de la mama no se vea alterada, el control radiológico no lo efectuemos o nos de negativo (85 % de fiabilidad para la RM) y que detectemos la rotura cuando la paciente nos consulta por adenopatías axilares siliconomatosas. Esta circunstancia, pensamos que será cada vez más frecuente en el futuro.
Conclusiones
De los resultados de esta revisión podemos deducir que:
- El biodesgaste de los implantes de silicona los conduce inexorablemente a la rotura.
- Considerando el grado de cohesividad del gel de silicona y la estructura de las prótesis, el escape del gel más allá de la cápsula periprotésica es difícil de detectar clínicamente.
- Con prótesis de última generación, el fallo en la integridad de las mismas puede debutar tarde en el tiempo y manifestarse clínicamente con adenopatías axilares siliconomatosas.
- Considerando la actividad laboral y social de las pacientes, la integridad de las prótesis de silicona comienza a ser dudosa después de los 5 años de haber sido implantadas, e insegura después de los 10 años.
- Necesitamos mantener a las pacientes dentro de un protocolo de seguimiento que debe durar mientras sean portadoras de prótesis.
- Las pacientes que se intervienen a edades tempranas, deben ser estimuladas al recambio protésico cada más o menos 10 años.
Bibliografía
1. van Diest, P.J., Beekman,W.H., and Hage, J.J.: "Pathology of silicone leakage from breast implant"s. J. Clin. Pathol. 1998; 51(7): 493. [ Links ]
2. Kessler, D.A: "The basis of the FDA's decision on breast implants". N Engl J Med. 1992; 326(25):1713. [ Links ]
3. www.fda.gov/cdrh/pdf2/P020056d.pdf [ Links ]
4. www.fda.gov/cdrh/pdf3/p030053d.pdf [ Links ]
5. Peters, W.J.: "Factors affecting the rupture of silicone-gel breast implants". Ann. Plast. Surg 1994; 32:449. [ Links ]
6. Truong, L.D., Cartwright, J., Goodman, M.D., and Woznick,i D.: "Silicone lymphadenopathy with augmentation mammoplasty. Morphologic features of nine cases". Am. J. Surg. Pathol. 1988; 12:484. [ Links ]
7. http://www.fda.gov/cdrh/breastimplants/. [ Links ]
8. http://www.secpre.org/pdf/EQUAMConsDec 14-7-04 FINAL.pdf [ Links ]
9. Schnur, P.L., Weinzweig, J., Harris, J.B.,et al: "Silicon Analysis of Breast and Periprosthetic Capsular Tissue from Patients with Saline or Silicone Gel Breast Implants". Plas. Reconstr, Surg. 1996, 98(5):798. [ Links ]
10. Holmich, L.R., et al.: "Prevalence of silicone breast implant rupture among Danish women". Plast. Reconstr. Surg. 2001; 108(4):848. [ Links ]
11. Hölmich, L.R., et al.: "Untreated silicone breast implant rupture". Plast. Reconstr. Surg. 2004; 114:20. [ Links ]
12. Robinson,O.G., Bradley, E.L., and Wilson, D.S.: "Analysis of Explanted Silicone Implants, A Report of 300 Patients"., Ann. Plast. Surg.1995; 34: 1. [ Links ]
13. Goldberg, E.P., Widenhouse, C., Marotta, J., and Martin, P.: "Failure of Silicone Gel Breast Implants: Analysis of Literature Data of 1652 Explanted Prostheses", Plast. Reconstr. Surg.1997; 100: 281. [ Links ]
14. Argenta, L.C.: "Migration of silicone gel into breast parenchyma following mammary prosthesis rupture". Aest. Plast. Surg. 1983;. 7: 253. [ Links ]
15. Peters, W.J.: "The rupture of silicone-gel breast implants". Ann Plast Surg 1994; 33:462. [ Links ]
16. Truong, L.D., Cartwright, J Jr., Goodman M.D., Woznicki D.: "Silicone lymphadenopathy associated with augmentation mammaplasty. Morphologic features of nine case"s. Am. J. Surg. Pathol. 1988 Jun;12(6):484. [ Links ]
17. Katzin, W. E., Ceneno, J. A., Feng, Lu-Jean et a.: "Pathology of Lymph Nodes From Patients With Breast Implants: A Histologic and Spectroscopic Evaluation". Am. J .Surg. Pathol. 2005;29 (4): 506. [ Links ]
18. Austad, E.D.: "Breast Implant-Related Silicone Granulomas: The Literature and the Litigation". Plast. Reconstr. Surg. 2002;109(5):1724. [ Links ]
19. Cook, R., Bowlin, S., Curtis, J. M. et al.: "Silicone Gel Breast Implant Rupture Rates: Research Issues"., Ann. Plast. Surg. 2002; 48(1):92. [ Links ]
20. McLaughlin, J K. , Lipworth, L S., Murphy, D K. et al.: "The Safety of Silicone Gel-Filled Breast Implants: A Review of the Epidemiologic Evidence". Ann Plast Sugr. 2007; 59(5):569. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Dr. Jorge Amorrortu Velayos.
Clínica Dual
C/ Colón no 4, 2o
46004 Valencia (España)
e-mail: jorgeamorrortu@hotmail.com
Comentario al trabajo "Doctor, tengo un bulto en la axila. Adenomegalia siliconomatosa postmamoplastia de aumento: a propósito de ocho casos"
Dr. Guillermo Peña Cabús
Director del Capítulo de Biomateriales FILACP (2002-2012). San Pedro Sula, Honduras
El artículo de Amorrortu y cols., aparentemente presenta una serie bastante corta de pacientes con rotura de implantes mamarios, sin embargo resulta ser sumamente válida como significativa al considerar el amplio contexto de pacientes estudiado por los autores. Si la casuística resulta corta, es porque es real y ajustada a la realidad conocida y documentada. Con un título que resulta muy llamativo nos invita a presenciar una exposición muy clara, útil y de fácil lectura, que de manera importante nos conduce a la reflexión sobre nuestra práctica habitual. Debe destacarse en este artículo la expuesta importancia de la buena práctica y del adecuado seguimiento de casos clínicos, para proveer respuestas que sustenten la constante necesidad de mejoría de servicios en la Especialidad. La discusión en el artículo invariablemente orienta a prestarle mucha atención a conocer mejor un biomaterial ampliamente utilizado y sus implicaciones prácticas que obligan a ciertas reflexiones generadas por el artículo y planteadas a continuación.
La rotura de un implante mamario o fallo de integridad de cubierta, puede ser vista desde diferentes ángulos. Puede ser considerada una complicación de nuestro procedimiento efectuado, como también ser en realidad, la ocurrencia de un evento anticipado en el espectro de tiempo de la vida útil del biomaterial utilizado. En la serie presentada, asumiendo que no existieron cambios en la técnica quirúrgica por la época (1998-2006), sí es posible que en realidad se hayan utilizado implantes de características fisicoquímicas que pudieran condicionar comportamientos diferentes entre si; sin embargo ese detalle no resta importancia práctica alguna a los resultados planteados. Los elastómeros de silicona producidos en las últimas dos décadas para los implantes mamarios, han cambiado mucho sus características intrínsecas y en consecuencia su biotolerancia. El elastómero empleado para producir la cubierta del implante tiene que ser de grado médico, algo que significa ser de manera comprobada inerte y con escasa o nula respuesta tisular de defensa. La cubierta del implante está constituida con una proporción sumamente baja de componentes de bajo peso molecular (CBPM), que son los contaminantes responsables de ocasionar la respuesta inflamatoria sostenida. El gel de silicona se sabe que está constituido por una mayor proporción de contaminantes de CBPM, en comparación con el empleado en la cubierta del implante y su exposición a los tejidos desencadena una mayor respuesta inflamatoria de defensa. La adenopatía resultante no es más que la respuesta tisular de defensa. Sin condiciones de carcinogénesis demostrada, resulta ser entonces, una condición no maligna, por lo cual se debe bajar el nivel de alarma entregado a las pacientes con su hallazgo. Es sin embargo posible que la elevada polimerización que produjo el incremento en la cohesividad del gel, también redujo la respuesta inflamatoria al reducir los CBPM que la incitaban.
En este artículo se mencionan dos importantes detalles prácticos: la texturización de la superficie de los implantes y la fricción ocasionada con los tejidos circundantes. La texturización se desarrolló con el objetivo de producir estabilidad posicional por adherencia al tejido circundante. De no ocurrir adherencia, invariablemente ocurre fricción y la consecuente posibilidad de seromas ocasionados por lubricantes producidos por la conocida metaplasia vellosa sinovial circundante alrededor de implantes móviles. Por esta y única razón, se evita rutinariamente, el masaje con implantes de superficie texturizada.
El otro punto de interés en este artículo es que relaciona la importancia de las estructuras linfáticas con la implantación mamaria de aumento. Con un aumento proporcional, se considera el diámetro anatómico disponible y de esa manera se preservan las rutas linfáticas que se encuentran en el nivel suprafascial pectoral; la axila entonces es mantenida como el nivel linfático receptor. Lo contrario ocurre si los linfáticos se interrumpen durante la colocación con disección amplia en el plano subglandular para colocar implantes de mayor diámetro que el permitido por la anatomía de la paciente; la redirección de linfáticos ahora va a crear un giro anatómico hacia la ruta endotorácica en lugar de hacia la axila, algo que en realidad se convierte en un mayor riesgo para la paciente. Esto invariablemente tiene connotaciones de importancia oncológica y debemos mantenerlo en mente para cada caso que se presente. El dilema se relaciona con dos eventos, el diámetro anatómico disponible y el hecho de escoger el diámetro acorde del implante a colocar. Ambas condiciones son consecuentemente, responsabilidad del cirujano a cargo.
El punto de pivote móvil y la formación de un punto de debilidad de cubierta (fold flaw theory) ha sido ampliamente demostrado como el sitio preferencial de rotura para los implantes de alta deformabilidad (movilidad interna), es decir los de gel no cohesivo o de solución salina. A eso se refiere acertadamente en el artículo, como la fatigabilidad del biomaterial de silicona. El mantenimiento de forma y la reducción de formación de pliegues y pivotes posibles de ruptura, es ahora la regla de fabricación aceptada con la alta cohesividad del gel interno.
El punto crucial del artículo es cuando enfatiza que el implante utilizado tiene una vida útil, similar y sin diferencia, como todo lo utilizado en Medicina y que la adenopatía axilar puede ser el único signo detectable para un implante roto y expuesto a los tejidos circundantes; esto es algo conclusivo y muy real con los biomateriales disponibles en la actualidad. Acertadamente se presenta el hecho de que los cirujanos debemos enfrascarnos en el mantenimiento de una ejecución técnica apropiada, sin embargo los biomateriales propuestos y aceptados así como su comportamiento y biotolerancia, son responsabilidad exclusiva del productor.
Agradezco a la Directora de nuestra Revista la oportunidad de encargarme hacer comentarios sobre un artículo tan sobrio, útil, como muy bien elaborado, de tal manera que debe ser considerado como una base sustanciada de aprendizaje y soporte fundamental de la práctica clínica.
Respuesta al comentario del Dr. Guillermo Peña Cabús
Dr. Jorge Amorrortu Velayos
Debo agradecer al Comité Editorial de Cirugía Plástica Iberolatinoamericana y especialmente a la Dra. Ma del Mar Vaquero que, tras varias revisiones, la publicación quedase finalmente como ha quedado. También debo agradecer seguramente a la Directora la, desde mi punto de vista, acertada elección del comentarista.
Debo decir que es un honor que el Dr. Guillermo Peña Cabús, Director del Capitulo de Biomateriales de la FILACP, aceptara comentar este articulo y que además lo haya leído y sentido casi exactamente como nos gustaría que lo vieran y sintieran todos los lectores del mismo
El Dr. Peña, como excelente profesional que es y conocedor del comportamiento de los biomateriales, ha visionado perfectamente la lectura indirecta de aspectos esbozados en el artículo como ideas subliminales o sutiles pinceladas: una de las ventajas de las prótesis texturadas es su mayor posibilidad de fijación e integración y hay que permitir que esto ocurra eliminando los masajes tempranos. El masaje temprano facilita el seroma periprotésico desde las microvellosidades de la cápsula periprotésica. En muchas ocasiones cuando recambiamos las prótesis de una paciente, encontramos pequeños contenidos de líquido periprotésico que semeja un líquido sinovial con contenido leucocitoclástico; y también en ocasiones muchos cirujanos hemos tenido pacientes con seromas tardíos, lejanos en el tiempo (más de 2 años después de la intervención) cuyo mecanismo de producción es probablemente el despegamiento friccional repetitivo de la cápsula periprotésica de prótesis de superficie texturada (mucha mayor fricción cuando están en un plano retromuscular).
También el Dr. Peña, nuestro comentarista, ha visionado que el eje central del trabajo está en el título mismo, "Doctor tengo un bulto en la axila", y la relación de este "bulto" con las prótesis de mama que porta la paciente. El Dr. Peña, magnífica pero también tímidamente, ve y comenta la posibilidad de que después de la adenectomía axilar: "la redirección de linfáticos ahora va a crear un giro anatómico hacia la ruta endotorácica en lugar de hacia la axila, algo que en realidad se convierte en un mayor riesgo para el paciente". Nosotros no nos atrevimos ni siquiera a eso y lo dejamos en la posibilidad de: "la aparición de algún acumulo de silicona residual o silicona en tránsito que requerirá un nuevo tratamiento quirúrgico", pero en nuestra mente está la permeación transtorácica mediastínica después de un bloqueo parcial o total de los linfáticos axilares. Creímos que hablar de esto podía ser conflictivo. Gracias Dr. Peña por ver prácticamente lo mismo.
Hemos echado de menos algún comentario sobre la vida útil de las prótesis, y sobre una de nuestras conclusiones: "considerando la actividad laboral y social de las pacientes, la integridad de las prótesis de silicona comienza a ser dudosa después de los 5 años de haber sido implantadas, e insegura después de los 10 años"; porque esto hubiera dado lugar a que insistiéramos en que nosotros recomendamos a nuestras pacientes (sobre todo las que se intervienen entre los 18 y los 25 años de edad) que después de los 5 años del procedimiento deben mantener un control anual con su cirujano y si tienen posibilidades piensen en el recambio protésico profiláctico cada 10 años.
Sinceramente, gracias Dr. Peña, gracias Dra. Vaquero.


















