My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.36 n.3 Madrid Jul./Sep. 2010
Estado actual de las terapias con células madre derivadas de tejido adiposo en el ámbito de la Cirugía Plástica
The state of the adipose-derived stem cell therapies in Plastic Surgery
Lasso, J.M.*; Cortina, E.**; Goñi, E.***; Arenas, L.***; Nava, P.****; Fernández, M.E.*****; Pérez Cano, R.******
* Jefe de Sección, Servicio de Cirugía Plástica y Reparadora.
** Especialista visitante, Servicio de Cirugía Plástica y Reparadora.
*** Médico Interno Residente, Servicio Cirugía Plástica y Reparadora.
**** Bióloga de la Universidad de Investigación y Regeneración Titular del Servicio de Cirugía Plástica y Reparadora.
***** Bióloga, Directora Sala Blanca y Terapia Celular.
****** Jefe del Servicio de Cirugía Plástica y Reparadora.
Hospital General Universitario Gregorio Marañón. Madrid (España).
Dirección para correspondencia
RESUMEN
Durante la última década, la terapia celular ha emergido como una estrategia útil en el tratamiento de diversas enfermedades como la isquemia miocárdica y las fístulas en la enfermedad de Crohn; pero últimamente, hay también ya líneas de investigación centradas en su uso en reconstrucción mamaria, cuyos resultados van siendo publicados paulatinamente. Existen varios tipos de células madre adultas que han sido investigadas en estudios preclínicos y clínicos diseñados para este propósito: células de medula ósea, células del sistema circulatorio y mioblastos y, recientemente se está trabajando en una población de células madre en el tejido adiposo, que presentan una fácil extracción y manipulación. Estas células son capaces de diferenciarse en múltiples líneas celulares, como los adipocitos y las células endoteliales entre otras. En el presente artículo, trataremos de hacer una revisión de los principios básicos de las células madre derivadas del tejido adiposo (tipos, características, procesos de obtención y multiplicación), los primeros estudios experimentales y los ensayos clínicos que están siendo realizados en la actualidad.
Palabras clave: Células madre, Terapia celular, Tejido adiposo.
Código numérico: 19
ABSTRACT
Over the past decade, cell therapy has emerged as a new approach to reverse several diseases as myocardial ischemia and fistula in Crohn disease; but lately new efforts are centered in breast reconstruction. Several types of adult stem cell have been studied in both preclinical and clinical condition for this purpose: bone marrow cells, circulating cells, and myoblasts. Recently the existence of a population of stem cells located in the adipose tissue has been observed. These cells are able to differentiate into multiple cell lineage including adipocytes and endothelial cells. In this review we discuss the basic principle of adipose-derived stem cell (types, characteristic, harvesting and expansion), the initial experimental studies and the currently ongoing clinical trials.
Key words: Stem cells, Cellular therapy, Adipose tissue.
Numeral Code: 19
Introducción
Durante los últimos años, en el campo de la Cirugía Plástica y Reconstructiva, se vienen desarrollando una serie de avances tecnológicos y quirúrgicos que abren la puerta hacia el alcance de uno de los paradigmas de la Cirugía Plástica: la utilización de tejidos generados artificialmente con el fin de reparar zonas dañadas de la anatomía, sin tener que recurrir a zonas donantes.
Tal vez uno de los avances más prometedores en este campo es el uso de las células madre (CM) como fuente ideal de células capaces de regenerarse gracias a su multipotencialidad y habilidad para replicarse y originar tejidos viables. Por tanto, las terapias basadas en CM para la reparación y regeneración de diferentes órganos y tejidos podrían ser el principio de un nuevo enfoque de soluciones terapéuticas para diferentes enfermedades.
No obstante, no todas las CM son directamente útiles en la medicina regenerativa. Aunque las células madre embrionarias y las células madre pluripotenciales son, de forma teórica, altamente beneficiosas, existen varias limitaciones a su uso debido a las propias regulaciones celulares, así como a consideraciones éticas y manipulación genética (1).
Las células madre adultas sin embargo, se obtienen de una manera más sencilla y no presentan consideraciones o restricciones de tipo ético o inmunorreactivo, debido a que su origen está en el tejido autólogo. Quizás, incluso su obtención en un futuro no lejano, se haga desde bancos de tejidos y de células. Los primeros estudios con células madre adultas se centraban en células madre mesenquimales aisladas del estroma de la médula ósea, el cual ha demostrado poseer potencial adipogénico, osteogénico, condrogénico, miogénico y neurogénico in vitro. Sin embargo, la obtención de CM de esta fuente es dolorosa para los pacientes y provee un reducido número de células (2).
Últimamente se han desarrollado procesos de obtención de células madre adultas desde el tejido adiposo, mediante simple lipoaspiración. El tejido adiposo es rico en este tipo de células y su obtención es más fácil que desde la médula ósea. Aunque existe algún debate sobre si las CM se originan en el tejido graso o sin tal vez son mesenquimales, o quizás son CM de sangre periférica pasando a través de la grasa tisular, está demostrado que representa una fuente de obtención rápida de CM potencialmente útiles. Estas células han sido denominadas generalmente Células Madre Derivadas del Tejido Adiposo (Adipose-Derived Stem Cells: ASCs) (3).
Según Gimble, una CM que sea aplicada en medicina regenerativa ha de reunir las siguientes características: 1 - Encontrarse en gran cantidad (millones a billones de células); 2 - Extraerse mediante procedimientos sencillos; 3 - Diferenciarse en múltiples líneas celulares de una forma regulada y reproducible; 4 - Poder ser trasplantada de manera sencilla y eficaz en un huésped autólogo y alogénico; 5 - Ser manufacturada de acuerdo a los requisitos de la Good Manufacturing Practice (4).
Células madre derivadas del tejido adiposo
Tipos y Características
Está demostrado que las células madre mesenquimales (Mesenchymal Stem Cells: MSCs), tienen una habilidad inherente para autorrenovarse, proliferar y diferenciarse hacia tejidos maduros dependiendo del microambiente que las rodea. Tales características, intrínsecas a todas las CM, las hacen muy atractivas para su uso en terapia celular y en medicina regenerativa. Originalmente se creía que estas células se encontraban exclusivamente en la médula ósea, donde residen los progenitores y precursores hematopoyéticos junto con otras células que proveen un soporte estructural para la hematopoyesis: el estroma de la médula ósea. Sin embargo, también se ha demostrado la presencia de estas células en el tejido graso (5).
El tejido adiposo ha sido considerado una de las zonas donantes más atractivas debido a su fácil obtención mediante un simple lipoaspirado y la alta cantidad de células que se pueden aislar. Además, el aislamiento de células madre mesenquimales del tejido adiposo (Fig. 1) es un proceso sencillo y fácilmente reproducible, con un resultado óptimo; por ello, las zonas grasas parecen desbancar a la médula ósea como fuente de obtención de CM.
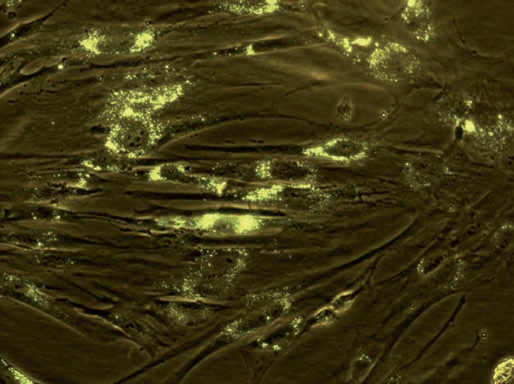
Fig. 1. Células mesenquimales marcadas con DiI, 10 días después de
ser extraídas de la paciente no 4 del estudio RESTORE.
En los mamíferos, existen dos tipos de tejido adiposo: la grasa parda (GP) y la grasa blanca (GB). La GP funciona como un órgano disipador de energía, mientras que la GB sirve como principal reservorio de energía del organismo. También se ha demostrado que la fracción vascular obtenida de la grasa inguinal (grasa blanca) posee una inmensa facilidad para diferenciarse en osteoblastos, células endoteliales, adipocitos, células hematopoyéticas y cardiomiocitos, en comparación con la fracción vascular derivada de la GP. Por lo anteriormente señalado la GB tiene una gran población de CM, lo que la convierte en una zona donante óptima para la terapia celular (6).
Con el aumento de la incidencia de obesidad en los países desarrollados, los cúmulos subcutáneos de grasa también son mayores; además, los cirujanos plásticos están muy familiarizados con la técnica de liposucción y son capaces de obtener, incluso bajo anestesia local, cantidades pequeñas de grasa para procesar (Fig. 2). Esto hace que la extracción de CM de esta procedencia sea poco costosa y tenga una baja morbilidad cuando el personal que manipula la grasa está familiarizado con la técnica. Se considera que, de 1 gr. de tejido adiposo, se pueden obtener 5 x 103 CM, lo que supone una cantidad mayor de células de las que se obtienen de la médula ósea.

Fig. 2. Grasa abdominal recién obtenida, antes de comenzar el proceso
de extracción de las células madre.
En los primeros datos obtenidos en humanos se ha detectadotambién un mayor número de CM en la regiónperiumbilical que en la de los flancos. Parece incluso evidenteque la densidad de CM derivadas de la grasa es mayor en el tejido abdominal que en los trocánteres (7).
No obstante, hay quienes señalan que ni el tipo de procedimiento quirúrgico empleado, ni la localización anatómica de la cual se obtiene la grasa (abdominal, subcutánea, o subcutánea periférica), afecta al número total de células viables obtenidas de la fracción estromal e indican que parece cierto que factores tales como la edad, tipo de tejido adiposo y condiciones de cultivo (incluyendo el medio, tipo de plástico, concentración celular, etc.) pueden afectar a la capacidad de diferenciación y proliferación de ASCs (8). En los estudios realizados en el hospital Gregorio Marañón, el hecho de realizar extracciones en varones para regeneración miocárdica y en mujeres para reconstrucción mamaria, ha permitido demostrar una mayor proporción de CM en el abdomen de las mujeres con respecto al de los varones.
A pesar de los grandes avances que se realizan en la actividad clínica, todavía no existe un acuerdo claro acerca de la nomenclatura utilizada para describir las células progenitoras del estroma del tejido adiposo, lo cual genera confusión en los foros científicos. Los términos Células Estromales Derivadas del Tejido Adiposo (Adipose Tissue-Derived Stromal Cell: ADSC), Células de la Fracción Vascular de la Grasa (Adipose Stromal-Vascular Cell Fraction: SVF) y Células Regeneradoras Derivadas de la Grasa (Adipose-Derived Regenerative Cells: ADRCs) corresponden a células obtenidas inmediatamente después de la digestión del tejido adiposo por colagenasas.
Por el contrario, los términos Células Provenientes del Lipoaspirado (Processed Lipoaspirate Cells: PLA) y Células Madre Derivadas del Tejido Graso Adherentes al Plástico (Plastic-Adherent Adipose-Derived Stem Cells: ASCS) describen a aquellas CM obtenidas después de cultivar las anteriormente mencionadas.
Como término unificador, podemos referirnos a estos tipos celulares como Células Madre Derivadas del Tejido Adiposo (Adipose-Derived Stem Cells: ASCs) de acuerdo con el Consenso de La Sociedad Internacional de la Tecnología Aplicada a la Grasa (International Fat Applied Technology Society Consensus) (9); sin embargo, las propiedades de las células frescas sin cultivar distan bastante de las que presentan las que han sido sometidas a cultivos, siendo estas últimas células, en principio, de menos calidad en la reconstrucción de tejidos.
La Sociedad Internacional para la Terapia Celular (International Society for Cell Therapy: ISCT) define los siguientes criterios mínimos para ser consideradas ASCs:
1. Adherencia al plástico en condiciones estándar de cultivo.
2. Fenotipo positivo (>95%): CD105, CD73, CD90 Fenotipo negativo (<2%): CD45, CD34, CD14 o CD11b, CD79α o CD19, y HLA-DR.
3. Diferenciación in vitro: osteoblastos, adipocitos, condroblastos (demostrados por tinción de cultivo celular in vitro).
La aceptación y generalización del uso de estos mínimos criterios por los científicos ayudaría a estandarizar protocolos usados en la obtención de células y en la caracterización de cada tipo celular, con lo cual aseguraríamos una progresión más eficiente de los estudios preclínicos y clínicos (Tabla I).
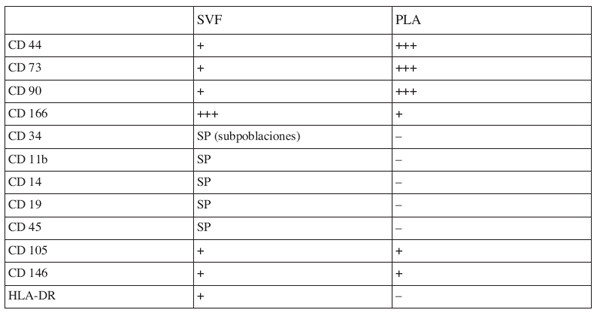
Tabla I: Características de la superficie celular de las células madre derivadas del tejido
adiposo, en los dos estadíos de diferenciación: fracción vascular del estroma (SVF)
y lipoaspirado procesado (PLA).
Extracción y expansión
Existen diversos protocolos de expansión y diferenciación para las células obtenidas del tejido adiposo, que permiten obtener una gran variedad de resultados. Normalmente las ASCs, se usan tras una digestión con colagenasas, lo que se identifica como Fracción Vascular Fresca del Estroma (SVF) o después de un proceso de expansión con 3 ó 4 pases de cultivo, en cuyo caso se denominan Células del Lipoaspirado Procesadas (PLA). No obstante, hay estudios preclínicos en los que se han utilizado subpoblaciones de la SVF, como por ejemplo, los preadipocitos.
El método de aislamiento de las SVF es una versión modificada de la de Zuk; Se realiza un tratamiento de la grasa con colagenasas de 30 a 60 minutos, en condiciones de agitación constante. La solución obtenida se centrifuga a baja velocidad durante 10 minutos y se filtra el resultante por una malla de nylon de 40-200 micras. La nueva solución se centrifuga otra vez y las células se resuspenden en un nuevo medio de expansión. Es importante tener en cuenta que este procedimiento ha de efectuarse en condiciones de extrema esterilidad (Fig.3).

Fig. 3. Resuspensión del concentrado de células madre procedente
de 250 cc. de grasa abdominal.
En la expansión de las PLA, se cuentan las células nucleadas de la SVF y se valora su viabilidad. Posteriormente estas células son cultivadas en un medio de expansión con DMEM (Dulbecco´s Modified Eagle´s Medium) al 10% y antibióticos. Los cultivos han de mantenerse en una incubadora a 37 oC y una concentración de CO2 del 5%. Las células que no presentan adherencia se retiran entre las 12 a 24 horas. El medio se cambia 2 veces por semana. Pueden repetirse hasta un total de 4 pases.
Rubio ha demostrado que las ASCs pueden sufrir una transformación maligna cuando se realizan más de 4 pases prolongados. Este fenómeno implica que las células frescas pueden ser más seguras que las que han sido cultivadas (10).
Uso preclínico de las células madre derivadas de adipocitos
A lo largo de los últimos años se han realizado numerosos estudios preclínicos que confirman la utilidad de las CM derivadas de la grasa en la regeneración de determinados tejidos, incluso sin aplicarlas en animales de experimentación. Mizuno demostró la regeneración in vitro del tejido adiposo mediante ASCS con técnicas de inmunofluorescencia, después de 8 semanas (11).
En extremidades isquémicas de ratas, la administración tanto intramuscular como endovenosa de ASCs aumentó la vascularización. Este hecho se produjo tanto por la diferenciación de las mismas en células endoteliales, como por su secreción de factores de crecimiento (12).
En estudios realizados en colgajos, la necrosis originada por un inadecuado aporte sanguíneo es una complicación común. La población de CM en el tejido adiposo posee un potencial angiogénico elevado, lo que podría contribuir en el tratamiento preventivo y efectivo de los colgajos; en este sentido se han desarrollado trabajos en ratones en los que se prueba que mejora la viabilidad de colgajos randomizados de piel. Hay autores que han constatado que el mecanismo de prevención de la necrosis podría deberse a la diferenciación directa de las CM derivadas de tejido adiposo en células endoteliales o por un efecto indirecto debido a la liberación de factores de crecimiento angiogénico (13), al igual que en las extremidades isquémicas.
También se ha probado su eficacia en la cicatrización de úlceras mediante aplicación tópica, así como en ulceras en ratones diabéticos (14).
En cirugía periodontal o en la regeneración del hueso craneal se han obtenido también resultados satisfactorios, incluso en la regeneración de la pared miocárdica después de un infarto (15).
Aplicaciones clínicas y estudios en marcha
Al contrario que en los estudios preclínicos, la investigación en humanos con las ASCs ha sido menos explorada, aunque en los últimos años están surgiendo ensayos clínicos cuyos resultados habrá que evaluar muy detenidamente. A pesar de ello se habla continuamente de las CM en Cirugía Plástica, sin evidencia científica, ni datos rigurosamente constatados mediante estudios serios.
Las CM se han empleado inicialmente para estimular la reparación ósea en defectos importantes de cráneo y en la curación de fístulas crónicas en pacientes con enfermedad de Crohn (este último fue un estudio clínico en fase I en pacientes con fístulas que no respondían a tratamientos médicos. La curación completa se logró en el 75% de los casos) (16).
En el estudio PRECISE (ensayo clínico patrocinado por la empresa privada Cytori) que se ha desarrollado en el Hospital Gregorio Marañón en Madrid (España), mediante colaboración de los Servicios de Cardiología y Cirugía Plástica junto con el Centro Hospitalario Thoraxcenter de Rótterdam (Holanda), supone una esperanza en el uso de estas células para mejorar el rendimiento funcional en pacientes con infarto crónico de miocardio. Se trata de un estudio que comenzó en el año 2007, prospectivo, doble ciego, randomizado, que incluyó 36 pacientes. Los primeros resultados se han presentado en el 7th International Symposium on Stem Cell Therapy and Cardiovascular Innovations celebrado en Mayo de 2010. En este ensayo clínico, se extrajeron CM procedentes del tejido adiposo, que fueron inyectadas en el espesor del miocardio infartado. Mediante un mapeo de diferencia de potenciales con la técnica NOGA, se identificó con exactitud la zona infartada del corazón, de manera que, mediante cateterismo, se realizaron inyecciones intramiocárdicas de las CM procedentes de la grasa. Estas células inyectadas se encontraban en suspensión y eran células frescas, que no habían recibido ningún pase o expansión. En dicho Simposium se presentaron resultados que demuestran la mejoría de la calidad de vida de estos pacientes tratados.
La transferencia de ASCs combinadas con grasa libre ha desempeñado un papel importante en el mantenimiento del volumen de grasa inyectada (17). Estas células también se están aplicando en Cirugía Plástica para promover el mantenimiento del tejido graso autólogo trasplantado para aumentar el volumen mamario en pacientes sometidas a cuadrantectomía mamaria, mediante una tecnología similar a la empleada en el estudio PRECISE. Aunque existe un precedente en Japón, donde se realizó un estudio para regenerar tejido mamario después de resección parcial de la mama, no existen resultados publicados a largo plazo, por lo que el primer ensayo clínico multicéntrico a nivel mundial es el que se está llevando a cabo en Europa (Estudio RESTORE). Quizá en el futuro este tipo de técnica podría ser un accesorio importante en los procesos de reconstrucción mamaria.
En España, el estudio RESTORE está siendo realizado en el Hospital General Universitario Gregorio Marañón, junto con otros 5 centros europeos localizados en Reino Unido, Italia, Bélgica y Francia. En este último país se centralizan las pruebas de imagen realizadas enlas pacientes, sobre las que se evaluará la seguridad y la eficacia del tratamiento. Se trata de un estudio de fase IV, en el que se practican rellenos de cuadrantectomías mamarias con grasa autóloga enriquecida con CM de origen mesenquimal procedentes de la grasa abdominal (Fig. 4).
Fig. 4. Grasa abdominal centrifugada y desfragmentada, que está enriquecida
con el concentrado de células madre, antes de ser utilizada en una zona
de cuadrantectomía mamaria.
Dicho estudio está llegando a su fase final y los primeros resultados se han presentado en Julio de 2010 en el Simposium Winchester / Jersey Masterclass in Oncoplastic Breast Surgery and Modern Concepts: Breast Aesthetics & Reconstruction Symposium celebrado en Coventry (Reino Unido). La selección del hospital Gregorio Marañón se efectuó por la experiencia previa de su Servicio de Cirugía Plástica en el estudio RESTORE y por el amplio volumen de pacientes con cáncer de mama que a lo largo del año pasan por este Servicio. En este estudio europeo se incluyeron 70 pacientes con cuadrantectomía mamaria y un período libre de enfermedad de más de 2 años. Las pacientes no podían tener un estadío tumoral mayor de T2,N0,M0. En el protocolo de estudio, se rellenaron los defectos de las cuadrantectomías mediante grasa autóloga enriquecida con CM autólogas, frescas, mediante intervención ambulatoria realizada en dos tiempos: un primer tiempo de extracción celular y procesado celular y un segundo tiempo de relleno de la mama.
Las pacientes fueron sometidas a Resonancia Nuclear magnética (RNM) previa a la intervención y después de 12 meses, para valorar la morfología y calidad radiológica de la reconstrucción. En los criterios de inclusión se insistió de manera prioritaria en la necesidad de valorar la seguridad de las pacientes en todo momento. Los resultados valoran la satisfacción de las pacientes, la de los facultativos y los resultados volumétricos clínicos y radiológicos de manera objetiva.
Existen trabajos que tienen por objetivo aumentar el volumen de la mama mediante inyección de grasa autóloga, en los que reiteradamente se comunica que en la grasa procesada va una cantidad consistente de células madre mesenquimales que se diferencian espontáneamente en preadipocitos y posteriormente se convierten en adipocitos que compensan el volumen perdido. Sus autores concluyen que el tejido graso inyectado tiene el mismo potencial de acción que las células adultas pluripotenciales, pero no cuantifican de modo alguno la cantidad de CM que ejercen esta acción. Por ello es conveniente ser prudentes a la hora de hablar de la inyección de grasa en la mama y no utilizar gratuitamente el término "células madre". No obstante hay autores que han publicado los efectos adversos producidos al emplear estas técnicas, puesto que no se garantiza una correcta vascularización de la grasa injertada (18).
Actualmente se están aplicando también para una gran variedad de indicaciones cosméticas y reconstructivas: defectos postraumáticos de cara y cuerpo, desordenes involutivos tipo atrofia hemifacial, etc. Sin embargo, se recomienda variar la estrategia de relleno con grasa autóloga mediante un enriquecimiento de la propia grasa con células adiposas progenitoras. Los resultados preliminares sugieren que este tratamiento es efectivo y seguro (19).
Pero el uso de CM en Cirugía Reconstructiva no está exento de problemas éticos y legales. Sabemos que existe un tipo de células llamadas Tumor Initiating Cell o Cancer Stem Cells (CSC), cuya presencia está demostrada en algunas líneas celulares de cáncer de mama. Según esta hipótesis, ciertos tumores estarían producidos por células cuyas propiedades coinciden con las de las CM: autorrenovación, teratogenicidad y deferenciación multilinear, lo cual podría explicar la heterogenicidad del cáncer de mama. De hecho, los tumores mamarios que expresan la molécula de superficie CD44, pero no expresan la CD24, se clasifican como tumores derivados de las CSC. Esto obligaría a replantear el abordaje de estos tumores y a modificar las líneas de actuación (20).
No obstante, dado que no se conoce con profundidad la interacción que estas CSC pueden tener con las ASCs, es importante destacar que el uso de las mismas ha de ser siempre controlado, procurando que las actuaciones sobre los pacientes estén dentro de ensayos clínicos, puesto que es la manera efectiva y legal de obtener resultados fiables y reproducibles con esta nueva forma de tratamiento, sin descuidar la seguridad de los pacientes y valorando la posibilidad de que se puedan producir efectos adversos que deben ser comunicados a las autoridades sanitarias.
Conclusiones
Las ASCs han emergido como un nuevo y prometedor tipo de CM con dos claras ventajas sobre las células de la médula ósea, sangre o músculo esquelético anteriormente utilizadas. Las CM derivadas del tejido adiposo tienen una manera fácil y reproducible de tratamiento, lo que permite su obtención en grandes cantidades por un método mínimamente invasivo, así como un potencial proliferativo incrementado para expandirse en cultivos, ya sea debido a las propiedades de las células o como resultado de una mayor frecuencia de CM dentro de la población usada al inicio del cultivo.
Existen algunas preguntas científicas y médicas relacionadas con las CM que necesitan encontrar respuesta antes de su aplicación clínica sistemática. Una de ellas es el desarrollo a gran escala de técnicas de procesamiento de acuerdo a los requerimientos de las Buenas Prácticas de Producción (Good Manufacturing Practices, GMP). Esto permitirá determinar cómo manipular, almacenar y moldear las ASCs, siempre bajo condiciones GMP para evitar la contaminación.
Un punto interesante, que merece una investigación preclínia profunda, es la inmunogenicidad de las ASCs. Como hemos observado, clase I y II del complejo mayor de histocompatibilidad se expresan en solo el 1% de ASCs y por lo tanto, se ha hipotizado sobre que estas células podrían comportarse como células donantes universales y por tanto, podrían ser usadas para trasplantes autólogos y alogénicos. Otra propiedad interesante de estas células es su capacidad de producir un efecto inmunosupresor, lo que podría ser utilizado para control de la enfermedad injerto contra huésped.
Bibliografía
1. Takahashi K, Yamanaka S: "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors". Cell 2006; 126: 663. [ Links ]
2. Ferrari G, Cusella-De Angelis G, Coletta M, et al.: "Muscle regeneration by bone marrow-derived myogenic progenitors". Science 1998; 279: 1528. [ Links ]
3. Zuk PA, Zhu M, Mizuno H, et al.: "Multi-lineage cells from human adipose tissue: implication for cell-based therapies". Tissue Eng 2001; 7: 211. [ Links ]
4. Gimble JM: "Adipose tissue-derived therapeutics". Expert Opin Biol Ther 2003; 3: 705. [ Links ]
5. Villaron EM, Almeida J, Lopez-Holgado N, et al.: "Mesenchymal Stem cells are present in peripheral blood and canengraft after allogeneic hematopoietic stem cell transplantation". Haematologica 2004; 89: 1421. [ Links ]
6. Prunet- Marcassus B, Couisn B, Caton D. et al.: "From heterogeneiti to plasticity in adipose tissues: Sitespecific differences". Exp Cell Res 2006; 312: 727. [ Links ]
7. Almeida KA, Campa A, Alonso-Vale MIC, et al.: "Fracción vascular estromal de tejido adiposo: cómo obtener células madre y su rendimiento de acuerdo a la topografía de las áreas donantes: estudio preliminar". Cir.plást.iberolatinoam. 2008; 34: 71. [ Links ]
8. Dicker A, Le Blanc K, Aströmg G, et al.: "Functional studies of mesenchymal stem cells derived from adult human adipose tissue". Exp Cell Res 2005; 308: 283. [ Links ]
9. Dominici M, Le Blanc K, Mueller I, et al.: "Minimal critering for definig multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement". Cytotherapy 2006; 8; 315. [ Links ]
10. Rubio D, García-Castro J, Martín MC, et al.: "Spontaneous human adult stem cell transformation". Cancer Res. 2005;65:3035. [ Links ]
11. Mizuno H.: "Adipose-derived Stem Cells for Tissue Repair and Regeneration: Ten Years of Research and a Literature Review". J Nippon Med Sch 2009;76: 56. [ Links ]
12. Rehman J, Traktuev D, Li J, et al.: "Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells". Circulation 2004; 109: 1292. [ Links ]
13. Lu F, Mizuno H, Uysal AC, et al.: "Improved viability of random pattern skin flaps through the use of adiposederived stem cells". Plast Reconstr Surg 2008; 121: 50. [ Links ]
14. Nambu M, Ishihara M, Nakamura S, et al.: "Enhanced healing of mitomycin C-treated wounds in rats using inbred adipose tissue-derived stromal cells within an atelocollagen matrix". Wound Repair Regen. 2007; 15: 505. [ Links ]
15. Watanabe C T, Lee S, Daniela E, et al.: "Intracoronary adipose tissue-derived stem cell preserves left ventricular function in a porcine infarct model". 2004; 94 (suppl I): 188E. [ Links ]
16. García-Olmo D, García-Arranz M, García LG, et al.: "Autologus stem cell transplantation for treatment of rectovaginal fistula in perinanal Crohn´s disease: a new cellbased therapy". Int J Colorectal Dis, 2003,18:451. [ Links ]
17. Timothy A. Moseley, Min Zhu, Marc H.: "Adipose-Derived Stem and Progenitor Cells as Fillers in Plastic and Reconstructive Surgery". Plast Reconstr Surg. 2006; 118: 121S. [ Links ]
18. Hyakusoku H, Ogawa R, Ono S, et al.: "Complications after autologous fat injection to the breast". Plast Reconstr Surg 2009;123:360. [ Links ]
19. Yoshimura K, Suga H, Eto H.: "Adipose-derived stem/progenitor cells: roles in adipose tissue remodeling and potential use for soft tissue augmentation". Regen Med 2009; 2:265. [ Links ]
20. Charafe-Jauffret E, Monville F, Ginestier C, et al.: "Cancer stem cells in breast: current opinion and future challenges". Pathobiology 2008;75:75. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. José María Lasso
Cirugía Plástica y Reparadora. Edificio Central. Área 3400
Hospital General Universitario Gregorio Marañón.
Dr Esquerdo 46. 28007. Madrid (España).
e-mail: jlasso.hgugm@salud.madrid.org














