Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.37 no.2 Madrid abr./jun. 2011
https://dx.doi.org/10.4321/S0376-78922011000200014
Efecto protector de la toxina botulínica en colgajos cutáneos
The protective effect of botulinum toxin on skin flaps
Astudillo Carrera, C.X.*
* Médico Residente. Instituo Jaliscense de Cirugía Reconstructiva "Dr. José Guerrerosantos". Guadalajara, México.
Trabajo galardonado con el Primer Premio del Concurso de Residentes "Dr. José Barba Rubio "del 37 Simposio Anual Internacional de Cirugía Plástica-Estética del Instituto Jaliscense de Cirugía Reconstructiva Dr. José Guerreosantos, celebrado en Guadalajara, México, Noviembre de 2010, y con el Primer Premio del XL Concurso Nacional de Residentes "Dr. Fernando Ortiz Monasterio" del XLII Congreso Nacional de la Asociación Mexicana de Cirugía Plástica, Estética y Reconstructiva celebrado en Zacatecas, México, Mayo de 2011.
Dirección para correspondencia
RESUMEN
Los colgajos cutáneos de patrón vascular randomizado son de gran utilidad en Cirugía Reconstructiva; un aporte vascular adecuado es el factor más importante para la supervivencia de los mismos. Realizamos un estudio experimental levantando un total de 36 colgajos en el dorso de 9 conejos (4 en cada conejo): a) 9 controles, b) 9 con aplicación de toxina botulínica tipo A transoperatoria a lo largo del colgajo, c) 9 con toxina botulínica tipo A aplicada 7 días antes del procedimiento quirúrgico, y, d) 9 con aplicación de toxina botulínica tipo A transoperatoria más epinefrina.
El análisis de los colgajos se realizó a través de imágenes digitales que se examinaron con el programa ImageJ. Efectuamos el análisis estadístico con la prueba T de Student. La evaluación final de los colgajos se realizó al séptimo día, tiempo en el cual se obtuvo: a) una media de área necrótica en los controles del 72.17 ± 3.9% ; b) en los que se aplicó toxina botulínica transoperatoria el porcentaje de aérea necrótica fue del 5.09 ± 1.2% p = 0.032; c) en aquellos en los que la toxina botulínica se aplicó 7 días antes del procedimiento se reportó necrosis del 24.97 ± 2.7% p = 0.041 y d) en los que se aplicó toxina botulínica transoperatoria más epinefrina el porcentaje de necrosis fue del 23.90 ± 3.9% p = 0.045. Concluimos que la toxina botulínica tipo A actúa como protector contra el proceso de sufrimiento-isquemia de los tejidos, debido a su acción vasodilatadora, recomendando su aplicación al inicio del procedimiento quirúrgico.
Palabras clave: Toxina botulínica, Supervivencia colgajos cutáneos, Epinefrina.
Código numérico: 1583-263
ABSTRACT
Random-pattern cutaneous flaps are very useful in Reconstructive Surgery; an adequate vascular contribution is an important factor for the survival of the flaps. We designed an experimental study elevating a total of 36 dorsal flaps, divided in 4 groups: a) 9 were controls, to which 0.9% physiological solution was applied, b) 9 with a transoperatory application of type A botulinum toxin throughout the length of the flap, c) 9 with an application of type A botulinum toxin 7 days before surgery and d), 9 with type A botulinum toxin with epinephrine applied transsurgery in all the flap.
The skin flaps were analyzed 7 days after surgery with Image J program and the T Student test. We take a medium of the necrotic area: a) for the controls of 72.17 ± 3.9%, b) botulinum toxin transsurgery 5.09 ± 1.2% p = 0.032, c) botulinum toxin applied 7 days before 24.97 ± 2.7% p = 0.041 and d) botulinum toxin with epinephrine 23.90 ± 3.9% p = 0.045. We conclude that botulinum toxin acts as a protector against the suffering process - ischemia of the tissues, thanks to its vasodilator action and that it should be applied in the beginning of the surgical procedure.
Key words: Botulinum Toxin, Skin flap survival. Epinephrine.
Numeral Code: 1583-263
Introducción
Los colgajos cutáneos de patrón vascular randomizado son fundamentales en Cirugía Reconstructiva; su aporte vascular es muy importante ya que su alteración se traduce en necrosis que perjudica el resultado del procedimiento quirúrgico. Se han desarrollado técnicas de soporte, como el retardo de los colgajos en varios tiempos quirúrgicos (1); el uso de agentes farmacológicos sean simpaticolíticos, vasodilatadores, bloqueadores de los canales de calcio, agentes hemorreológicos, prostaglandinas, anticoagulantes, esteroides, etc, cuyo inconveniente es el requerir dosis altas que pueden provocar respuestas sistémicas secundarias e importantes efectos adversos (2); electroacupuntura; aplicación de agentes tópicos con resultados limitados, como el nicoboxil y la nitroglicerina, entre los más destacados (3).
En los últimos años se ha evidenciado un avance importante y satisfactorio con la utilización de la toxina botulínica en muchos aspectos médicos tanto estéticos, como reconstructivos y funcionales, lo que ha llevado a estudiar con mayor profundidad sus mecanismos de acción encontrando efectos de interés en su aplicación clínica.
Desde que Van Emengem (Bélgica) en 1895 aisló por primera vez el Clostridium Botulinum y desde su primera aplicación clínica por Scott en 1977, el uso de la toxina botulínica se ha acrecentado en la medicina (4,5). Su mecanismo de actuación es ampliamente conocido (6) y el inicio del efecto tiene lugar entre las 6-36 horas tras la inyección, logrando su efecto máximo entre los 7 y los 14 días.
El resultado clínico está directamente relacionado con la dosis aplicada y debe ajustarse para cada caso concreto. La toxina botulínica A se obtiene en el mercado en presentaciones de 100 UI y 500 UI, donde 1 unidad se define como la dosis media letal intraperitoneal para ratones Webster suizos (LD50). La dosis indicada es de 14-60ng/kg (LD50 = 420-1800).
Como fármaco ha demostrado que es seguro. La difusión de la toxina y la paralización de los grupos musculares adyacentes a la inyección representan el efecto adverso más frecuente. Está contraindicado el tratamiento con toxina botulínica en caso de que exista una enfermedad neuromuscular (miastenia, síndrome de Eaton Lambert) y coincidiendo con tratamientos a base de aminoglucósidos, penicilamina, quinina y bloqueadores de los canales del calcio, ya que éstos pueden potenciar sus efectos.
En los casos de resistencia a la toxina botulínica tipo A, algunos pacientes responden al tratamiento con Toxina tipo B inicialmente, puesto que al cabo de varias sesiones se desarrolla también resistencia que se explica como el desarrollo de anticuerpos contra el nuevo serotipo o como antigenicidad cruzada (7).
Las indicaciones médicas para su uso incluyen todas aquellas patologías que resultan de la hiperfunción muscular y la disfunción autonómica. En abril de 2002 la FDA aprobó la utilización de la toxina botulínica A para el tratamiento cosmético de la zona glabelar y desde esa fecha se extendieron las aplicaciones estéticas faciales sobre todo para el tercio superior y finalmente para el tratamiento de la hiperhidrosis (6).
Últimamente se han extendido las investigaciones sobre el posible efecto de la toxina botulínica en la perfusión sanguínea muscular, en el metabolismo de la glucosa, en su relación con la liberación de sustancia P, glutamato, Fos (un producto de c-fos) y de calcitonina (8). Posiblemente de esta forma también se ha planteado su capacidad para mejorar la viabilidad de los colgajos cutáneos utilizándola como mecanismo de retardo, disminuyendo la resistencia miocutánea de los colgajos en expansión, mejorando el área de expansión, la velocidad del proceso inflamatorio y reduciendo la contracción del colgajo miocutáneo (9)
También se han descrito avances en casos de desorden vasoespástico (fenómeno de Raynaud específicamente), en los que la toxina botulínica podría ser una alternativa de tratamiento; los pacientes han presentado mejoría al bloquear la liberación de acetilcolina con este producto. El músculo liso de los vasos arteriales está inervado por fibras simpáticas que utilizan norepinefrina en el mecanismo de transmisión sináptica; la toxina botulínica presentaría una acción doble: inhibiendo el vasoespasmo por bloqueo de la vasoconstricción producida por el frío y previniendo el reclutamiento de los receptores α2 a nivel de la musculatura lisa vascular.
Igualmente se ha informado también de la utilidad de esta terapia para el tratamiento de úlceras en dígitos de origen isquémico y en el síndrome de atrapamiento del túnel carpiano (10,11).
Basándonos en el principio de liberación del péptido de calcitonina, un potente vasodilatador, efecto atribuido a la toxina botulínica, se ha propuesto la prevención de la trombosis vascular de las anastomosis vasculares, la cual se presenta en el 80% de los casos en los dos primeros días tras la cirugía. Con la aplicación de toxina botulínica de manera experimental, se ha evidenciado que el diámetro de los vasos arteriales anastomosados, en los casos en que se aplicó (0.68 ± 0.2mm) fue mayor que en los casos del grupo control (0.53 ± 0.02mm), p < 0.001, e incluso se reporta menor dificultad para la anastomosis (12).
Últimamente se ha planteado también la efectividad de la epinefrina para acelerar el tiempo de acción corto de la toxina botulínica en la hiperactividad muscular. Hantash y Gladstone (13) presentan un estudio que sugiere la aceleración de la tasa de inicio de acción de la toxina botulínica cuando se administra conjuntamente con epinefrina (agonista alfa-1, alfa-2, beta-1, beta-2 y beta-3 adrenérgico) para el tratamiento de arrugas periorbitarias, manteniendo el tiempo de acción a largo plazo.
Young (14), en el año 2009, determinó el rol de la Toxina Botulínica tipo A (BoTA) en la prevención del colapso de los vasos periféricos en los colgajos cutáneos y el incremento en su supervivencia. El estudio incluyó 10 ratas Sprague - Dawley divididas en 2 grupos: el primero recibió un total de 20 UI de BoTA intradérmica en las áreas proximal, media y distal de un colgajo cutáneo de 3x10cm diseñado en el dorso de los animales una semana antes de levantarlo y un segundo grupo control tratado con placebo. A los 7 días de postoperatorio evaluó el área viable de los colgajos, 93.79 ± 6.06% para el grupo BoTA y 52.63 ± 6.55% para el grupo control p = 0.042. Por medio de flujometría Doppler se determinaron diferencias significativas entre los grupos previamente mencionados, al levantar el colgajo p = 0.043 y a los 7 días p = 0.042 en el área distal, con franco beneficio para el grupo BoTA. Finalmente, el autor presenta un aumento en el número de capilares del colgajo manteniendo la morfología de arteriolas y vénulas en el grupo BoTa en contraste con el grupo control. Concluyen que existe un beneficio con el pretratamiento mediante ToBA para incrementar la supervivencia de los colgajos cutáneos.
Material y método
Diseñamos un estudio experimental, prospectivo y transversal. Nuestro objetivo fue comparar la viabilidad de un colgajo cutáneo determinando el área de necrosis y los cambios histológicos vasculares de los colgajos de patrón vascular randomizado con y sin la aplicación de toxina botulínica tipo A preoperatoria o transoperatoria (con y sin administración complementaria de epinefrina). Calculamos el tamaño de la muestra por comparación de medias independientes utilizando el programa EPIDAT 3.1 (Análisis epidemiológico de datos tabulados, Xunta de Galicia & OPS-OMS. 2006) con un nivel de confianza del 95%; de esta manera se determinó una muestra de 9 conejos adultos Nueva Zelanda, catalogados como sanos, con peso de entre 2-3 kg. Se eliminaron los animales que presentaron complicaciones quirúrgicas, que no sobrevivieron al estudio y aquellos en los que no se completó el plan terapéutico establecido. El análisis estadístico lo realizamos con el paquete estadístico SPSS versión 16.0 (SPSS, INC., Chicago, ILL). Incluimos evaluación descriptiva, estadística inferencial con la prueba T de Students, Chi2 y prueba exacta de Fisher para los valores menores de 5. Se consideró p < 0.05 como significativo para todas las pruebas. Los resultados se presentan con la media ± desviación estándar.
Marcamos los colgajos cutáneos de patrón vascular randomizado en el dorso rasurado de los conejos; las dimensiones de los mismos fueron 2 cm de base por 8 cm de longitud (Fig.1). De esta forma obtuvimos 4 colgajos en el dorso de cada conejo (Fig.2) distribuidos al azar, cada uno representando a cada grupo de estudio, con un total de 36 colgajos. Nueve colgajos se tomaron como control y en ellos se aplicó solución fisiológica 0.9%; en otros 9 se aplicó toxina botulínica tipo A, en toda la longitud del colgajo, 7 días antes de levantarlo (TBoA7d previo), en 9 más se aplicó toxina botulínica tipo A de forma transoperatoria (TBoA Transqx) y en los últimos 9 la aplicación de toxina botulínica tipo A transquirúrgica en la totalidad del colgajo se acompaño de aplicación simultánea de epinefrina (TBoA+Epi).
La administración de toxina botulínica fue intradérmica en todos los casos. La dilución de la presentación comercial de 100UI se realizó en 2 cc de solución fisiológica al 0.9%. En cada colgajo se colocaron 16 puntos de aplicación de 0.5 UI cada uno, dando un total de 8 UI por colgajo, lo que representa 24 UI en cada conejo (3 con toxina botulínica y 1 sin ella) ó 0.14ng de toxina botulínica. Cada unidad se distribuyó a 10 mm de distancia de la otra. Para este motivo determinamos el centro o punto 0 de un triángulo isóceles (el cuál se basa en la unión de las medianas de éste) y diseñados simétricamente sobre la longitud del colgajo, se depositó la sustancia de una manera más uniforme (Fig. 3). De igual forma la epinefrina se administró a una dilución de 1:100, 000 con solución fisiológica 0.9% para mantener la isotonicidad.
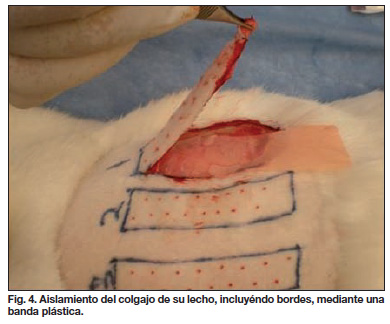
A los 7 días de la administración de la toxina botulínica tipo A se anestesiaron los conejos mediante una combinación con hidrocloruro de xilazina al 2% (5 mg / kg I.M.) y clorhidrato de ketamina (5 mg /kg I.M.) manteniendo la anestesia a través del uso de isofluorano 3-5%. Una vez anestesiados los animales, se levantaron los colgajos, se aislaron de su lecho y del contacto con el tejido periférico colocando una banda plástica sobre el lecho y sus bordes para asegurar que la vascularización únicamente dependiera de la base del colgajo. El colgajo, una vez aislado a través de este sistema, se suturó a su lecho para mantenerlo fijo (Fig. 4-5).
En el postoperatorio empleamos enrofloxacina al 5% (5-10 mg /kg I.M.) como profilaxis antibiótica y meglumina de flunixin (1-2 mg/ kg S.C.) cada 12 horas como analgesia. Se realizaron estudios macroscópicos y fotografías para valorar el porcentaje de necrosis y supervivencia del tejido. La valoración fotográfica de los colgajos se hizo cada 24 horas hasta que se delimitaron completamente los cambios clínicos.
Los conejos fueron sacrificados 7 días más tarde, bajo anestesia profunda acompañada de sobredosis de pentobarbital sódico (90-210 mg/kg I.V.) y los colgajos se enviaron a evaluación histológica con tinción de hematoxilina y eosina. Los cadáveres de los animales sacrificados se manejaron conforme a la NOM-087-ECOLSSA1-2002: depositados en bolsas color amarillo y trasladados al Depósito Temporal de Desechos de nuestro hospital.
En cuanto a las correspondientes consideraciones éticas, se siguieron las normativas éticas especificadas en el Diario Oficial de la Federación de los apartados animales en condiciones de bioterio "Norma Oficial Mexicana NOM-062-ZOO-1999, Especificaciones Técnicas para la Producción, Cuidado y Uso de los Animales de Laboratorio". El procedimiento anestésico lo realizó un médico veterinario zootecnista experto, al igual que el manejo de la analgesia y los cuidados postquirúrgicos. El seguimiento específico y los requerimientos necesarios de los animales en cuestión, se realizaron por el investigador y por el médico veterinario zootecnista.
Resultados
Se incluyeron en el estudio 9 conejos con un peso medio de 4.268 gr (3500-4440 gr.); en el dorso de cada conejo se trazaron 4 colgajos cutáneos, obteniendo así un total de 36 colgajos cutáneos con patrón vascular randomizado que se analizaron con el programa ImageJ (Image Processing and Analysis in Java. Version 1.34s; National Institutes of Health, Bethesda, Md.), obteniendo sus dimensiones en pixeles, que serían nuestras unidades para transformación y medición.
Desde la primera observación a las 24 horas, se evidenciaron cambios con respecto a la palidez del tejido, especialmente en su extremo distal, manifestándose de manera predominante en el grupo control que presentó un 37.89 ± 9.2% de palidez en esas primeras 24 horas.
Los signos clínicos de sufrimiento del colgajo, es decir, la palidez, a las 48 horas se convirtió en cianosis. El grupo control presentó 61.47 ± 6.3% de cianosis, el TBoATransqx 4.43 ± 1.1%, el TBoA7dprevio 21.69 ± 3.2% y finalmente TBoA+Epi 22.91 ± 4% denotando significancia estadística de todos ellos (p < 0.05) frente al grupo control (Tablas I y II. Gráfico 1).
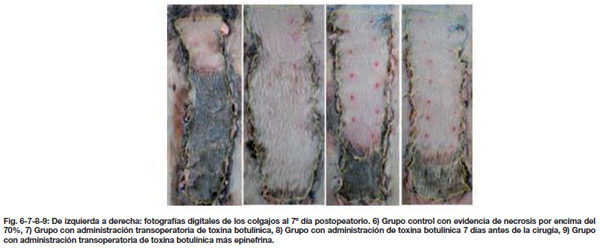
Esta evolución clínica se manifiestó con necrosis franca a partir del tercer día, con un mayor sufrimiento en el colgajo del grupo control. La última evaluación con el colgajo aún fijo a su lecho (aislado con la banda plástica) se realizó al séptimo día, encontrando 72.17 ± 3.9% de necrosis en el grupo control, en el TBoA+Epi con 23.90 ± 3.9% y en el TBoA 7 días previo con 24.97 ± 2.7%, siendo menor en el que se administró TBoATransqx con 5.09 ± 1.2% de necrosis p < 0.05. (Tabla III. Fig. 6-13).

Este mismo día, después de la medición previa en la que los colgajos se encuentran suturados al lecho, se procede a la liberaración de los mismos y a su levantamiento para una nueva medición. Los resultados mantienen la tendencia de necrosis en el grupo control con 71.28 ± 4.3%; los colgajos que recibieron TBoATransqx 5.26 ± 1.4%, TBoA+Epi 23.71 ± 5.1% y TBoA7dprevio 24.70 ± 2.0% presentan de igual manera significancia estadística p < 0.05 al parearlos con el grupo control. Estas cacterísticas que soportan al analizar el reverso de los colgajos: control 68.61 ± 6.4%, TBoATransqx 4.57 ± 1.2, TBoA+Epi 23.87 ± 4.4% y TBoA7dprevio 24.58 ± 1.2% p < 0.05 (Tablas IV y V. Fig. 14-21).
El análisis histológico del área viable se realizó de forma ciega para el patólogo. Se evaluaron los cambios morfológicos estructurales, encontrándose variación en los diámetros de las estructuras vasculares. El calibre interno de los vasos en los cortes histológicos se midió a través de imágenes obtenidas a 100 aumentos, encontrando que el área de los vasos sanguíneos estaba en relación directa con los cambios de sufrimiento de los colgajos. Así: el grupo control presentó un área de 528 ± 54.29 pixeles, el TBoATransqx de 2883 ± 85.51pixeles, el TBoA7dprevio de 2396 ± 388.33 pixeles y finalmente el TBoA+Epi un área de 2518 ± 281.02 pixeles con una p < 0.05 (Tabla VI).
Discusión
El gran espectro de acción de la toxina botulínica no ha sido completamente definido hasta el momento; se han llevado a cabo múltiples estudios y aún se continúa determinando los potenciales beneficios de esta sustancia. Su acción vasodilatadora es ahora el centro de atención y más aún cómo obtener un inicio más precoz de su efecto, lo que provocaría un cambio radical en sus indicaciones actuales sobre todo en lo referente a la supervivencia de los tejidos utilizados en nuestra especialidad. Este proyecto cobra especial importancia al evaluar la acción protectora de la toxina botulínica tipo A ante la necrosis en los colgajos cutáneos de patrón vascular randomizado y la evaluación de su uso combinado con epinefrina.
Contamos con los antecedentes del efecto vasodilatador de la ToBA demostrado por Van Beek (15) y Neumeister (10) en desórdenes vasoespásticos, así como los reportados por Clemens (12) quién utiliza la ToBA para prevenir la trombosis anastomótica disminuyendo el vasoespasmo. Aunque Arnold-Merrit (16) no encuentra diferencias significativas vasculares en su estudio sobre la viabilidad de colgajos en isla aplicando ToBA perivascular, Young (14) por medio de flujometría doppler demuestra un mayor aporte sanguíneo tanto en el segmento distal, como en el medio y en el proximal con la aplicación de ToBA p< 0.05.
Nuestro estudio valora el efecto benéfico de la toxina botulínica sobre colgajos cutáneos de patrón randomizado, tal y como lo desarrolla Young (14) en su investigación. Tratamos de avanzar buscando mejorar el inicio de acción (a través de la administración conjunta de epinefrina) y determinar el momento ideal de aplicar la toxina; ambas variables no se habían considerado con anterioridad.
Creamos tres instancias diferentes de acción de la ToBA. Al aplicar la ToBA 7 días antes de levantar los colgajos, es decir, creando un efecto de retardo, obtuvimos un resultado significativo al mejorar la viabilidad del colgajo en comparación con el grupo control (24.97% vs 72.17% de área de necrosis) con una p < 0.05, corroborando por tanto el efecto de la ToBA como menciona Young (14).
Hantash y Gladstone (13) en su estudio piloto, mencionan que la adición de epinefrina a la dilución con ToBA acelera la tasa de inicio de acción de la toxina botulínica tipo A. Con esta premisa creamos un segundo grupo de estudio, ToBA + Epi, para valorar el comportamiento del área de necrosis, suponiendo que al acelerar el inicio de la acción de la toxina obtendríamos menor sufrimiento del colgajo. Nuestros datos de 23.90% de necrosis en este grupo sugieren que existe acción protectora de la ToBA si la comparamos con el grupo control 72.17% de necrosis p < 0.05, pero no evidencian una mejoría notable en relación con los otros grupos.
El tercer grupo, TBoATransqx, es el que genera más relevancia. Este grupo presenta 5.09% de área con necrosis, totalmente significativo en comparación con el grupo control, 72.17% de necrosis p < 0.05.
Finalmente, al igual que otros autores como Arnold (11), hemos demostrado que los resultados clínicos se correlacionan con los histológicos evidenciando un aumento del área interna de los vasos en los cortes histológicos con una p < 0.05.
Reiteramos que en la actualidad no existen estudios en los que la aplicación de la toxina botulínica se lleve a cabo en el momento de levantar el colgajo a fin de determinar si éste puede ser el momento ideal para su aplicación en el mismo.
Conclusiones
Observamos que el efecto de la toxina botulínica sobre los colgajos cutáneos, como protector de los mismos, es significativo. Su efecto se manifiesta desde las primeras 24 horas, tiempo en el que se inicia la organización del área isquémica.
No encontramos un resultado certero de la epinefrina como medio de aceleración de la tasa de inicio de acción de la toxina botulínica; sin embargo, su aplicación transoperatoria presenta un resultado satisfactorio como mecanismo de ayuda contra el sufrimiento del colgajo cuando se compara con el grupo control.
Concluimos que la toxina botulínica actúa como protector contra el proceso de sufrimiento-isquemia de los tejidos debido a su acción vasodilatadora y que además, su aplicación puede realizarse al inicio del procedimiento quirúrgico de disección del colgajo.
Sugerimos realizar estudios adicionales para valorar variables suplementarias, como la perfusión de los tejidos a los que se aplique toxina botulínica y así lograr un mayor rango de seguridad para su aplicación en la disección de colgajos.
Agradecimientos
Al Maestro José Guerrerosantos, Director fundador del Instituto Jalisciense de Cirugía Reconstructiva. A la Dra. Celina Verónica Kishi Sutto, Directora de investigación del Instituto Jalisciense de Cirugía Reconstructiva. A la Dra. Cristians Xitlali Barón Ramos, colaboradora en la elaboración del manuscrito.
Nota del autor
Los viales de Xeomeen®, empleados para este estudio fueron proporcionados por Merz Pharma, S.A. de C.V.
Bibliografía
1. Qi Z. Gu Y. Kim D. Hiura A. Sumi S. Inoue K. "The effect of fibrin on the survival of ischemic skin flaps in rats". Plast. Reconstr. Surg. 2007;120 (5):1148. [ Links ]
2. Rinker B. Fink B. Barry N. Fife J. Milan M. "The effect of calcium chanel blockers on smoking-induced skin flap necrosis". Plast. Reconstr. Surg. 2010;125 (3):866. [ Links ]
3. Uema D. Orlandi D. Freitas R. Rodgério T. Yamamura Y. Tabosa A. "Effect of electroacupuncture on DU-14 (Dazhui), DU-2 (Yaoshu), and Liv-13 (Zhangmen) on the survival of wistar rats' dorsal skin flaps". J. Burn. Care. Res. 2008;29 (2):353. [ Links ]
5. Erbguth F. "From poison to remedy: the chequered history of botulinum toxin". J Neural Transm. 2008;115:559. [ Links ]
6. Redaelli A. Forte R. "Botulinum toxin dilution: our technique". Cosmetic & Laser Ther. 2003;5:218 [ Links ]
7. Alcolea López J.M.: "Actualización sobre aplicaciones de la toxina botulínica en estética facial". Cir.plást.iberolatinoam 2011, 37 (1): 81. [ Links ]
8. Currá A. Berardelli A. "Do the unintended actions of botulinum toxin at distant sites have clinical implications?". Neurology 2009;72:1095. [ Links ]
9. Matic D. Lee T. Wells R. Gan B. "The effects of botulinum toxin type A on muscle blood perfusion and metabolism". Plast. Reconstr. Surg. 2007;120 (7):1823. [ Links ]
10. Chenwang D. Shiwei B. Dashan Y. et al. "Application of botulinum toxin type A in myocutaneous flap expansion". Plast. Reconstr. Surg. 2009;124 (5):1450. [ Links ]
11. Neumeister M. Chambers C. Herron M. et al. "Botox therapy for ischemic digits". Plast. Reconstr. Surg. 2009;124 (1):191. [ Links ]
12. Arnold P. Campbell C. Rodeheaver G. Merrit W. Morgan R. Drake D. "Modification of blood vessel diameter following perivascular application of botulinum toxin A". Hand 2009;4:302. [ Links ]
13. Clemens M. Higgins J. Wilgis E. "Prevention of anastomotic thrombosis by botulinum toxin A in an animal model". Plast. Reconstr. Surg. 2009; 123 (1):64. [ Links ]
14. Hantash B. Gladstone H. "A pilot study on the effect of epinephrine on botulinum toxin treatment for periorbital rhytides". Dermatol Surg 2007;33:461. [ Links ]
15. Kim YS. Roh T. Lee W. Yoo W. Tark K. "The effect of botulinum toxin A on skin flap survival in rats". Wound Rep Reg 2009;17:411. [ Links ]
16. Beek A. Lim P. Gear A. Pritzker M. "Management of vasospastic disorders with botulinum toxin A". Plast. Reconstr. Surg. 2007;119 (1):217. [ Links ]
17. Arnold P. Merritt W. Rodeheaver G. "Campbell A. Morgan R. Drake D.: "Effects of perivascular botulinum toxin A application on vascular smooth muscle and flap viability in the rat". Ann Plast Surg. 2009;62 (5):463. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Cristian Xavier Astudillo Carrera
Av Federalismo Nte. # 2022. Col. Guadalupana
CP 44220. Guadalajara, Jalisco, México.
e-mail: astudillocristian1@hotmail.com