Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.40 no.3 Madrid jul./sep. 2014
https://dx.doi.org/10.4321/S0376-78922014000300016
Utilidad práctica de la fibrina autóloga en medicina reparadora y cirugía plástica
Pratical use of autologous fibrin in repartive medicine and plastic surgery
Hernández I.*; Rossani G.*; Alcolea J.M.**; Castro-Sierra R.***; Pérez Soto W.**** y Trelles M.A.*****
* Cirujano Plástico INGECEL, Instituto Peruano de Ingeniería Celular y Manufactura Tisular, Lima, Perú.
** Licenciado en Medicina y Cirugía. Master en Medicina Estética. Clínica Alcolea, Barcelona, España.
*** Cirujano Plástico, Jefe del Servicio de Cirugía Plástica, Hospital Nacional Hipólito Unanue (HNHU), Lima, Perú.
**** Cirujano Plástico, Director del Programa de Investigación y Desarrollo del Servicio de Cirugía Plástica, Hospital Nacional Hipólito Unanue (HNHU), Lima, Perú.
***** Cirujano Plástico, Instituto Vilafortuny, Cambrils (Tarragona), España.
Dirección para correspondencia
RESUMEN
El objetivo del presente estudio es determinar la eficacia clínica de la fibrina autóloga en heridas traumáticas con exposición de tejido noble, en el pie diabético y en úlceras por insuficiencia venosa crónica. El concepto es regenerar el tejido afectado e inducir de manera asistida la formación de tejido de granulación suficientemente compacto para incorporar autoinjertos de piel o facilitar el cierre por segunda intención cuando no puede realizarse injerto. La regeneración más rápida del tejido lesionado se traduce en la reducción del tiempo de morbilidad, disminución de los costes hospitalarios y mejora de la calidad de vida del paciente.
Realizamos un estudio clínico prospectivo, observacional, longitudinal y aleatorio, con casos controles, entre octubre de 2011 y noviembre de 2013, en una muestra de 34 pacientes que cumplieron los criterios de inclusión de entre un total de 84 pacientes examinados. Estudiamos lesiones de 3 etiologías diferentes, todas ellas localizadas en miembros inferiores y que correspondían a heridas traumáticas con exposición de hueso y/o tendón, úlceras por insuficiencia venosa crónica Clase VI y lesiones de pie diabético Tipo II. A todos los pacientes incluidos en el estudio se les aplicó fibrina autóloga de forma asistida y ambulatoria, completando el tratamiento con la aplicación de gasas parafinadas y vendaje oclusivo durante 4 días. El control evolutivo y de ventajas de la técnica se realizó sobre lesiones de similar extensión, profundidad y localización, en 50 pacientes tratados de forma convencional, sin fibrina.
Las lesiones que evolucionaron más rápidamente fueron las secundarias a traumatismos que exponían tejidos nobles, seguidas de las lesiones por insuficiencia venosa y, por último, de las lesiones correspondientes al pie diabético. En las lesiones de origen traumático, el tiempo de granulación para incorporar autoinjertos de piel parcial y/o de cierre por segunda intención fue en promedio 72,7% más rápido; en contraste con las lesiones del grupo control (8 semanas de diferencia). Las úlceras por insuficiencia venosa se recuperaron un 70,6% más rápido, con un promedio de 12 semanas de diferencia en comparación con el grupo control. En las lesiones de pie diabético la recuperación supuso un 58,3% de promedio, con 14 semanas de diferencia respecto a los controles.
Todos los pacientes, tanto los de consulta externa como los hospitalizados por lesiones incapacitantes, fueron atendidos ambulatoriamente en el consultorio externo sin necesidad de ningún tipo de anestesia. El tiempo de evolución se redujo en un 64,7% de promedio con respecto al grupo de pacientes no tratados con fibrina. El tiempo de recuperación, estancia hospitalaria y la satisfacción mostrada por los pacientes frente a los resultados obtenidos alcanzaron significación estadística p < 0,05.
La utilización de fibrina autóloga en lesiones de reconocida evolución lenta e incierta, acorta el tiempo de recuperación al inducir mejor cicatrización, mejora la calidad del tejido resultante, disminuye el tiempo de hospitalización y conlleva un alto grado de satisfacción de los pacientes por los resultados obtenidos.
Palabras clave: Fibrina Autóloga, Tejidos nobles, Tendón, Traumatismo, Pie Diabético, Lesión Vascular, Úlcera Varicosa, Reparación Tisular.
Nivel de evidencia científica II.
ABSTRACT
Our aim is to determine the clinical efficacy of autologous fibrin in traumas with deeply exposed open wounds; in diabetic foot, and ulcers due to chronic venous insufficiency. The goal was to regenerate the affected tissue and assist in inducing the formation of sufficiently compact granulation tissue, in order to enable auto-skin grafts or facilitate the closure by second intention, when grafts are not able to be used. The most rapid tissue regeneration becomes in a lower morbidity rate, reduction in hospital costs and a better quality of life.
We present a clinical prospective study, observational, over time and random with control cases, carried out between October 2011 and November 2013, in a sample of 34 patients that met the inclusion criteria of a total of 84 patients examined. Lesions of 3 different etiologies were studied, all of them located in the lower limbs and that corresponded to trauma wounds with exposure of bone and/or tendons. Ulcers due to chronic venous insufficiency class VI and diabetic foot wounds type II were also included. All patients received autologous fibrin with assistance as outpatients, completing the treatment with the application of paraffin dressings and occlusive bandaging cures were done every 4 days. Controls of treatment and advantages of the technique were carried out on lesions of similar size, deepness and location, in 50 patients that were treated in a conventional way without using fibrin.
Lesions that evolved faster were those due to trauma with exposure of bones or other soft tissue, followed by those due to venous insufficiency and lastly, those diabetic foot ones. In those lesions of traumatic origin, the granulation time, in order to incorporate partial auto-skin grafts and/or closure by second intention, was in an average of 72,7% faster when compared to those of the control group (8 weeks difference). Ulcers due to venous insufficiency healed 70,6% faster, with an average of 12 weeks difference with the control group. Diabetic foot wounds healed in an average of 58,3%, with 14 weeks difference with respect to the control group.
All patients both consulted externally and those hospitalized due to their serious wound characteristics, were treated as outpatients with no need for any type of anaesthesia. Healing was reduced in an average of 64,7% in comparison to those treated without fibrin. Recovery time, hospital stay and satisfaction as reported by patients with regards to results obtained, was statistically significant p < 0,05.
In conclusion, the use of autologous fibrin in lesions of known slow healing and uncertain evolution, decreases recovery time as it induces better wound healing. The use of fibrin helps to obtain better tissue quality, decreases hospital stay and achieves high patient satisfaction with results obtained.
Key words: Autologous fibrine, Noble tissue, Tendon, Trauma injury, Diabetic foot, Vascular injury, Varicose ulcer, Tissue repair.
Level of evidence II.
Introducción
La pérdida de continuidad que se produce a consecuencia de una lesión en el tejido blando se denomina herida, y puede comprometer piel, tejido subcutáneo, músculos, tendones, nervios, huesos y órganos blandos, dependiendo de su severidad.
La fase de inflamación se inicia cuando se produce la herida, siendo un complejo proceso en el que intervienen células y mediadores químicos cuyos primeros estímulos tienen como diana el plasma y el endotelio vascular. La liberación de mediadores de la inflamación por las plaquetas conlleva de forma inmediata el incremento de la velocidad de migración de células diversas hacia la zona lesionada (1). Las células implicadas liberarán factores quimiotácticos cuya misión es atraer macrófagos con la finalidad de fagocitar los detritus de los tejidos dañados.
Seguidamente, en la fase proliferativa de la cicatrización, el contacto de la sangre con el colágeno tisular provoca la degranulación de las plaquetas liberándose los gránulos alfa cuyo contenido consta de citoquinas, proteínas adhesivas, factores de crecimiento e inmunoglobulinas, entre otros. Por otra parte, la estimulación de la síntesis de glicoproteínas estimula la formación de una matriz sobre la que simultáneamente se enlazan la fibrina y la fibronectina para formar una red tridimensional que retiene proteínas y células a fin de evitar la pérdida de sangre. En el proceso de coagulación, las proteínas de la matriz extracelular, citoquinas y factores de crecimiento procedentes de la degranulación plaquetaria estimulan la velocidad de división celular.
En condiciones normales, el factor que desencadena la vasodilatación es la histamina, la cual convierte a los vasos sanguíneos en porosos, fenómeno de fenestración vascular, permitiendo el desarrollo de edema debido a las proteínas aportadas por el torrente sanguíneo al espacio extravascular. Sin embargo, en lesiones de lenta evolución, la perfusión está disminuida debido a los cambios adaptativos que induce la cronicidad del proceso. Por esta razón, en el presente estudio decidimos proporcionar a estos tejidos dañados factores responsables de los procesos inflamatorios y/o de la cicatrización directamente sobre el lecho cruento. De esta manera logramos en la mayoría de los casos, siendo pacientes debidamente seleccionados, potenciar el proceso de inflamación de los tejidos que inducirá un nuevo tejido de granulación, el cual será adecuado para recibir injertos o bien para producir el cierre por segunda intención.
Simultáneamente, mientras las células endoteliales proliferan, los fibroblastos se multiplican de forma activa a fin de generar la matriz de colágeno en la cicatriz, lo que tiene lugar entre la segunda y la cuarta semanas de aplicada la fibrina sobre el lecho cruento. También conviene tener en cuenta que la falta de oxigenación crónica inhibe el crecimiento y el depósito de componentes de la matriz extracelular, al tiempo que produce un tejido fibrinoide que imposibilita la correcta reestructuración arquitectónica de la zona lesionada. En este caso, la fibrina aportada hace que la fase de epitelización se inicie gracias a la formación de tejido granular, favoreciendo la migración de las células epiteliales a través del nuevo tejido, lo que a su vez crea una barrera entre la herida y el medio ambiente.
En los márgenes de la herida encontramos queratinocitos y apéndices dérmicos que formarán una cubierta sobre la misma que, en condiciones normales, desplaza los bordes hacia el centro de la misma, fenómeno que se denomina contracción. Cuando los niveles de producción y degradación del colágeno se estabilizan, se inicia la fase de reparación del tejido. El tiempo de consolidación de esta fase es incierto, pudiendo extenderse hasta un año dependiendo del tamaño y del tipo de herida, así como de las condiciones generales de salud del paciente.
Existen diferentes tipos y clasificaciones de las heridas, pero para efectos del presente estudio, seleccionamos las heridas traumáticas con exposición de tejido noble, las úlceras de pie diabético y las úlceras por insuficiencia venosa. Estas dos últimas comparten características similares desde el punto de vista fisiopatológico en cuanto al compromiso de los tejidos blandos frente a las heridas de tipo traumático. En el caso de las úlceras por insuficiencia venosas, las lesiones suelen ser más profundas, llegando a dañar músculos, tendones e incluso huesos, aunque debemos resaltar que estas heridas suelen presentar mejor perfusión sanguínea (Tabla I).
Las lesiones traumáticas están comprendidas dentro de la clasificación de las heridas abiertas y complicadas, que por la forma de presentación se pueden dividir en agudas, como en el caso particular de las heridas cuya etiología principal son los accidentes de tráfico, y crónicas o reagudizadas. Las heridas de tipo ulcerativas, para fines del presente estudio, se escogieron entre las causadas por insuficiencia venosa crónica y aquellas asociadas al pie diabético.
La evaluación de las lesiones en el momento de su examen es el primer escalón en el tratamiento de las heridas (2); aunque la selección de un sistema de clasificación es una tarea no exenta de dificultad (3,4). Las heridas crónicas, en las que se incluyen las úlceras, son procesos dinámicos y a medida que se profundiza en su conocimiento, las clasificaciones han ido perfeccionándose con criterios de uniformidad.
Las lesiones que comprometen los tejidos blandos alterando el lecho vascular, independientemente de su extensión y profundidad, hacen complejo establecer un protocolo de tratamiento que optimice el tiempo de formación de tejido de granulación para lograr un cierre eficaz en primera o segunda intención, resolviendo las complicaciones frecuentes que suelen presentarse en estas patologías, tal y como resumimos en la Tabla II.
En cuanto al diagnóstico nosológico de pie diabético, a pesar de los múltiples sistemas de clasificación propuestos, el ideal no se ha logrado hasta el momento. Esto da idea de la complejidad de estas lesiones en las que intervienen múltiples variables, lo que dificulta la creación de un sistema que las integre adecuadamente de forma sencilla y, a la vez, práctica. De la misma manera, son muchos los factores sistémicos implicados en la formación y desarrollo del componente vascular, lo que junto con la infección y destrucción de los tejidos profundos y otros factores agravantes, como la disminución de la perfusión sanguínea, contribuyen a perpetuar la lesión. Estas lesiones constituyen los precursores más comunes de una posible amputación, siendo motivo de debate aún no resuelto (5, 6).
Clasificación
Entre las múltiples clasificaciones existentes cabe citar: la de Gibbons (7), Forrest y Gamborg-Neilsen (8), la de Pecoraro y Reiber conocida como clasificación de Seattle (9), la de Brodsky también denominada clasificación por Profundidad-Isquemia (10), la de Liverpool (11), la SAD (Size/Area/Depth) (Sepsis, Arteriopathy, Denervation) (12) validada por Treece y col. en 2004 (13), la clasificación PEDIS (14), la DEPA (15), la clasificación según Wound Score de Strauss y Aksenov (15) y la de SINBAD (17), entre otras.
Si bien es cierto que la Conferencia Nacional de Consenso sobre Úlceras de la Extremidad Inferior (CONUEI) de noviembre 2008 y publicada en 2009 (18) se considera como uno de las de mayor rigor científico, hasta el momento no se ha logrado imponer. La clasificación de Wagner-Meggitt, conocida como clasificación de Texas o Escala Texas, es la más utilizada. Esta escala, descrita en 1976 por Meggitt (19) y popularizada por Wagner en 1981 (20), divide las lesiones en 6 grados y continúa siendo probablemente, el sistema de clasificación más idóneo y universalmente aceptado del pie diabético (21) (Tabla III A).
En cuanto a las úlceras de origen vascular, específicamente las debidas a insuficiencia venosa, la Unión Internacional de Flebología estableció la definición de insuficiencia venosa crónica como aquellos cambios producidos en las extremidades inferiores resultado de la hipertensión venosa prolongada, que incluyen la hiperpigmentación, el eccema, la dermatitis de ectasia venulo-capilar y por último a las úlceras (Tabla III B). Se sabe que del 10% al 35% de los adultos mayores de 65 años, según la OMS, tienen alguna forma de trastorno venoso crónico que varía desde arañas vasculares y varices simples, hasta llegar a úlceras venosas que afectan al 4% de esta población.
En España, según el estudio Detect-IVC que incluyó 16.186 pacientes, el 62% de los encuestados presentaba algún signo o síntoma de insuficiencia venosa crónica y el 17% padecía algún tipo de cambio trófico o úlcera, mientras 1 de cada 5 presentaba edema (22). Los factores de riesgo asociados estaban presentes en el 80,2% de las mujeres y en el 19,2% de los hombres.
El objetivo del presente estudio es comprobar que las heridas traumáticas con exposición de tejido noble, las úlceras por insuficiencia venosa crónica (Clase VI) y las debidas a pie diabético (Tipo II), cuando se tratan con fibrina autóloga, logran una recuperación más rápida, con mejor reparación de la arquitectura normal de la piel, al tiempo que disminuye la necesidad de practicar colgajos de rotación. Con el tratamiento de fibrina se busca ayudar a formar un adecuado tejido de granulación que permita la incorporación de injertos o el cierre por segunda intención. Todo ello conllevaría una menor estancia hospitalaria, con reducción del tiempo de baja laboral y disminución significativa de los costes socio-sanitarios. Además, estos resultados se traducirían en una mejor calidad de vida y un alto grado de satisfacción de los pacientes con los resultados del tratamiento.
Material y método
Para alcanzar los objetivos del estudio elaboramos un programa de captación de pacientes que presentaran lesiones de conocida evolución lenta, así como un protocolo de extracción y preparación de fibrina autóloga destinado a emplearse de forma tópica y ambulatoria. El protocolo de fibrina autóloga debería ofrecer una alternativa terapéutica válida y de bajo costo asistencial.
Tipo de estudio
Diseñamos un estudio clínico prospectivo observacional, longitudinal, aleatorio y comparativo con casos control. El estudio se realizó entre octubre de 2011 y noviembre de 2013.
Incluimos 50 pacientes en el grupo control que fueron tratados convencionalmente con limpieza quirúrgica y curas oclusivas de ácido acético al 2% después de desbridar los tejidos necróticos. Tras esta operación, cubrimos las lesiones expuestas con gasas parafinadas hasta lograr un tejido uniforme. Posteriormente se trataron con cremas de ácido fusídico al 20%. Las curas se realizaron cada 4 días según protocolo habitual, hasta lograr un tejido suficientemente fuerte que permitiera incorporar injertos o proceder a colgajos de rotación.
Los 50 pacientes control sirvieron para observar la evolución del grupo de estudio de 34 pacientes que presentaban lesiones de 3 diferentes etiologías: 1) heridas traumáticas con exposición de hueso y/o tendón; 2) úlceras producto de insuficiencia venosa; 3) lesiones de pie diabético, todas ellas localizadas en miembros inferiores (Tabla IV A, IV B). Los 34 pacientes fueron tratados en el Servicio de Cirugía Plástica del Hospital Nacional Hipólito Unanue (HNHU) de Lima, Perú.
Criterios de inclusión
• Pacientes afectos de lesiones traumáticas con exposición de tejido noble (hueso y/o tendón).
• Pacientes con úlceras crónicas de reconocida respuesta lenta al tratamiento habitual, como son el pie diabético y las úlceras vasculares por insuficiencia venosa crónica.
• Pacientes que aceptaron el consentimiento informado.
• Tratados por el mismo equipo médico del Hospital, con los mismos protocolos propuestos en cuanto a aislamiento, selección y secuencia de aplicación de la fibrina.
• Dentro del rango de edad seleccionado.
• Estables desde el punto de vista hemodinámico.
• Con estado físico y nutricional adecuado. A tal fin, en todos determinamos la proteinemia y hemoglobinemia. Consideramos adecuados aquellos pacientes con valores no inferiores a 3,5 mg/100 ml, y a 11 mg/100 ml, respectivamente.
Criterios de exclusión
• Signos evidentes de infección en el momento del ingreso (bien de tejido blando y/o con exposición de hueso).
• Heridas de gran complejidad, por lo cual eran candidatos en primera instancia de colgajos fasciocutáneos o músculo-cutáneos.
• Edad superior o inferior a la preestablecida.
• Pacientes que no aceptaron el consentimiento informado.
• Aquellos que no pudieron ser tratados por el mismo equipo médico y/o que no siguieron el mismo protocolo de actuación propuesto.
• Los que eran hemodinámicamente inestables.
• Los que presentaban signos de desnutrición y/o estado físico deteriorado, con dificultad para comunicarse verbalmente.
• Proteinemia inferior a 3,5 mg/100 ml y/o Hb inferior a 11 mg/100 ml, en el momento del ingreso.
Pacientes
Seleccionamos 34 pacientes de un total de 84. Los 50 pacientes excluidos, que no cumplían los criterios de inclusión, sirvieron de control. De los 34 participantes, 8 fueron mujeres y 26 varones; 21 fueron hospitalizados y 13 se atendieron en consulta externa. Las edades oscilaron entre los 15 a los 65 años (promedio de 40 años). Hubo 21 pacientes con lesiones traumáticas que presentaban exposición de hueso y/o tendón; 7 pacientes padecían úlceras secundarias a insuficiencia venosa crónica Clase VI, y 6 sufrían úlceras por pie diabético Tipo II.
Los pacientes acudieron a consultorio externo o fueron derivados a Cirugía Plástica desde otros servicios, como Traumatología o Cirugía Vascular (Tabla IV).
A todos se les aplicó desde la primera consulta, de forma ambulatoria y tras desbridar los tejidos necróticos, fibrina autóloga en bloque, completando el tratamiento con la aplicación de gasas parafinadas y vendaje oclusivo durante 4 días hasta la siguiente cura. La fibrina es un derivado plasmático que al ser expuesto al gluconato de calcio al 10% cambia su estado de líquido a gel, quedando a modo de bloque, lo que le da mayor estabilidad para su manipulación y permite rellenar lesiones profundas o, inclusive, puede suturarse. Se mantiene estable durante varios días, pudiendo observar restos de la sustancia en el lecho cruento al cuarto día de retirada de las gasas para efectuar una nueva cura y evaluación.
Equipo médico
El personal encargado de reclutar a los participantes fue entrenado para incorporar aquellos pacientes cuyas lesiones cumplieran los criterios de inclusión del estudio. Con esa finalidad se editaron fichas clínicas para la toma de datos junto a material fotográfico y las correspondientes instrucciones para obtener imágenes en similares condiciones de luz. El entrenamiento se realizó mediante formación específica por parte de los 2 primeros autores, a fin de unificar criterios en la selección y protocolos de actuación comunes a todo el equipo médico.
Material empleado
Empleamos jeringas estériles desechables de diferentes capacidades y tubos estériles de vacío de 3.5 ml para las tomas de sangre, mezclada con citrato de sodio al 3.2% como anticoagulante. Una vez obtenidas las muestras, se procedió a su centrifugado empleando una centrifugadora analógica, GreedMed (GT 119-100T, USA) de 6 tubos programable hasta 4000 revoluciones por minuto (rpm). Del resultante de la primera centrifugacion, que corresponde a la serie amarilla (sobrenadante plasmático), extrajimos la mitad superior para su inmediato traslado siguiendo las medidas de bioseguridad pertinentes para tubos de ensayo estériles, sin conservantes, mediante técnica cerrada. Esta muestra se activó con gluconato de calcio al 10% para su posterior centrifugación y para la estabilización del bloque de fibrina. Para el tratamiento oclusivo empleamos gasas parafinadas y apósitos, todo ello esterilizado. Las curas y evaluaciones se llevaron a cabo cada 4 días.
Obtención de la fibrina autóloga
Las extracciones fueron de 20 ml de sangre, cantidad suficiente para obtener unos 10 a 12 ml de fibrina autóloga. El modo de obtención de fibrina difiere según el método sea abierto o cerrado. En el Perú, mientras se trate de técnica cerrada al vacío, en pequeñas cantidades y bajo manipulación nula o mínima, no requiere seguimiento sanitario; pero es y sería ideal contar con el asesoramiento de un especialista en Hematología. De la misma manera, en España, en caso de emplear el método primero (técnica abierta), debe solicitarse permiso previo al organismo sanitario correspondiente que inspeccionará las instalaciones antes de otorgarlo. Si se emplea el método cerrado, no se precisa el permiso mencionado, aunque el kit empleado en todo el proceso deberá disponer del marcado CE (Comunidad Europea).
En el hospital, el equipo médico de Cirugía Plástica fue el encargado de procesar la sangre extraída para este propósito mediante técnica cerrada, bajo la autorización y supervisión del Departamento de Hematología y de acuerdo a los protocolos internacionales de manipulación nula o mínima de tejidos autólogos.
La extracción de sangre se realizó por venopunción en tubos de 3,5 ml estériles y cerrados al vacío que contenían citrato sódico al 3,2%. Los tubos se colocaron en la centrifugadora que se programó a 3.200 rpm durante 12 minutos.
El objetivo de la primera centrifugación fue separar la serie roja de los componentes plasmáticos, además de logar una concentración alta de fibrina y localizada en un sector fácil de identificar. La cantidad de sangre obtenida de cada paciente no superó los 20 ml; de esta cantidad obtuvimos después de la primera centrifugación entre 10 a 12 ml de suero rico en fibrina, cantidad suficiente para cubrir las zonas lesionadas de acuerdo a nuestra experiencia. La fibrina autóloga a obtener tras la primera centrifugación queda confinada a la mitad superior de la serie plasmática resultante. Esta serie, además de plaquetas, contiene células blancas, citoquinas y colágeno. El resto, que se localiza en la mitad inferior del tubo, se conoce como PRP (Plasma Rico en Plaquetas).
Una vez obtenida por aspiración la fibrina autóloga, añadimos 0.1 ml de gluconato de calcio al 10% por cada ml de fibrina con la finalidad de continuar el proceso de la coagulación y estimular la liberación de factores de crecimiento de las plaquetas contenidas en esta serie para que se forme un adecuado y compacto bloque de fibrina.
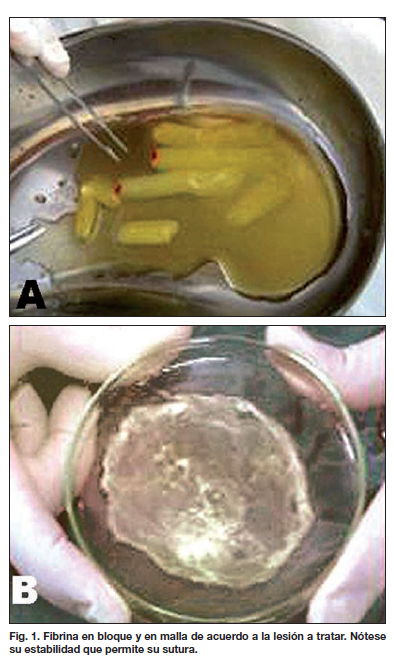
Luego, para obtener fibrina compacta existen 2 opciones. En la primera, se traslada la muestra a tubos de ensayo estériles para una segunda centrifugación estandarizada a 3.200 rpm durante 12 minutos, lo que hace que se forme un gel con la forma del tubo que lo contiene. En la segunda opción, se traslada la muestra a placas de Petri para obtener una malla susceptible de cubrir lesiones planas (Fig. 1). En este último caso, la muestra toma la forma de la placa después de 10 a 15 minutos de la activación con gluconato de calcio.
La fibrina, ya sea en bloque o en capa, se aplicó directamente sobre la zona cruenta y a los pocos segundos formó una membrana adherente a modo de cobertura biológica, la cual puede suturarse.
Inmediatamente después procedimos a colocar los apósitos parafinados y sobre ellos, gasas estériles en forma de tratamiento oclusivo, manteniéndolos durante 4 días. Pasado este periodo realizamos la apertura, valorando la evolución, aspecto de las lesiones y resultados. La cura oclusiva se repitió las veces necesarias hasta lograr el objetivo, a fin de formar un tejido de granulación fuerte que permitiera la incorporación de autoinjertos de piel o el cierre por segunda intención.
Las maniobras de aplicación de fibrina podrán realizarse cada vez que se estime conveniente, aunque en nuestra experiencia, no son necesarias más de 3 aplicaciones antes de valorar la capacidad de recepción de los injertos y/o la posibilidad de cierre por segunda intención.
Consentimiento informado
A todos los pacientes se les informó debidamente del procedimiento a realizar, dándoseles la opción de negarse a recibir el tratamiento. Se siguió y se respetaron los tratados de Helsinki, así como los de las APTCELL, ISCT en referencia al concepto de manipulación mínima de tejidos autólogos. (Asociación Peruana de Terapia Celular/International Society For Cellular Therapy)
Estudio estadístico
Para el tratamiento de datos empleamos el sistema SPSS® v. 21 para Windows; y como test de contraste estadístico, t de Student para muestras independientes tomando p=0,05 como punto de significación. Para el estudio de la respuesta clínica empleamos una Escala Visual Analógica (EVA) a fin de evaluar el cierre por segunda intención o bien el desarrollo de un tejido de granulación lo suficientemente compacto para soportar un autoinjerto.
La EVA en una herramienta útil para valorar la evolución de la mejoría clínica. En este caso, 0 representó que la evolución de la herida no presentaba cambios favorables significativos, mientras que 10 significaba que el tratamiento fue altamente exitoso. Esta evaluación se realizó a partir del 4o día de haber tratado la lesión por primera vez. En los tratamientos posteriores con fibrina, las evaluaciones se realizaron cada 4 días hasta que se obtuvo un tejido adecuado.
Resultados
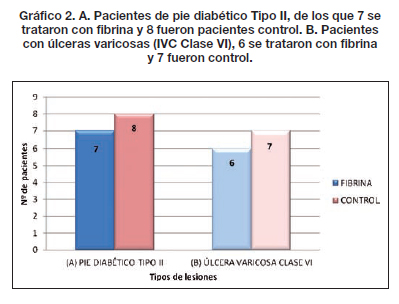
De los 34 pacientes tratados, 21 presentaban lesiones traumáticas cuyas características mostramos en el Gráfico 1; 7 pacientes fueron diagnosticados como pie diabético Tipo II (Gráfico 2A y 2B) y 6 presentaban lesiones por insuficiencia venosa crónica Clase VI. Todas las lesiones se localizaron en los miembros inferiores.
Del total de 84 pacientes, 34 fueron candidatos al tratamiento con fibrina autóloga, mientras que los 50 restantes sirvieron como grupo control. Al grupo de 34 pacientes se le realizó tratamiento con fibrina desde la primera cura que posteriormente se repitieron cada 4 días. A los otros 50 pacientes se les realizó tratamiento convencional. Su evolución sirvió para controlar y comparar, respecto al grupo tratado con fibrina, la aparición de tejido de granulación compacto y resistente, el crecimiento de tejido cicatricial y el cierre por segunda intención.
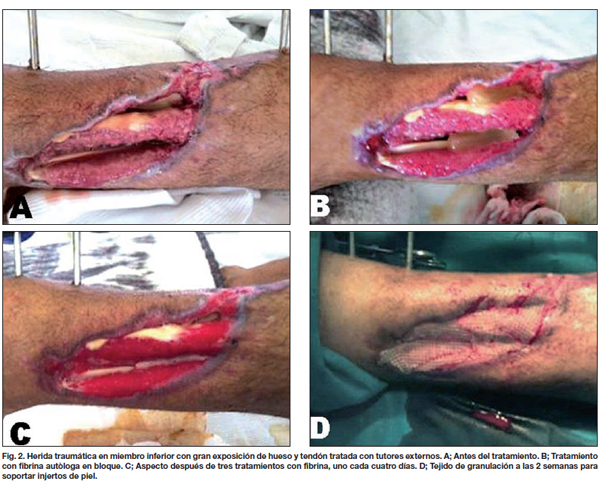
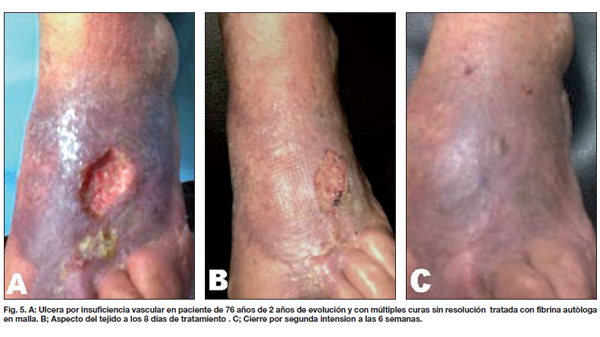
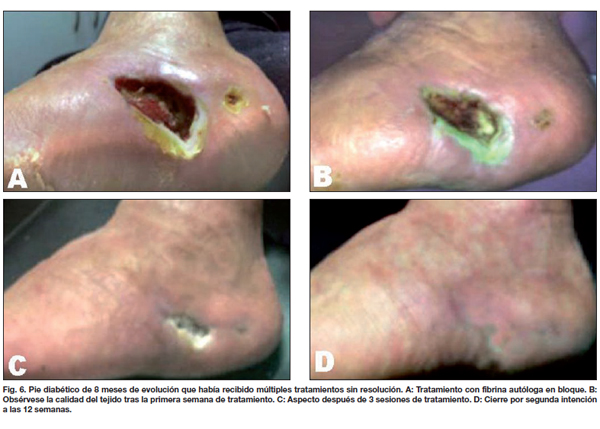
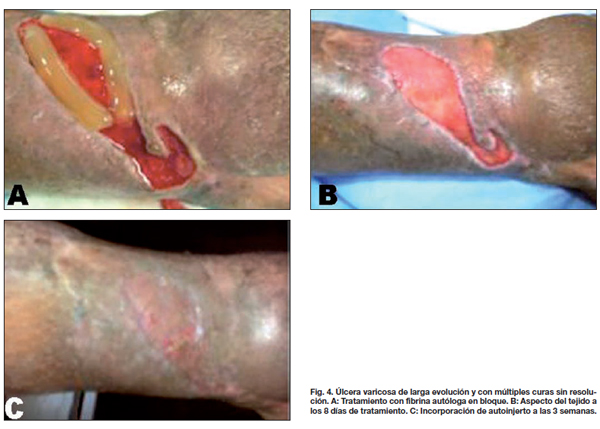
Comparamos entre ambos grupos la calidad de la piel, el tipo y tiempo de evolución, observando que las lesiones traumáticas fueron las que más rápidamente evolucionaron con aparición de los característicos signos de contracción de la herida a los 4 días, mostrando tejido de granulación evidente a los 8 días, momento en que realizamos la segunda evaluación (Fig. 2-4). En los 21 pacientes, la recuperación se logró en un promedio de 3 semanas en comparación a las 11 semanas promedio que precisaron los casos control para alcanzar el mismo resultado. De la misma manera, los 7 pacientes que presentaban úlceras secundarias a insuficiencia venosa crónica tardaron un promedio de 5 semanas en lograr un tejido adecuado para la incorporación de autoinjertos, aunque desde la primera evaluación apreciamos signos de granulación evidente y desecho de detritus necróticos (Fig. 5). Esto supuso un notable avance respecto a las 17 semanas de promedio que tardaron los casos control en lograr los mismos resultados. Por último, de los 6 pacientes tratados con fibrina y que sufrían pie diabético, 2 cerraron por segunda intención y 4 fueron injertados exitosamente (Fig. 6); mientras que a los 7 pacientes control con la misma tipificación hubo que realizarles injertos de piel repetidos (Gráfico 3).

Hay que tener en cuenta que las lesiones de pie diabético tardaron más en evolucionar hacia la epitelización, en concreto el doble de tiempo en comparación con las lesiones por insuficiencia venosa y el triple en relación a las traumáticas, con la diferencia de que todas ellas cerraron por segunda intención sin necesidad de colgajos o aplicación de autoinjertos. El tiempo de evolución promedio de los casos control fue de 24 semanas. Solo 2 de los 8 pacientes del grupo de edad entre 20 y 40 años lograron el cierre por segunda intención. El resto, 42 pacientes, precisaron tratamiento con colgajos o autoinjertos.
El análisis de contraste empleando la t de Student fue significativo. Verificamos si la diferencia entre medias era estadísticamente significativa en la aparición de tejido de granulación y en el cierre por segunda intención, tomando los valores promedio obtenidos para las 3 clases de lesiones tratadas con fibrina en contraste con los casos control. En todos los casos tratados con fibrina se alcanzó p < 0,05, indicando que la diferencia entre medias era estadísticamente significativa.
Ningún paciente del grupo de tratamiento con fibrina recibió antibióticos profilácticos ni analgésicos para no bloquear la respuesta inflamatoria asistida.
En dicho grupo no se presentaron casos de infección a diferencia de 29 casos de infección detectados entre los 50 pacientes del grupo control.
Discusión
Las lesiones de origen vascular y endocrino-neuropático suelen presentar una evolución tórpida en función de su extensión, localización y de las condiciones particulares que presente el paciente. En muchas ocasiones pueden derivar en complicaciones importantes como secuelas físicas, debidas a la propia cicatrización o bien a una amputación inevitable. De otra parte, las secuelas emocionales pueden ser altamente traumáticas en la psicología del paciente cuando se presentan procesos cicatriciales con incapacidad motriz residual o amputaciones. Asimismo, estas secuelas repercuten socialmente con altas tasas de absentismo laboral, cuya extensión en el tiempo es difícil de pronosticar. Igualmente, los sobrecostes hospitalarios cuando la evolución es difícil, hacen necesario implementar tratamientos eficaces que acorten la duración del tratamiento y minimicen las secuelas postraumáticas. En cualquier caso, una más rápida recuperación se reflejará en el grado de satisfacción por parte del paciente con respecto a los resultados del tratamiento.
Aunque no muy numerosas, se encuentran referencias sobre la utilización de hemoderivados, específicamente PRP, en la cicatrización de úlceras crónicas en extremidades inferiores desde la década de los 80 (23). Pero, a partir de los años 90 se han publicado trabajos sobre el empleo de preparados plaquetarios en solución o gel, como el estudio prospectivo de Frykbert (24) de respuesta estadísticamente significativa para el tratamiento de úlceras crónicas. Posteriormente, Montón (25) ha comunicado buenos resultados, aunque sin cuantificación analítica, sobre úlceras de etiología diversa de largo tiempo de evolución. Últimamente nuestro grupo ha realizado un importante trabajo sobre un número significativo de pacientes, comunicando buenos resultados mediante la utilización de PRP en la curación de quemaduras de segundo grado (26).
Sin embargo, no se encuentran tantas referencias sobre la utilización de fibrina en el tratamiento de lesiones como las que hemos tratado, aunque hay que citar el trabajo de Poon (27) ya que ayuda a desvelar la relación entre los mecanismos inmunomoduladores moleculares y los factores de crecimiento que intervienen en la reparación del daño tisular. Kazakos (28) ha comunicado los buenos resultados que obtiene al tratar heridas traumáticas y quemaduras por fricción empleando PRP en forma de gel.
Como consecuencia de la utilización de fibrina en los procesos que requieren actividad de la regeneración tisular en diversos órganos o tejidos, hemos de plantearnos la posibilidad de utilizar este hemoderivado particularmente en lesiones de conocida lenta evolución. Es sabido que ante una lesión de estas proporciones se origina una respuesta inflamatoria con participación de mediadores químicos y enzimáticos, radicales libres y hormonas (29). A esta respuesta se añade la activación sucesiva de macrófagos y otras células entre las que se incluyen las plaquetas, que igualmente liberan mediadores de la reparación del tejido. En esta situación, el planteamiento del presente estudio fue acelerar el proceso reparativo con el concentrado de fibrina, previniendo las complicaciones cicatriciales, en ocasiones de carácter incapacitante.
A la vista de los resultados observados podría ofertarse el uso de fibrina como tratamiento alternativo de las lesiones descritas, ya que tiene la ventaja de ser un producto autólogo. Es conveniente que la extracción hemática se realice en completa asepsia, por lo que proponemos el uso de la técnica cerrada. El resto de medidas encaminadas a plas heridas sin contaminación, propias del tratamiento de este tipo de lesiones, son prioritarias. En este sentido, la propuesta terapéutica de emplear fibrina autóloga sería válida como aliado eficaz en el caso de lesiones que requerieran injertos, colgajos o que corren el riesgo de sufrir una amputación. Aún más, si se tiene en cuenta que la calidad del tejido de granulación que se consigue, se da en menos tiempo y con resultados muy buenos. El uso de fibrina, obtiene una calidad de protección de las lesiones compacta y consistente y que, en el mismo acto de tratamiento, puede suturarse si es necesario.
No podemos dejar de mencionar que el tipo de lesiones que presentamos en este estudio constituye un grave problema de salud pública con un alto costo económicoasistencial, que tiene como consecuencias cargas sociales y emocionales negativas en las personas que las sufren (30-32).
Conclusiones
Atendiendo al número de pacientes de este estudio y en comparación con los trabajos comentados, estimamos que las observaciones efectuadas en el tratamiento de las lesiones que presentamos muestra de forma notable la eficacia del tratamiento con fibrina. Siendo la fibrina un producto natural, carente de toxicidad, no inmunogénico, autólogo y de muy bajo coste de obtención, se perfila como sumamente útil en el tratamiento de las lesiones de origen traumático que precisan de una rápida cobertura biológica.
El tiempo de recuperación más breve en relación al de los pacientes del grupo control tratados sin fibrina, junto al análisis estadístico de resultados significativos (p< 0,05) en cuanto a la rapidez de la cicatrización, afianzan este método como tratamiento prometedor. La buena homogeneidad de la superficie y características de la piel tras el cierre por segunda intención que se produce en las lesiones que precisaron injertos de piel, validan las observaciones del presente estudio.
El coste socio-sanitario fue netamente inferior debido al menor gasto derivado de un periodo de hospitalización más breve de los pacientes. Significativamente, éstos manifestaron sentirse satisfechos con los resultados obtenidos así como por haber logrado incorporarse más tempranamente a sus actividades habituales gracias a las ventajas del tratamiento con fibrina que, tal como fue diseñado, es fácilmente reproducible.
Declaración
Los autores manifiestan no tener ningún interés comercial en los productos o aparatos reseñados en el presente trabajo. Agradecen a D. Juan Carlos Medina, estadístico, su colaboración en los análisis de los datos del presente estudio.
Bibliografía
1. Tayapongsak P, O'Brien DA, Monteiro CB, Arceo-Diaz LY.: Autologous fibrin adhesive in mandibular reconstruction with particulate cancellous bone and marrow. J Oral Maxillofac Surg. 1994; 52(2):161-165; discussion 166. [ Links ]
2. Strauss MB, Aksenov IV.: Evaluations of diabetic wound classifications and a new wound score. Clin Orthop Relat Res. 2005; 439:79-86. [ Links ]
3. Lavery LA, Armstrong DG, Harkless LB.: Classification of diabetic foot wounds. Ostomy Wound Manage. 1997; 43(2):44-48. [ Links ]
4. Amstrong DG, Lavery LA, Harkless LB.: Validation of a diabetic wound classification system. The contribution of depth, infection, and ischemia to risk of amputation. Diabetes care. 1988; 21(5):855-859. [ Links ]
5. Apelqvist J, Bakker K, van Houtom WH, Schaper NC: International Working Group on the Diabetic Foot (IWGDF) Editorial Board. Practical guidelines on the management and prevention of the diabetic foot: based upon the International Consensus on the Diabetic Foot (2007) Prepared by the International Working Group on the Diabetic Foot. Diabetes Metab Res Rev. 2008; 24 Suppl 1:S181-187. [ Links ]
6. Bakker K, Apelqvist J, Schaper NC: International Working Group on the Diabetic Foot Editorial Board. Practical guidelines on the management and prevention of the diabetic foot 2011. Diabetes Metab Res Rev. 2012; 28 Suppl 1:225-231. [ Links ]
7. Gibbons G, Eliopoulos G.: Infection in the diabetic foot. In: Kozak GP, Hoar CS Jr, Rowbowthan JL, Wheelock FC Jr, Gibbons GW, Campbell D, eds. Management of the Diabetic Foot Problems. Philadelphia: Joslin Clinic and New England Deaconess Hospital.Philadelphia:W. B. Saunders, 1984:97-102. [ Links ]
8. Forrest RD, Gamborg-Nielsen P.: Wound assessment in clinical practise: A critical review of methods and their application. Acta Med Scand Suppl. 1984; 687:69-74. [ Links ]
9. Pecoraro RE, Reiber GE.: Classification of wounds in diabetic amputees. Wounds. 1990; 2:65-73. [ Links ]
10. Brodsky JW.: Clasificación de las lesiones del pie en los pacientes diabéticos. En: Levin ME, O'Neal LW, Bowker JH, Pfeifer MA. Levin y O'neal. El pie diabético. Elsevier 7a Edición. Barcelona; 2008:223-228. [ Links ]
11. Laing P.: The development and complications of diabetic foot ulcers. Am J Surg. 1998; 176(2A Suppl):11S-19S. [ Links ]
12. Macfarlane RM, Jeffcoate WJ.: Classification of diabetic foot ulcers: the S(AD) SAD system. Diabetic Foot 1999; 2:123-131. [ Links ]
13. Treece KA, Macfarlane RM, Pound P, Game FL, Jeffcoate WJ. Validation of a system of foot ulcer classification in diabetes mellitus. Diabet Med 2004; 21 (9): 987-991. [ Links ]
14. Schaper NC. Diabetic foot ulcer classification system for research purposes: a progress report on criteria for including patients in research studies. Diabetes Metab Res Rev. 2004; Suppl 1:S90-95. [ Links ]
15. Younes NA, Albsoul AM.: The DEPA scoring system and its correlation with the healing rate or diabetic foot ulcers. J Foot Ankle Surg. 2004; 43(4):209-213. [ Links ]
16. Strauss MB, Aksenov IV.: Evaluations of diabetic wound classifications and a new wound score. Clin Orthop Relat Res. 2005; 439:79-86. [ Links ]
17. Ince P, Abbas ZG, Lutale JK, et al.: Use of the SINBAD classification system and score in comparing outcome of foot ulcer management on three continents. Diabetes Care. 2008; 31(5):964-967. [ Links ]
18. Verdú J, Marine-lo J, Armans E, Carreño P, March JR, Martín V, Soldevilla J.: Conferencia Nacional de Consenso sobre úlceras de la Extremidad Inferior-CONUEI. EdikaMed. 2009. ISBN 978-84-7877-555-2. [ Links ]
19. Meggitt BF.: Surgical management of the diabetic foot. Br J Hosp Med. 1976; 16:227-332. [ Links ]
20. Wagner FW.: The dysvascular foot: a system for diagnosis and treatment. Foot Ankle. 1981; 2(2):64-122. [ Links ]
21. Jeffcoate WJ, Macfarlane RM, Fletcher EM.: The description and classification of diabetic foot lesions. Diabetic Med. 1993; 10(7):676-679. [ Links ]
22. Álvarez-Fernández LJ, Lozano F, Marinel·lo J, Masegosa-Medina JA.: Encuesta epidemiológica sobre la insuficiencia venosa crónica en España: Estudio DETECT-IVC 2006. Agiología. 2008; 60(1):27-36. [ Links ]
23. Knighton DR, Ciresi KF, Fiegel VD, Austin LL, Butler EL.: Classification and treatment of chronic nonhealing wounds. Successful treatment with autologous platelet-derived wound healing factors (PDWHF). Ann Surg. 1986; 204(3):322-330. [ Links ]
24. Frykbert RG, Driver VR, Carman D, et al.: Chronic wounds treated with a physiologically relevant concentration of platelet-rich plasma gel: a prospective case series. Ostomy Wound Manage. 2010; 56(6):36-44. [ Links ]
25. Montón J, Pérez S, Gómez GJ.: Experiencia clínica en el empleo de factores de crecimiento autólogos obtenidos de plasma rico en plaquetas. Cir plást iberolatinoam. 2007; 33(3):155-162. [ Links ]
26. Rossani G, Hernández I, Alcolea JM, Castro-Sierra R, Pérez-Soto W, Trelles MA.: Tratamiento de quemaduras mediante plasma rico en plaquetas (PRP). Part I. Cir plást iberolatinoam. 2014; 40(2):229-238. [ Links ]
27. Poon IK, Hulett MD, Parish CR.: Molecular mechanisms of late apoptotic/necrotic cell clearance. Cell Death Differ. 2010; 17(3):381-394. [ Links ]
28. Kazakos K, Lyras DN, Verettas D, Tilkeridis K, Tryfonidis M.: The use of autologous PRP gel as an aid in the management of acute trauma wounds. Injury. 2009; 40(8):801-805. [ Links ]
29. Henderson JL, Cupp CL, Ross EV, et al.: The effects of autologous platelet gel on wound healing. Ear Nose Throat J. 2003; 82(8):598-602. [ Links ]
30. Holzer SE, Camerota A, Martens L, Cuerdon T, Crystal-Peters J, Zagari M.: Cost and duration of care for lower extremity ulcers in patients with diabetes. Clin Ther. 1998; 20(1):169-81. [ Links ]
31. Ramsey SD, Newton K, Blough D, McCullough DK, Sandhu N, Reiber GE, Wagner EH.: Incidence, outcomes, and cost of foot ulcers in patients with diabetes. Diabetes Care. 1999; 22(3):382-387. [ Links ]
32. Chow I, Lemos EV, Einarson TR.: Managment and prevention of diabetic foot ulcers and infections: a health economic review. Pharmacoeconomics. 2008; 26(12): 1019-1035. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Iván Hernández
Av. Javier Prado Este 414
San Isidro, Lima, Perú.
e-mail: ihernandez@ingecel.com