My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.40 n.4 Madrid Oct./Dec. 2014
https://dx.doi.org/10.4321/S0376-78922014000400002
Estandarización de modelo experimental porcino para defectos óseos maxilares
Standardization of porcine experimental model for osseous maxillary defects
Aguilera-Salgado, A.F.* y Pérez-Dosal, M.R.**
* Médico Residente Servicio de Cirugía Plástica, Estética y Reconstructiva.
** Jefa de la Clínica de labio y paladar hendido.
Servicio de Cirugía Plástica, Estética y Reconstructiva, Hospital Dr. Manuel Gea González, México DF, México.
Artículo galardonado con el Primer Premio del Concurso Internacional de Residentes de la FILACP celebrado durante el XX Congreso de la Federación Iberolatinoamericana de Cirugía Plástica, Cancún (México), 22-27 de septiembre de 2014, y con el Primer Premio de Residentes de la AMCPER celebrado durante el XLIV Congreso Nacional de la Asociación Mexicana de Cirugía Plástica, Estética y Reparadora, Puerto Vallarta (México), 16-20 de abril de 2013.
Agradecemos al CONACYT por la financiación del proyecto (Fondo Sectorial en Salud)
Dirección para correspondencia
RESUMEN
Para evaluar la eficacia y seguridad de cualquier sustituto óseo es necesario probarlo en modelos experimentales antes de iniciar estudios clínicos. En la literatura encontramos distintos modelos experimentales que no han tenido una estandarización adecuada para su evaluación. Nuestro proyecto forma parte de una línea de investigación cuya finalidad es desarrollar un implante óseo mediante técnicas de ingeniería de tejidos. Presentamos la primera etapa del mismo que consiste en estandarizar un modelo experimental en crecimiento.
Incluimos 16 cerdos criollos sanos, destetados, de entre 3 y 6 semanas de vida, con peso mayor de 5 kg y de ambos sexos: 10 hembras y 6 machos. Realizamos 56 defectos óseos midiendo en cada uno alto, ancho y espesor con compás quirúrgico. Tras la cirugía, realizamos TAC de cráneo con reconstrucción tridimensional midiendo los mismos valores. Para evaluar el grado de regeneración lograda y los volúmenes residuales, realizamos a las 8 semanas nueva TAC de cráneo midiendo los mismos parámetros. Finalmente, analizamos clínicamente los defectos en cada cerdo tras someterlos a eutanasia y tomamos muestras del tejido regenerado para análisis morfológico, histológico, bioquímico y molecular. Para evaluar la reproducibilidad de la técnica, utilizamos el coeficiente de correlación intraclase, y para la correlación entre las evaluaciones clínicas y tomográficas, el coeficiente de correlación de Pearson.
Estudiamos 56 defectos óseos, el menor de 5 x 5 x 5 mm y el mayor de 25 x 15 x 7 mm, encontrando alta reproducibilidad en la medición clínica y tomográfica del tamaño de los defectos óseos, con altos coeficientes de correlación intraclase. Tras 8 semanas encontramos un alto porcentaje de regeneración ósea en todos los defectos. Realizamos la caracterización del tejido regenerado mediante microscopía electrónica, tinción de hematoxilina/eosina y de Von Kossa, análisis de componentes orgánicos y PCR, obteniendo datos compatibles con tejido óseo.
Nuestro proyecto permitió la estandarización de la técnica quirúrgica para crear defectos óseos maxilares en el modelo porcino, con buena reproducibilidad, corto tiempo quirúrgico y sin complicaciones en la zona.
Palabras clave: Regeneración ósea, Modelo porcino, Defectos óseos mandibulares, Defectos óseos maxilares.
Nivel de evidencia científica: V
ABSTRACT
To evaluate the efficacy and safety of any osseous substitute, we have to try them in experimental models before beginning with clinical trials. Published articles regarding experimental models have not an appropriate standardization which allows correct evaluation. Our project is part of an investigation to develop an osseous implant using tissue-engineering techniques. We present the first stage, where we standardize an experimental model in growing age.
The study included 16 healthy creole pigs, weaned, 3 to 6 weeks of life, with a weight above 5 kg and of both genders: 10 females and 6 males. We realized a total of 56 osseous defects measuring in each one its width, thickness and length. After surgery, a head CT scan with 3D reconstruction was performed, measuring the same values. To evaluate the degree of regeneration achieved and the residual volumes, 8 weeks after surgery, a new head CT scan with 3D reconstruction was performed. Finally we clinically analyzed the defects in each pig after being euthanized, and we took samples of the regenerated tissue for its morphologic, histological, biochemical and molecular analysis. To evaluate the reproducibility of this technique we used the intraclass correlation coefficient, and for the correlation between the clinical and tomographic evaluations, we used the Pearson coefficient correlation.
A total of 56 osseous defects were made, being the smallest and the largest one of 5 x 5 x 5 mm and 25 x 15 x 7 mm respectively. We found a high reproducibility in the clinical and tomographic measure of the size of the defects, with high interclass correlation coefficients. After 8 weeks, we found a high percentage of osseous regeneration in all the defects. We achieved the characterization of the regenerated tissue using electronic microscopy, hematoxylin/eosin stain, Von Kossa stain, organic component analysis and PCR, obtaining similar values to osseous tissue.
Our project allowed the standardization of a surgical technique to create maxillary osseous defects in the porcine model, with good reproducibility, low surgical times and without complications in the zone.
Key words: Osseous regeneration, Porcine model, Mandible osseous defects, Maxillary osseous defects.
Level of evidence: V
Introducción
Los injertos óseos se emplean con frecuencia para resolver deficiencias de tejido, sobre todo el hueso esponjoso autólogo tomado de cresta ilíaca, mentón o tibia, dadas sus características de rigidez y resistencia mecánica, y a la interfase con la zona receptora, puesto que se necesita estabilidad en las partes que lo rodean y una adecuada vascularización (1).
La toma del injerto de hueso puede conllevar múltiples complicaciones (2-8), por lo que las fuentes de material óseo son limitadas (9) y su indicación depende del tamaño del defecto óseo a reconstruir (10).
La regeneración tisular es la respuesta que consigue la restitutio ad integrum del tejido perdido tras un trauma, a diferencia de la reparación en la que el tejido que se forma es cicatricial, con características morfométricas, histológicas y moleculares diferentes del original (11). En este sentido, el hueso es el único tejido del organismo, a excepción del tejido embrionario, que se restituye totalmente tras una lesión. La regeneración ósea origina una respuesta en la que están involucrados los vasos sanguíneos, las células y la matriz extracelular (12).
Los modelos experimentales en los que se han probado intervenciones para evaluar la regeneración ósea se han descrito en las siguientes especies: roedores, conejos, cabras, ovejas, gorilas, chimpances, perros y cerdos; las 2 últimas son especies mayores y se prefieren por manejo y coste.
En cuanto a los déficits óseos mandibulares y el proceso de regeneración ósea, se han propuesto algunos modelos experimentales porcinos en los que las dimensiones de los defectos creados fueron arbitrarias, al igual que el tiempo transcurrido tras la intervención para evaluar la regeneración ósea (13,14). Otros estudios han intentado probar la eficacia de la aplicación de células madre en esos defectos óseos, encontrando buenos resultados en cuanto a regeneración ósea (15-17). El problema metodológico de dichos estudios es el que en ellos no se estandarizó el modelo experimental antes de aplicar la intervención, de manera que el éxito reportado pudo atribuirse a los mecanismos propios del huésped que favorecieron la regeneración ósea espontánea. Dado que deseamos como objetivo final (fase III de nuetro proyecto) evaluar la eficacia y seguridad de un implante osteogénico en un modelo experimental porcino en crecimiento y no adulto, necesitamos la estandarización del modelo y la determinación del defecto de tamaño crítico en cerdos recién destetados (4 a 6 semanas de edad) (18).
Por otra parte, no hemos encontrado información en la literatura que hable del tamaño del defecto crítico necesario para que no haya regeneración ósea en defectos óseos maxilares. La información publicada es para defectos óseos craneales y mandibulares, con resultados divergentes en cuanto a dimensión y volumen de los defectos (19,20).
El Hospital General "Dr. Manuel Gea González" (México DF, México) es un centro nacional de referencia para Cirugía Craneofacial, en el que los pacientes con defectos óseos con labio-paladar hendido, síndrome de Treacher Collins, fisuras faciales y aquellos con secuelas de trauma o resección oncológica se beneficiarían de contar con un sustituto óseo autólogo.
El proyecto que presentamos forma parte de una línea de investigación cuya finalidad es el desarrollar un implante óseo mediante técnicas de ingeniería de tejidos que permita la reconstrucción de defectos óseos maxilares y mandibulares con mínima morbilidad y con una zona donadora no visible. Su primera etapa consiste en estandarizar un modelo experimental en crecimiento con el que se puedan obtener las dimensiones mínimas necesarias para que un defecto óseo no se regenere por sí solo (18,19). Obtener un modelo experimental estandarizado favorecerá realizar estudios experimentales donde puedan compararse distintos tipo de sustitutos óseos. El elegir un modelo experimental en una especie mayor, como el cerdo, permite comparaciones indirectas y ascensos más rápidos para estudios preclínicos en el campo de la Cirugía Craneofacial, Cirugía Máxilofacial, Odontología y Oncología. Se trata por tanto de un proyecto innovador debido a que, hasta ahora, no se ha cuestionado cuál es el tamaño de defecto óseo crítico en la región maxilar y mandibular antes de probar la efectividad de cualquier sustituto óseo.
Material y método
Hemos realizado un estudio experimental, analítico, prospectivo y longitudinal, con el objetivo de estandarizar la técnica quirúrgica para obtener defectos óseos maxilares reproducibles. Nuestros objetivos secundarios fueron la caracterización del tejido óseo porcino y óseo regenerado, así como la determinación del tamaño crítico del defecto maxilar donde no haya regeneración ósea. Nuestra población objetivo incluyó un modelo animal porcino, eligiendo cerdos de la especie criolla (cerdo blanco) y el periodo de estudio se estableció entre noviembre y diciembre del 2012.
Tamaño de la muestra
Dado que esta etapa del proyecto es un estudio piloto para estandarización de un modelo experimental en la que podría optarse por una muestra por conveniencia, decidimos calcular un tamaño de muestra en base a la reproducibilidad del procedimiento quirúrgico, pues nuestro objetivo más relevante es la estandarización de una técnica. Así, si deseamos detectar un coeficiente de correlación de 0,95 con un nivel de confianza del 99 %, una potencia de prueba del 90 % y un error alfa del 5 %, requerimos un tamaño de muestra de 16 casos.
Criterios de selección
Elegimos 16 cerdos criollos provenientes de 2 camadas, destetados, de entre 4 y 6 semanas de vida, con un peso mayor de 5 kg, sanos y de ambos sexos (Fig. 1). Excluímos aquellos con antecedente quirúrgico previo o con instrumentación en el sitio de manipulación. Eliminamos también aquellos con alguna enfermedad que requiriera la aplicación de medicamentos inmunosupresores o que retrasen la cicatrización durante el periodo de seguimiento, así como los que sufrieron muerte no relacionada con el procedimiento realizado.
Descripción de procedimientos
Los animales fueron donados por el Departamento de Producción Porcina de la Facultad de Veterinaria de la Universidad Nacional Autónoma de México y se manejaron de acuerdo a los códigos internacionales de ética hacia los animales (20,21), además de contar con la aprobación del Comité Interno para el Cuidado y Uso de Animales de Laboratorio y del Comité de Investigación del Hospital General "Dr. Manuel Gea González" (05-80-2012).
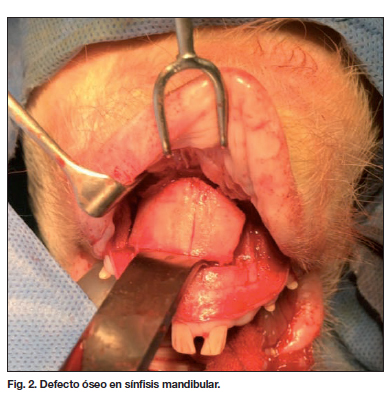
Bajo anestesia general, previa antisepsia vestibular con isodine, tomando como punto de referencia el sitio de emergencia del canino, realizamos 4 defectos óseos en 8 cerdos con osteotomos y martillo quirúrgico. En los 8 cerdos restantes, realizamos 3 defectos óseos tomando como punto de referencia la sínfisis mandibular para realizar el tercer defecto (Fig. 2). Medimos el alto, ancho y espesor de cada defecto con un compás quirúrgico. Tras la cirugía se les realizó una tomografía computarizada (TAC) de cráneo con reconstrucción tridimensional (3D), midiendo el alto, ancho y espesor de cada defecto (Fig. 3).
Tras un periodo de recuperación, los animales fueron transladados a un corral en el bioterio del hospital, y tratados con antibiótico y analgésico, manteniéndolos en ayuno durante 24 horas para posteriormente continuar con libre acceso a comida y agua.
Los cerdos continuaron en observación durante 8 semanas, manteniéndolos en un ambiente limpio, recibiendo cuidados y atención por un equipo de veterinarios. Al cumplir ese tiempo, realizamos una nueva TAC de cráneo midiendo los mismos parámetros para evaluar el grado de regeneración lograda y los volúmenes residuales, siendo este el tiempo en el que otros estudios han evaluado defectos óseos en modelos experimentales porcinos.
Finalmente, analizamos clínicamente los defectos en cada cerdo tras someterlos a eutanasia. En esta etapa, tomamos muestras del tejido regenerado para su análisis morfológico mediante microscopía electrónica; histológico, mediante tinción de hematoxilina/eosina y Von Kossa; bioquímico, mediante difracción de rayos X; y molecular mediante PCR.
Para evaluar la reproducibilidad de la técnica hemos utilizado el coeficiente de correlación intraclase, y para la correlación entre las evaluaciones clínicas y tomográficas, el coeficiente de correlación de Pearson.
RESULTADOS
Incluimos en el estudio 16 cerdos criollos de 4 semanas de edad, destetados y con un peso promedio de: 13,13 ± 3,04kg, 10 hembras (62,5 %) y 6 machos (37,5 %), en los cuales realizamos un total de 56 defectos óseos con las siguientes dimensiones y distribución de los defectos:
• A: 5 x 5 x 5 mm en la región maxilar derecha.
• B: 10 x 10 x 5 mm en la región maxilar izquierda.
• C: 20 x 20 x 7 mm en la sínfisis mandibular.
• D: 10 x 10 x 10 mm en la región mandibular derecha.
• E: 15 x 15 x 10 mm en la región mandibular izquierda.
• F: 20 x 15 x 7 mm en la región maxilar derecha.
• G: 25 x 15 x 7 mm en la región maxilar izquierda.
El promedio de las medidas clínicas se muestra en la Tabla I. Las medidas de espesor y volumen presentaron cierto grado de variación en los defectos B, C, E y F por la anatomía propia del modelo experimental, siendo en todos estos casos defectos bicorticales.
El tiempo promedio para realizar los defectos óseos en el cerdo fue de: 50 ± 17,04 minutos, disminuyendo a medida que progresábamos en experiencia.
Al realizar el análisis de reproducibilidad de las medidas clínicas obtenidas en los 16 cerdos, encontramos un coeficiente de correlación intraclase (CCI) de 0,874 para la medida altura basal clínica (p =; 0,0001), CCI de 0,85 (p =; 0,001) para la medida ancho basal, y CCI de 0,809 para el espesor basal.
Un cerdo (12,5 %) presentó como complicación postoperatoria inmediata broncoaspiración que se resolvió con maniobras de soporte pulmonar. Ningún cerdo presentó infección del área quirúrgica. La mortalidad fue cero.
A continuación, realizamos TAC con reconstrucción 3D y obtuvimos, de acuerdo a cada defecto, las mediciones que presentamos en la Tabla II. A través de estas reconstrucciones analizamos el grado de concordancia entre 2 evaluadores independientes (radiólogo y cirujano plástico), encontrando una buena correlación en las siguientes medidas: altura basal (r =; 0,83), ancho basal (r =; 0,72) y volumen basal (r =; 0,74). Encontramos una baja correlación en el espesor (r =; 0,40). Esta última medida requirió de mayor estandarización, lo que hizo necesaria una mayor capacitación de evaluadores hasta lograr una correlación para la medida espesor (r =; 0,72).
La comparación entre evaluaciones clínicas y radiológicas mostró una correlación adecuada en las variables: altura (r=0,74), ancho (r=0,82), espesor (r=0,72) y volumen (r=0,76).
Después de 8 semanas, los cerdos fueron sometidos a eutanasia previa realización de TAC con reconstrucción 3D. Realizamos las mismas mediciones al final del seguimiento y encontramos los valores que presentamos en la Tabla III.
Al comparar los volúmenes iniciales y finales para cada tipo de defecto encontramos diferencias en todos los grupos, observando una clara disminución del volumen inicial del defecto al final del seguimiento, lo que implica regeneración ósea. En la Tabla IV podemos apreciar las diferencias en cuanto al volumen inicial y el volumen final, así como el alto porcentaje de regeneración ósea en cada defecto.
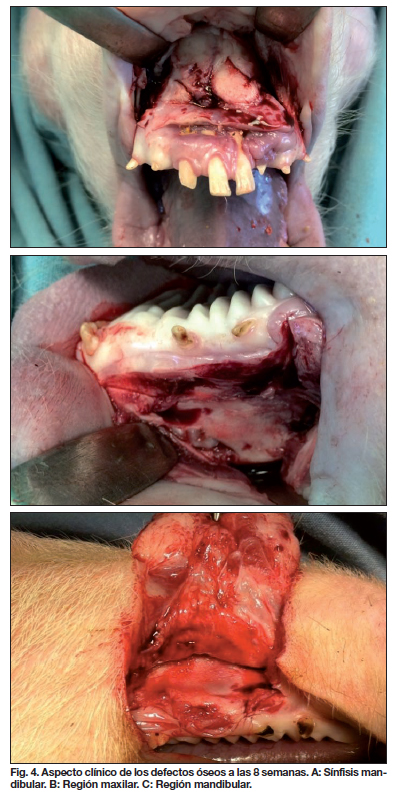
Al realizar la eutanasia, pudimos comprobar clínicamente, mediante evaluación macroscópica, la existencia de regeneración ósea en todos los casos (100 %), observando puentes óseos o láminas óseas externas delgadas en todos ellos. Solo en 4 casos (25 %) había trazos residuales del defecto óseo original; en los casos restantes, clínicamente era imposible diferenciar el hueso sano del hueso regenerado (Fig. 4).
Tomamos muestras del tejido óseo regenerado para su caracterización mediante microscopia electrónica, en la que evaluamos la presencia de trabéculas ordenadas y puentes óseos en el 100 % de los defectos.
El análisis histológico con hematoxilina/eosina mostró proliferación fibroblástica y de osteoblastos. En todos los casos se demostró regeneración de periostio, lo cual es prueba de que el periostio es una fuente de precursores osteogénicos autosustentable (Fig. 5). La tinción de Von Kossa demostró que la matriz extracelular estaba calcificada (Fig. 6).
Realizamos análisis bioquímico del tejido óseo regenerado mediante análisis de componentes orgánicos, evaluando los porcentajes de carbono, oxígeno, sodio, magnesio, silicio, fósforo, potasio, calcio, hierro y zinc. El calcio (Ca) presentó valores promedio de 26,3 gr, mientras que el fósforo (P) fue de 13,3 gr, con una relación Ca:P de 2:1, lo cual es compatible con el tejido óseo sano de la especie porcina y humana.
Finalemente, identificamos mediante PCR la expresión de RUNX2, colágeno tipo I y osteopontina. Dicho comportamiento molecular es característico del tejido óseo.
Discusión
La descripción de modelos animales experimentales para defectos óseos y determinación del tamaño crítico de los mismos para estudios de regeneración ósea, se ha hecho para distintas especies en región craneal y mandibular. Propusimos en este trabajo la estandarización de un modelo experimental porcino para estudios de regeneración ósea subsecuentes en región maxilar y mandibular en cerdos en etapa de crecimiento.
En la literatura se han planteado 3 modelos experimentales porcinos para defectos óseos. En el primer estudio, descrito por Schlegel (22), se propone un modelo experimental en cerdos adultos con defectos craneales monocorticales de 10 x 10 x 10 mm, en los cuales evaluó la efectividad del hueso esponjoso autólogo, sin encontrar regeneración completa en seguimientos de hasta 52 semanas.
Zheng (23,24), evaluó la efectividad de la aplicación de células madre en 4 tipos de defectos óseos en sínfisis mandibulares de cerdos de 12 a 16 semanas de vida (en etapa de crecimiento). Las dimensiones que utilizó este autor fueron similares a las de nuestros defectos A y B. Lo criticable de este estudio es que demuestra la efectividad de la regeneración en todos los defectos sin haber estandarizado su modelo experimental. El defecto de tamaño crítico se basa en lo descrito para tamaños críticos craneales. Finalmente, elige 2 cerdos que sacrifica a las 4 semanas de realizado el defecto sin encontrar regeneración; sin embargo, por el tiempo de evolución, es posible que la falta de regeneración en esa etapa fuera evaluada de forma muy temprana. La eficacia de su intervención se pone en duda con los hallazgos reportados en otros estudios.
Finalmente, Ruehe (25) demuestra en un modelo animal porcino adulto regeneración ósea en defectos mandibulares de 10,1 cm3, 4,2 cm3 y 1,9 cm3, del 75,5 %, 87,2 % y 57,4 % respectivamente a las 6 semanas después de realizados los defectos, por lo que el autor pone en duda el concepto de que el defecto de tamaño crítico para regeneración ósea establecido en la literatura sea de 5 cm3 y exhorta a la realización de una mayor investigación que permita el análisis cualitativo y cuantitativo tanto de los injertos como de los sustitutos óseos.
De forma contradictoria, nuestros hallazgos demuestran que aún realizando defectos óseos bicorticales, encontramos un alto porcentaje de regeneración en todos los defectos óseos realizados. Empleamos distintas dimensiones (mínimas y máximas), incluso más grandes que las reportadas en la literatura para la edad y tamaño de cerdos en crecimiento, reproduciendo el fenómeno de regeneración.
Con nuestros hallazgos no pudimos obtener un tamaño crítico de defecto óseo en el que la regeneración sea mínima. Lo único que podemos recomendar es que los defectos óseos deberán ser mayores de 25 x 15 x 7 mm en cerdos de 4 semanas de edad con las mismas características que los nuestros. La necesidad de realizar estudios en modelos porcinos en crecimiento radica en el estudio del proceso de regeneración y uso de sustitutos óseos en pacientes pediátricos. Se sabe que los primeros 6 meses de vida del modelo porcino implican los 10 primeros años de vida de un humano.
Ponemos en duda los resultados de otros autores que demuestran eficacia de intervenciones en regeneración ósea con defectos óseos menores e iguales a los nuestros, y recomendamos continuar con investigaciones subsecuentes para determinar realmente cual es el tamaño de defecto crítico.
Demostramos que la técnica quirúrgica es reproducible y confiable. Existe buena correlación entre las medidas clínicas y tomográficas en las mediciones de alto, ancho y volumen del defecto; sin embargo, habrá que trabajar en una mayor estandarización de evaluadores con respecto a la medición espesor, que reflejó una baja reproducibilidad.
Por otra parte, aportamos nueva información sobre la caracterización histológica, molecular (PCR), análisis de superficie ósea (microscopia electrónica) y análisis de componentes macroscópicos (difracción de rayos X) en hueso porcino, datos que no están recogidos en la literatura y que nos permiten tener parámetros basales de comparación a la hora de probar la eficacia de sustitutos óseos en investigaciones subsecuentes.
Conclusiones
En nuestro estudio fue posible estandarizar un modelo experimental porcino en crecimiento para defectos óseos maxilares con una alta confiabilidad y reproducibilidad.
Las mediciones clínicas y tomográficas presentan una buena correlación y muestran buena reproducibilidad.
En todos los defectos creados hubo regeneración ósea demostrada clínica y radiológicamente.
El tejido regenerado demostró ser histológicamente compatible con hueso (tinción con hematoxilina/eosina); además posee una matriz ósea que se mineraliza (depósitos de calcio mediante tinción de Von Kossa) y expresa factores de transcripción RUNX2 y proteínas osteoinductoras como la osteopontina (PCR).
La superficie del tejido regenerado mostró en todos los casos espículas y puentes óseos mediante microscopia electrónica.
Determinamos los componentes orgánicos del tejido óseo mediante difracción de rayos X encontrando un alto componente de calcio y fósforo, con una relación 2:1 en el tejido óseo de nuestra especie.
Por el contrario, no logramos obtener un tamaño crítico de defecto óseo en el que la regeneración fuera mínima. Hacemos notar que en la literatura que recoge la efectividad de sustitutos óseos, ésta se debe a regeneración propia y no al sustituto que los investigadores prueban, lo que hace necesario continuar investigando el defecto de tamaño crítico en el que la regeneración ósea sea mínima, aún cuando para ello se tengan que realizar defectos tan grandes como una hemimandibulectomía o una hemimaxilectomía.
Agradecimientos
Agradecemos al Hospital General "Dr. Manuel Gea González", al Instituto Nacional de Rehabilitación, a la UNAM y a todos los médicos involucrados en la realización de nuestro modelo.
Bibliografía
1. Laurell L, Gottlow J, Zybutz M, et al. Treatment of intrabony defects by different surgical procedures. A literature review. J Periodontol 1998;69(3):303-313. [ Links ]
2. Eufinger H, Leppanen H. Iliac crest donor site morbidity following open and closed methods of bone harvest for alveolar cleft osteoplasty. J Craniomaxillofac Surg 2000; 28 (1):31-38. [ Links ]
3. Dawson KH, Egbert MA, Myall RW. Pain following iliac crest bone grafting of alveolar clefts. J Craniomaxillofac Surg 1996; 24(3):151-154. [ Links ]
4. Kalk WW, Raghoebar GM. Morbidity from iliac crest bone harvesting. J Oral Maxillofac Surg 1996; 54: 1424-1429. [ Links ]
5. Skouteris CA, Sotereanos GC. Donor site morbidity following harvesting of autogenous rib grafts. J Oral Maxillofac Surg 1989; 47: 808-812. [ Links ]
6. Marx RE, Morales MJ. Morbidity from bone harvest in major jaw reconstruction: a randomized trial comparing the lateral anterior and posterior approaches to the ilium. J Oral Maxillofac Surg 1988; 48: 196-203. [ Links ]
7. Younger EM, Chapman MW. Morbidity at bone graft donor sites. J Orthop Trauma 1989;3:192-195. [ Links ]
8. Oakley MJ, Smith WR, Ziran NM, et al. Repetitive posterior iliac crest autograft harvest resulting in an unstable pelvic fracture and infected non-union: case report and review of the literature. Patient Safety in Surgery 2007, 1:6-12. [ Links ]
9. Zheng YX, Ringe J, Liang Z. Osteogenic potential of human periosteum-derived progenitor cells in PLGA scaffold using allogeneic serum. J Zhejiang Univ Sci B. 2006; 7(10):817-824. [ Links ]
10. De Bari C, Dell'Accio F, Karystinou A. A biomarkerbased mathematical model to predict bone-forming potency of human synovial and periosteal mesenchymal stem cells. Arthritis Rheum 2008; 58(1):240-250. [ Links ]
11. Katagiri T, Takahashi N. Regulatory mechanisms of osteoblast and osteoclast differentiation. Oral Dis 2002; 8(3):147-159. [ Links ]
12. Cancedda R, Bianchi G, Derubeis A. Cell therapy for bony disease: a review of current status. Stem Cells 2003; 21:610-619. [ Links ]
13. Gil Albarova J, Garrido Lahiguera R, Gil Albarova R, et al. Materiales para la reparación y sustitución ósea. Modelos animales. Mapfre Medicina, 2003; 14: 51-65. [ Links ]
14. Hollinger JO, Kleinschmidt JC. The critical size defect as an experimental model to test bone repair materials. J Craniofac Surg. 1990 Jan;1(1):60-68. [ Links ]
15. Rabie AB, Chay SH. Clinical applications of composite intramembranous bone grafts. Am J Orthod Dentofacial Orthop. 2000;117(4):375-383. [ Links ]
16. Hennessey JW, López-Noriega JC, Sámano-Osuna I. Uso de injerto autógeno en la reconstrucción de defectos óseos de la región maxilofacial: casos clínicos. Revista Odontológica Mexicana 2205;9(2):97-106. [ Links ]
17. Syed-Picard FN, Larkin LM. Three-dimensional engineered bone from bone marrow stromal cells and their autogenous extracellular matrix. Tissue Eng 2009; 15(1):187-195. [ Links ]
18. Pérez-Dosal MR, Sánchez-Guerrero FJ, Martínez-Lopez V, Ruvalcaba E, Zárate D, Luna-Bárcenas G, Velasquillo-Martínez MC. Desarrollo de línea osteogénica derivada de células madre para el tratamiento de fisuras palatinas. Tesis para obtener el grado de Maestría en Ciencias Médicas, Programa de Maestría y Doctorado en Ciencias Médicas, Odontológicas y de la Salud, UNAM. [ Links ]
19. Reynolds MA, Aichelmann-Reidy ME, Branch-Mays GL, et al. The efficacy of bone replacement grafts in the treatment of periodontal osseous defects. A systematic review. Ann Periodontol 2003;8(1):227-265. [ Links ]
20. Ito K, Yamada Y, Naiki T, Ueda M. Simultaneous implant placement and bone regeneration around dental implants using tissue-engineered bone with fibrin glue, mesenchymal stem cells and platelet-rich plasma. Clin Oral Implants Res 2006;17(5):579-586. [ Links ]
21. Rutherford KM, Donald RD, Lawrence AB, Wemelsfelder F. Qualitative Behavioural Assessment of emotionality in pigs. Appl Anim Behav Sci. 2012; 139:(3-4):218-224. [ Links ]
22. Schlegel KA, Lang FJ, Donath K, et al. The monocortical critical size bone defect as an alternative experimental model in testing bone substitute materials. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;102(1):7-13. [ Links ]
23. Zheng, Y. Liu, C.M. Zhang, et al. Stem Cells from Deciduous Tooth Repair Mandibular Defect. En Swine. J Dent Res. 2009; 88(3): 249-254. [ Links ]
24. Liu Y, Zheng Y, Ding G, et al. Periodontal Ligament Stem Cell-Mediated Treatment for Periodontitis in Miniature Swine. Stem Cells. 2008 ; 26(4): 1065-1073. [ Links ]
25. Ruehe B, Niehues S, Heberer S, et al. Miniature pigs as an animal model for implant research: bone regeneration in critical-size defects. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009;108(5):699-706. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Alexandro Fernando Aguilera Salgado
Av. Calzada de Tlalpan #4800, Colonia Sección XVI,
Delegación Talpan
México Distrito Federal, CP: 14080 México
e-mail: alexandruss@hotmail.com