My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.41 n.1 Madrid Jan./Mar. 2015
https://dx.doi.org/10.4321/S0376-78922015000100003
Uso de expansores tisulares a modo de soporte cutáneo. presentación de un nuevo dispositivo
Tissue expanders as cutaneous support. presentation of a new device
Moretti, E.
Jefe del Servicio de Cirugía Plástica, Estética y Reparadora, Sanatorio los Arroyos, Grupo Gamma, Servicio Universitario acreditado por la Universidad Abierta Interamericana, sede Rosario.
Dirección para correspondencia
RESUMEN
Presentamos a la comunidad médica un nuevo dispositivo de diseño personal para uso en reconstrucción mamaria bilateral. Es similar a un expansor tisular, pero posee como diferencias un tubo conector de 3,3 mm de diámetro interno y 5 mm de diámetro externo, pico Lubber para conexión directa a jeringa y sin válvula. El sistema ha sido diseñado por el Departamento de Ingeniería de la fábrica Nagor®, Cumbernauld, Escocia, Reino Unido, siguiendo las indicaciones del autor.
Su uso se limita a casos de mastectomía con conservación de tejidos (mastectomía con conservación de piel, mastectomía con conservación de areola-pezón) y mastectomía para reducción de riesgo (adenomastectomía profiláctica), ya que su propósito es dar soporte tisular durante un corto período de tiempo (promedio de 10 días), hasta que se reciba el informe final histopatológico y se proceda al cambio por los implantes definitivos ajustados en tamaño y simetría.
Presentamos resultados en 30 casos en los que el dispositivo se ha usado de forma bilateral.
Palabras clave: Reconstrucción mamaria, Expansores tisulares, Mastectomía, Adenomastectomía.
Nivel de evidencia científica 4.
ABSTRACT
A new device to be used in bilateral breast reconstructions is presented to the medical community. The device is similar to a tissue expander, but has a 5 mm connector tube (3,3 mm inside), with a Lubber tip with direct syringe connection and it has no valve. With the co-operation of the Department of Engineering at Nagor Corp®, Cumbernauld, Scotland, United Kingdom, the new device was designed in line with the specifications drawn up by the author.
It is exclusively designed to be used in mastectomies with tissue preservation (skin sparing mastectomy, nipple- sparing mastectomy) and risk-reducing mastectomies (prophylactic adenomastectomies), since its purpose is to be used as a tissue support for a short period of time (average 10 days) until the final anatomical pathology report is received and thus the change is made for definitive implants, adjusted in size and symmetry.
We present the results in 30 cases using the new device in bilateral procedures.
Key words: Breast reconstruction, Tissue expanders, Mastectomy, Adenomastectomy.
Level of evidence 4.
Introducción
En los últimos tiempos observamos un aumento mundial en la frecuencia del cáncer de mama, con detección en pacientes cada vez más jóvenes. La aparición de grupos de alto riesgo (pacientes portadoras de mutaciones del BRCA I y II, antecedentes familiares múltiples de cáncer de mama, mamas de difícil seguimiento, pacientes portadoras de cáncer de mama tratado con factores de alto riesgo asociado, etc) (1), así como el aumento de la cancerofobia que ha llevado a la exigencia por parte de las pacientes de la extirpación de sus mamas, han creado un sensible aumento de la cirugía de mastectomía bilateral en los últimos 2 años (2-3).
La indicación de una mastectomía bilateral o de una mastectomía unilateral con adenomastectomía profiláctica contralateral ha significado todo un nuevo desafío para los cirujanos plásticos.
El empleo de expansores y su posterior cambio por implantes definitivos es la técnica más utilizada para efectuar la reconstrucción mamaria inmediata (75%) según la Sociedad Americana de Cirugía Plástica (4).
Desde 1978, con Radovan (5-6), son numerosos los grupos con experiencia en reconstrucción inmediata que utilizan expansores anatómicos de superficie texturizada y con válvula incorporada o con válvula remota (7).
La colocación de un implante-expansor (modelo Becker) (8) no se indica con frecuencia ya que para su correcto uso se necesita una amplia curva de aprendizaje previa empleando expansores convencionales. Se utilizan en particular en casos de reconstrucción mamaria en los que hay probable dificultad para lograr la simetría y en situaciones especiales para reducir el número de tiempos quirúrgicos (9).
El motivo de esta publicación es presentar a la comunidad médica un nuevo dispositivo que posee las característica de un expansor tisular, con sus beneficios para estos casos, pero que funciona a modo de sostén o soporte de los tejidos cutáneos postmastectomía conservadora de piel y tras mastectomía de reducción de riesgo (adenomastectomía profiláctica), diseñado con la colaboración del Departamento de Ingeniería de la empresa Nagor Corp® (Cumbernauld, Escocia, Reino Unido), siguiendo las especificaciones realizadas por el autor.
Material y método
Descripción del dispositivo
El dispositivo tiene las características de un expansor tisular de válvula remota similar a los tradicionalmente producidos por la empresa, de forma anatómica, superficie lisa, con modificaciones en el tubo conector. Dicho tubo pasa de una medida de 1,3 mm en su interior y 3,8 mm en su exterior, a ser un tubo de 3,3 mm en su interior y 5 mm en el exterior. En el extremo conector hemos colocado un pico tipo Lubber para conexión directa a jeringa. No tiene válvula (Fig. 1).
Los detalles técnicos de la pared del dispositivo siguen las especificaciones propias de fabricación de los expansores: 5 capas de silicona, capa barrera, pruebas de elongación que superan el valor 400, todo ello de acuerdo con la información provista por el Departamento de Ingeniería de Nagor® (10). Los nuevos dispositivos se identifican por impresión con láser del número de lote y tamaño, se empaquetan y esterilizan por óxido de etileno. Poseen además la certificación CE para expansores obtenida por la empresa bajo el certificado CE 02248 (11).
Se fabricaron 60 dispositivos con volúmenes entre 335 cc a 540 cc para su empleo en el proyecto de investigación.
Diseño del estudio
En marzo del 2010 diseñamos un protocolo de investigación de fase clínica para empleo de los nuevos dispositivos en pacientes sometidas a procedimientos de reconstrucción mamaria bilateral tras cirugía oncológica inmediata.
Entre mayo del 2010 y mayo del 2012 tratamos 30 pacientes en las que efectuamos mastectomías con conservación de piel y mastectomías de reducción de riesgo (adenomastectomías profilácticas) en la mama contralateral, con colocación de nuestro dispositivo expansor de forma bilateral y simétrica en cada caso.
La edad promedio de las pacientes fue de 42 años (29 a 53 años). Todas fueron evaluadas previamente por el Comité de Tumores de nuestra institución y se acordó en todos estos casos efectuar el procedimiento quirúrgico de forma bilateral debido a diferentes factores: lesiones contralaterales, mamas muy densas difíciles de controlar, microcalcificaciones, cancerofobia, etc.). En la mama con lesión maligna efectuamos estudio de ganglio centinela, y en la mama contralateral, en solo 4 casos, realizamos dicho procedimiento por indicación de Mastología. En todos los casos se procedió a la extirpación del tejido mamario por parte del grupo quirúrgico oncólogomastólogo, ingresando el equipo reconstructivo al finalizar el tiempo oncológico. Al comenzar la etapa reconstructiva procedimos a disecar el bolsillo para la colocación del dispositivo; este bolsillo siempre fue parcialmente submuscular, debajo del músculo pectoral mayor.
En todos los casos seccionamos las inserciones medias (internas) y bajas del músculo a la altura del 5o espacio intercostal (Fig. 2). Esta sección completa interna logró la relajación muscular y permitió que el dispositivo alcanzara una mayor aproximación a la zona central esternal. Así mismo, en todos los procedimientos, colocamos una malla de poliglactina 910 (Vicryl® código VKMM) de 6´´x 6´´: 15 x 15 cm (12) suturada con el mismo material al borde inferior libre del músculo pectoral mayor (Fig. 3), y en el otro extremo al surco submamario. De esta manera, se cortó la malla y ocupó el espacio entre la línea axilar anterior por fuera, el borde del músculo pectoral mayor por arriba, el surco submamario por abajo y la separación obtenida por la sección del pectoral internamente, en la parte medial. Logramos así el cierre del espacio submuscular parcial manteniendo el dispositivo en dicho lugar, evitando su migración al espacio dejado por la adenomastectomía y disminuyendo la retracción hacia arriba de las fibras del pectoral (Fig. 4).
En el grupo de estudio colocamos 60 dispositivos y exteriorizamos los tubos de llenado por contrabertura, extrayéndolos a nivel de la zona central de la incisión submamaria, para permitir así la ubicación correcta del dispositivo sin desplazamiento (Fig. 5). Los tamaños de los dispositivos variaron dependiendo del tejido extirpado calculado según principio de Arquímedes (Fig. 6), con un promedio de 435 cc (entre 335 y 515 cc). A continuación, los llenamos con solución fisiológica estéril a través del tubo conector con jeringa tipo Lubber de 60 cc. Con el dispositivo expandido en su totalidad, efectuamos los ajustes necesarios en los bolsillos submusculares así como los ajustes de la malla de poliglactina 910. De esta forma controlamos completamente el posicionamiento del dispositivo, la ubicación del músculo pectoral mayor y la tensión de la malla. También definimos correctamente el surco submamario y liberamos los tejidos próximos para tratar de obtener la mayor simetría posible. Una vez logrado dicho objetivo, procedimos a desinflar el dispositivo dejando solo un 20% del volumen total con el objeto de evitar la presión sobre los tejidos cutáneos (Fig. 7-10).



En todos los casos dejamos un drenaje en el lecho de la mastectomía y próximo al dispositivo, que se exteriorizó por contrabertura a nivel de la línea axilar anterior. Colocamos cura oclusiva en las incisiones quirúrgicas y alrededor de los drenajes y espuma de poliuretano sobre la superficie cutánea del tórax más un vendaje compresivo elástico suave.
Todas las intervenciones se realizaron bajo anestesia general con intubación orotraqueal. El tiempo promedio de las cirugías fue de 3 horas, de las cuales 90 minutos correspondieron al acto reconstructivo propiamente dicho.
La cirugía fue bien tolerada en todos los casos siguiendo un internamiento hospitalario de 36 horas promedio (entre 24 a 48 horas). Todas las pacientes permanecieron en sala común con antibioticoterapia de tratamiento (cefadroxilo 500 mg cada 12 horas hasta el momento de la segunda intervención quirúrgica), analgésicos convencionales, protectores gástricos (lanzoprazol), profilaxis de trombosis venosa profunda con vendajes elásticos en ambos miembros inferiores, enoxiheparina 40 mg en dosis única diaria durante la hospitalización, y deambulación precoz. En el seguimiento posterior de las pacientes, retiramos los drenajes en un promedio de 4 días (entre 3 y 6 días).
Con respecto al comportamiento de los dispositivos, en la primera cura realizada en el momento del alta hospitalaria a las 36 horas de la intervención controlamos la vitalidad de los tejidos cutáneos y procedimos a la expansión según tolerancia al dolor. Los volúmenes utilizados en esta expansión fueron de 180 cc como promedio en cada dispositivo (rango entre 120 a 240 cc). Las pacientes fueron controladas a los 5 y 7 días, momento en el que continuamos expandiendo. Los volúmenes colocados en estos 2 controles fueron de 90 a 120 cc como promedio por dispositivo y en cada control, logrando así una expansión completa del sistema a los 7 días del postoperatorio (Fig. 11).
Una vez recibido el informe anatomo-patológico diferido por parte del grupo oncológico y estudiada nuevamente cada paciente por el Comité de Tumores de nuestra Institución para determinar la conducta a seguir en cada caso particular, procedimos a llevar a las pacientes nuevamente a quirófano para efectuar el recambio de los dispositivos expansores por los implantes definitivos, así como todos los ajustes necesarios para obtener la mayor simetría mamaria posible.
Este segundo acto quirúrgico se realizó a los 10 días como promedio (entre 8 y 12 días), bajo anestesia con máscara laríngea; procedimos a la retirada de los dispositivos y a la colocación de implantes mamarios definitivos de la misma marca comercial. Los implantes fueron todos anatómicos, con superficie texturizada y volumen de entre 335 y 515 cc., con diferentes alturas (CoGel® system) dependiendo de la anchura y la altura de la mama a reconstruir. En total, 26 implantes CoGel® XF3 y 34 implantes CoGel® XM3. Los volúmenes de los implantes del primer grupo fueron: 16 implantes 405-XF3, 8 implantes 465-XF3 y 2 implantes 515-XF3, siendo el promedio de este grupo de 430 cc; en el segundo grupo los volúmenes fueron: 2 implantes 335-XM3, 4 implantes 375-XM3, 18 implantes 440- XM3 y 10 implantes 485-XM3, con un promedio de 440 cc (Fig. 12).
En todos los casos libramos la malla de poliglactina 910 a nivel del surco submamario para retirar y colocar el implante definitivo, anclando nuevamente la malla con el mismo material.
Resultados
No constatamos procesos infecciosos, febriles o eritematosos en las zonas operadas. Las expansiones a los 5 y 7 días se realizaron en el consultorio, con técnicas asépticas, y con solución fisiológica estéril. Todas las pacientes toleraron la expansión completa sin evidencias de sufrimiento de la piel o dolor intenso.
En el momento de decidir el recambio por los implantes definitivos, las pacientes tuvieron la oportunidad de opinar sobre el tamaño final en colaboración con el equipo de Cirugía Plástica, ya que fue sencillo inflar o desinflar los dispositivos expansores con una jeringa de 60 cc.
El recambio por los implantes definitivos se realizó a los 10 días (entre 8 y 12 días). En todos los casos procedimos a la toma de cultivos para bacteriología y colocamos los implantes definitivos en el mismo plano en el que se encontraban los expansores.
En 2 casos, el equipo oncológico procedió a efectuar estudio de la región axilar debido a que el estudio anatomopatológico diferido informó de la presencia de carcinoma en la mama contralateral (hallazgo en la pieza de adenomastectomía profiláctica). Este abordaje de la región axilar se realizó por una incisión independiente en axila.
El promedio de duración del segundo procedimiento quirúrgico fue de 60 minutos y el alta hospitalaria en todos los casos se dio a las 24 horas con drenajes bilaterales por contrabertura que se dejaron en promedio 48 horas más. Retiramos los antibióticos cuando se extrajeron los drenajes, excepto en 2 casos que dieron cultivos positivos (Proteus - Gram negativo y Staphylococcus coagulasa negativo- Gram positivo). En ellos, fue necesario comenzar un nuevo esquema de antibioticoterapia con trimethoprim/sulfamethoxazole y ciprofloxacina, 500 mg cada 12 horas, durante 8 semanas. Además, todos los casos siguieron durante 90 días con altas dosis de combinación de Vitamina A y E así como con una dosis de enalapril 5 mg (2 tomas por día) para prevenir la contractura capsular (13).
Durante 30 días las pacientes usaron un sujetador compresivo.
Los controles postoperatorios se hicieron a los 15, 30, 90 y 180 días (Fig. 13-30).




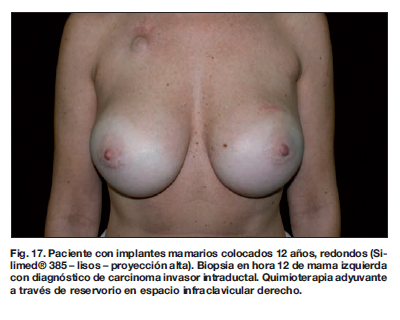
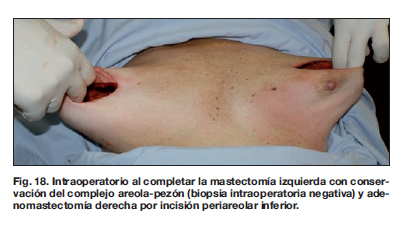





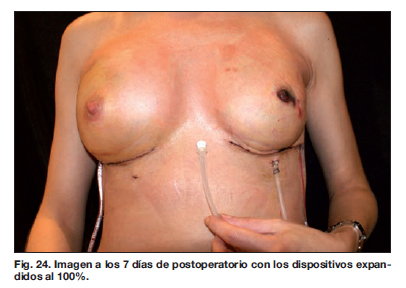

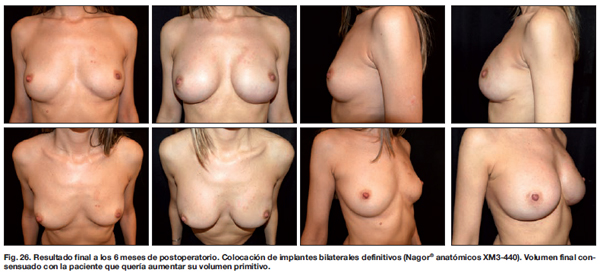
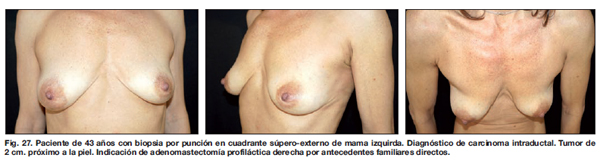



Los resultados a largo plazo demostraron en este grupo de pacientes ausencia de procesos infecciosos, recuperación de su vida social a los 15 días del 2 procedimiento, y aceptación del resultado estético final por parte de todas las pacientes.
Tras 2 años de seguimiento, no hemos identificado casos de contractura capsular.
Discusión
Cuando se finaliza una reconstrucción inmediata postmastectomía con frecuencia se genera una incertidumbre durante la primera semana, en especial cuando se trata de mastectomías con conservación de piel y mastectomías de reducción de riesgo (adenomastectomías profilácticas). Con respecto a la cirugía, debemos controlar la vitalidad de los tejidos cutáneos ya que un sufrimiento de los mismos conlleva la exposición de los implantes o expansores. Por otra parte, también debemos evaluar la simetría lograda debido a que hay numerosas variables que la afectan. A su vez, debemos esperar el resultado del estudio anatomo-patológico diferido, que puede modificar el esquema inicial. Con frecuencia aparecen en los estudios histológicos de las adenomastectomías profilácticas carcinomas in situ o microinvasiones que obligan a estudiar la axila. Todo ello hace que entre los 8 y 10 días, debamos decidir las pautas finales de tratamiento.
Lo mismo acontece con la radioterapia; finalizada la cirugía ablativo-reconstructiva desconocemos en numerosos casos si la paciente va a recibir radioterapia postoperatoria. Las indicaciones de radioterapia tras reconstrucción mamaria inmediata han variado en los últimos años, y se toma en consideración el estado ganglionar, el tamaño tumoral y otros factores pronósticos de tipo histológico. El estado axilar, independientemente del tamaño tumoral, con axilas positivas con 1 a 3 ganglios comprometidos o 4 o más ganglios, pueden ser indicación de radioterapia de acuerdo a la experiencia o a los protocolos de tratamiento actuales (14-16).
Estas pautas cobran importancia en relación a la intercurrencia que puede haber en la asociación de expansores y radioterapia. Es sabido que la reconstrucción con expansores y prótesis es la más utilizada en la actualidad (76% de todas las reconstrucciones mamarias en Estados Unidos) (4) y también son conocidos los efectos negativos de la radioterapia en los resultados cosméticos de estas reconstrucciones en relación al aumento de las complicaciones y a la alta tasa de contracturas capsulares severas (17). La utilización de expansores con válvula metálica incorporada genera también controversia sobre la dificultad técnica que puede generar ésta válvula en la correcta ejecución de la radioterapia y en la homogeneidad de las dosis administradas (18-19).
En centros internacionales, en los casos de indicación de radioterapia una vez recibido el informe anatomo- patológico diferido y después de haberse colocado un expansor con válvula incorporada, hay controversias acerca de cómo tratar a estas pacientes. Ante esta situación, en el Memorial Sloan Kettering de New York, EE.UU., Cordiero y McCarthy (20-21) realizan primero la quimioterapia adyuvante (si está indicada), cambian el expansor por un implante definitivo de silicona lo antes posible y luego realizan la radioterapia. Este orden permite evitar irradiar el expansor con los inconvenientes que esto conlleva, y mantener un resultado más armónico disminuyendo la tasa de complicaciones. Una publicación reciente del Instituto Nationale dei Tumori de Milán, Italia, Nava (22) demuestra que esta conducta de colocar el implante definitivo previamente a la radioterapia disminuye el porcentaje de complicaciones y no incrementa el índice de recidivas locales, en comparación con irradiar el expansor antes de su recambio. Otra alternativa publicada es la propuesta de Kronowitz y Rob del MD Anderson Cáncer Center de Houston, Texas, EE.UU. (23) que consiste en desinflar el expansor tisular, realizar la radioterapia y posteriormente reemplazarlo por una reconstrucción mamaria con tejido autólogo, lo cual conlleva un segundo procedimiento quirúrgico alejado en el tiempo y de mayor complejidad.
El empleo del nuevo dispositivo expansor que presentamos, ofrece a nuestro juicio numerosas ventajas ante estas situaciones complejas:
1. Permite evaluar la vitalidad de los tejidos cutáneos tras mastectomía conservadora de piel y mastectomía de reducción de riesgo (adenomastectomía profiláctica).
2. Reduce la posibilidad de sufrimiento cutáneo ya que al finalizar el acto quirúrgico no se somete a presión a los tejidos (el dispositivo solo se expande en un 20%).
3. Permite no tomar decisiones apresuradas acerca del tamaño y forma de los implantes definitivos.
4. Facilita el llenado y desinflado muy rápido ya que no posee válvula y el tubo conector es de mayor calibre que el de los expansores convencionales.
5. Posibilita la opinión de las pacientes en cuanto al tamaño de los implantes definitivos.
6. Permite modificar el plan quirúrgico cuando se recibe el informe final de Anatomía Patológica sin sacrificar los logros obtenidos. También que el equipo oncológico realice revisiones, retomas o exploración de la axila durante la segunda intervención.
7. En caso de que sea necesario irradiar a las pacientes, se procedería al cambio del dispositivo expansor por los implantes definitivos en muy corto plazo, sin demorar el inicio de las terapias adyuvantes.
8. Supone un menor coste debido a que estos expansores no tienen válvula remota o incorporada.
Conclusiones
Presentamos a la comunidad médica un nuevo dispositivo expansor para uso en reconstrucción mamaria bilateral. Este dispositivo es similar a un expansor tisular pero presenta modificaciones en el tubo conector y no tiene válvula. Es de uso exclusivo para los casos en los que se efectúa mastectomía con conservación de piel y mastectomía de reducción de riesgo (adenomastectomía profiláctica), ya que su objetivo es el servir de soporte tisular durante un corto período de tiempo (promedio 10 días) hasta recibir el informe final de Anatomía Patológica y así proceder al cambio por los implantes definitivos, ajustados en tamaño y simetría por este nuevo dispositivo, y sin interferir con o demorar las terapias adyuvantes.
Bibliografía
1. Rebbeck T, Friebel T, Lynch H, Neuhausen S, van 't Veer L, Garber J, Evans G, Narod S, Isaacs C, Matloff E, Daly M, Olopade O, Weber B: Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA2 mutation carriers: The PROSE Study Group. J Clin Oncol 2004; 15:22 (6):1055-1062. [ Links ]
2. Stefanek M.: Risk-reduction mastectomy: clinical issues and research needs. J Natl Cancer Inst. 2001; 5;93 (17):1297-1306. [ Links ]
3. Zakaria S, Degnim A: Prophylactic Mastectomy. Surg Clin North Am 2007; 87 (2): 317-331. [ Links ]
4. ASPS U.S.A. American Society of Plastic Surgeons. Cosmetic Surgery Statistics, 2007. http://www.plasticsurgery.org. [ Links ]
5. Radovan C.: Reconstruction of one breast after mastectomy using temporary expander Plast Surg Forum 1978, 1: 41-44. [ Links ]
6. Radovan C.: Reconstruction of one breast after mastectomy using temporary expander. Plast Surg Surg 1982; 69 (2):195-206. [ Links ]
7. Maxwell GP, Falcone PA.: Eighty-four consecutive breast reconstructions using a textured silicone tissue expander. Plast Reconstr Surg. 1992; 89 (6):1022-1034. [ Links ]
8. Becker H.: Breast reconstruction using an inflatable breast implant with detachable reservoir. Plast Reconstr Surg 1984; 73 (4):678-683. [ Links ]
9. Woods JE, Mangan MA.: Breast reconstruction with tissue expanders: obtaining an optimal result. Ann Plast Surg 1992; 47:1461-1466. [ Links ]
10. Custom Fabrication Service, 129 Deerdykes View, Westfield Industrial Estate, Cumbernauld, Glasgow, United Kingdom, enquires@nagor.com, www.nagor.com, 2015. [ Links ]
11. CE Certificate-Full Quality Assurance Sysytem - BSI (British Standards Institution): n: CE 02248, Certificate renewal, N: 8125394, 26 de marzo del 2014. [ Links ]
12. Malla Tejida VICRYLtm (poliglactina 910), Ethicon, Johnson-Johnson, www.ni.ethicon.com, 2015. (Ethicon Wound Closure Manual. 2007. Ethicon, Inc. [ Links ]).
13. Zimman O, Tobilli J, Stella I, Ferder M, Ferder L, Inserra F.: The Effects of Angiotensin-Converting Enzyme Inhibitors on the Fibrous Envelope around Mammary Implants. Plast Reconstr Surg 2007; 120 (7): 2025-2033. [ Links ]
14. Albino F, Koltz P, Ling M, Langstein H: Irradiated autologous breast reconstructions: effects of patient factors and treatment variables. Plast Reconstr Surg. 2010; 126 (1): 12-16. [ Links ]
15. Ascherman J, Hanasono M, Newman M, Hughes D: Implant reconstruction in breast cancer patients treated with radiation therapy. Plast Reconstr Surg. 2006; 117 (2):359-365. [ Links ]
16. Victor S, Brown D, Horwitz E, Martinez E, Kini V, Pettinga J, Shaheen K, Benitez P, Chen P, Vicini F: Treatment outcome with radiation therapy after breast augmentation or reconstruction in patients with primary breast carcinoma. Cancer. 1998; 82 (7):1303-1309. [ Links ]
17. Benediktsson K: Capsular contracture around saline-filled and textured subcutaneously-placed implants in irradiated and non-irradiated breast cancer patients: five years of monitoring of a prospective trial. J Plast Reconstr Aesthet Surg. 2006; 59 (1):27-34. [ Links ]
18. Moni J: Dosimetry around metallic ports in tissue expanders in patients receiving postmastectomy radiation therapy: an ex vivo evaluation. Med Dosim. 2004; 29 (1):49-54. [ Links ]
19. Barry M: Radiotherapy and breast reconstruction: a meta-analysis. Breast Cancer Res Treat. 2011; 127 (1):15-22. [ Links ]
20. Cordeiro P, McCarthy C: A single surgeon's 12-year experience with tissue expander/implant breast reconstruction: part I. A prospective analysis of early complications. Plast Reconstr Surg. 2006; 118 (4): 825-831. [ Links ]
21. Cordeiro P, McCarthy C: A single surgeon's 12-year experience with tissue expander/implant breast reconstruction: part II. An analysis of long-term complications prospective analysis of early complications, aesthetic outcomes and patient satisfaction. Plast Reconstr Surg. 2006; 118 (4): 832-839. [ Links ]
22. Nava M, Pennati A, Lozza, L, Spano A, Zambetti, M, Catanuto G: Outcome of Different Timings of Radiotherapy in Implant-Based Breast Reconstructions. Plast. Reconstr. Surg 2011; 128: 353-359. [ Links ]
23. Kronowitz S, Rob G: Therapy and Breast Reconstruction: A Critical Review of the Literature. Plast. Reconstr. Surg 2009; 124(2): 395-408. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Ernesto Moretti
Italia 1460
(2000) Rosario, Argentina
e-mail: contacto@esteticacentrum.com.ar
























