Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.42 no.2 Madrid abr./jun. 2016
Primer caso en México y América Latina de linfoma anaplásico de células gigantes en paciente con implantes mamarios
First case report in Mexico and Latin America of anaplastic large cell limphoma in a patient with mammary implants
Cesar Torres-Rivero*; Guillermo Ramos-Gallardo**; M. de Jesús Nambo-Lucio*** y M. Mar Vaquero-Pérez****
* Especialista en Cirugía Plástica, Estética y Reconstructiva, Presidente del Colegio de Cirugía Plástica de Querétaro, Asociación Mexicana de Cirugía Plástica, Estética y Reconstructiva (AMCPER), Querétaro, Querétaro, México.
** Especialista en Cirugía Plástica, Estética y Reconstructiva, Universidad de Guadalajara, México, Miembro del Comité de Seguridad de la AMCPER, Centro Universitario de la Costa, Puerto Vallartá, Jalisco, México.
*** Jefa del Servicio de Hematología, Hospital de Oncología Siglo XXI e Instituto Mexicano del Seguro Social, Ciudad de México, México.
**** Especialista en Cirugía Plástica, Estética y Reparadora, Directora del Comité de Registro de Implantes de la Federación Iberolatinoamericana de Cirugía Plástica (FILACP), Madrid, España.
Conflicto de intereses: los autores declaran no tener ningún interés financiero relacionado con el contenido de este artículo.
Dirección para correspondencia
RESUMEN
El Linfoma Anaplásico de Células Gigantes (LACG) asociado a implantes mamarios es una patología poco frecuente. Desde el primer caso publicado en la década de los noventa, en los últimos años hemos observado un mayor número de casos recogidos en la literatura. Si bien se tiene información de aproximadamente 90 casos publicados en el mundo, algunos autores mencionan la posibilidad de que existan más de 100 o 200 casos, por lo que su presencia ha suscitado mucha controversia, si bien en general se sigue considerando una patología infrecuente.
Hasta donde hemos podido conocer, presentamos el primer caso de LACG documentado por un cirujano plástico en México y América Latina, en una mujer de 43 años de edad portadora de implantes mamarios, con historia de asimetría mamaria unilateral por seroma tardío, y en la que tras 2 punciones sin mejoría de la sintomatología se realizó retirada del implante y capsulectomía, confirmando en líquido periprotésico la presencia del LACG.
Palabras clave: Linfoma anaplásico células gigantes, Implantes mamarios, Seroma tardío.
Nivel de evidencia científica: 4 Terapéutico.
ABSTRACT
Anaplastic Large Cell Lymphoma (ALCL) associated to breast implants is a rare condition. Since the first case report in the nineties, we have seen lately an increase of the total of reported cases. In the literature, we can find around 90 cases and some authors mentioned the possibility of 100 or 200 cases around the world. Anyway it keeps on been and infrequent pathology.
To our knowledge,we present the first case reported by a plastic surgeon in Mexico and Latin America in a 43-year female with history of breast augmentation, and unilateral asymmetry due late seroma. After 2 punctures without success, removal of breast implant and capsulectomy was scheduled. Diagnostic of ALCL was confirmed in the periprosthetic fluid.
Key words: Anaplastic large cell lymphoma, Breast Implants, Late seroma.
Level of evidence: 4 Therapeutic.
Introducción
El Linfoma Anaplásico de Células Gigantes (LACG) asociado a implantes mamario es una patología de la cual poco se conoce todavía, y que si bien no es común, nos obliga a actualizar conocimientos y familiarizarnos con su presentación para poder detectar su presencia ante datos de sospecha.
Los primeros casos se reportaron en la década de los noventa, y posteriormente se empezó a observar un aumento de recogida de casos que ha sido progresivo en los últimos años, estimándose que pueden existir entre 100 ó 200 casos en el mundo. El primero publicado se recogió en los Estados Unidos (EE.UU.), llamando la atención por su rareza y diagnóstico histopatológico (1). Se trató de una mujer de 41 años, portadora de implantes mamarios rellenos de solución salina (McGhan® Medical Corporation, style 168). La paciente presentó un crecimiento de la mama derecha secundario a una tumoración que en la biopsia resultó ser un linfoma de células gigantes, con marcador de superficie CD30, (Ki-1) positivo. En ese momento los autores no pensaron en una posible asociación entre la tumoración y los implantes mamarios; en la actualidad la información ha cambiado y posiblemente el manejo y tratamiento de este caso hubiera sido distinto.
La mayor parte de las publicaciones sobre esta patología provienen de EE.UU. En especial, 2 centros hacen referencias a series de casos: el Centro Oncológico "City of Hope" en California, y el reconocido centro M.D. Anderson en Texas (2,3). La posibilidad de contar con centros de concentración de casos y el interés de esta nación por la investigación, puede ser el motivo de que la mayor parte de la información provenga de este país. En Europa y Oceanía se hace también referencia a algunos casos. En México, sabemos de una paciente que fue operada de mamoplastia de aumento en la frontera y con el paso de los años presentó un crecimiento mamario unilateral debido a seroma tardío, con diagnóstico final de LACG y que recibió tratamiento en los EE.UU. (4).
La mayor parte de los reportes en la literatura mencionan el inicio de esta patología como asimetría mamaria debida a un seroma tardío, aunque también existen informes de tumoraciones adyacentes a la cápsula periprotésica y de adenopatías (5). En algunas ocasiones, la enfermedad se ha presentado de manera bilateral y también están recogidos algunos casos de defunción (6).
En la actualidad, no contamos con un tratamiento estándar para esta entidad debido a su rareza, y para poder confirmar su diagnóstico necesitamos de la ayuda de patólogos con experiencia, por lo cual en ocasiones el diagnóstico y tratamiento de estas pacientes puede retardarse con la consiguiente influencia en el pronóstico (5).
Hasta donde hemos podido comprobar, presentamos en este trabajo el primer caso clínico de LACG asociado a implantes mamarios recogido por un cirujano plástico en México y América Latina.
Caso clínico
Mujer de raza mestiza de 43 años de edad, con antecedente de mamoplastia de aumento realizada en junio de 2009: incisión periareolar, disección transglandular, bolsillo subfascial, colocación de implantes anatómicos de gel cohesivo texturizado de 290 cc, (McGhan® Medical Corporation, Santa Bárbara, California, EE.UU.) En la misma intervención se le realizó también abdominoplastia y liposucción de la zona baja de la espalda. Se colocaron drenajes aspirativos que se retiraron a las 24 horas de la intervención. El postoperatorio cursó sin incidencias y el resultado fue satisfactorio.
Al año del procedimiento, la paciente presentó molestias y edema en la mama derecha que cedieron con antinflamatorios no esteroideos a dosis de 120 mg por día durante 7 días. La evolución posterior fue satisfactoria hasta el año 2015, es decir 5 años después de esos síntomas y 6 tras la intervención, cuando la paciente nuevamente presentó molestias y edema en la mama derecha, así como aparición de galactorrea. Se le realizaron estudios de imagen mediante resonancia magnética (RM) documentando la presencia de abundante líquido periprotésico en la mama afectada (Fig. 1).
En vista de la situación, se le practicó punción guiada por ultrasonido obteniendo 270 cc de material seroso, sin detritus en su interior, de color amarillo oscuro y sin olor característico. Se remitió muestra para estudio citológico que informó de mastitis crónica con reacción granulomatosa y cultivo negativo. Sin embargo, el aumento paulatino de la mama continuó en los meses posteriores, realizándose 2 nuevas punciones sin éxito. En la segunda punción se envió nuevamente líquido para estudio de malignidad ante la sospecha de un posible carcinoma ductal. Se evaluó nuevamente a la paciente mediante estudios de imagen por ultrasonido y RM sin encontrar anomalías en el parénquima mamario, por lo cual, se optó por la retirada del implante, con capsulectomía y revisión del tejido mamario mediante biopsia transoperatoria. La cirugía se llevó a cabo en conjunto con un cirujano oncólogo, el cual revisó la glándula mamaria y tomó muestras de los diferentes cuadrantes.
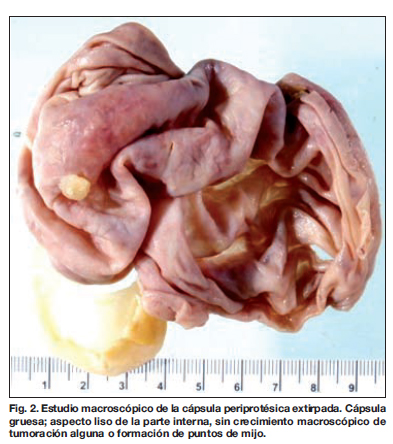
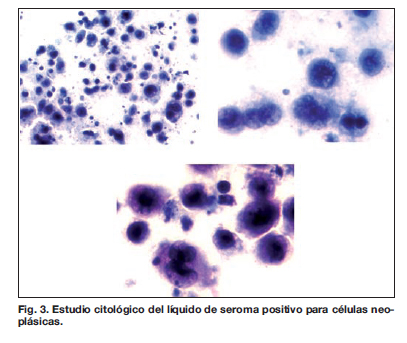
El estudio transoperatorio y el definitivo, tanto del tejido mamario enviado como de la cápsula periprotésica resultó negativo para malignidad (Fig. 2). Sin embargo el líquido periprotésico evacuado durante la cirugía resultó positivo para células neoplásicas en el estudio citológico (Fig. 3). Este líquido se estudió también mediante elaboración de bloque celular y procesado con técnica de histológica (Fig. 4 y 5) e inmunohistoquimia. Esta última obtuvo un resultado positivo para LACG, inmunofenotipo T, positivo para CD 45, CD3, CD 30 y EMA (antígeno de membrana epitelial), negativo para CKAE1/AE3 (citoqueratina), CD 20 y ALK (kinasa de linfocitos anaplásicos) e índice de proliferación 80% (Tabla I), (Fig. 6 y 7).
El Servicio de Hematología propuso la realización de estudio de tomografía por emisión de positrones (PET), sin embargo la paciente decidió no continuar con los estudios de estadiaje a pesar del diagnóstico final de linfoma, y ha rechazado hasta la fecha seguir ningún tipo de tratamiento, ni siquiera la retirada del implante contralateral. Actualmente (mayo de 2016) se encuentra asintomática.
Discusión
En la actualidad, se estima que el riesgo de que una paciente con implantes mamarios, ya sea por motivo estético o reconstructivo, presente un LACG es bajo. Ya en los años 90, estudios holandeses sobre una población de en torno a 100.000 a 300.000 mujeres con implantes mamarios, calcularon una incidencia anual de LACG de 0.1 a 0.3 por cada 100.000 mujeres, Después compararon con casos control diagnosticados de otros tipos de linfomas no-Hodgkin en la mama, y determinaron que el odds ratio (OR) para una mujer con implantes mamarios para desarrollar un LACG era de 18.2 (7). En contraste, estudios epidemiológicos posteriores con series más largas de pacientes en Norteamérica y Europa no han mostrado un riesgo incrementado de desarrollo de LACG en este tipo de pacientes, llegando a estandarizar un índice de incidencia de 0.89 (95% intervalo de conficencia, 0.67 a 1.18) (5).
Dada la rareza de esta patología, todavía existen varios puntos importantes que no se han esclarecido (8,9). Uno de ellos es la posibilidad de que la texturización de los implantes mamarios pudiera ser un detonante en pacientes genéticamente susceptibles (10). Sin embargo, en la literatura al respecto, la mayor parte de los trabajos recogidos no mencionan esta característica de los implantes: si eran lisos, texturizados o de cubierta de poliuretano; en cuanto a su relleno, si eran de gel de silicona o de solución salina; también se tiene poca información sobre el volumen, así como de la forma redonda o anatómica (11-13).
No hay una uniformidad en la recogida de datos que permita establecer conclusiones ciertas en este sentido. De lo que sí tenemos conocimiento es de que el LACG asociado a implantes mamarios puede aparecer en cualquier escenario, ya sea estético o reconstructivo, y con diversos modelos de implantes, si bien parece que de lo poco reportado sobre las características de los mismos, es decir, cuando este dato está recogido, la mayor parte serían texturizados. Informes extraoficiales mencionan la existencia también de casos con implantes lisos, y nosotros pudimos encontrar algunos casos publicados en los que se mencionan implantes con cubierta de poliuretano (14,15). Sin embargo, este punto resulta hoy por hoy controvertido dentro de la posible etiología de esta patología.
Acerca de la marca de los implantes y de la posibles influencia de los diferentes métodos de texturización que emplea cada fabricante, mucho se ha comentado al respecto y, más en concreto sobre algunas marcas en particular. Quizá el punto de controversia está en que la mayor parte de las publicaciones sobre este tema provienen de países desarrollados, y concretamente en el hecho de que en EE.UU. durante mucho tiempo, la Food and Drug Administration (FDA) prohibió el uso de implantes de silicona con fines estéticos, aprobando posterior y progresivamente determinados modelos de solo 3 marcas, lo que ha podido llegar a condicionar un sesgo en la casuística que involucre más a algunas marcas sobre otras. Es importante mencionar aquí que existen casos con prácticamente todas las marcas (5,7,12), por lo que consideramos que será importante analizar en las próximas publicaciones la recogida sistemática de todos los datos relativos al tipo de implante para poder llegar a unas conclusiones válidas. En base a esto, y en el caso que presentamos, hemos tratado de ser lo más exhaustivos posibles en la recogida de todos estos datos con el fin de aportar hechos fehacientes que contribuyan en el futuro a crear bases de datos sistematizadas de los casos diagnosticados.
Siguiendo con el análisis de posibles influencias en el desarrollo del LACG asociado a implantes mamarios, otro factor importante que tal vez podría sumarse es el de la formación de biofilm o biopelícula periprotésica, más relacionada con los implantes de texturización macroscópica o comúnmente llamada agresiva, y la influencia de esta asociación en pacientes inmunológicamente susceptibles. No debemos olvidar que el sistema inmunitario responde de manera distinta en cada ser humano, y se ha llegado a pensar en la existencia de algún tipo de mutación relacionada (12,13) que predispusiera en determinadas pacientes al desarrollo de la patología.
Con mucho aún por estudiar y concluir respecto al LACG asociado a implantes mamarios, lo que sí creemos importante es estar alerta ante la sospecha de nuevos casos para poder conducirlos rápidamente hacia los estudios más adecuados de anatomopatología, inmunohistoquimia y genética, confirmar el diagnóstico, y contar con la mayor información posible sobre el caso concreto. De esta manera, una vez confirmado el diagnóstico y en colaboración con hematólogos y/u oncólogos experimentados, hacer un estadiaje preciso de la enfermedad. Si bien hay algún caso en el que se sugiere el uso de la PET como herramienta útil en este proceso, dado lo poco frecuente de la patología no existe un estándar diagnóstico y tratamiento para todas las pacientes, por lo que lo más indicado es la individualización diagnóstica y terapéutica de cada una (13).
En la actualidad, se estima que puede haber en torno a unos 200 casos registrados (16), sin embargo los casos publicados en la literatura como tales suman alrededor de 90; posiblemente no todos los casos están registrados y no todos están completos (13). La información en su mayoría proviene de EE.UU. y le siguen países de Europa, Australia y algunos casos en Asia (Irán). Poca información se tiene de América Latina, África o de regiones del Este de Asia como China, Corea o Japón. En el trabajo de Brody y col. se menciona la existencia de 4 posibles casos en Brasil (16) y no se desestima la probabilidad de que en América Latina existan más casos. Tengamos en cuenta también que este autor solo recoge en su búsqueda bibliográfica publicaciones en inglés, con lo que de haber sido publicado algún caso en otra lengua o en una revista local de menor impacto, es fácil que tampoco haya sido contabilizado.
Por detallar algo más las informaciones procedentes de Europa, registramos que en Francia, en febrero de 2015, la Agencia Nacional para la Seguridad de Medicamentos y Productos Sanitarios (ANSM) presentó un informe sobre 18 casos de LACG asociado a implantes mamarios registrados por la Red Nacional de Expertos en Linfomas (LYMPHOPATH). En Italia, Santanelli y col. recogen también en agosto de 2015, 4 casos en un centro dedicado a la cirugía mamaria, 3 asociados a implantes texturizados y 1 a implante de cubierta de poliuretano (17). Y en cuanto a la búsqueda que hemos realizado de casos publicados en España, solo hemos encontrado 2 trabajos que recogen 1 mismo caso (18,19).
Viendo los datos recogidos en los registros publicados, llama la atención que la mayoría de las veces no se hace referencia a la raza de las pacientes. Sin embargo Santenelli y col. en su publicación, además de sugerir la ya mencionada posible acción del propio implante como detonante de la patología, también mencionan que pudiera existir un componente genético en una población predispuesta por tanto a la patología (17). Es por ello que, dado que el caso que nosotros presentamos sería, hasta donde hemos podido conocer, el primero publicado por un cirujano plástico en México, hemos recogido el dato de que la paciente era de raza mestiza para intentar aportar este aspecto también a la casuística internacional.
Como enseñanzas generales de todas estas publicaciones, los signos que deben ponernos en alerta y que concuerdan con la presentación clínica que hemos descrito para nuestro caso, son básicamente la aparición de un seroma tardío, entendido como tal todo aquel que se manifiesta después del primer año de la colocación de los implantes, y que comúnmente se asocia a un crecimiento mamario unilateral. Pero no debemos descuidar que también se han recogido casos de presentación bilateral, o a través de adenopatías y/o masas adyacentes a la cápsula periprotésica. Muy pocos casos recogen la presencia de enfermedad a distancia (20).
En cuanto al tiempo de presentación, se han recogido casos desde 1 hasta 40 años tras la colocación de los implantes, con un promedio de 11 años (12,13). En nuestra paciente en concreto, los primeros signos y síntomas de asimetría mamaria por seroma aparecieron al año de la cirugía y a los 6 años. Todo esto se produce en ocasiones en el contexto de sospecha de cuadros infecciosos o molestias inespecíficas, por lo que dada la rareza de esta patología puede favorecerse que el proceso quede enmascarado y se retrase por tanto el diagnóstico final y el tratamiento Tal pudo suceder en nuestro caso, en el que la paciente presentó además de la asimetría por seroma tardío, galactorrea que quizá fue un hallazgo incidental y no relacionado con el caso.
En cuanto al tratamiento, nuestra paciente ha entrado en una fase de duelo que le hace rechazar el seguimiento de las pruebas para estadiaje de la patología y aplicación de un tratamiento individualizado (21-23). También rechaza por el momento la retirada del otro implante. En el momento de esta publicación, no ha presentado ninguna otra molestia, y a pesar de que se le ha dado seguimiento y explicaciones detalladas sobre el beneficio de continuar evaluación y tratamiento médico, se mantiene en su postura de no recibir terapia (Fig. 8 y 9).
Por lo general, y con un abordaje multidisciplinario, está recogido en la literatura que la mayor parte de las pacientes cuentan con un buen pronóstico, aunque se han dado casos de fallecimiento en pacientes con enfermedad avanzada, diseminación extracapsular, con adenopatías positivas e infiltración en otras estructuras anatómicas (2, 6).
Como cirujanos plásticos, cabe señalar que lo más importante ante la sospecha es la retirada de los implantes y de su cápsula. Personalmente no recomendamos en estas pacientes la recolocación de nuevos implantes, dado que en esta patología aún quedan muchas preguntas por responder. Es también importante recordar que tenemos la responsabilidad de seguir a largo plazo a las pacientes a las que practicamos cirugía mamaria con implantes, ocupándonos no solo de la valoración de los resultados estéticos de la mamoplastia de aumento o el procedimiento de reconstrucción, sino de la evaluación periódica de la mama en colaboración con Ginecología, y la realización periódica de pruebas de control por imagen de los implantes. Como propuesta adicional, consideramos que la información sobre la hoy por hoy escasa incidencia del LACG asociado a implantes debe formar parte de la conversación preoperatoria en consulta con las pacientes y seguramente la comunidad científica deberá contemplar la necesidad de introducir en los consentimientos informados preoperatorios alguna nota sobre la remota posibilidad de desarrollo de esta patología en las pacientes que se van a someter a cirugía mamaria con implantes.
Conclusiones
Presentamos el primer caso de LACG asociado a implantes mamarios recogido por un cirujanos plástico en México y, hasta donde creemos conocer, en América Latina. Si bien no es una patología frecuente, debemos estar familiarizados con su forma de presentación clínica para poner en marcha cuanto antes los procedimientos quirúrgicos y diagnósticos adecuados de cara al estadiaje de la patología y a su tratamiento individualizado.
Para poder conocer mejor esta entidad, recomendamos la recogida exhaustiva de todos los datos relativos a la cirugía y a los implantes en cada caso reportado, y ese ha sido el principal intento de nuestra presentación.
Consideramos también básico el abordaje multidisciplinario de las pacientes y llamamos al consenso de la comunidad científica para establecer las pautas más adecuadas de información preoperatoria sobre la incidencia de esta entidad en las pacientes que van a someterse a cirugía mamaria con colocación de implantes, ya sea con fines estéticos o de reconstrucción.
Bibliografía
1. Keech JA Jr, Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg. 1997;100(2):554-555. [ Links ]
2. Popplewell L, Thomas SH, Huang Q, Chang KL, Forman SJ. Primary anaplastic large-cell lymphoma associated with breast implants. Leuk Lymphoma. 2011;52(8):1481-1487. [ Links ]
3. Miranda RN, Lin L, Talwalkar SS, Manning JT, Medeiros LJ. Anaplastic large cell lymphoma involving the breast: a clinico pathologic study of 6 cases and review of the literature. Arch Pathol Lab Med. 2009;133(9):1383-1390. [ Links ]
4. Weathers WM, Wolfswinkel E, Hatef DA, Lee E, Hollier LH, Brown Rh. Implant-associated anaplastic large cell lymphoma of the breast: insight into a poorly understood disease. Can J Plast Surg 2013; 21(2): 95-98. [ Links ]
5. Kim B, Roth C, Chung KC, Young VL, Busum K, Schnyner Ch, Mattke S. Anaplastic large Cell Lymphoma and Breast implants: A Systematic Review. Plastic Reconst Surg 2011; 127(6):2141-2150. [ Links ]
6. Carty MJ, Pribaz JJ, Antin JH, Volpicelli ER, Toomey CE, Farkash EA, Hochberg EP. A patient death attributable to implant- related primary anaplastic large cell lymphoma of the breast. Plast Reconstr Surg. 2011;128(3):112e-118e. [ Links ]
7. Kim B, Predmore ZS, Mattke S, Busum K, Gidengil CA. Breast implant associate anaplastic large cell lymphoma: Update Results from Structured Expert consultation process. 2015 PRS Global Open: 1-15. [ Links ]
8. Story SK, Schowalter MK; Geskin LJ. Breast implant-Associated ALCL: A Unique Entity in the Spectrum of CD30 Lymphoproliferative Disorders. The Oncologist 2013;18:301-307. [ Links ]
9. De Jong D, Vasmel LE, de Boer JP. Anaplastic Large-cell lymphoma in women with breast implants. JAMA 2008; 300 (17): 2030-2035. [ Links ]
10. Lee K. Silicone implant and primary breast ALK1-negative anaplastic large cell lymphoma, fact or fiction? Int J Clin Exp Pathol 2010;3(1):117-127. [ Links ]
11. Largent J. Oefele in M, Kaplan HM. Risk of lymphoma in women with breast implants: analysis of clinical studies. Eur J Cancer Prev. 2012; 21 (3): 274-280. [ Links ]
12. Thompson PA, Prince M. Breast Implant associated anaplastic large cell lymphoma: a systematic review of the literature and mini meta analysis. Current Hematologic Malignancy Reports, 2013; 8(3): 196-210. [ Links ]
13. Miranda RN, Aladily TN, Princ MH, Kanagal-Shamanna R, de Jong D, Fayad Le, et al. Breast implant-associated anaplastic large cell lymphoma: long-term follow up of 60 patients. Journal of Clinical Oncology 2014 32(2): 114-120. [ Links ]
14. Smith TJ, Ramsaroop R. Breast implant related anaplastic large cell lymphoma presenting as late onset peri-implant effusion. Breast 2012; 21(1): 102-104. [ Links ]
15. Fritzsche FR, Pahl S, Petersen I, Burkhardt M, Dankof A, Dietel M, Kristiansen G. Anaplastic large-cell non-Hodgkin's lymphoma of the breast in peri prosthetic localization 32 years after treatment for primary breast cancer: a case report. Virchows Arch. 2006;449(5):561-564. [ Links ]
16. Brody GS, Deapen D, Taylor CR, Pinter-Brown L, House- Lightner SR, Andersen JS, et al. Anaplastic Large Cell Lymphoma Occurring in Women with breast implants: Analysis of 173 cases. Plastic Reconst Surg 2015;135(3): 695-702 [ Links ]
17. Santanelli di Pompeo F, Laporta R, Sorotos M, et al. Breast implants Associated Anaplastic Large Cell Lymphoma: Proposal for monitoring Protocol. Plastic Reconst Surg 2015; 136(2)144e-151e. [ Links ]
18. Tardío JC, Granados R. Axillary Lymphadenopathy: An Outstanding Presentation for Breast Implant-Associated ALKNegative Anaplastic Large Cell Lymphoma. Int J SurgPathol. 2015; 23(5): 424-428. [ Links ]
19. de Torres Olombrada M, García T, Caballero P, Sotoca A, et al. Anaplastic Large Cell Lymphoma associated with breast implant: A case report and review of the literature. Rep Pract Oncol Radio 2013; 18: S275-S276 [ Links ]
20. Estes C, Zhang D, Reyes R, Korentager R, McGinness M, Lominska C. Locally advanced breast implanted-associated anaplastic large-cell lymphoma: a case report of successful treatment with radiation and chemotherapy. Front Oncol. 2015; 5: 1-4. [ Links ]
21. Liu V, McKee PH. Cutaneous T-cell Lymphoprolipherative disorders: Approach for the surgical pathologist: Recent advances and clarification of confused issues. Advance AnatPathol 2002; 2: 79-100. [ Links ]
22. Honghua H, Jacombs A, Vickery K, Merten SI, Pennington DG, Deva AK. Chronic Biofilm Infection in Breast Implants Is Associated with an Increased T-Cell Lymphocytic Infiltrate: Implications for Breast Implant-Associated Lymphoma. Plastic Reconst Surg 2015;135(2): 319-329. [ Links ]
23. Aladily TN, Medeiros LJ, Amin MB, Haideri N, Ye D, Azevedo SJ, et al. Anaplastic large cell lymphoma associated with breast implants: a report of 13 cases. Am J Surg Pathol. 2012; 36(7):1000-1008. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. César Torres Rivero
AMCPER
Flamencos 74, San José Insurgentes
03900 Benito Juárez, Ciudad de México, México
Correo electrónico: cetori@gmail.com
Recibido (esta versión): 22 mayo/2016
Aceptado: 10 junio/2016