Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cirugía Plástica Ibero-Latinoamericana
versión On-line ISSN 1989-2055versión impresa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.43 no.1 Madrid ene./mar. 2017
ESTÉTICA
ORIGINAL / Series clínicas
Descripción de un nuevo sistema cerrado de procesamiento de grasa para la obtención de nanofat: análisis de resultados clínicos y citométricos
Description of a new closed system to process fat and to obtain nanofat: analysis of clinical and cytometric results
Jorge Planas; Juan Muñoz y Dorian González
Cirujano Plástico, Clínica Planas, Barcelona, España.
Este estudio fue parcialmente financiado por los proyectos de investigación DEP 2010-22205-C02-01 del Plan Nacional I+D+I 2008-2011(Ministerio Español de Economía y Competitividad), por el Ministerio de Sanidad Español (CP07/00098; PI08/1132) y Thermo Fisher Scientific, Inc.
Conflicto de intereses: Nanofat Planas Kit® es comercializado por Corjos Inc, Italia. El primer autor obtiene beneficios por la venta de cada kit.
Dirección para correspondencia
RESUMEN
Antecedentes y Objetivo. En la actualidad, la grasa es una de las herramientas más importantes en la Cirugía Plástica Estética y Reconstructiva. De hecho, ha cambiado el enfoque de múltiples tratamientos y protocolos en la última década. Nanofat es un nuevo procedimiento derivado de emulsionar la grasa e inyectarla en dermis indicado para mejorar la calidad de la piel especialmente en ojeras, mejillas, cuello, escote y manos.
En este trabajo describimos cómo obtener la grasa y procesarla con un circuito cerrado que hemos desarrollado así como nuestra experiencia con la técnica nanofat. Explicamos el procedimiento, sus aplicaciones clínicas, casos y estudios del tejido procesado para evaluar su contenido en células madre.
Material y método. Entre marzo de 2013 y febrero de 2015 realizamos la técnica nanofat en 56 pacientes sanos en la piel de mejillas, surcos nasogenianos, cuello, manos, escote y en particular para corregir la coloración de las ojeras, en combinación o no con microinjertos de grasa para tratar el surco nasoyugal. Para la infiltración de nanofat utilizamos una aguja de 27G, La cantidad infiltrada varió dependiendo del área a tratar; en ojeras el promedio fue de 2 ml, en cara y cuello de 7.5 ml, y en manosde 4.8 ml por mano. Infiltramos nanofat a nivel subdérmico. Evaluamos el tejido emulsionado con citometría de flujo para determinar la viabilidad de las células del producto de esta grasa emulsionada, así como la presencia de células CD34+.
Llevamos a cabo la valoración clínica mediante fotografía y escala de satisfacción de Likert a los 3, 6 y 12 meses del tratamiento.
Resultados. Todos los casos mostraron mejoría significativa a partir de los 3 a 6 meses del tratamiento. No hubo complicaciones mayores, ni observamos efectos indeseables. Recogimos sólo 1 complicación menor (hiperpigmentación inflamatoria). Con el uso de citometría de flujo, demostramos que las células CD34 + viables estaban presentes en la grasa emulsionada.
Conclusiones. Nanofat parece una herramienta eficaz para el rejuvenecimiento de la piel. Observamos una mejoría importante de la calidad y la elasticidad de la piel, disminución de arrugas finas y de la pigmentación en áreas como las ojeras. El uso de un circuito cerrado evita la manipulación directa, con lo cual redujimos la exposición del tejido al aire ambiente. El mecanismo fisiológico del nanofat mediante el cual se obtiene estos resultados positivos aún no ha sido completamente dilucidado; el efecto paracrino de las células madre derivadas de tejido adiposo (ADSC) no puede descartarse como mecanismo de acción.
Palabras clave: Injertos grasos, Microinjertos grasos, Células madre, Células madre derivadas de tejido adiposo (ADSC), Rejuvenecimiento cutáneo.
Nivel de evidencia científica: 4 Terapéutico.
ABSTRACT
Background and Objective. Currently, fat is one of the most important tools in Aesthetic and Reconstructive Plastic Surgery. In fact, it has changed the approach of multiple treatments and protocols in the last decade. Nanofat is a new procedure derived from emulsifying the fat and injecting it into the dermal layer. The authors describe how to harvest the fat with a closed loop that they have developed, and their experience with nanofat technique. The procedure, clinical applications, cases reports, and tissue studies to evaluate its stem cell content will be explained.
Method: Between March 2013 and February 2015, the nanofat technique was performed in 56 healthy patients. We apply this technique to the skin of cheeks, nasolabial folds, neck, hands, neckline and in particular to correct the color of dark circles in combination or not with micrograft to treat the nasal groove. For the infiltration of nanofat we used a needle of 27G, The infiltrated quantity of nanofat varied depending on the area to be treated, in the case of the dark circles the average was 2 ml, in face and neck was 7.5 ml and in hands was 4.8 ml per hand. The infiltration of nanofat was performed at the subdermal level. The emulsified tissue was evaluated with flow cytometry to determine the viability of the cells of the product of this emulsified fat, as well as the presence of CD34 + cells.
The clinical assessment was done by means of photography and the Likert satisfaction scale at 3, 6 and 12 postoperative months.
Results. All clinical cases showed significant improvement from 3 to 6 months after treatment. There were no major complications or undesirable effects.
There was only 1 minor complication (inflammatory hyperpigmentation).
With the use of flow cytometry, we have demonstrated that viable CD34+ cells were present in the emulsified fat.
Conclusions. Nanofat looks like an effective tool for skin rejuvenation. We have observed a significant improvement in the quality and elasticity of the skin, decrease in fine wrinkles and pigmentation in areas such as dark circles.
The use of a closed circuit avoids direct manipulation, in which the authors reduce the exposure of the tissue to ambient air. The physiological mechanism of nanofat through which these positive results are obtained has not yet been fully elucidated; the paracrine effect of stem cells derived from adipose tissue (ADSC) cannot be ruled out as a mechanism of action.
Key words: Fat graft, Micrograft, Stem cells, Adipose-derived stem cells (ADSCs), Skin rejuvenation.
Level of evidence: 4 Therapeutic.
Introducción
Es conocido en todo el mundo que la grasa es una de las herramientas más importantes en Cirugía Plástica, Reconstructiva y Estética. De hecho, se ha cambiado la perspectiva de múltiples tratamientos y protocolos en la última década, y gracias a que la liposucción se ha practicado durante muchísimos años los injertos de grasa se han desarrollado y mejorado por muchos autores desde entonces.(1) Recientemente, los estudios de las células madre y de la fracción vascular estromal (SVF) han cambiado los métodos de análisis y uso de la grasa. Las células madre derivadas de tejido adiposo (ADSC) fueron descubiertas en 2001(2) y, desde entonces, ha habido numerosos estudios y prácticas desarrollados con ellas que han hecho que, en la actualidad, las aplicaciones de las ADSC sean numerosas y muy conocidas en muchos otros campos de la Medicina, además de la Cirugía Plástica: tratamientos para enfermedades hematológicas, para determinados tipos de cáncer como la leucemia, y para algunas patologías genéticas o inmunológicas.(3-8) En el campo de la Medicina Estética se aplican en la alopecia, en la regeneración y bioestimulacion de la piel,(9) y en Cirugía Plástica Reconstructiva para enriquecer la grasa en la lipoinyección,(10) entre otros.
Las ADSC se aíslan de la grasa recogida durante un procedimiento de liposucción quirúrgica. Poseen fenotipos y características funcionales muy similares a las de las células madre mesenquimales derivadas de la médula ósea, con la capacidad de diferenciarse en otros linajes celulares incluyendo el condrogénico, osteogénico, adipogénico, miogénico, neural, y endotelial.(11-19).
A finales de 2012, Tonnardy col.(20) describieron el uso de Nanofat como una infiltración intradérmica de grasa emulsionada para el rejuvenecimiento de la piel. La principal diferencia en comparación con las otras técnicas de injerto de grasa conocidas hasta entonces está en que en ella no hay adipocitos viables en el contenido inyectado, mientras que las ADSC mantienen sus propiedades funcionales. Los resultados obtenidos en el estudio realizado por Tonnard fueron excelentes, mejorando la calidad general de la piel y reduciendo las áreas de pigmentación. Aunque los autores concluyeron que el principal efecto de la inyección de nanofat estaba probablemente relacionado con una actividad de las células madre, no está claro cuál es la causa de esta mejoría, no pudiendo descartarse la hipótesis de un efecto paracrino de estas células madre.
Chang y col.(21) publicaron recientemente un estudio preliminar llevado a cabo in vivo en ratones en el que demuestran un efecto de las células madre que produce blanqueamiento de la piel pigmentada. Este efecto posiblemente está relacionado con la acción apocrina de las ADSC cuando secretan citoquinas, especialmente un regulador de la tirosina que está directamente relacionada con la síntesis de melanina, Chang concluye en su estudio que las ASDC inhiben la formación de melanina inducida por la exposición a la luz ultravioleta. En otros estudios se menciona el efecto restaurador de las citoquinas en la piel junto con la mejora de las arrugas.(8)
La principal aplicación conocida de la técnica nanofat es mejorar la calidad de la piel, en especial la de los párpados inferiores (ojeras), mejillas, surcos nasogenianos, cuello, escote y manos.(20-21)Las ojeras y la pérdida de la calidad de la piel (turgencia y elasticidad) de las otras zonas mencionadas son un problema estético muy común que afecta a un gran número de personas, y que influye en su salud biopsicosocial. Se han empleado muchas técnicas terapéuticas para tratar estos problemas, pero la mayoría de ellas, hasta ahora, han obtenido pobres resultados.
Hemos desarrollado un kit para el procesamiento de la grasa para la obtención de nanofat que incluye un filtro de nylon que separa el tejido conectivo de la muestra del resto del tejido adiposo. Analizamos en el presente trabajo el nanofat procesado con dicho kit mediante valoración por citometría de flujo para conocer la viabilidad de las células tras su paso por el filtro de nylon y hacemos una valoración clínica del resultado obtenido en cada paciente utilizando fotografías y escala de Linker.
Material y método
Entre marzo de 2013 y febrero de 2015, realizamos la técnica de nanofat en 56 pacientes sanos: 52 mujeres y 4 hombres, para mejorar la calidad de la piel de la cara, el cuello y las manos, el daño actínico de la piel y las ojeras pigmentadas, en combinación o no con microinjertos de grasa (micrograft) para corregir el surco nasoyugal pronunciado (tear trough). Obtuvimos el consentimiento informado de cada paciente para realizar la liposucción y la obtención de nanofat así como el respectivo estudio
Método
La técnica de Tonnard se resume de la siguiente manera. Se realiza infiltración del abdomen inferior con una solución modificada de Klein (800 mg de lidocaína / 1l de suero salino y 1 ml de adrenalina en dilución 1: 1.000.000). Se extrae la grasa usando un dispositivo de liposucción estándar con una cánula de 3 mm multipuerto, con agujeros laterales de 1 mm de diámetro (Tulip® Medical Products, EE.UU.).
Posteriormente, se lava esa grasa con solución salina colocada sobre una malla de nylon sobre un recipiente estéril, donde se le agrega solución salina, y posteriormente se filtra a través de esta malla que tiene poros de 0.5 mm de diámetro; se realiza la emulsificación y se filtra nuevamente sobre la misma malla de nylon. La emulsión del lipoaspirado se hace mecánicamente por desplazamiento de la grasa entre dos jeringas de10 ml conectadas entre sí mediante un conector luer-lok hembra a hembra. A través de 30 pases, la grasa se transforma en una emulsión. Después de este proceso, el líquido graso se filtra de nuevo con la malla de nylon estéril y se recoge en un recipiente estéril. Este producto adiposo es lo que denomina nanofat.
Finalmente se inyecta el producto obtenido de este procedimiento con una aguja fina, de calibre 27G, a nivel intradérmico y subdérmico, en trazado de abanico o multipunción.
Nuestro protocolo y método
Desde que empezamos a utilizar esta técnica, uno de nuestros principales objetivos fue siempre el evitar la manipulación de la grasa, tratando de establecer un proceso donde se obviara la manipulación excesiva y la exposición de ese material al aire ambiente.
En los primeros casos utilizamos una modificación de la técnica de Tonnard basada en evitar el paso de la grasa por la malla para eliminar la exposición al aire ambiente. El área donante de grasa se prepara con técnicas de asepsia y antisepsia: limpieza con clorhexidina y colocación de campos estériles. Infiltramos el área con una solución modificada Klein (lidocaína al 2%: 400 mg de lidocaína/ 500 ml de solución salina y adrenalina 0.5 ml 1: 1.000) mediante una aguja espinal 22G x 90 mm. Luego, recogimos la grasa mediante liposucción de abdomen inferior. Realizamos la liposucción usando una cánula de 3 mm multipuerto con agujeros laterales afilados de 1 mm y con alta presión negativa (Tulip®), con jeringa de 10 ml. El promedio de grasa extraída para la realización del nanofat fue de 10 ml. Si el procedimiento se acompañaba de microinjerto de grasa, realizamos la extracción de aproximadamente 10 ml más de grasa. A continuación, centrifugamos esa grasa a 20 revoluciones por minuto (rpm) durante 1 minuto para separar el exceso de sangre y el líquido de anestesia.
En el caso de nanofat, emulsionamos el lipoaspirado mediante el desplazamiento de la grasa 30 veces entre dos jeringas de10 ml conectadas entre sí por un conector luer-lok hembra-hembra. No filtramos la grasa con la malla de nylon como originalmente propuso Tonnard, tratando de mantener así todo el procedimiento en un sistema cerrado con el fin de evitar la contaminación y la oxidación del tejido.
Preparamos el área de infiltración como la zona donante, con clorhexidina y campos estériles. Las áreas de infiltración más frecuentes fueron las ojeras, la piel de la cara, cuello y escote. Debido a que no hicimos uso de la malla de nylon para filtrar, utilizamos agujas de 25G para la inyección; es decir, el diámetro de las agujas utilizadas fue ligeramente mayor al que utiliza Tonnard. La aguja 25G actuó como un filtro mecánico para las partículas residuales de la emulsificación, especialmente en el tejidoconectivo. Fue necesario cambiar la aguja varias veces durante el procedimiento, ya que se obstruía con este tejido conectivo.
El uso de agujas con un diámetro mayor aumentó la presencia de equimosis después del tratamiento. Por esta razón, después de realizar esta técnica en pocos pacientes, decidimos diseñar un dispositivo estéril que nos permitiera filtrar la grasa emulsionada sin estar expuestos al aire ambiente, y que nos permitiera a su vez utilizar agujas de menor diámetro, 27G, para la infiltración y así evitar la equimosis.
Desarrollo de un nuevo sistema
Hemos desarrollado nuestro propio sistema (Nanofat Planas Kit®, Corios, Italia) según las exigencias solicitadas a la empresa fabricante, para poder llevar a cabo la emulsión de la grasa y su filtración empleando un sistema completamente cerrado.
Este dispositivo consta de 2 jeringas de 10 ml conectadas a un dispositivo o llave de 3 vías, una bolsa recolectora de 10 ml con un filtro de 120 micras en el interior, y otra jeringa de 10 ml para recolección del producto final (nanofat) (Fig. 1). Este filtro de malla de nylon con poros de 120 micras fue elegido como óptimo para evitar la presencia de tejido conectivo en la grasa emulsionada, y también para preservar las células madre intactas en el producto final.
Con este dispositivo se puede llevar a cabo la emulsión de la grasa transfiriéndola 30 veces de una jeringa a otra a través del conector de 3 vías. Una vez realizada esta acción, enviamos el contenido de la jeringa a la bolsa recolectora girando la llave de 3 vías, y en esa bolsa se filtran las partículas residuales. El contenido final se aspira directamente mediante una jeringa de 10 ml ubicada distalmente de la bolsa recolectora (Fig. 1). De esta manera logramos una mínima manipulación de los tejidos y evitamos la exposición al aire ambiente. A través de un conector luer-lok hembra-hembra transferimos el producto final de la emulsión de la grasa (nanofat) a jeringas luer-lok de 1 ml, y luego infiltramos el producto final con agujas de 27G. La técnica utilizada para inyectar el nanofat consiste en una infiltración intradérmica que causa pequeños habones de color amarillento en la dermis.
En los casos, en los que combinamos nanofat con microinjertos grasos, infiltramos estos con microcánulas de 0.7 mm. Previamente realizamos una punción superficial con aguja de 21G para facilitar la introducción de la cánula. El plano de infiltración fue profundo, por debajo del surco nasoyugal, a nivel supraperióstico del reborde orbitario inferior.
Es importante destacar que en las zonas tratadas con nanofat y microinjertos de grasa no fue precisa la infiltración de anestésicos locales ya que los volúmenes aplicados fueron pequeños y las punciones son bien toleradas por los pacientes. También de esta forma evitamos la distorsión de la zona que se produce cuando se emplean anestésicos locales por el volumen que su infiltración provoca.
Recolección de imágenes y equipo fotográfico
Tomamos fotografías preoperatorias en todos los pacientes, con controles fotográficos postoperatorios a los 3 y 6 meses y al año, siempre en 5 proyecciones: frontal, tres cuartos derecho, perfil derecho, tres cuartos izquierdo y perfil izquierdo. De esta forma pretendíamos poder evaluar la coloración y calidad de la piel y el surco nasoyugal de los pacientes intervenidos.
Fue necesario para ello mantener ciertos criterios, a fin de obtener fotografías comparables en el tiempo.Estos criterios fueron:
1. Distancia de la cámara al sujeto (paciente) de 1.5 m y distancia del sujeto al telón de fondo de 50 cm.
2. Uso de la misma cámara fotográfica réflex: Olympus E500, con un lente Olympus Zuiko digital ED 40-150 mm 1:4.0-5.6
3. Uso de fuente de luz similar, constituida por 2 reflectores modelo FQS-180, potencia 180 Ws, y voltaje 220V/50Hz.
4. Uso de un telón de fondo estándar azul Kaisongmei, modelo: b1020be.
Los parámetros fotográficos utilizados fueron: modo prioridad tiempo de exposición (Tv), velocidad 120; ISO 1000; con lo cual se realizaba un ajuste automático de la apertura del diafragma para obtener una iluminación estándar de cada paciente.
Almacenamos las fotografías en formato JPEG, a color en cuatricromía Cyan, Magenta, Yellow y Key (CMYK), con una resolución de por lo menos 300 puntos por pulgada (DPI).
Valoración de los resultados
Realizamos una escala valorativa del grado de satisfacción de los pacientes y del grado de satisfacción de los resultados por parte del equipo médico. Las encuestas empleadas se rigieron por la Escala Psicométrica de Likert de Satisfacción que es una de las más usadas en encuestas para la investigación y se basa en la suma de las respuestas de los elementos del cuestionario. Los elementos a valorar fueron los siguientes: 1. Mejoría del color de la piel; 2. Mejoría de la calidad de la piel; 3. Mejoría de la forma del surco nasogeniano (Tablas I y II). Llevamos a cabo esta valoración a los 3 y 6 meses, y 1 año después de realizado el tratamiento.
Establecimos 2 grupo para la valoración: Grupo A, constituido por un cirujano y una enfermera de la consulta, y un Grupo B, constituido por un familiar o acompañante habitual del paciente y por el propio paciente. Ambos grupos usaron las fotografías preoperatorias y las de los controles postoperatorios para realizar las valoraciones de las áreas tratadas.
Análisis de células madre
Enviamos las muestras de grasa emulsionada (nanofat) para su evaluación al Institut de Recerca Contra la Leucèmia Josep Carreras (Barcelona, España). Mediante el uso de citometría de flujo, se analizó la presencia de células CD34 + viables. Además se utilizó microscopía de contraste de fases para mostrar el tejido adiposo roto y las células apoptóticas (Fig. 2 y 3).
A fin de superar las limitaciones asociadas con el rendimiento y/o recuperación del conteo de células madre después de la separación celular magnética, hemos realizado mediciones de inmunofluorescencia directa para las células CD34+ con recuento absoluto de estas utilizando citometría de flujo.
En nuestro estudio, las células restantes de grasa emulsionada se tiñeron simultáneamente con anticuerpos conjugados al fluorocromo FITC (isotiocianato de fluoresceína), CD45, ficoeritrina (PE), CD34, y la sonda fluorescente Vybrant Dye Cycle® Violet (DCV) como sistema de una tinción celular permanente de los ácidos nucleícos que puede penetrar al núcleo sin fijación celular y es compatible con muchas aplicaciones en células vivas; FITC, PE y DCV son moléculas capaces de emitir fluorescencia al ser excitadas a ciertas longitudes de onda mediante láser violeta y láser azul. La grasa emulsionada se filtró a través de una malla de nylon 52 µm, y el efluente se recogió para ensayos de citometría de flujo. Alícuotas de nanofat (100 pl) se tiñeron con CD34-PE, CD45-FITC y DCV durante 20 min a temperatura ambiente protegido de la luz.
Mediciones citometría de flujo
Todas las medicionesde células se realizaron utilizando el Attune® Acoustic Focusing Cytometer (Thermo Fisher Scientific Inc. Eugene, EE.UU). Las muestras de nanofat se tiñeron simultáneamente con anticuerpos monoclonales PE-CD34, y FITC-CD45. PE son las siglas correspondientes al fluorocromo ficoeritrina y FITC al isotiocianato de fluoresceina, necesario para identificar las células progenitoras. Esta tinción utiliza también Vybrant Dye Cycle Violet (DCV), una sonda fluorescente específica de ADN. Dicha combinación de marcadores fluorescentes permite identificar con mucha precisión las células CD34+/CD45+ viables contenidas en el producto emulsionado. La combinación de filtros ópticos utilizada en el citómetro de flujo consistió en filtro dicroico de paso largo a 555 nanómetros, filtro de paso de banda a 530/30 nanómetros para la fluorescencia verde (FITC), filtro dicroico de paso largo a 620 nanómetros, y filtro de paso de banda a 574/26 nanómetros para la fluorescencia de color naranja (PE). La adquisición celular se detiene cuando se recogieron un mínimo de unos 10.000 DCV+. La fluorescencia de FITC, PE y DCVse recogió en una escala logarítmica con la finalidad de identificar y cuantificar la presencia de células progenitoras humanas CD34+/ CD45+ y CD34+/ CD45-.
RESULTADOS
En este estudio fueron tratados 56 pacientes: 52 mujeres y 4 hombres, con un intervalo de edad de entre 20 a 62 años (media de 31 años).
El tratamiento se hizo solo para la coloración oscura de las ojeras en 18 pacientes; para la corrección del surco nasoyugal en 10 pacientes; para tratamiento combinado de coloración oscura de ojeras y surco nasoyugal en 22 pacientes; y en 6 pacientes a los que se les hizo tratamiento combinado de ojeras y surco nasoyugal, se les practicó también tratamiento para mejorar la calidad de piel de cuello, escote y manos.
El área de recolección de grasa en todos los casos fue la zona periumbilical (Tabla III).
La cantidad de grasa extraída del área periumbilical varió desde 10 hasta 30 ml (media de 20 ml).
La cantidad de grasa infiltrada para la corrección de la coloración oscura de las ojeras osciló entre 1.5 a 3 ml de nanofat por lado (media de 2 ml). En cara, cuello y escote la infiltración varió desde 6 a 10 ml (media de 7.5 ml). Para los casos de tratamiento con nanofat en manos, el volumen infiltrado varió desde 3 a 6 ml por mano (media de 4.8 ml). Para la corrección del surco nasoyugal con microinjertos de grasa, la infiltración osciló de 2 a 5 ml por lado (media de 2.5 ml).
La valoración por parte de los pacientes y del equipo médico de los resultados al año de realizados estos procedimientos reportó los siguientes resultados (Tablas IV y V):
- En los casos en los que practicamos tratamiento de la coloración oscura de las ojeras, 17 pacientes (94%), los resultados fueron satisfactorios y muy satisfactorios para el equipo médico; los resultados valorados por los propios pacientes fueron muy satisfactorios para 14 pacientes (77%), satisfactorios para 3 pacientes (17%), e insatisfactorios para 1 paciente.
- En el surco nasoyugal, el grado de satisfacción valorado por el equipo médico fue: satisfactorio en 3 casos (30%), y muy satisfactorio en 7 casos (70%). La evaluación por parte de los pacientes reportó un resultado satisfactorio en 8 casos (80%), muy satisfactorio en 7 casos (70%), e insatisfactorio en 1 caso.
- En los casos de tratamiento combinado de nanofat y microinjertos, los resultados evaluados por el equipo médico fueron valorados como muy satisfactorios en 16 pacientes (73%). No hubo casos de insatisfacción. La valoración por los pacientes fue muy satisfactoria en 18 pacientes (82%) y satisfactorias en 4 pacientes (18%).
- La valoración de la piel de cuello, escote y manos fue similar tanto para el equipo médico como para los pacientes: satisfactoria en 4 pacientes (67%), y muy satisfactoria en 2 pacientes (33%).
Las complicaciones inmediatas, ocurridas en los primeros 15 días tras el tratamiento, que presentaron los pacientes fueron: equimosis, edema y leve dolor del área de recolección de grasa, que desaparecieron progresivamente sin necesidad de tratamiento específico.
La complicación a mediano plazo, entre la 6a y la 12a semana postratamiento, que presentaron los pacientes fue coloración rojiza del área de infiltración de nanofat, que desapareció progresivamente. Solo recomendamos el uso de protector solar spf 50.
La complicación tardía, entre el 4o y el 6o mes tras el tratamiento, que se presentó fue hiperpigmentación postinflamatoria Un solo caso presentó esta complicación que tratamos con vitamina K de uso tópico aplicada 3 veces al día, y sesiones de terapia lumínica LED, 1 a 2 sesiones durante 6 semanas, solucionándose por completo.
No se presentaron complicaciones tardías como hipercorrección de volumen del surco nasoyugal, ni irregularidades en la piel infiltrada.
Como ventajas del procedimiento descrito señalar el que pudimos realizar una adecuada emulsión de la grasa y un filtrado de la misma con una mínima manipulación, y que fue más fácil la infiltración de nanofat en las dermis con aguja de 27G, ya que no se obstruyó la luz de la aguja durante las infiltraciones. Asimismo, apuntar también que pudimos utilizar el mismo filtro hasta para 20 ml de grasa emulsionada.
Análisis de células madre
Enviamos al laboratorio para análisis un total de 12 muestras de pacientes escogidas aleatoriamente. Pudimos observar en ellas detección de células CD34+ en la grasa emulsionada (>50% del total de células DCV; Fig. 4), y cerca de la mitad de las células CD34+/CD45+co-expresada (43.22%; Fig. 5), indicando su origen hematopoyético. Estos resultados mostraron un enriquecimiento de las células CD34+ en las 12 muestras de nanofat enviadas, lo que sugiere que el tejido adiposo puede constituir un depósito hipóxico para las células CD34+ madre hematopoyéticas.
Confirmamos con los análisis realizados a las muestras de nanofat que la presencia de CD34+ viables estaba por encima del 50% de las células restantes en las muestras, lo que indica un elevado número de células madre.
Discusión
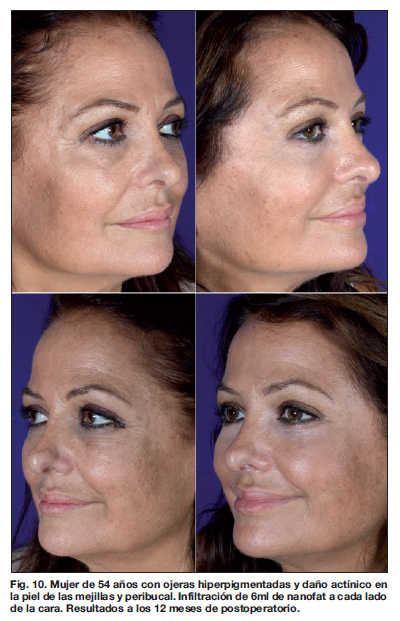
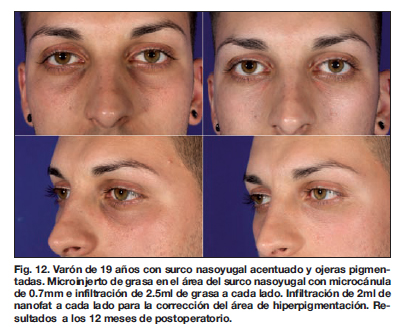
En nuestro estudio, los resultados clínicos fueron evidentes a partir de los 3 meses después del tratamiento. Las valoraciones de los resultados a los 3 y 6 meses, tanto por el equipo médico como por los pacientes, fueron menos satisfactorias en los diferentes parámetros analizados que la valoración realizada después de 1 año de la realización del tratamiento (Fig. 6-12).
Observamos que en las evaluaciones de los pacientes a los 6 meses no se evidenciaba una importante mejoría de la coloración de la piel (ojeras oscuras y pequeñas discromías cutáneas); sin embargo, la calidad de la piel (luminosidad turgencia, hidratación) fue percibida tanto por el equipo médico como por los pacientes con una mejoría satisfactoria.
La pigmentación rojiza que hemos descrito como una complicación a mediano plazo en las áreas de infiltración de nanofat, fue la causa de la baja valoración en la mejoría de la coloración de la piel, aspecto descrito de manera similar por Tonnard.(20)
En los casos en los que realizamos microinjertos de grasa en el surco nasoyugal, las valoraciones fueron ligeramente diferentes entre el equipo médico y los pacientes. El grado de satisfacción del equipo médico fue mayor, pues se observó una corrección adecuada del surco nasoyugal a los 12 meses. Sin embargo, 2 pacientes reportaron mayor satisfacción con el resultado a los 3 meses, momento en el que había un aspecto de mayor plenitud del surco; este aspecto de plenitud a los 3 meses fue valorado por el equipo médico como edema o sobrecorrección del surco nasoyugal.
La valoración de la piel de manos, cuello y escote fue muy similar para el equipo médico y para los pacientes a los 12 meses, no presentando casos de insatisfacción. Debemos destacar que las valoraciones a los 3 meses fueron no satisfactorias en todos los casos para ambos grupos de valoración, pues no apreciaban ningún cambio en la calidad y coloración de la piel.
Como mencionamos anteriormente, se presentó en nuestro grupo de estudio una complicación tardía por hiperpigmentación postinflamatoria de 6 meses de evolución; sin embargo, debemos señalar el hecho de que la paciente que sufrió dicha complicación presentó equimosis significativa en el postoperatorio inmediato que probablemente propició el depósito de hemosiderina en el área tratada con nanofat. Este caso fue tratado con vitamina K de uso tópico aplicada 3 veces al día y sesiones de terapia lumínica LED, con 1 a 2 sesiones durante 6 semanas, tras lo cual se produjo una remisión progresiva de la hiperpigmentación. Esta paciente no refirió satisfacción en el resultado final, a los 18 meses de postoperatorio, sin embargo el equipo médico valoró el resultado como satisfactorio. Esta diferencia en la valoración final de la paciente puede deberse a que sus expectativas superaban los resultados ofrecidos por el equipo médico durante la visita informativa del tratamiento.
Desde un punto de vista general, la combinación de nanofat y microinjerto de grasa resulta una alternativa interesante para el tratamiento de las ojeras mixtas.(20) Los resultados fueron satisfactorios en todos los casos de nuestro grupo de estudio, a excepción de la paciente que presentó la hiperpigmentación postinflamatoria ya comentada.
El promedio de recuperación de la equimosis fue de entre 2 a 3 semanas. Observamos cambios en la pigmentación a partir del tercer mes. La corrección del surco nasoyugal con microinjerto de grasa fue satisfactoria en la mayoría de los casos ya durante el primer trimestre de valoración.
Se postula que el tejido adiposo puede constituir un depósito hipóxico para células hematopoyéticas CD34+. El elevado número de células CD34+ podría ser debido al hecho de que el tejido adiposo puede secuestrar células madre porque es especialmente hipóxico (40-50 mmHg).(21) Con el uso de la citometría de flujo con enfoque acústico, hemos demostrado que las células CD34+ viables estaban presentes en la grasa emulsionada (>50% de las células nucleadas totales DCV+), estimando que, en 2000 ml de lipoaspirado hay al menos 10 millones de células CD34+.
Aunque el efecto fisiológico de nanofat, que contiene células en altos porcentajes de CD34+ viables, aún no está del todo claro, tenemos evidencia clínica de una mejoría en la pigmentación, en las ojeras y en las arrugas de los pacientes que han sido sometidos a este procedimiento y que hemos analizado en nuestro grupo de estudio.(22) Hacemos hincapié en que la mejoría más notoria la observamos en pacientes con ojeras tipo P (pigmentaria) y de tipo mixto (PS- pigmentaria y estructural) de la clasificación de Huang.(23)
Conclusiones
La técnica nanofat es una excelente herramienta para el rejuvenecimiento de la piel; permite tratar la pigmentación de la piel y mejorar la calidad de la misma. Hemos utilizado esta técnica en cara, escote y manos, así como para el tratamiento de las ojeras. En todos los pacientes se observó una mejoría importante de la calidad y la elasticidad de la piel, reducción de arrugas finas y reducción de la pigmentación.
El kit que hemos desarrollado, permite disponer de un sistema cerrado estéril para la manipulación del tejido, que facilita el procesamiento e infiltración del nanofat.
Hasta ahora, la técnica nanofat había demostrado tener resultados efectivos en la pigmentación y en el rejuvenecimiento de la piel. En las muestras analizadas en nuestro estudio, la presencia de CD34+ viables en el nanofat estaba por encima del 50% de las células restantes (presencia de un alto número de células madre), lo que podría ser la respuesta a la capacidad para lograr buenos resultados clínicos, sin el impacto apocrino de los nanoelementos.
Agradecimientos
Los autores de este trabajo están muy agradecidos a Michael D. Ward, Jolene Bradford, Paola Paglia, Clara Streiff, Sergio Ramón, Lluís Sainz, Juanma Cárdenas, Marta Fornell, de Thermo Fisher Scientific, Inc. por toda su ayuda en este campo de investigación. Al Dr. Jordi Petriz, anterior Presidente de la Sociedad Ibérica de Citometría y al Institut de Recerca Contra la Leucèmia Josep Carreras, de Barcelona, España.
Bibliografía
1. Coleman SR. Long-term survival of fat transplants: controlled demonstrations. Aesthetic Plast Surg. 1995; 19(5):421-425. [ Links ]
2. Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 2001; 7:211-228. [ Links ]
3. Okura H, Saga A, Soeda M, et al. Intracoronary artery transplantation of cardiomyoblast-like cells from human adipose tissue- derived multi-lineage progenitor cells improve left ventricular dysfunction and survival in a swine model of chronic myocardial infarction. Biochem Biophys Res Commun. 2012; 425:859-865. [ Links ]
4. Fawzy El-Sayed KM, Dörfer C, Fändrich F, et al. Adult mesenchymal stem cells explored in the dental field. Adv Biochem Eng Biotechnol. 2013; 130:89-103. [ Links ]
5. Oh JS, Park IS, Kim KN, Yoon do H, Kim SH, Ha Y. Transplantation of an adipose stem cell cluster in a spinalcord injury. Neuroreport. 2012;23:277-282. [ Links ]
6. Puissant B, Barreau C, Bourin P, et al. Immunomodulatory effect of human adipose tissue-derived adult stem cells: Comparison with bone marrow mesenchymal stem cells. Br J Haematol. 2005; 129:118-129. [ Links ]
7. Yoo KH, Jang IK, Lee MW, et al. Comparison of immunomodulatory properties of mesenchymal stem cells derived from adult human tissues. Cell Immunol. 2009; 259:150-156. [ Links ]
8. Kim JH, Jung M, Kim HS, et al. Adipose-derived stem cells as a new therapeutic modality for ageing skin. Exp Dermatol. 2011; 20:383-387. [ Links ]
9. Kim WS, Park BS, Park SH, et al. Antiwrinkle effect of adipose-derived stem cell: activation of dermal fibroblast by secretory factors. J Dermatol Sci. 2009; 53:96-100. [ Links ]
10. Krumboeck A, Giovanoli P, Plock JA. Fat grafting and stem cell enhanced fat grafting to the breast under oncological aspects--recommendations for patient selection. Breast. 2013; 22(5):579-584. [ Links ]
11. Zhou B, Yuan J, Zhou Y, et al. Administering human adiposederived mesenchymal stem cells to prevent and treat experimental arthritis. Clin Immunol. 2011; 141:328-337. [ Links ]
12. Fraser, J. K., Schreiber, R., Strem, B., Zhu, M., Alfonso, Z., Wulur, I., and Hedrick, M. H. Plasticity of human adipose stem cells toward endothelial cells and cardiomyocytes. Nat Clin Pract Cardiovasc Med. 2006; 3, S33-S37. [ Links ]
13. Fraser, J. K., Wulur, I., Alfonso, Z., and Hedrick, M. H. Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol. 2006; 24, 150-154. [ Links ]
14. Schäffler, A., and Büchler, C. Concise review: adipose tissuederived stromal cells--basic and clinical implications for novel cell-based therapies. Stem Cells. 2007; 25, 818-827. [ Links ]
15. Rehman, J., Traktuev, D., Li, J., Merfeld-Clauss, S., Temm- Grove, C. J., Bovenkerk, J. E., Pell, C. L., Johnstone, B. H., Considine, R. V., and March, K. L. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. Circulation. 2004; 109, 1292-1298. [ Links ]
16. Safford, K. M., and Rice, H. E. Stem cell therapy for neurologic disorders: Therapeutic potential of adipose-derived stem cells. Curr Drug Targets. 2005; 6, 57-62. [ Links ]
17. Strem, B. M., Hicok, K. C., Zhu, M., Wulur, I., Alfonso, Z., Schreiber, R. E., Fraser, J. K., and Hedrick, M. H. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 2005; 54, 132-141. [ Links ]
18. Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, Nie J, Jonsdottir GA, Ruotti V, Stewart R, Slukvin II, Thomson JA. Induced pluripotent stem cell lines derived from human somatic cells. Science. 2007; 318 (58): 1917-1920. [ Links ]
19. Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 2007; 131(5):861-872. [ Links ]
20. Tonnard, P., Verpaele, A. Peeters, G., Hamdi, M., Cornelissen, M., Declercq, H. Nanofat Grafting: Basic Research and Clinical Applications. Plast Reconstr Surg. 2013; 132(4):1017-2106. [ Links ]
21. Fotia C, Massa A, Boriani F, Baldini N, Granchi D. Hypoxia enhances proliferation and stemness of human adipose-derived mesenchymal stem cells. Cytotechnology. 2015; 67(6):1073-1084. [ Links ]
22. Chang H, Park JH, Min KH, Lee RS, Kim EK. Whitening effects of adipose-derived stem cells: a preliminary in vivo study. Aesthetic Plast Surg. 2014; 38(1):230-233. [ Links ]
23. Huang YL, Chang SL, Ma L, Lee MC, Hu S. Clinical analysis and classification of dark eye circle. Int J Dermatol. 2014; 53(2):164-170. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Jorge Planas Ribó
Clínica Planas
Pere II de Moncada no 16
08034 Barcelona, España
Correo electrónico: jorge@clinica-planas.com
Recibido (esta versión): 27 enero/2017
Aceptado: 27 febrero/2017