Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Cirugía Plástica Ibero-Latinoamericana
versão On-line ISSN 1989-2055versão impressa ISSN 0376-7892
Cir. plást. iberolatinoam. vol.43 no.2 Madrid Abr./Jun. 2017
Masa palpable como presentación atípica de linfoma anaplásico de células gigantes asociado a implantes mamarios
Palpable mass as an atypical presentation of breast implants-associated anaplastic large cell lymphoma
Isabel Fernández-Sobrino*; Juan-José Cordones-Guerrero**; Olivia Benítez-Dupin**; José-Ignacio Cornejo-Ladrero*** y Francisco Lobo-Samper****
* Médico Residente, Servicio de Radiología.
** Médico Adjunto, Servicio de Radiología.
*** Médico Adjunto, Servicio de Anatomía Patológica.
**** Jefe del Servicio de Oncología Médica.
Hospital Universitario Fundación Jiménez Díaz, Madrid, España.
Conflicto de intereses: los autores declaran no tener ningún interés financiero relacionado con el contenido de este artículo.
Dirección para correspondencia
RESUMEN
Presentamos el caso de una paciente de 40 años con antecedentes de mamoplastia reductora y posterior colocación de prótesis mamarias, remitida a la Unidad de Mama para estudio de nódulo objetivado a la autopalpación en mama izquierda. Las pruebas de imagen revelaron presencia de múltiples nódulos sospechosos de malignidad adyacentes a la prótesis y varias adenopatías locorregionales. El estudio anatomopatológico confirmó el diagnóstico de linfoma anaplásico de células gigantes asociado a prótesis mamaria.
Tras la retirada de las prótesis y capsulectomía, la evolución de la paciente fue favorable. Revisamos la especial forma de presentación de la patología, y las características clínicas, anatomopatológicas y radiológicas de esta entidad que, a pesar de su baja incidencia, debe ser considerada en un contexto determinado.
Palabras clave: Linfoma anaplásico células gigantes, Prótesis mamarias, Implantes mamarios.
Nivel de evidencia científica: 5 Diagnóstico.
ABSTRACT
We report a case of a 40-year-old woman with a history of breast reduction and later breast implants placement, who was referred to the Breast Unit for the study of a nodule identified at self-palpation in her left breast. Imaging tests revealed the presence of multiple suspicious malignant nodules adjacent to the prosthesis and several loco regional lymph nodes. The anatomopathological study confirmed the diagnosis of anaplastic giant cell lymphoma breast implants associated.
After the explant of the prosthesis and the accomplishment of a capsulectomy the evolution of the patient was favorable.
We review the special presentation of the pathology, and the clinical, anatomopathological and radiological features of this entity that, despite its low incidence, must be considered in a given context.
Key words: Anaplastic large cells lymphoma, Breast implants.
Level of evidence: 5 Diagnostic.
Introducción
El subtipo histológico más frecuente de cáncer de mama es la neoplasia de estirpe epitelial. Entre las neoplasias no epiteliales, las de origen hematológico son las más habituales, representando menos del 1% de todos los cánceres de mama, y entre ellas, el linfoma Hodgkin de células B es el tumor más frecuente.(1,2)
El linfoma anaplásico de células gigantes (LACG) es una forma extremadamente infrecuente de linfoma no Hodgkin (2-3% de los casos).(3) Se estima que la incidencia del LACG asociado a implantes mamarios (LACG-AI o LCAL-BI en sus siglas en inglés) es de 0.3/100.000 mujeres portadoras de prótesis al año.(3-5)
Esta entidad fue descrita por primera vez en 1997 por Kerch y Creech,(6) y a partir de esa fecha se han publicado en la literatura varias series de casos, entre los que destacan la serie de Miranda en 2014 con 60 casos(7) y la de Brody en 2015 con 173.(8)
Aunque la mayoría de las pacientes están asintomáticas en el momento del diagnóstico, no es infrecuente el aumento de volumen mamario como forma de presentación clínica de la enfermedad. El hallazgo radiológico más común es el seroma periprotésico de aparición tardía, con una media de 9 años tras la colocación de los implantes. Es menos habitual que esta entidad adopte la apariencia clínico-radiológica de los procesos agresivos de la mama, tales como masa palpable o adenopatías con criterios sospechosos de malignidad. Otro rasgo diferenciador del LACG-AI es su buen pronóstico tras la retirada de las prótesis mamarias.
En este artículo presentamos el caso de una paciente diagnosticada de esta entidad en nuestra institución que creemos interesante por su atípica forma de presentación, y llevamos a cabo una revisión bibliográfica de los casos publicados hasta el momento con el fin de actualizar los conocimientos sobre esta rara enfermedad que tanto el cirujano como el radiólogo deben incluir en su diagnóstico diferencial en un escenario clínico concreto.
Caso clínico
Paciente de 40 años de edad remitida a la Unidad de Mama de nuestro hospital por autopalpación de nódulos en la mama izquierda 2 semanas antes. En la exploración física se confirmó la presencia de una tumoración de consistencia pétrea adherida a planos profundos, en la región infraclavicular izquierda. La paciente no refería otra sintomatología asociada.
Entre sus antecedentes personales constaba una intervención por mamoplastia de reducción a los 17 años y posterior mamoplastia de rejuvenecimiento con colocación de implantes mamarios a los 33 años y una oforectomía unilateral por endomietroma. No existían otros antecedentes personales ni familiares de interés.
La mamografía realizada inicialmente no reveló ningún hallazgo patológico en unas mamas con un patrón fibroglandular denso (composición D) y un potencial efecto de enmascaramiento que limitaba la detección de lesiones. En la ecografía complementaria confirmamos que la lesión palpable correspondía a una masa sólida, de comportamiento agresivo, asociada a varios nódulos periprotésicos (Fig. 1). Las prótesis mamarias estaban en situación retropectoral y mostraban un aspecto íntegro, sin líquido periprotésico ni otros signos de complicación. Esta exploración también puso de manifiesto la presencia de adenopatías tanto en cadena mamaria interna como en regiones axilares (Fig. 2). Catalogamos los hallazgos como BI-RADS 5 (Breast Imaging Reporting and Data System), es decir, altamente sospechosos de malignidad de acuerdo al actual sistema de clasificación del ACR (American College of Radiology 2015), realizando a continuación biopsia con aguja gruesa (14G) tanto de la lesión dominante como de una de las adenopatías axilares.
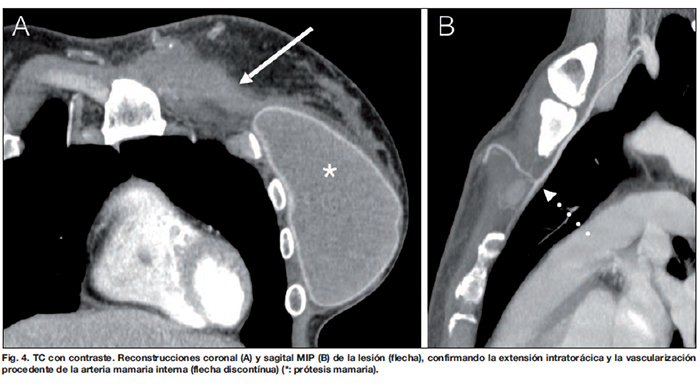
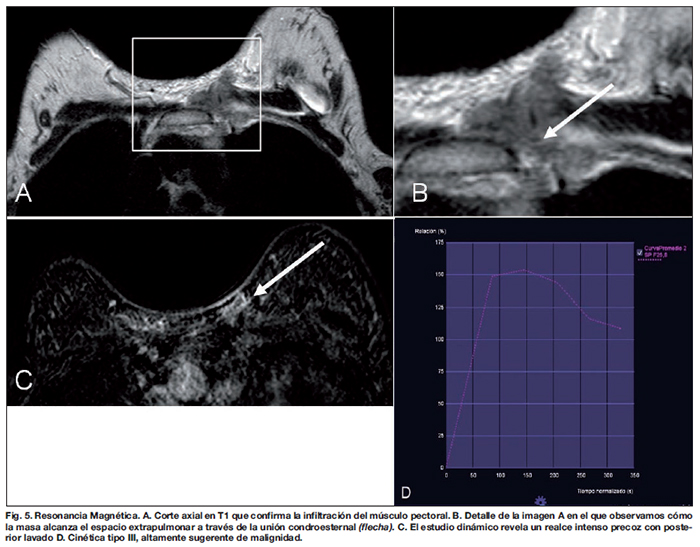
La Resonancia Magnética (RM) y la Tomografía Computerizada (TC), confirmaron la afectación del músculo pectoral y la extensión del tumor al espacio extrapulmonar (Fig. 3 y 4).
Tanto esta lesión como los restantes nódulos periprotésicos descritos en la ecografía mostraron un comportamiento morfológico y dinámico sugerente de malignidad, presentando una intensidad de señal similar al parénquima en imágenes potenciadas en T1 y cinética con curvas tipo III en las secuencias tras la administración de contraste (Fig. 5). Asimismo, tanto la RM como la TC confirmaron la presencia de adenopatías axilares y en la cadena mamaria interna. Comprobamos también la integridad de ambas prótesis y la ausencia de líquido periprotésico. El estudio de extensión con TC no demostró lesiones a distancia.
El diagnóstico inicial fue de carcinoma multicéntrico con afectación linfática locorregional T2 N2 M0 (American Joint Committee of Cancer 7a edición). El estudio anatomopatológico confirmó el diagnóstico de linfoma T anaplásico asociado a implante mamario. Al tratarse de una entidad hematológica completamos el estudio de extensión con biopsia de médula ósea y tomografía con emisión de positrones (PET-TC), que resultaron negativos.
El estudio anatomopatológico del nódulo demostró un infiltrado polimorfo con alto índice proliferativo (del 90%) con células que expresaban CD30 y CD15 y eran negativas para ALK (anaplastic lymphoma kinase) (Fig. 6). La biopsia de la adenopatía axilar reveló la infiltración focal por linfoma.
Tras valoración en comité multidisciplinar se decidió realizar retirada de los implantes mamarios con capsulectomía completa en ambas mamas. Los implantes retirados fueron de la marca McGhan®, modelo MM,texturizados, de 320 cc. Dado el carácter infiltrativo de la lesión principal, no se llevó a cabo extirpación de la masa ni de los nódulos periprotésicos.
El estudio anatomopatológico de la pieza quirúrgica confirmó infiltración tumoral de la cápsula periprotésica izquierda, sin evidencia de lesión en la mama contralateral.
Una semana después de la intervención, evidenciamos clínicamente una disminución significativa de la masa infraclavicular, motivo por el que realizamos TC de reevaluación que confirmó la práctica resolución de la misma, así como una marcada reducción del tamaño de las adenopatías (Fig. 7). La confirmación histológica de afectación ganglionar obligó a completar el tratamiento con 6 ciclos de quimioterapia siguiendo la fórmula CHOP (Ciclofosfamida, Doxorrubicina, Vincristina, Prednisolona).
Tras 12 meses de evolución, la paciente se ha sometido a un seguimiento clínico y analítico periódico a los que hemos sumado la realización de varias pruebas de imagen: RM a los 6 meses del diagnóstico, ecografías periódicas y TC tóraco-abdominal al finalizar el tratamiento, confirmando la remisión completa en la última evaluación oncológica.
Discusión
El subtipo histológico más frecuente de linfoma anaplásico es el de células gigantes, siendo menos frecuentes los de estirpe folicular y linfoplasmocítica. Dentro del grupo de los LACG se diferencian 3 tipos: ALK+, ALK- (según expresen o no la proteína anaplasik linfoma kinase) y el linfoma cutáneo. Los LACG-AI tienen un perfil inmunohistoquímico característico, con células T CD30 + y ALK-. Los LACG que se desarrollan en mujeres sin prótesis mamarias son extremadamente raros (incidencia de 3 casos / 100 millones / año)(9) y suelen derivar de Células B ALK +.(10)
Aunque siguen existiendo dudas sobre su etiopatogenia, se han propuesto la infección e inflamación crónicas como posibles desencadenantes de la enfermedad, al igual que ocurre en otros linfomas asociados a determinados agentes infecciosos (MALT: tejido linfoide asociado a las mucosas por sus siglas en inglés: mucosa-associated lymphoid tissue) o que acontecen en el contexto de enfermedades autoinmunes (enfermedad celíaca, tiroiditis de Hashimoto, etc).(1)
En el caso concreto del LACG-AI, el hecho de que se desarrolle ante la presencia de un material específico implantado en una región anatómica concreta, así como la detección de abundantes células T en la cápsula que rodea a los implantes, apoyan la hipótesis de que existen mediadores de la inflamación crónica desencadenados por un cuerpo extraño que estarían implicados en el desarrollo de la enfermedad. El LACG-AI surge de la propia cápsula periprotésica, a diferencia de los linfomas primarios de la mama que se desarrollan en el tejido mamario, fuera de la cápsula.
Las células del LACG-AI comparten morfología e inmunofenotipo con las del linfoma cutáneo, lo que apoya la hipótesis de un patogenia común y una cierta predisposición genética.(8,9,11)
En relación con el tipo de prótesis mamaria, están descritos casos asociados a prótesis tanto rellenas de silicona como de suero. Sin embargo, el desarrollo de LACG-AI parece más frecuente cuando las prótesis son de superficie texturizada que cuando son de superficie lisa (al menos en los casos en que está recogido en la historia clínica de la paciente el tipo de implante del que eran portadoras).(2) En el caso que presentamos los implantes eran de superficie texturizada, forma anatómica y altura y perfil moderados.
La media de edad de las pacientes incluidas en las distintas series publicadas está en torno a los 50 años. El tiempo transcurrido desde la cirugía hasta el desarrollo del tumor es variable, con un tiempo medio de 9 años, aunque se han descrito casos que oscilan desde los 3 meses hasta los 25 años. En el caso que presentamos, transcurrieron 7 años desde el la colocación de los implantes hasta el desarrollo del tumor, lo que sitúa el caso en la media de presentación descrita hasta la fecha. Aunque la mayor parte de las pacientes suelen estar asintomáticas en el momento del diagnóstico, están descritas varias formas de presentación clínica, siendo la más habitual la inflamación y el edema unilateral de aparición tardía en ausencia de signos de infección ni traumatismo previo; esto se debe a la formación de un seroma periprotésico que se considera tardío cuando aparece al menos 6 meses después de la cirugía de colocación de los implantes mamarios. El dolor y los síntomas B (fiebre, pérdida de peso y sudoración nocturna) son menos habituales en este tipo de linfoma.(2,8)
Lo característico del caso que presentamos es que, a diferencia de la mayoría de los casos publicados, nuestra paciente presentó varios nódulos y adenopatías palpables en ausencia de líquido periprotésico.
Ante la aparición de edema en una mama portadora de prótesis, la ecografía es la modalidad de imagen de elección para determinar la presencia o no de seroma y la extensión del mismo, en cuyo caso deberemos extraer una muestra mediante punción guiada por ecografía y enviarla en fresco para su análisis. Cuando estemos ante la presencia de una masa, debemos realizar biopsia.
Una vez confirmado el diagnóstico de LACG-AI, la afectación a distancia confirmada mediante PEC-TC y biopsia de médula ósea determinarán la indicación de tratamiento neoadyuvante. El habitual, que fue el que empleado en el caso que nos ocupa, consiste en la combinación de agentes citostáticos según la fórmula CHOP; sin embargo, hoy en día se tiende a la aplicación de otras fórmulas CHOP-like de forma personalizada para cada paciente y bajo consenso con especialistas en Hematología.(7)
La retirada de los implantes mamarios y capsulectomía completa son ineludibles para conseguir la curación de estas pacientes. La evolución favorable de la enfermedad tras la retirada de las prótesis y/o el empleo de agentes quimioterápicos en los casos de extensión, ha desplazado al tratamiento radioterápico en los últimos años.(8)
La mayoría de las pacientes no tienen enfermedad diseminada en el momento del diagnóstico (estadío I). El pronóstico suele ser excelente, con una tasa de supervivencia a los 5 años que oscila entre el 75 y el 100%, dependiendo de si la enfermedad se presenta como masa palpable o como seroma respectivamente.(7,12) Se estima que entre el 15 y el 45% de los casos se presenta como enfermedad diseminada.(2,12) Es importante reseñar que el tiempo medio de seguimiento de los casos reflejados en la literatura es de 2 años,(7,12) por lo que no es posible predecir la evolución de estas pacientes a largo plazo. Del mismo modo, los índices de recurrencia de la enfermedad son controvertidos y no hay datos claros debido al escaso tiempo de seguimiento y al desconocimiento del tipo de tratamiento quirúrgico empleado en muchos de los casos.(8,11)
En el caso que presentamos la respuesta de la paciente al tratamiento fue óptima, encontrándose en remisión completa en el momento actual tras 12 meses de seguimiento.
Consideramos que el mayor interés del caso que describimos radica por un lado en las escasas referencias bibliográficas sobre LACG-AI en la literatura, y aún más en la española y latinoamericana(13, 14) y por otro lado, en su presentación clínica atípica y en el estrecho seguimiento clínico-radiológico al que sometimos a la paciente desde el diagnóstico.
Conclusiones
El LACG-AI es una enfermedad rara que debe sospecharse ante la presencia de un seroma mamario tardío o de nódulos periprotésicos en pacientes portadoras de implantes mamarios.
Los hallazgos en ecografía y RM son inespecíficos pero pueden orientar al diagnóstico. El estudio anatomopatológico revela un perfil inmunohistoquímico específico que determina el diagnóstico definitivo.
El tratamiento indicado es la retirada de las prótesis mamarias con capsulectomía completa y quimioterapia en los casos de afectación extramamaria.
La buena respuesta al tratamiento es un rasgo distintivo de esta enfermedad, de la que se recogen altos índices de supervivencia a los 5 años.
Bibliografía
1. Miranda, et al. Anaplastic Large Cell Lymphoma Involving the Breast. Arch Pathol Lab Med 2009;133:1383-1390. [ Links ]
2. Jewell M, et al. Anaplastic Large T-Cell Lymphoma and Breast Implants: A Review of the Literature. Plast. Reconstr. Surg. 2011;128(3):651-661. [ Links ]
3. Clemens M.W., Miranda R.N.: Breast Implant-Associated Anaplastic Large Cell Lymphoma After 18 Years of Investigation. Clin Plastic Surg 2015,42:605-613. [ Links ]
4. Hwang M.J., Brown H., Murrin R., Momtahan N., Sterne G.D.: Breast Implant-Associated Anaplastic Large Cell Lymphoma: A Case Report and Literature Review. Aesth Plast Surg 2015,39:391-395. [ Links ]
5. De Jong D, Vasmel L.E., de Boer J.P. Anaplastic Large Cell Lymphoma in women with breast implants. JAMA 2008;300(17):2030-2035. [ Links ]
6. Keech J.A., Creech BJ. Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plast Reconstr Surg 1997;100(2):554-555. [ Links ]
7. Miranda RN, Aladily TN, Prince HM, et al. Breast implantassociated anaplastic large-cell lymphoma: long-term followup of 60 patients. J Clin Oncol 2014;32:114-120. [ Links ]
8. Brody GS, et al. Anaplastic Large Cell Lymphoma Occurring in Women with Breast Implants: Analysis of 173 Cases. Plast. Reconstr. Surg. 2015;135:695-705. [ Links ]
9. Peters, W. Update on anaplastic large cell lymphoma in women with breast implants. Plast Surg 2014;22(4):267-269. [ Links ]
10. M. Bizjak, et al. Silicone implants and lymphoma: The role of inflammation. Journal of Autoimmunity 2015;65:64-73. [ Links ]
11. Monreal J. Linfoma Anaplásico de Células Grandes Asociado a Prótesis de Mama: Situación Actual. Eur Aesth Plast Surg J. 2015;5(1):48-51. [ Links ]
12. Locke MB, Lofts J. Variable presentation of anaplastic largecell lymphoma in patients with breast implants. ANZ J Surg 2015;1:1-6. [ Links ]
13. Torres Olombrada M, García T, Caballero P, Sotoca A, Ludeña B, Caballero B, Rodriguez A, Bravo P, López A. Anaplastic Large Cell Lymphoma associated with breast implant: A case report and review of the literature. Rep Pract Oncol Radio 2013;18:S275-S281. [ Links ]
14. Torres-Rivero C., Ramos-Gallardo G., Nambo-Lucio M.J., Vaquero-Pérez M.M. Primer caso en México y América Latina de linfoma anaplásico de células gigantes en paciente con implantes mamarios. Cir. plást. iberolatinoam. 2016,42(2):175-180. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dra. Isabel Fernández Sobrino
Servicio de Radiología
Hospital Fundación Jiménez Díaz
Av. Reyes Católicos, 2, 28040 Madrid, España
Correo electrónico: isabelfdezsobrino@gmail.com
Recibido (esta versión): 11 mayo/2017
Aceptado: 1 junio/2017