My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Cirugía Plástica Ibero-Latinoamericana
On-line version ISSN 1989-2055Print version ISSN 0376-7892
Cir. plást. iberolatinoam. vol.43 suppl.1 Madrid Sep. 2017
MIEMBRO SUPERIOR
ORIGINAL / Series Clínicas
Seguridad y efectividad de la eliminación linfocitaria en trasplante de manos
Safety and effectiveness of lymphocyte depletion in hand transplantation
Luis Landín-Jarillo*; Jorge Bonastre-Juliá*; Pedro Bolado-Gutiérrez* y Carlos Jiménez-Martín**
* Especialista en Cirugía Plástica, Estética y Reparadora, Servicio de Cirugía Plástica y Reparadora, Hospital Universitario La Paz, Madrid, España.
** Jefe de Sección de Nefrología, Hospital Universitario La Paz, Madrid, España.
Conflicto de intereses: los autores declaran no tener ningún interés financiero relacionado con el contenido de este artículo.
Dirección para correspondencia
RESUMEN
Introducción y Objetivo. Los trasplantes de tejidos compuestos están indicados para casos en los que no hay alternativa reparadora y la reconstrucción alogénica es la única opción terapéutica disponible. Los receptores de tejidos compuestos requieren inmunosupresión crónica que entraña ciertos riesgos. Pese al uso de triple terapia inmunosupresora estándar se pueden producir episodios de rechazo agudo (RA), cuyo tratamiento habitual incluye ajuste del tratamiento, bolos de corticoides y el uso de inmunosupresores de forma tópica, aunque en ocasiones es necesario eliminar la población linfocitaria.
En el presente trabajo evaluamos la seguridad y efectividad de la eliminación linfocitaria utilizando globulina anti-timocítica (GAT) en el rescate de RA.
Material y Método. Llevamos a cabo una revisión sistemática sobre resultados y complicaciones tras la administración de GAT en trasplante de tejidos compuestos, incluyendo un total de 108 publicaciones que resumen la evolución de 57 pacientes. La revisión se acompaña de la presentación del curso inmunológico de 1 paciente trasplantado de brazos en nuestro centro.
Resultados. En 5 casos la GAT se administró con éxito para el tratamiento de rechazo resistente a corticoides, si bien no se consiguió prevenir la aparición de episodios de rechazo posteriormente. Nuestro paciente presentó un episodio de RA celular de grado III en la escala Banff que fue tratado con 2 cursos de metil-prednisolona y ajuste al alza del tratamiento inmunosupresor sin respuesta clínica. Finalmente el paciente recibió 2 dosis de GAT en el día 50 y 57 posttrasplante y tras 450 días de seguimiento permanece libre de rechazo. Por el momento no ha presentado complicaciones relacionadas con el uso de GAT.
Conclusiones. El rescate del RA resistente a corticoides en trasplantes de tejidos compuestos puede realizarse mediante administración de GAT. Todos los casos descritos en la literatura respondieron favorablemente, así como el caso tratado en nuestro centro.
Palabras clave: Trasplante, Manos, Tejidos compuestos, Rechazo agudo, Timoglobulina.
Nivel de evidencia científica: 4d Terapéutico.
ABSTRACT
Background and Objective. Composite tissue allotransplantation is usually indicatedwhen no reconstructive option is available and allogenic reconstruction becomes the only feasible treatment. Patients receiving a composite tissue allotransplant require chronic immunosuppression,which expose them to certain risks. Despite the administration of triple immunosuppressive therapy, these patients are at risk of suffering acute rejection (AR), whose usual treatment includes therapy adjustment, corticoid boluses and topical administration of immunosuppressive drugs, although the more severe cases may require lymphocyte depletion.
In this study we report the safety and effectiveness of antithymocyte globulin (ATG) as rescue treatment for a steroid-resistant AR episode.
Methods. We conducted systematic review of complications after administration of ATG, including 108 publications about 57 patients. We also report on a case of bilateral arm transplantation in whomATG was used after a steroid-resistant AR episode.
Results. ATG was mainly used as induction therapy, and also to control steroid-resistant AR episodes in 5 patients. All patients that had received ATG successfully responded,but ATG did not prevent further rejection episodes except for 1 patient. Our patient presented a grade III episode of acute cellular rejection according to the Banff scale, treated unsuccessfully with 2 courses of methylprednisolone. On day 50 and 57 post-transplantation ATG was given and the rejection successfully responded, and after 450 days of follow-up the patient remained free of rejection. At the moment the patient has not experienced any complications related to ATG.
Conclusions. The treatment of steroid-resistant AR episodes in composite tissue allotransplantation can be successfully performed administrating ATG. All cases described in the literature responded favorably to ATG as was the case treated in our center.
Key words: Transplant, Hands, Composite tissues, Acute rejection, Thymoglobulin.
Level of evidence: 4d Therapeutic.
Introducción
Los trasplantes de tejidos compuestos (TTCs) representan una de las incorporaciones más recientes en técnicas de reconstrucción para casos en los que no hay alternativa reparadora, como por ejemplo la amputación de extremidades o las lesiones faciales complejas.(1) Este tipo de reconstrucciones ha inaugurado un área que combina la reconstrucción y el trasplante, conocida como Trasplantología Reconstructiva. Los TTCs están constituidos por tejidos vascularizados de diferente capacidad antigénica, siendo la piel el compartimento tisular más frecuentemente afectado por el rechazo inmunológico.(2) Los TTCs además pueden contener tejido adiposo, muscular, tendinoso, fascial, óseo, nervioso e incluso mucoso y dentario. La reconstrucción alogénica aporta todas las estructuras necesarias para la reconstrucción en un solo tiempo quirúrgico. Sin embargo se diferencia de los trasplantes de órgano sólido en que su función no es metabólica, y depende de la neurotización del aloinjerto en el transcurso de los meses que siguen a la intervención. Entre sus inconvenientes se encuentra la necesidad de recibir inmunosupresión de forma crónica para prevenir el rechazo del aloinjerto. La medicación inmunosupresora expone a los receptores de TTCs a numerosos efectos adversos, por lo que la seguridad y efectividad de los protocolos de inmunosupresión continúa siendo campo de investigación clínica.(3)
La inmunosupresión en receptores de TTCs se divide en tres momentos, a saber inducción, mantenimiento y tratamiento del rechazo agudo (RA). La globulina anti-timocítica (GAT) consiste en una mezcla de anticuerpos policlonales que se administra durante la fase de inducción y que se obtiene del suero de conejos tras su inmunización con timo humano. Después de su administración se produce una eliminación de células linfocitarias, en particular de linfocitos T, que tiene lugar en el sistema retículo-endotelial. La linfopenia puede durar meses, mientras que la eliminación de la subpoblación CD4+ puede durar años. Entre los efectos secundarios destacan fiebre, tiritonas, artralgias, anafilaxia, enfermedad del suero, leucopenia, trombocitopenia e infección o reactivación de citomegalovirus (CMV).(4) También se ha descrito la administración de GAT para tratamiento de RA resistente al tratamiento con corticoides.(5)
El presente trabajo pretende revisar de forma sistemática la seguridad y efectividad del tratamiento del RA resistente a corticoides en trasplante de manos mediante la administración de GAT, así como su uso durante la fase de inducción. Como objetivo secundario describimos el uso de GAT en el contexto de RA resistente a corticoides en un paciente trasplantado de manos en nuestro centro hospitalario.
Material y método
Realizamos una revisión sistemática sobre trasplantes de mano publicados siguiendo criterios descritos previamente.( 6) De forma resumida, la búsqueda en la base de datos MedLine tuvo lugar el 8 de Junio de 2015 incluyendo los campos de búsqueda: "composite tissue allograft" AND "hand allograft transplantation" AND "hand transplantation". La base de datos devolvió un total 155 resultados. Seleccionamos aquellos artículos que describían uno o más casos de trasplante de manos tras la introducción de los inhibidores de la calcineurina (ICN) y que hubiesen sido publicados en inglés, francés o alemán entre 1999 y 2015. Encontramos 63 artículos que cumplían los criterios de inclusión y revisamos sus referencias para obtener artículos adicionales. También incluimos los resúmenes de congresos cuando fueron accesibles o hubiesen sido publicados. Sumando las referencias obtuvimos un total de 108 publicaciones. Sólo 82 artículos aportaron datos relevantes sobre la evolución de 57 pacientes y fueron seleccionados para su análisis.
Recopilamos datos demográficos, quirúrgicos y los relativos a la terapia inmunosupresora de inducción, mantenimiento y tratamiento del RA resistente a corticoides. Seguimos cada uno de los 57 pacientes a lo largo de las sucesivas publicaciones. Actualizamos los datos siempre con la última publicación disponible. Recogimos como variables de resultado la resolución del episodio de rechazo, la aparición de nuevos episodios de rechazo y la presentación de complicaciones infecciosas, metabólicas y oncológicas.
Nuestro centro hospitalario recibió la aprobación para la realización de TTCs en 2008. La evaluación de posibles receptores de trasplante de manos se inició en 2011. En 2012 valoramos a un paciente de 41 años que presentó quemaduras eléctricas en el 40% de la superficie corporal que resultaron en una amputación transhumeral bilateral (Fig. 1). Adicionalmente el paciente necesitó un colgajo libre de latissimus dorsi izquierdo para la reconstrucción de la cobertura de su pierna ipsilateral y otro colgajo libre sural medial derecho tras la liberación de una cicatriz axilar izquierda. Como antecedente de interés constaba un brote de esclerosis múltiple (EM) en el año 2002 que no requirió tratamiento, tras el que el paciente fue dado de alta de la patología en 2006. En 2012 presentó un nuevo brote de EM que se diagnosticó tras la extubación de la lesión por quemadura, consistente en diplopia de la que se recuperó espontáneamente sin secuelas clínicas, radiológicas ni neurofisiológicas. El paciente no adaptó prótesis y solicitó una valoración para incorporarse al programa de reconstrucción alogénica. Fue evaluado en varias visitas y recibió información verbal y escrita que incluía los beneficios de la recuperación funcional y los riesgos de las complicaciones metabólicas, infecciosas y oncológicas, así como la posibilidad de fallecimiento. El paciente presentaba pulsos palpables en ambas axilas, signo de Tinel positivo para los nervios radial, mediano y cubital en tercio proximal de brazo, y control voluntario de bíceps braquial y tríceps.
En 2014 la familia de un donante multiorgánico en muerte cerebral y corazón latiente, de características antropométricas similares a las del receptor con el que compartía positividad para CMV, grupo sanguíneo 0+, histocompatibilidad de 1 sobre 6 (alelo B44) del complejo mayor de histocompatibilidad y prueba cruzada virtual (Luminex®, Austin, EE.UU.) negativa, consintió la donación de ambos miembros superiores. El procedimiento quirúrgico consistió en la extracción de ambos aloinjertos a nivel del cuello quirúrgico humeral y lavado con 2 litros de solución de Belzer-Wisconsin (Viaspan®, Bristol-Myers Squibb, Dublín, Irlanda) por la arteria braquial hasta obtener un retorno claro por la vena basílica. Posteriormente se adaptaron prótesis cosméticas en el donante y los aloinjertos fueron sumergidos en la misma solución de preservación a 4 oC. Simultáneamente, dos equipos prepararon los muñones de amputación en el receptor. Tras la llegada de los aloinjertos al quirófano del receptor se evaluó su longitud y se tallaron de forma recíproca a los muñones. Las osteosíntesis de húmero fueron realizadas con placas LCP de 4.5 mm (Synthes®, Oberdorft, Suiza). Se realizaron miorrafias de músculos bíceps braquial y tríceps y neurorrafias de nervios radial, mediano, cubital y musculocutáneo. Las anastomosis de arteria braquial y las anastomosis respectivas de venas basílicas y cefálicas se realizaron mediante interposición de injertos venosos. Se hizo cierre parcial de heridas con injertos de piel de espesor parcial en zonas mediales. El tiempo de isquemia fría fue de 8 horas en total para ambos aloinjertos.
El paciente recibió inducción con 20 mg de basiliximab (Simulect®, Novartis, Basilea, Suiza) y 1 g de metilprednisolona en el momento de la revascularización. La terapia inmunosupresora de mantenimiento se inició en el tercer día postoperatorio con un objetivo en sangre de 15 ng/ml valle de tacrolimus (Prograf®, Astellas Pharma, Berlín, Alemania), micofenolato mofetil (Cell Cept®, Roche, Basilea, Suiza) 1g cada 12 horas y dosis descendentes de prednisona hasta alcanzar los 30 mg al final del primer mes y los 5 mg al final del tercer mes. La profilaxis antibiótica consistió en amoxicilina/clavulánico 2 g cada 8 horas intravenosa. La profilaxis antiviral se realizó con valganciclovir 450 mg cada 24 horas vía oral. Transcurridos 4 días se administró la segunda dosis de basiliximab según indicaciones del fabricante. La profilaxis antibiótica para Pneumocitis jirovecii consistió en trimetoprim- sulfametoxazol 400 mg cada 24 horas vía oral durante 3 meses.
En el seguimiento del paciente se tuvieron en cuenta los efectos adversos atribuibles a la medicación inmunosupresora en los ámbitos metabólico, infeccioso y oncológico. También las complicaciones derivadas de la administración de GAT, de la cirugía, y finalmente los resultados inmunológicos del procedimiento.
Los anticuerpos específicos contra el donante (anti- HLA) fueron medidos por la misma técnica cada 6 meses y en cada episodio de RA. La sospecha de RA se definió por la aparición de máculas en los aloinjertos. En caso de sospecha de RA el estudio histológico se realizó sobre la lesión clínica con peor aspecto tomando una muestra cutánea de 4 mm. No se realizaron en ningún caso biopsias de piel sana. Las biopsias se estudiaron con tinción de hematoxilina-eosina (H-E) y se clasificó la severidad del rechazo según la escala Banff para trasplantes de órganos que contienen piel (Tabla I).(2)
RESULTADOS
De los 57 pacientes trasplantados de manos que identificamos, 32 fueron unilaterales (56%) y 25 bilaterales (44%). El 89% de los receptores (51 pacientes) presentó algún episodio de RA durante su seguimiento, y en el 94% de estos (48 pacientes) el primer episodio de RA se presentó durante los primeros 6 meses de postoperatorio. El 98% de los receptores (50 pacientes), presentó algún episodio de RA de grado II o superior. Los episodios de RA fueron trataron con corticoides sistémicos en 20 pacientes (39%), y en combinación con tacrolimus de forma tópica en 15 casos (29%). En 14 pacientes (25%) con episodios de RA no pudimos encontrar referencias a su tratamiento.
El empleo más frecuente de GAT fue en el momento de inducción, con 22 pacientes (39%) (Tabla II). En 9 casos (18%) la GAT se empleó en monoterapia, mientras que en 5 (10%) se asoció a corticoides sistémicos. Sólo en 1 paciente (2%) se empleó una combinación de GAT con corticoides y micofenolato mofetil, mientras que en otros 4 (8%) se combinó con tacrolimus. En 3 casos (6%) se empleó como terapia de inducción una combinación de GAT con corticoides, tacrolimus y micofenolato mofetil. Dos pacientes (4%) desarrollaron la enfermedad del suero tras la administración de GAT en el momento de la inducción.
Los pacientes que recibieron GAT durante la inducción sufrieron una media aproximada de 1episodio de rechazo en los 6 primero meses, mientras que los que no recibieron GAT sufrieron una media de 1.4 episodios de RA, no siendo la diferencia significativa. El número de episodios de RA a largo plazo fue de 2.3 sin significancia estadística. Entre los pacientes que recibieron GAT en la inducción encontramos 3 pérdidas de los aloinjertos (14%) por falta de adherencia al tratamiento y 2 fallecimientos (9%) en los casos de TTC múltiple (combinado cara y manos), o bien en quadritrasplante.
En 5 casos (10%) se empleó GAT como tratamiento de RA resistente al tratamiento habitual (Tabla III).(6-9) Todos los episodios fueron diagnosticados de grado III histológico, tuvieron lugar antes de los primeros 90 días post-trasplante (PTx) y se resolvieron en un periodo máximo de 3 semanas tras la administración de GAT. Si bien los 5 pacientes respondieron favorablemente y todos conservan sus aloinjertos, sólo en 1 caso (20%) no se han dado nuevos episodios de RA, mientras que los otros 4 (80%) desarrollaron nuevos episodios posteriormente. El paciente que no presentó más episodios fue un varón con trasplante unilateral de mano que tras 2 episodios leves de RA presentó un rechazo grado III el día 42 post-trasplante. Requirió tratamiento con GAT, manteniéndose sin nuevos episodios de rechazo desde entonces.(6) Los otros 4 pacientes presentaron 1 o 2 episodios de rechazo leve grado I o II de Banff entre 2 y 10 meses después. Un paciente decidió abandonar la terapia de mantenimiento a los 5 años del trasplante y sufrió un nuevo episodio de rechazo de grado III que requirió tratamiento con GAT. Tras su resolución, el paciente volvió a tomar la inmunosupresión según su pauta habitual.(7)
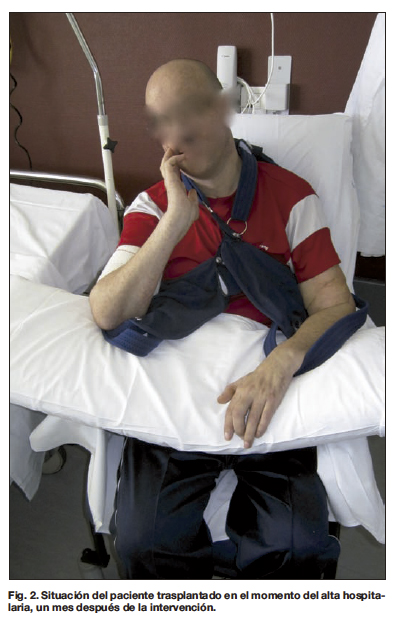
El paciente intervenido en nuestro centro fue dado de alta hospitalaria tras un mes de ingreso (Fig. 2) con tacrolimus, micofenolato mofetil y prednisona como tratamiento inmunosupresor. El color y textura de la piel fueron normales, así como el crecimiento de uñas y pelo en los aloinjertos. Desde el día 27 post-trasplante comenzó a ser evidente la presencia de máculas en ambos antebrazos y brazos, de inicio larvado (Fig. 3). Se tomaron biopsias y la evaluación histológica reveló una infiltración subepidérmica notable con linfocitos en la unión dermo-epidérmica, que se correspondía con un grado III Banff (Fig. 4). El tratamiento consistió en 2 cursos de 3 bolos consecutivos de metil-prednisolona (500 mg - 500 mg - 500 mg) en los días 28 y 38 post-trasplante, y ajuste de medicación inmunosupresora al alza. La determinación de anticuerpos anti-HLA fue negativa.
En el día 50 post-trasplante, al no presentar una evidente mejoría clínica de las máculas, se decidió añadir a la triple terapia inmunosupresora el tratamiento de eliminación linfocitaria. Se administraron 2 dosis de 125 mg de GAT (Timoglobulina®, Sanofi-Aventis, París, Francia) en los días 50 y 57 post-trasplante, observándo una respuesta clínica completa transcurridos 5 días (Fig. 5). El paciente permanece libre de rechazo inmunológico tras 450 días de seguimiento. No hubo linfopenia (Gráfico 1) ni trombocitopenia, pero la administración de GAT se acompañó de un síndrome febril que se recuperó con tratamiento sintomático. El paciente no sufrió infecciones de origen viral después la intervención, ni después de la administración de GAT.
Como complicaciones infecciosas notables, el paciente debutó con un aumento de la proteína C reactiva (PCR) en el día 7 post-trasplante y posteriormente en el día 50. Las heridas de ambos brazos se hicieron dehiscentes con salida de material necrótico-purulento. Se aisló Peptoniphilus gorbachii, Fusobacterium sp. y Prevotella sp., y se atribuyó la causa a una complicación quirúrgica por necrosis muscular. Las heridas fueron desbridadas en 4 ocasiones entre el día 7 y el momento del alta. Se necesitó un último desbridamiento tras una nueva dehiscencia en el día 50 y han permanecido estables desde entonces. El seguimiento radiológico en el húmero derecho permitió verificar la consolidación ósea transcurridos 4 meses, mientras que el lado izquierdo se encuentra pendiente de estabilización esquelética definitiva. El paciente sufrió una micosis cutánea que se resolvió con pomada antifúngica en el día 278 post-trasplante. También experimentó un episodio de diarrea de etiología no filiada en el día 425 post-trasplante con cultivos negativos, que fue tratada sintomáticamente y requirió hidratación intravenosa, mejorando sus niveles séricos de creatinina.
A nivel metabólico el paciente no sufrió hiperglucemia ni dislipemia. La tensión arterial se pudo controlar empleando únicamente amlodipino, que posteriormente ha sido cambiado por enalapril y que continúa recibiendo. Los niveles de creatinina sérica y de filtrado glomerular pueden observarse en el Gráfico 2. Transcurrido el año de seguimiento, el paciente no ha presentado complicaciones oncológicas. La medicación inmunosupresora en el día 450 post-trasplante consistía en tacrolimus 8 mg cada 24 horas (nivel sérico valle 9.70 ng/ml), micofenolato mofetil 1g cada 12 horas y prednisona 10 mg cada 24 horas (Gráfico 3).
Discusión
El uso de GAT ha sido descrito en el momento de la inducción y también para el rescate del RA resistente a corticoides, tanto en trasplante de órgano sólido como en TTCs.(1,4) La mayoría de los pacientes que sufrieron RA recibieron corticoides sistémicos con o sin tacrolimus tópico. En caso de no remitir el episodio tras la administración de 2 bolos de corticoides, la GAT fue una opción terapéutica para el rescate.(5) La utilización de GAT en el rescate del RA se ha descrito en sólo 5 receptores de TTCs. En todos ellos se logró controlar el episodio de RA, sin embargo la mayoría tuvieron otros episodios de RA.(6-9) No están descritos efectos secundarios importantes tras de la administración de GAT cuando se empleó como tratamiento de rescate, excepto por un síndrome febril. La administración de GAT permitió controlar los episodios de rechazo agudo resistente a corticoides, tanto en nuestro paciente, como en los encontrados durante la revisión sistemática.
Como terapia de inducción, la GAT se utilizó en monoterapia y asociada a otros inmunosupresores. A pesar de que todos los pacientes que recibieron GAT durante la inducción han sufrido episodios de RA, no se pudo realizar un estudio de superioridad debido a la heterogeneidad de la muestra. Las pérdidas de los aloinjertos en los pacientes chinos que recibieron GAT durante la inducción se pudo deber a falta de adherencia terapéutica.(1) Los fallecimientos observados pudieron obedecer a causas quirúrgicas por trasplantes masivos, al margen de la administración de la GAT.(13)
En nuestro paciente, la administración de GAT añadida a la triple terapia inmunosupresora permitió controlar en pocos días un episodio de RA severo de 1 mes de evolución. La indicación para el uso de GAT fue la resistencia del episodio de RA a 2 cursos completos (3 g) de esteroides intravenosos.(8) Tras la administración de GAT no se observaron las complicaciones típicas como la reactivación viral o la citopenia, aunque sí un síndrome gripal. El curso tras la eliminación linfocitaria en nuestro paciente resultó similar al observado en los pacientes de la revisión sistemática. Todos los pacientes conservan sus aloinjertos con datos de seguimiento en rango de 450 a 4380 días (Tabla III). El seguimiento en nuestro paciente libre de rechazo es de 13 meses, superando el tiempo más largo publicado sin episodios de rechazo (10 meses). Aunque hay descrito 1 caso sin nuevos episodios de rechazo tras la administración de la GAT, aún es pronto para saber si nuestro paciente se comportará de igual forma, ya que la mayoría de los casos (80%) presentaron un nuevo episodio de RA durante el seguimiento.
La administración de anticuerpos sin efecto eliminador durante la inducción, como por ejemplo basiliximab, es habitual en trasplante de órgano sólido y en TTCs,(1,3,4,10,11,14) pero no evitó la aparición de RA en nuestro paciente ni en otros.(5) En el caso que presentamos el paciente presentaba un antecedente de EM, por lo que se decidió realizar la inducción con basiliximab, y durante el curso postquirúrgico ha permanecido sin nuevos brotes de EM. El uso de basiliximab y metil-prednisolona en la inducción ha demostrado disminuciones modestas en las tasas de RA de trasplante renal bajo mantenimiento con triple terapia inmunosupresora. Su ventaja consiste en una tasa baja de complicaciones tanto en trasplante renal como extrarrenal.(14) Bonastre y col.. en una revisión previa, no lograron encontrar diferencias estadísticamente significativas entre receptores de TTCs de mano que recibieron basiliximab frente a otros fármacos biológicos de inducción, si bien el número de RA fue mayor en ese grupo.(10)
El episodio de RA de nuestro paciente fue diagnosticado clínicamente y se consideró resuelto tras la desaparición de las máculas. No se realizaron biopsias de seguimiento ya que la decisión de tratar se basó en las manifestaciones clínicas. Hasta donde conocemos, las biopsias por protocolo de receptores de TTCs muestran cierto grado de infiltración linfocitaria (grado I), incluso en ausencia de episodios clínicos de rechazo y con supervivencia de hasta 15 años.(17) Por otra parte, hasta el momento no se ha descrito ninguna asociación entre los niveles sanguíneos de los fármacos y la ausencia de infiltración linfocitaria dermo-epidérmica, por lo que la presencia de infiltrado linfocitario no indica la necesidad de dosis mayores de inmunosupresores.
La aparición de una infección bacteriana en el lecho quirúrgico fue una complicación severa que impidió tratar tempranamente el episodio de RA. Fueron necesarios un total de 5 desbridamientos quirúrgicos hasta completar la estabilización de las heridas en ambos brazos. El origen principal de los focos purulentos fueron los muñones tricipitales en ambos aloinjertos. Entre las causas probables de la necrosis muscular se encuentra un periodo largo de isquemia (8 horas) en comparación con los tiempos habituales de macrorreimplante de nuestro centro (6 horas, datos no publicados). Este largo tiempo puede deberse a las dificultades técnicas propias de una reconstrucción en un paciente quemado eléctrico y con muñones vasculares cicatriciales. Otra causa podría ser la desperiostización circunferencial completa del húmero trasplantado para realizar la osteosíntesis, que podría además tener relación con la ausencia de consolidación ósea en el lado izquierdo.
Los requerimientos orales de tacrolimus fueron altos para lograr los niveles sanguíneos valle terapéuticos (Gráfica 3). Hemos observado la dosificación alta de tacrolimus en algunos grupos de pacientes,(18) y en nuestro caso, requirió el doble de dosis de las habituales. En nuestro paciente se optó por la sustitución en el medio plazo por tacrolimus de liberación prolongada (Advagraf®, Astellas Pharma, Berlín) para mantener unos niveles séricos estables. El paciente ha presentado cierto grado de toxicidad renal, como muestra la Gráfica 2, con incremento de creatinina sérica y disminución del aclaramiento de creatinina. El deterioro de la función renal se observa frecuentemente en pacientes receptores de trasplante expuestos a fármacos inhibidores de la calcineurina como el tacrolimus.(19) Sin embargo la necesidad de tratamiento renal sustitutivo es menos frecuente, y por el momento no se ha descrito en TTCs. El fallo renal puede ocurrir hasta en un 36.6% de los pacientes receptores de trasplante cardiaco, necesitando un trasplante renal en el 0.5% de los casos. Es probable que con la acumulación de años de tratamiento y de pacientes de TTCs este tipo de complicación aparezca con más frecuencia.
La presentación de este caso clínico queda limitada por el corto seguimiento (450 días) y por tratarse de una descripción del curso inmunológico. El paciente continúa progresando en su mejora funcional y se encuentra pendiente de estabilización esquelética definitiva del húmero izquierdo, por lo que es necesario esperar para alcanzar una visión más definitiva del grado de funcionalidad adquirido.
Conclusiones
La eliminación linfocitaria mediante administración de globulina antitimocítica es habitual durante la fase de inducción después de un trasplante de tejidos compuestos. Su uso como tratamiento de rescate en episodios de rechazo agudo resistentes a tratamiento esteroideo es menos frecuente. Mediante una revisión sistemática identificamos 5 pacientes que recibieron tratamiento para el rechazo agudo resistente a esteroides con globulina antitimocítica. En todos ellos observamos buena respuesta clínica, aunque la mayoría sufrieron nuevos episodios posteriormente.
Presentamos además un caso de trasplante de brazos que requirió terapia de rescate del rechazo agudo mediante eliminación linfocitaria con globulina antitimocítica tras cursos habituales de tratamiento corticoideo a altas dosis. El tratamiento permitió la resolución del rechazo hasta los 450 días de seguimiento sin complicaciones relevantes.
Bibliografía
1. Petruzzo P., Lanzetta M., Dubernard J.M., Landin L., Cavadas P., Margreiter R., Schneeberger S., Breidenbach W., Kaufman C., Jablecki J., Schuind F. and Dumontier C. The International Registry on Hand and Composite Tissue Transplantation. Transplantation. 2010;90(12):1590-1594. [ Links ]
2. Cendales LC, Kanitakis J, Schneeberger S, Burns C, Ruiz P, Landin L, Remmelink M, Hewitt CW, Landgren T, Lyons B, Drachenberg CB, Solez K, Kirk AD, Kleiner DE, Racusen L. The Banff 2007 working classification of skin-containing composite tissue allograft pathology. Am J Transplant. 2008;8(7):1396-400. [ Links ]
3. Schneeberger S., Landin L., Jableki J., Butler P., Hoehnke C., Brandacher G. and Morelon E. Achievements and challenges in composite tissue allotransplantation. Transpl Int. 2011;24(8):760-769. [ Links ]
4. Fukuuchi F., Lefrancois N., Chapuis F., Gebuhrer L., Bosshard S., Dubernard J.M. and Touraine J.L. Comparative efficacy of prophylactic monoclonal (OKT3) and polyclonal antibodies (ATG) in immunologic high-risk renal transplant recipients. Transplant Proc. 1996;28(5):2808-2809. [ Links ]
5. Schneeberger S., Kreczy A., Brandacher G., Steurer W. and Margreiter R. Steroid- and ATG-resistant rejection after double forearm transplantation responds to Campath-1H. Am J Transplant. 2004;4(8):1372-1374. [ Links ]
6. Baldanti F, Lucchini G, Lilleri D, Lanzetta M. Sustained impairment of human cytomegalovirus (HCMV)-specific CD4+ and CD8+ T cell response is responsible for recurrent episodes of disseminated HCMV infection in a D+R- hand transplant recipient. Cases journal. 2008;1:155. [ Links ]
7. Breidenbach WC, Gonzales NR, Kaufman CL, Klapheke M, Tobin GR, Gorantla VS. Outcomes of the first 2 American hand transplants at 8 and 6 years posttransplant. J Hand Surg Am. 2008;33:1039-1047. [ Links ]
8. Hautz T, Engelhardt TO, Weissenbacher A., et al. World experience after more than a decade of clinical hand transplantation: update on the Innsbruck program. Hand Clin. 2011;27: 423-431. [ Links ]
9. Petruzzo P, Dubernard JM. World experience after more than a decade of clinical hand transplantation: update on the French program. Hand Clin. 2011;27: 411-416. [ Links ]
10. Bonastre J., Landin L., Diez J., Casado-Sánchez C. and Casado- Pérez C.8 Factors influencing acute rejection of human hand allografts: a systematic review. Ann Plast Surg. 2012; 68(6):624-629. [ Links ]
11. Schneeberger S., Khalifian S. and Brandacher G. Immunosuppression and monitoring of rejection in hand transplantation. Tech Hand Up Extrem Surg. 2013;17(4):208-214. [ Links ]
12. Cavadas P.C., Landin L., Thione A., Rodríguez-Pérez J.C., García-Bello M.A., Ibanez J., Vera-Sempere F., García-Cosmes P., Alfaro L., Rodrigo J.D. and Castro F. The Spanish experience with hand, forearm, and arm transplantation. Hand Clin. 2011;27(4):443-453. [ Links ]
13. Landín L., Domínguez A. and Sánchez-Sánchez M. Discussion of lessons learned from the first quadruple extremity transplantation in the world: the logic of massive allograft transplantation. Ann Plast Surg. 2014;73(3):341-342. [ Links ]
14. Hardinger K.L., Brennan D.C. and Klein C.L. Selection of induction therapy in kidney transplantation. Transpl Int. 2013;26(7):662-672. [ Links ]
15. Chen G., Gu J., Qiu J., Wang C., Fei J., Deng S., Li J., Huang G., Fu Q. and Chen L. Efficacy and safety of thymoglobulin and basiliximab in kidney transplant patients at high risk for acute rejection and delayed graft function. Exp Clin Transplant. 2013;11(4):310-314. [ Links ]
16. Morgan R.D., O'Callaghan J.M., Knight S.R. and Morris P.J. Alemtuzumab induction therapy in kidney transplantation: a systematic review and meta-analysis. Transplantation. 2012;93(12):1179-1188. [ Links ]
17. Petruzzo P., Gazarian A., Kanitakis J., Parmentier H., Guigal V., Guillot M., Vial C., Dubernard J.M., Morelon E. and Badet L. Outcomes after bilateral hand allotransplantation: a risk/benefit ratio analysis. Ann Surg. 2015;261(1):213-220. [ Links ]
18. Danovitch G. Handbook of Kidney Transplantation. Ed. LWW, Philadelphia, 2010. Capítulo 5, páginas 82-85. [ Links ]
19. Christie J.D., Edwards L.B., Aurora P., Dobbels F., Kirk R., Rahmel A.O., Stehlik J., Taylor D.O., Kucheryavaya A.Y. and Hertz M.I. The Registry of the International Society for Heart and Lung Transplantation: Twenty-sixth Official Adult Lung and Heart-Lung Transplantation Report-2009. J Heart Lung Transplant. 2009;28(10):1031-1049. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Luís Landín Jarillo
Servicio de Cirugía Plástica y Reparadora
Hospital Universitario La Paz
Paseo de la Castellana, 261 28046 Madrid, España
Correo electrónico: landinsurgery@gmail.com
Recibido (esta versión) 1/2/2016
Aceptado 15/7/2016