Introducción
Las quemaduras profundas provocan una gran morbilidad en el paciente por el daño intrínseco que conllevan y por la necesidad, en la mayoría de las ocasiones, de recurrir al uso de una zona dadora de piel para su resolución.
Desde hace unos años disponemos de un tratamiento conservador, no quirúrgico, que es el desbridamiento enzimático mediante productos como Nexobrid®(Mediwound Ltd., Israel). que en 4 horas consigue eliminar el tejido desvitalizado.(1) Tras la aplicación del producto, habitualmente aparece un lecho de herida con una capa blanquecina que a simple vista podría confundirse con una escara (Fig. 1). En los últimos años, han aparecido diferentes protocolos de valoración y manejo del lecho en el paciente quemado tratado con Nexobrid® según cada experiencia personal y la valoración clínica de cada Unidad de Quemados, consiguiendo en algunos casos la curación espontánea, mientras que en otros se acaba necesitando un injerto de piel(2) (Fig. 2).

Figura 1. Varón de 43 años con quemadura por fuego. Lecho de herida al 4º día tras aplicación de Nexobrid®.

Figura 2. Quemadura profunda al ingreso. Epitelización espontánea a los 40 días tras tratamiento con Nexobrid®.
En la actualidad, no existe ningún método de valoración objetivo, fiable y reproducible que permita predecir la futura evolución del lecho quemado tras la aplicación del desbridante enzimático.
El grosor de la dermis remanente es el factor más influyente en la buena evolución de la cicatrización postquemadura. El desarrollo de una técnica a través de la cual se pudiera medir la dermis remanente tras el desbridamiento enzimático, podría ayudar en la toma de decisiones sobre el manejo posterior de la herida y en consecuencia, ayudar a lograr mejores resultados.
La ultrasonografía cutánea ha demostrado su utilidad en el diagnóstico de ciertas enfermedades, como la esclerodermia, melanomas, dermatofibromas o en alteraciones del espesor cutáneo. (3 4-5). Dado que la quemadura es una alteración de la integridad cutánea, se podría extrapolar el uso de la ultrasonografía cutánea para ayudar a valorar la evolución de la quemadura tras desbridamiento enzimático.
Aplicamos así el conocimiento de la ecografía cutánea en un campo totalmente novedoso, el del manejo de quemaduras tras desbridamiento enzimático con Nexobrid®, con el fin de predecir el potencial de epitelización espontánea mediante la medición de la dermis remanente y valorar la evolución favorable o desfavorable de la quemadura y con ello, intentar establecer un diagnóstico y tratamiento más precisos de los pacientes quemados.
Material y método
Realizamos ecografía cutánea con sonda de 18 MHz en 15 pacientes con quemadura de segundo grado y tratados mediante desbridamiento enzimático con Nexobrid® (Mediwound Ltd. Israel).
El estudio incluyó 10 hombres y 5 mujeres, con edades comprendidas entre los 17 y los 66 años (media de 39.6 años). La etiología de las quemaduras fue variable: 4 pacientes con escaldadura, 4 pacientes por aceite hirviendo y 7 pacientes por fuego. No incluimos pacientes con quemaduras químicas.
La superficie media corporal afectada de los pacientes fue del 4.13% (1-8%). Las regiones afectadas fueron miembros superiores, tórax, espalda y miembros inferiores. No registramos ningún caso de afectación facial (Tabla I).
Tabla I. Datos demográficos de los 15 pacientes de la muestra de estudio.
| EDAD | SEXO | LOCALIZACIÓN | SUPERFICIE | AGENTE |
|---|---|---|---|---|
| 35 | Hombre | Antebrazo | 3% | Escaldadura |
| 43 | Mujer | Muslo anterior | 6% | Aceite |
| 66 | Hombre | Pierna | 5% | Fuego |
| 44 | Hombre | Brazo y antebrazo | 6% | Escaldadura |
| 29 | Mujer | Hombro escapular | 6% | Fuego |
| 40 | Hombre | Dedo | <1% | Escaldadura |
| 43 | Mujer | Muslo | 8% | Fuego |
| 42 | Mujer | Muñeca derecha | 1% | Aceite |
| 17 | Hombre | Dorso mano | >1% | Fuego |
| 32 | Hombre | Antebrazo y muñeca | 3% | Aceite |
| 35 | Hombre | Tobillo izquierdo | 2% | Fuego |
| 46 | Mujer | Muslo anterior | 7% | Escaldadura |
| 35 | Hombre | Brazo | 4% | Fuego |
| 29 | Hombre | Antebrazo | 3% | Aceite |
| 58 | Hombre | Cara posterior muslo | 6% | Fuego |
La aplicación del producto se realizó al ingreso del paciente, con una variabilidad de entre 3 a 24 horas dependiendo del momento en que el paciente llegó a nuestro hospital. La llevamos a cabo tras cura húmeda con clorhexidina y se mantuvo durante 4 horas. Posteriormente limpiamos el producto junto con los restos del desbridamiento y aplicamos nuevamente cura húmeda hasta completar 12 horas tras el tratamiento inicial. Finalmente, transcurridas esas 12 horas, realizamos una valoración ecográfica del lecho de la quemadura para obtener imágenes ultrasonográficas precisas del remanente dérmico y objetivar así su espesor. Asimismo, medimos el espesor de la dermis en regiones anatómicamente idénticas del mismo paciente pero no quemadas, con el fin de comparar ambos valores. La medición de las zonas sanas no quemadas se puede llevar a cabo en cualquier otro momento durante el ingreso, dado que el espesor en la dermis íntegra no se modificará sustancialmente. En nuestro caso, hicimos todo en el mismo momento por disponibilidad del aparato ecográfico.
Para la visualización correcta de la piel en la zona focal óptima de la sonda del ecógrafo, es necesario interponer suficiente material de gel conductor (2 cm de grosor). La sonda debe reposar sobre el gel sin que sea necesario ejercer ninguna presión, de lo contrario, la dermis se aplasta y no es posible su visualización y medida de forma correcta.
Resultados
Tras el tratamiento enzimático, todos los pacientes de nuestro grupo de estudio presentaron menor espesor dérmico en el área tratada que en el área sana (Fig. 5).
Los pacientes presentaron los siguientes grosores medios de remanente dérmico, evaluando primero la zona quemada en comparación con la sana: brazo quemado 2.0 mm, brazo sano 2.7 mm; antebrazo quemado 2.07 mm (2.0-2.1), antebrazo sano 2.57 mm (2.5-2.7); muñeca quemada 1,.7 mm (1.3-2.1), muñeca sana 2.3 mm (2.1-2.5); muslo quemado 2.52 mm (2.1-2.9), muslo sano 3.25 mm (2.9-3.5); pierna quemada 2.25 mm (2.2-2.3), pierna sana 2.85 mm (2.8-2.9).
La disminución de la dermis la analizamos también en porcentaje, obteniendo una disminución media de 26.6% (13-93%) (Tabla II).
Tabla II. Muestra demográfica con mediciones de dermis en lado sano y en lado quemado tras tratamiento con Nexobrid®. Nótese que en todos los casos hay una disminución del remanente dérmico. Asimismo, mostramos la evolución final del paciente.
| EDAD | SEXO | LOCALIZACION | Grosor dermis sana (mm) | Grosor dermis tras Nexobrid ® (mm) | Porcentaje de disminución(%) | Evolución |
|---|---|---|---|---|---|---|
| 35 | Varón | Antebrazo | 2.5 | 2.1 | 16 | EPITELIZACIÓN |
| 43 | Mujer | Muslo anterior | 3.2 | 2.5 | 22 | EPITELIZACIÓN |
| 66 | Varón | Pierna | 2.9 | 2.2 | 24 | EPITELIZACIÓN |
| 44 | Varón | Brazo y antebrazo | 2.7 | 2.0 | 26 | EPITELIZACIÓN |
| 29 | Mujer | Hombro escapular | 3.2 | 0.2 | 93 | INJERTO |
| 40 | Varón | Dedo | 2.4 | 2.1 | 13 | EPITELIZACIÓN |
| 43 | Mujer | Muslo | 2.9 | 2.1 | 27 | ESCARA. INJERTO |
| 42 | Mujer | Muñeca derecha | 2.1 | 1.3 | 38 | EPITELIZACIÓN |
| 17 | Varón | Dorso mano | 1.9 | 1.5 | 21 | EPITELIZACIÓN |
| 32 | Varón | Antebrazo y muñeca | 2.5 | 2.1 | 16 | EPITELIZACIÓN |
| 35 | Varón | Tobillo izquierdo | 2.8 | 2.3 | 18 | EPITELIZACIÓN |
| 46 | Mujer | Muslo anterior | 3.4 | 2.6 | 23 | EPITELIZACIÓN |
| 35 | Varón | Brazo | 2.7 | 2 | 26 | EPITELIZACIÓN |
| 29 | Varón | Antebrazo | 2.6 | 2.1 | 19 | EPITELIZACIÓN |
| 58 | Varón | Cara posterior muslo | 3.5 | 2.9 | 17 | EPITELIZACIÓN |
Discusión
Los estudios de ecografía cutánea han demostrado que el espesor de la piel varía según la edad del ser humano, siendo menor en niños y mayor en adultos. Asimismo la maduración de la piel genera variaciones en la intensidad de la ecogenicidad.(6) En nuestra experiencia, la ecografía cutánea ha demostrado ser una herramienta útil para el diagnóstico y evaluación de la respuesta al desbridamiento enzimático gracias a la precisión que nos ofrece del remanente dérmico y su comparación con una región equivalente de piel sana. Debido a esto podemos predecir, con un alto índice de éxito, la futura evolución de la quemadura y valorar una actitud terapéutica, expectante o quirúrgica.(7)
El tratamiento de las quemaduras profundas con Nexobrid® ha supuesto una revolución en el tratamiento del paciente quemado ya que disminuye su morbilidad al minimizar la necesidad de emplear zonas donantes. Sin embargo, existen amplias diferencias en el tratamiento posterior, con diferentes modos de actuación basados en la experiencia individual de cada Unidad de Quemados.(8) Hasta el momento, todas las decisiones sobre el plan de actuación posterior se siguen tomando sobre una base subjetiva de conocimientos personales, basados en la experiencia personal y en la valoración clínica del lecho de la quemadura tras la aplicación del desbridante enzimático(9). La ultrasonografía cutánea permite hacer mediciones objetivas de gran importancia en el proceso de toma de decisiones terapéuticas, tanto para esperar una reepitelización de la herida o para injertar de manera precoz.
A pesar de que el aspecto clínico o visual del lecho de la herida tras el desbridamiento con Nexobrid® suele ser el mismo en la mayoría de casos, el grosor de la dermis remanente es el factor más influyente en la buena evolución de la cicatrización. La ausencia de dermis o la persistencia de la escara auguran una necesidad de injertos posteriores, por lo que realizarlos a los pocos días tras el tratamiento enzimático sería la opción más aconsejable. A pesar de que es posible la reaplicación del producto, en nuestro estudio no hemos considerado realizar esta pauta. Es posible que algunos casos en los que exista escara remanente tras el desbridamiento inicial, puedan beneficiarse de esta forma de aplicación del tratamiento desbridante.
El espesor de la piel normal suele oscilar entre 1.4 +/- 0.3 mm en el dorso de la mano, hasta los 4.8 +/- 0.6 mm en el talón, con un valor medio de 2.4+/-1.0 mm.(6)
Para la ultrasonografía, la frecuencia óptima de la sonda debe ser superior a 15 MHz. La utilización de una sonda de 20 MHz permite visualizar estructuras hasta 6-7 mm de profundidad, lo cual supone la posibilidad de medir la epidermis, la dermis y una porción del tejido celular subcutáneo.(7)
En la ecografía de piel sana, normalmente la epidermis corresponde a la interfase con el gel que se expresa como una línea altamente ecogénica. El grosor de esta línea también dependerá de fenómenos de hiperqueratosis y atrofia cutánea. La dermis puede mostrar dos niveles bien diferenciados: una zona hipoecoica superficial y otra más hiperecoica de localización más profunda, que se correlacionan con la dermis papilar y reticular respectivamente, con un grosor aproximado de entre 2 y 4 mm. La hipodermis o tejido celular subcutáneo se representa como un tejido hipoecogénico con estrías lineales ecogénicas que representan las fibras que separan los lobulillos adiposos (Fig. 3).

Figura 3. Ecografía de piel normal que muestra la epidermis (numero 1), dermis (espacio comprendido entre las dos cruces y marcado con el número 2) e hipodermis (numero 3).
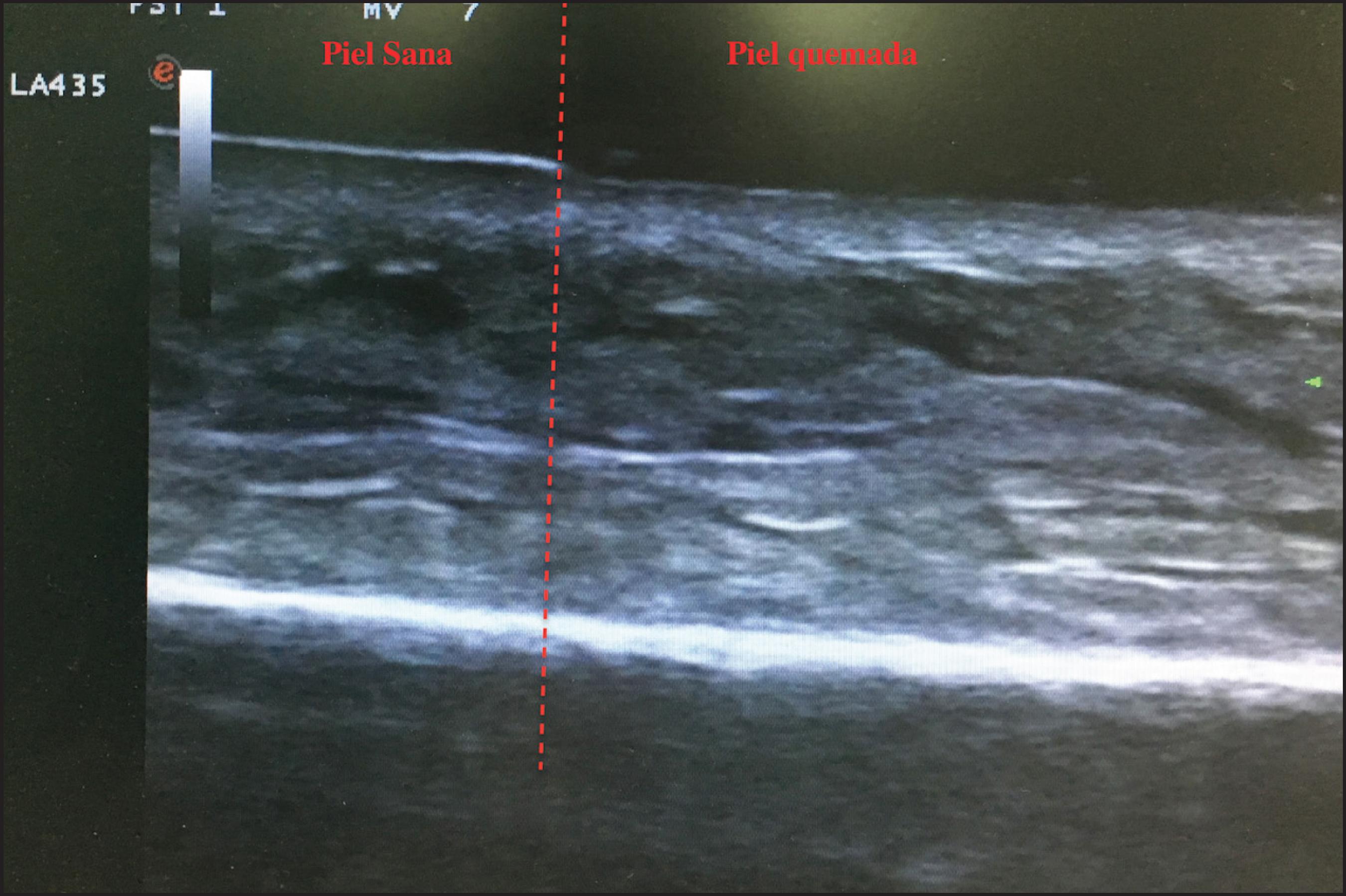
Figura 4. Zona de interfase entre piel sana y piel quemada antes de la aplicación del desbridante enzimático. Ausencia de epidermis en la piel quemada.
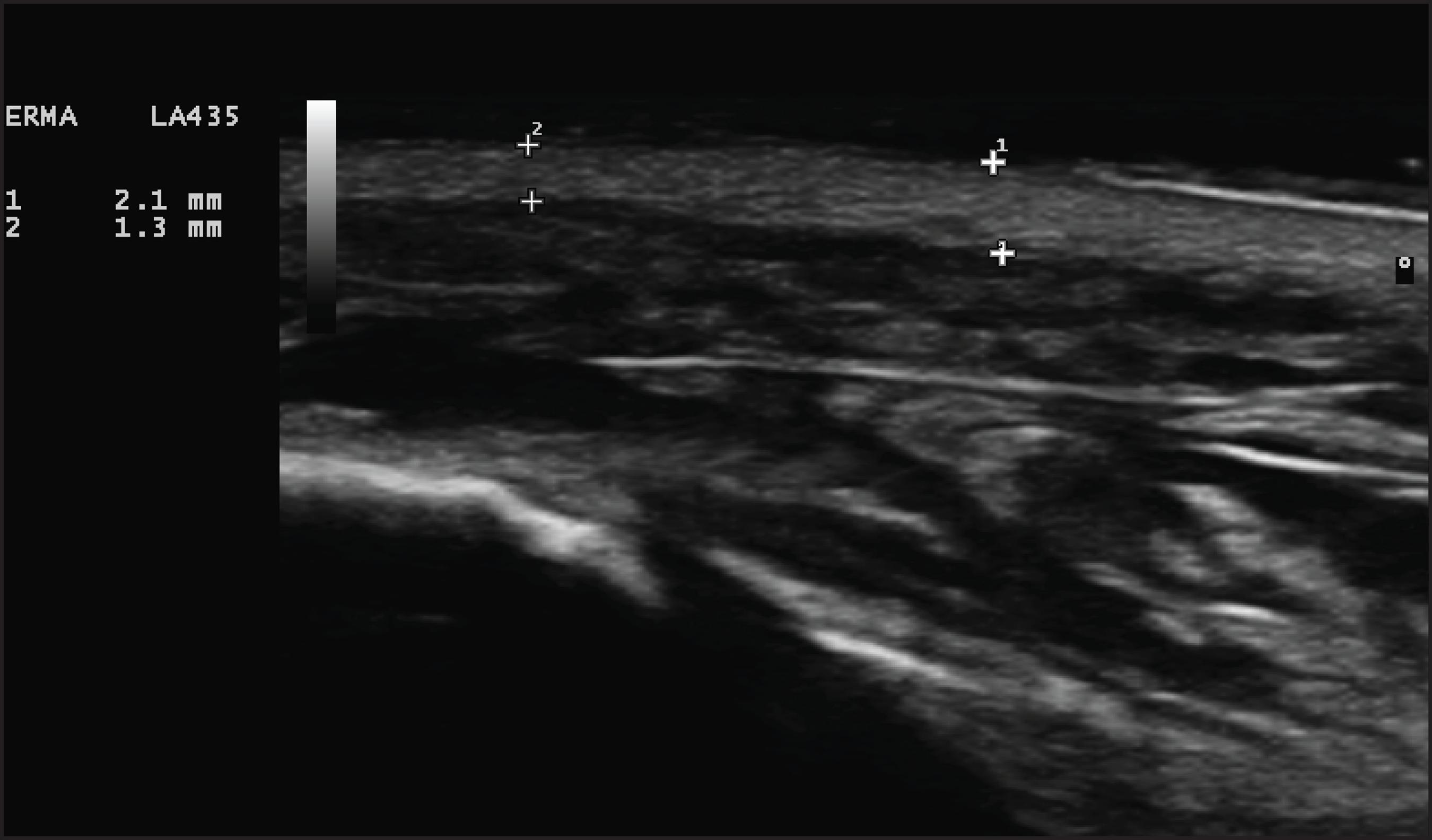
Figura 5. Zona de transición entre piel sana y piel quemada tras tratamiento con Nexobrid®. Menor espesor dérmico en la zona tratada (número 2) respecto a la zona sana (número 1).
En la piel quemada, antes de la aplicación de Nexobrid®, tan solo podremos observar la pérdida de integridad de la epidermis y cambios en la ecogenicidad de la dermis, aunque su espesor no se verá afectado (Fig. 4 y 5).
La paciente de la Fig. 6 , ingresó por quemadura profunda en espalda y brazo. Tras la aplicación de Nexobrid® observamos una clara mejoría clínica y visual en la espalda y un lecho blanquecino en el brazo, lo que nos llevó a pensar que la espalda tiene cierto potencial de epitelización espontánea, mientras que el brazo precisaría de injerto. En cambio, la ecografía demostró dermis remanente en el brazo y práctica ausencia de esta en la espalda, con potencial de epitelización por lo tanto en el brazo y ausencia del mismo en la espalda. La evolución de la herida confirmó el diagnóstico ecográfico sobre el visual. Se produjo por tanto en este caso una discordancia clínico-ecográfica gracias a la cual pudimos predecir una epitelización espontánea en la zona del brazo mientras que la región de la espalda tuvo que ser tratada con escarectomía e injerto.
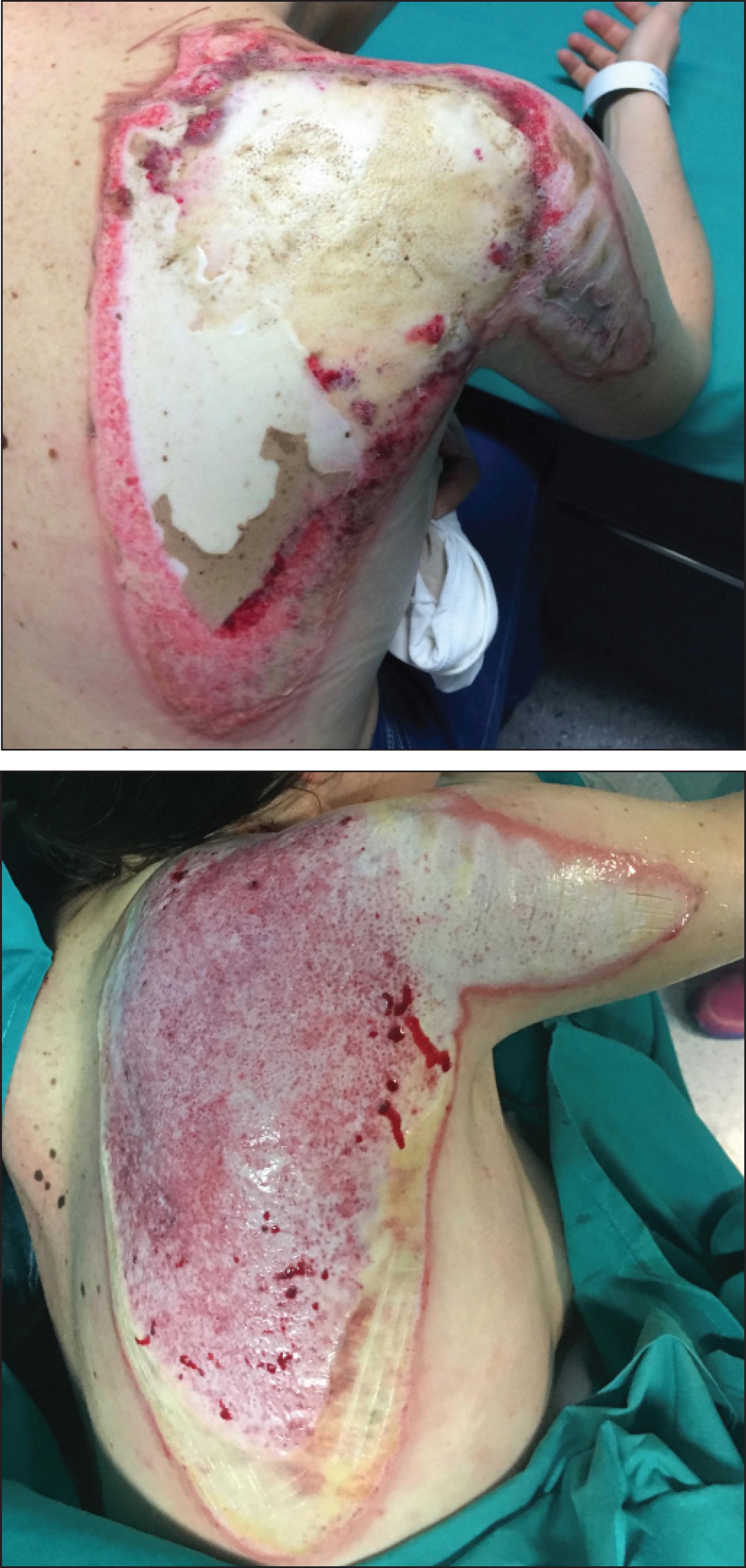
Figura 6 A. A. Quemadura profunda en espalda y cara posterior de brazo al ingreso y tras tratamiento con Nexobrid®. La espalda tiene un aspecto clínico más favorable que el brazo para la epitelización espontánea.

Figura 6 B. Ecografía cutánea que muestra la práctica ausencia de dermis en la espalda (derecha de la imagen). Las cruces marcan el grosor de la dermis del lado sano.

Figura 6 C. Evolución a los 20 días tras tratamiento con Nexobrid®. Quemadura del brazo en proceso de reepitelización y ausencia de progresión de la quemadura de la espalda, por lo que se decide cobertura con injertos de piel.

Figura 6 D. Evolución a los 27 días tras tratamiento con Nexobrid®. Quemadura del brazo totalmente curada por epitelización espontánea, e injertos de piel de la espalda prendidos.
En el caso de la Fig. 7 , la paciente presentaba el lecho de herida blanquecino habitual tras el tratamiento con Nexobrid®. La ecografía demostró una línea ecogénica densa concordante con diagnóstico de posible persistencia de escara. La evolución del lecho fue hacia escara, por lo que acabó precisando un injerto de piel.

Figura 7 A. Aspecto del lecho de herida de quemadura profunda en cara anterior del muslo a las 48 horas de tratamiento con Nexobrid®.
Por el momento, el diagnóstico de las quemaduras tras tratamiento enzimático con Nexobrid® nos ha ayudado a predecir el potencial de epitelización espontánea. Asimismo, basándonos en los resultados presentados en la Tabla II, podemos apreciar que una reducción de la dermis por encima del 40%, así como la presencia de escara tras el uso del producto se asocian a una ausencia de potencial de curación espontánea. Consideramos por tanto que un remanente dérmico mayor del 60% de la dermis sana (que implica una pérdida de menos del 40% de dermis en la quemadura) se asocia a una mejor evolución y a un pronóstico favorable para el paciente. No obstante, somos conscientes de que el volumen de nuestra muestra es limitado y de que quizá un estudio con más pacientes podría concretar el porcentaje asociado a una mejor evolución.
Asimismo, la presencia de escara remanente se asocia a una peor evolución. Como hemos comentado previamente, quizá la reaplicación del desbridante enzimático pueda favorecer la eliminación de la posible escara remanente favoreciendo la curación, dado que 1 caso de nuestra muestra, a pesar de que presentaba una pérdida de dermis del 27%, tuvo que ser tratado mediante escarectomía e injerto.(10)
No obstante, existen factores ajenos como la presencia de infección subclínica o de patología sistémica del paciente que podrían jugar un papel importante en la evolución de la quemadura y que también hemos de tener en cuenta. Desconocemos también todo lo relativo en cuanto al uso del producto en quemaduras faciales, dado que no incluimos ningún caso en nuestra muestra.(11)
También nuestra serie se ve limitada por la edad de los pacientes, dado que la media fue de 39.6 años, siendo los pacientes jóvenes más propensos a un mejor pronóstico. A pesar de que el volumen de pacientes no fue elevado para la diversidad de etiologías y zonas afectadas, consideramos que esto no supone una gran limitación al estudio dado que la comparación se hizo con el propio paciente, haciendo él mismo de caso y de control.

Figura 7 B. Ecografía cutánea: persistencia de línea ecogénica tras desbridamiento, diagnóstico compatible con persistencia de escara (marcada con numero 2).

Figura 7 C. Evolución a los 10 días que apoya el diagnóstico ecográfico, por lo que la paciente fue sometida a intervención quirúrgica con escarectomía e injerto de piel.
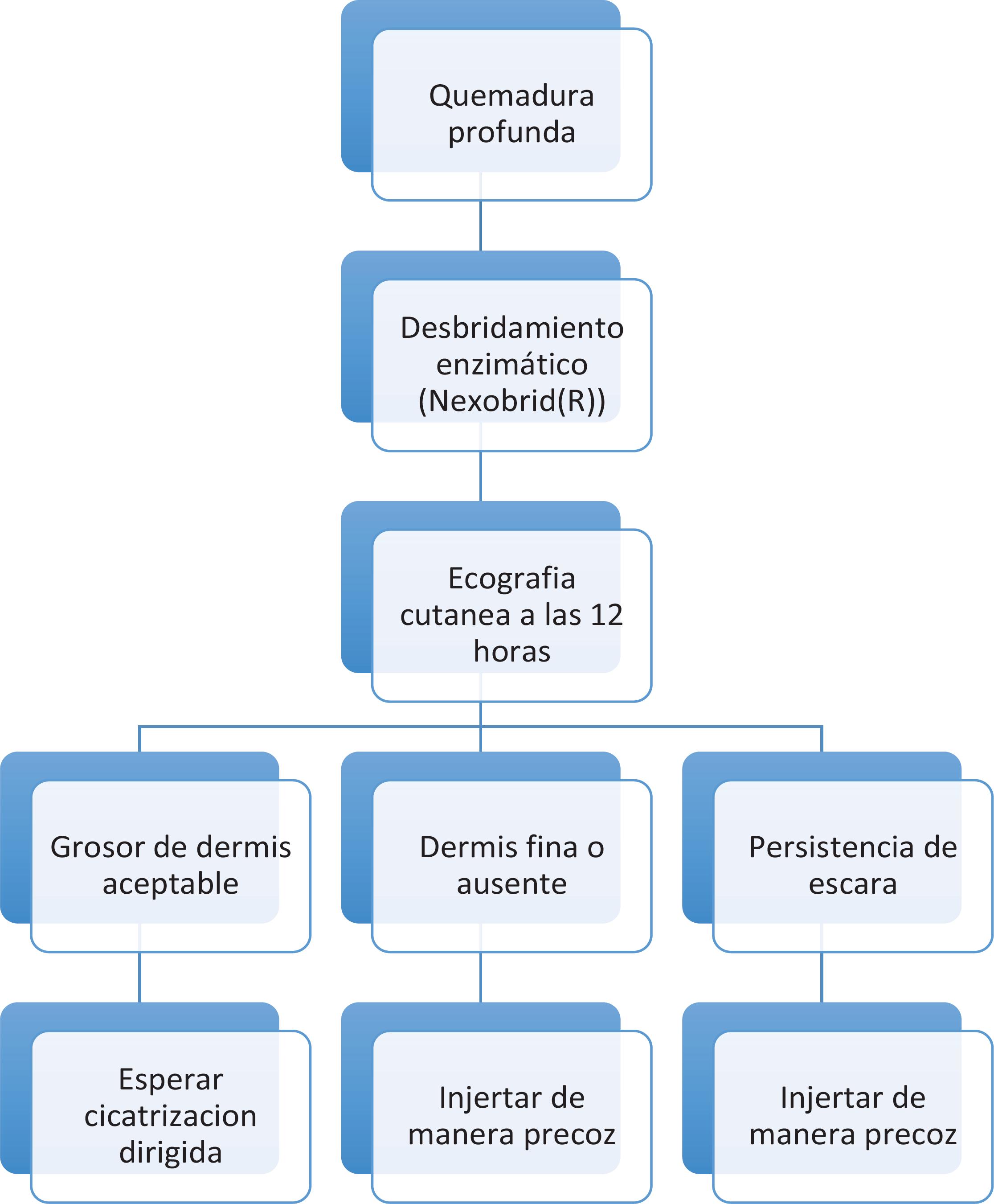
Por lo tanto, y en base a la experiencia extraída de nuestro estudio con ultrasonografía cutánea postdebridamiento enzimático de quemaduras, proponemos el siguiente protocolo de actuación.(11) (Fig. 8)
Creemos que es de gran importancia que los protocolos de actuación sean evaluados mediante ensayos clínicos para determinar el manejo óptimo después de tratamiento con Nexobrid®. Para evaluar la efectividad de dichos tratamientos es necesario disponer de métodos precisos y fiables que permitan re alizar mediciones objetivas. Asimismo, se requieren más valoraciones ecográficas de grosor de dermis remanente para establecer una medida más exacta de esta respecto a la dermis sanaante la cual la decisión terapéutica pueda cambiar. Nuestra muestra ha establecido este valor en un 40%, pero creemos que con más estudios se podría concretar mejor este valor para optimizar el tratamiento tras desbridamiento enzimático.
Conclusiones
La medición mediante ultrasonografía de la dermis remanente tras desbridamiento enzimático de quemaduras profundas podría ser de ayuda para proporcionar datos objetivos, fiables y reproducibles para el diagnóstico y manejo posterior del lecho de la herida.
El objetivo del presente estudio es establecer valores dérmicos de epitelización espontánea para mejorar el tratamiento del paciente quemado tras desbridamiento enzimático, basándolo en un criterio objetivo. En base a nuestros resultados establecemos que la existencia de dermis remanente menor del 60%, así como la presencia de escara, se asocian a la ausencia de potencial de epitelización espontánea.