Introducción
La gran actividad metabólica del tejido adiposo incluye secreción de productos como el factor de necrosis tumoral-a (TNF-a), interleucina-6 (IL-6), factor de crecimiento transformante-ß (TGF-ß), adiponectina, resistina, la leptina, el angiotensinógeno, el factor de crecimiento endotelial vascular (VEGF), el inhibidor del activador del plasminógeno 1 (PAI-1), entre otros. Estos factores tienen una amplia variedad de funciones, desempeñando un papel importante en el cuerpo humano al influir en los procesos fisiológicos y patológicos, en el que los diferentes tipos de células de tejido adiposo (adipocitos maduros, macrófagos, fibroblastos, preadipocitos y otros) participan activamente en su función endocrina.1,2 La tolerancia a la insulina, los niveles de glucosa, el mantenimiento de la integridad endotelial vascular, la perfusión miocárdica, el control de la presión arterial, la proliferación celular y la regeneración de tejidos son algunos ejemplos de estas funciones.
Además, la grasa presente em los órganos, en la médula ósea, alrededor de los vasos sanguíneos3 y en los folículos pilosos, también tiene un papel metabólico importante, local y sistémico, tal y como nosotros mismos presentamos en la Conferencia de la International Federation for Adipose Therapeutics and Science (IFATS) de 2016.
Hasta el restablecimiento de la conectividad microvascular, las células injertadas expresarán factores angiogénicos y tróficos que serán reconocidos y recibidos por las células del área del receptor ubicadas alrededor del tejido injertado, desencadenando una respuesta regenerativa. Los injertos adiposos se convierten en verdaderos “secretomos”, que expresan varios factores que determinarán su relación con el tejido receptor. La actividad molecular y los receptores del tejido localizado en el entorno donde se trasplantó la grasa son determinantes en los patrones de producción y expresión de estos factores.
Por esta razón, los injertos de tejido adiposo no pueden considerarse solo como una transferencia física de material biológico de un lugar a otro que simplemente sirven para la corrección volumétrica. Estas propiedades nos permiten utilizar la gasa para modular la regeneración de quemaduras y mejorar la apariencia de las secuelas cicatriciales.
Características anatómicas del tejido adiposo
La estructura del tejido adiposo es compleja y aunque macroscópicamente parece consistir principalmente en grasa, el número de adipocitos adultos es inferior al 20% de la celularidad total. El otro 80% está compuesto por la denominada fracción vascular estromal, que contiene preadipocitos, células endoteliales, células madre derivadas de tejido adiposo (ADSC), fibroblastos, pericitos y células hematopoyéticas. Los adipocitos adultos presentes en el tejido adiposo se presentan en varios tamaños y formas y tienen diferentes perfiles de expresión de adipocinas.4
La microanatomía del tejido adiposo se caracteriza por una rica red de capilares y nervios que relacionan todos los adipocitos.5, 6, 7 Contrariamente a la creencia previa de que la grasa está poco vascularizada, cada adipocito blanco maduro está en contacto con al menos un capilar sanguíneo cuya función es proporcionar apoyo para hacer que esta célula sea metabólicamente activa.8
Participación del tejido adiposo en la regeneración cutánea
Embriológicamente, el tejido adiposo se origina del estrato intermedio (mesodermo), y se localiza en varias regiones anatómicas y órganos del cuerpo humano. Algunos estudios9 demuestran que la fase proliferativa de la regeneración de la piel implica la repoblación de adipocitos dentro de la herida. Los adipocitos inmaduros se activan durante la fase proliferativa en una herida cutánea aguda y aparecen en ella adipocitos maduros junto con fibroblastos. Este estudio también demostró que los defectos en la función de los adipocitos durante la cicatrización de heridas provocan un fallo de la cicatriz.
Estos hallazgos mostraron la interacción entre el tejido adiposo subcutáneo y la piel y el intercambio de mensajes transmitidos por moléculas expresadas en ambos tejidos. El trauma cutáneo es capaz de activar los tejidos subyacentes, incluyendo la grasa y, de manera inversa, el trauma adiposo conduce a una respuesta cutánea.
El tejido adiposo como fuente de células madre
Las llamadas células madre derivadas de tejido adiposo (ADSC) representan una pequeña población de células que se encuentran en la grasa, que son de origen mesodérmico y expresan múltiples marcadores de superficie similares a los expresados por otras células madre mesenquimales, como las que se originan de la médula ósea.
De acuerdo con la Sociedad Internacional de Terapia Celular en 2005, las células madre mesenquimales (MSC) se definen por tres criterios mínimos:
Tener adhesión a plásticos.
Tener antígenos de superficie CD73 +, CD90 +, CD105 +, CD45-, CD34-, CD14 o CD11b-, CD79- o CD19-, HLA-DR.
Tener la capacidad de diferenciarse in vivo hacia adipocitos, osteoblastos y condrocitos.
Varios estudios demuestran la capacidad de ADSC para diferenciarse, in vitro, en un linaje adipogénico, osteogénico, condrogénico y miogénico. También se ha informado sobre la diferenciación en precursores neurales, hepatocitos, células endoteliales, células pancreáticas y similares en medios de cultivo específicos. Sin embargo, el hallazgo más emocionante es su capacidad para diferenciarse en linajes no mesodérmicos, haciendo que su potencial sea infinito, en una visión futura.
La comunicación intercelular
El intercambio de información funcional y genética entre las diversas células del organismo humano es posible a través de la comunicación directa entre dos o más células cercanas, por huecos y uniones celulares, por microtúbulos o a distancia, por la expresión de moléculas libres o encapsuladas en microvesículas que viajan a través de la ruta vascular y alcanzan todos los tejidos del cuerpo. Por esta razón, todos los estímulos o lesiones infligidos en un tejido son percibidos por los otros tejidos del cuerpo. Como ejemplo, uno puede mencionar lo que sucede en nuestro cuerpo después de una lesión menor, como una espina en el dedo del pie, cuando observamos en unas pocas horas una reacción inflamatoria alrededor de la lesión con la llegada de células de defensa hematopoyéticas. ¿Cómo ubican estas células la localización exacta de la herida? Mediante la intercomunicación celular y las sustancias liberadas en el sitio de la lesión, que atraen estas células centinelas al sitio.
Además, las microvesículas llamadas exosomas, que están entre 10 y 100 nm, transportan material genético (fragmentos de ARNm, miARN y ADN) y pueden transferirlo a un receptor celular cerca o lejos, lo que interfiere con su producción molecular y promueve cambios en su comportamiento.10Estudios recientes han demostrado que los adipocitos son células capaces de producir grandes cantidades de exosomas,11,12 demostrando la enorme capacidad del tejido adiposo para transmitir información genética.
El concepto de activación celular
Cuando una célula sufre agresión física o estrés metabólico (acidosis o hipoxia), se produce un cambio en la expresión de las moléculas sintetizadas por ella en un proceso llamado activación celular, que se traducirá en una respuesta local y sistémica. El trauma físico o metabólico puede ser tan grave que puede conducir a la destrucción celular y esta “muerte celular” puede ocurrir de dos maneras, por necrosis o por apoptosis.
La necrosis celular ocurre cuando el trauma causa la rotura de la membrana celular, lo que lleva a la extravasación del citoplasma, los orgánulos y las proteínas intracelulares, dando lugar a una gran reacción inflamatoria.
La apoptosis, a su vez, ocurre cuando la célula ha sido herida de muerte o ha completado su misión pero ha mantenido la integridad de su membrana celular el tiempo suficiente para producir cambios en su metabolismo, lo que permite una “muerte programada” al encapsular sus residuos y causar poca reacción inflamatoria local. Un ejemplo de terminación de la función es el comportamiento observado en los miofibroblastos, que después de realizar la contracción de la herida, entran en apoptosis y desaparecen de la lesión.13 La acidosis (pH alrededor de 5) es uno de los factores más importantes que induce cambios en el comportamiento celular debido a variaciones importantes en la membrana celular, aumentando su permeabilidad y aumentando la entrada y salida de sustancias hacia y desde las células. La hipoxia celular es otro factor importante que promueve la expresión de moléculas vasoactivas,14 como el VEGF (Factor de crecimiento endotelial vascular) y otros, que inducen la neovascularización y llevan el suministro de sangre al sitio (Fig. 1 y 2). La variación de temperatura también es un factor que afecta al comportamiento metabólico celular.15

Figura 1. Mecanismos de la neovascularización de una herida, desencadenada por injerto de grasa: recanalización de vasos trombosados (angiogénesis) y aparición de nuevos vasos (vasculogénesis)

Figura 2. Úlcera trocantérea sometida a injerto de grasa, antes y a los 5 días del tratamiento. Observamos el rápido crecimiento del tejido de neovascularización y la mejora del riego sanguíneo en los bordes de la herida
Por lo tanto, cada vez que realizamos una extracción de tejido adiposo de su lecho natural, ya sea quirúrgicamente o por aspiración, estamos sometiendo estas células a hipoxia y cambios en el pH y en la temperatura, lo que se traducirá en modificaciones en el comportamiento de estas células, alterando su patrón de expresión molecular.
El efecto antinflamatorio
La transferencia de grasa a un entorno inflamado desencadena un impresionante efecto antiinflamatorio con repercusiones locales, distantes, inmediatas y tardías. Los factores expresados por el injerto de grasa modulan la neoformación vascular, produciendo nuevos vasos, cuando el tejido necesita más irrigación para apoyar la defensa y la actividad mitótica celular, o inhibiendo la red vascular hipertrofiada que perpetúa el estado inflamatorio (Fig. 3).
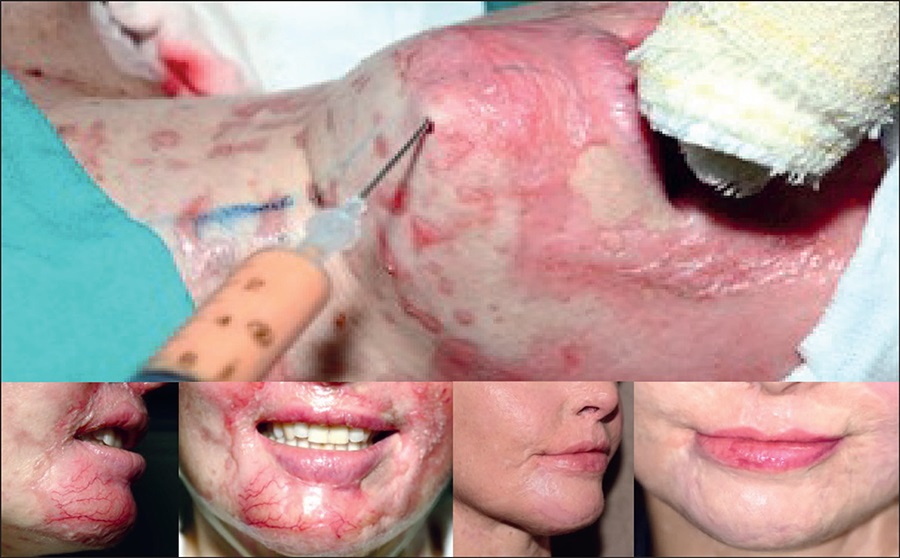
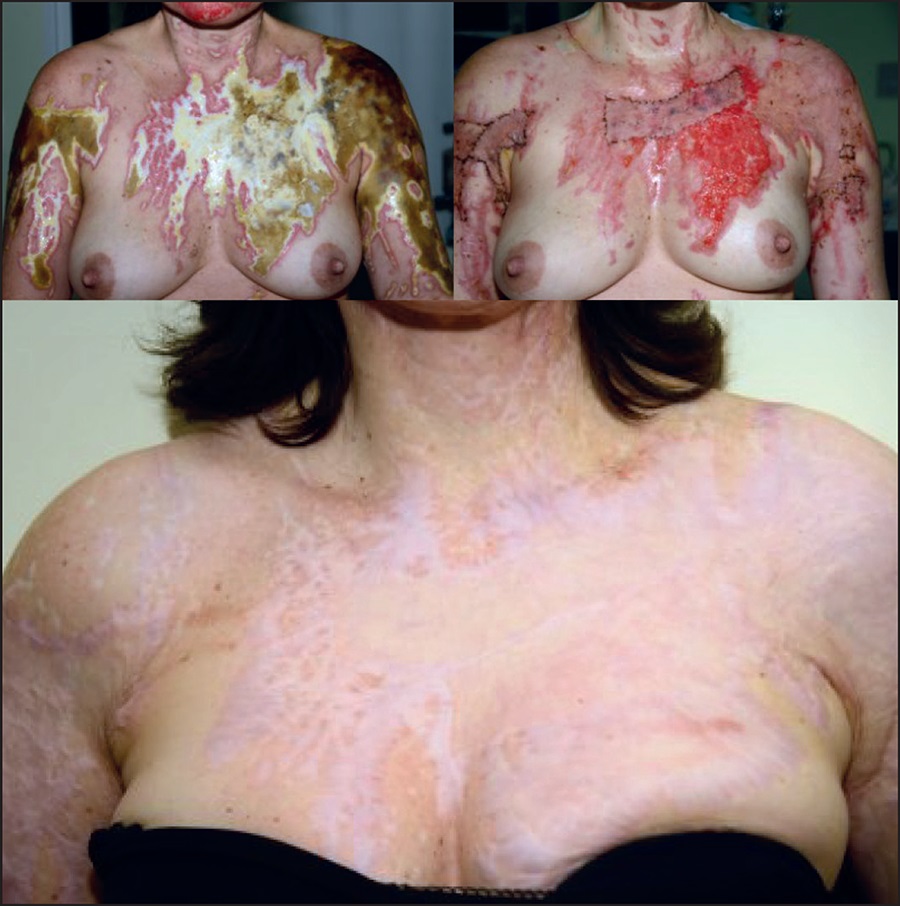
Figura 3. Cicatriz con hipertrofia vascular severa debido a actividad inflamatoria, sometida a 3 injertos de grasa y 2 injertos de piel. Imágenes a los 6 meses y a 1 año del tratamiento. Hemos de tener en cuenta la mejora progresiva a largo plazo
En la Figura 4 mostramos un ejemplo que demuestra la afinidad de los factores producidos por el injerto de grasa hacia los tejidos inflamados en un paciente en el que la aplicación de injerto de grasa en un área de quemadura eléctrica con exposición ósea, deja ver claramente la intensa neovascularización predominantemente alrededor del área de osteonecrosis.

Figura 4. Aplicación de injerto de grasa en un área de quemadura eléctrica con exposición ósea que demuestra la intensa neovascularización predominantemente alrededor del área de osteonecrosis (marcado en amarillo)
El efecto beneficioso del injerto de grasa se puede observar no solo en el sitio de aplicación del injerto, sino también a distancia. Además, el efecto a medio y largo plazo se traduce en una curación de mejor calidad, tanto desde un punto de vista funcional como estético (Fig. 5 y Fig. 6, 7).

Figura 5. Apariencia del injerto de piel en malla en el área donde recibió el injerto adiposo en comparación con las áreas circundantes que no recibieron grasa
Material y método
Este estudio se realizó en el Departamento de Medicina Regenerativa y Tratamiento de Quemaduras y Heridas Complejas de la Clínica São Vicente de Río de Janeiro, Brasil, en pacientes de diferentes grupos de edad, víctimas de varios tipos de quemaduras, desde agudas, subagudas hasta las secuelas resultantes de las mismas.
Desde el punto de vista metabólico y para aprovechar las citocinas expresadas por el tejido adiposo, el método más efectivo es utilizar un injerto con la menor presencia posible de células hematopoyéticas. Esto se puede lograr en la primera liposucción, cuando la grasa aún está clara, con poca sangre. Dado que el volumen de la liposucción para el efecto metabólico es menor, no es difícil obtener injertos limpios y claros (Fig. 8). Las células de tejido adiposo injertadas en el nuevo sitio (área receptora) pasarán por un período inicial de privación seguido de un suministro de oxígeno y nutrientes muy reducido, lo que disminuirá drásticamente su actividad metabólica priorizando la supervivencia celular. Por lo tanto, el tiempo del tejido adiposo fuera de su lecho natural debería ser el más corto posible.

Figura 8. Aspecto ideal de la grasa para uso regenerativo sin centrifugación, filtración o decantación
Es imprescindible programar la cantidad requerida de grasa a aspirar, el área donante y la anestesia a utilizar. El área donante más utilizada es la parte inferior del abdomen, pero hemos estado utilizando otras áreas como los flancos, la cara medial de los muslos, la región trocantérea y la cara medial de las rodillas.
Hay algunos informes de disminución de la actividad mitótica y la expresión de microARN de adipocitos en medios de cultivo con lidocaína,16 razón por la que en nuestra práctica preferimos usar bupivacaína (Marcaine®) como anestésico local, o ningún anestésico cuando el paciente está bajo anestesia general. El uso de adrenalina con solución salina al 0.9% en una proporción de 1:200.000 resulta efectivo para disminuir la presencia de sangre en la liposucción.
Aspiramos el tejido adiposo con una cánula fina, de 3 mm, unida a una jeringa de 3 a 60 cc dependiendo de la cantidad requerida, cambiando la posición de la cánula tan pronto como aparezcan rastros de sangre en la liposucción.
Resultados
Uso de grasa en quemaduras agudas
La aplicación del injerto adiposo en quemaduras agudas tiene como objetivo obtener revascularización (Fig. 9) o acelerar la epitelización, según la profundidad de la lesión. La técnica consiste en extender la grasa en una gasa sintética sobre la quemadura y luego invertir la gasa poniendo la grasa en contacto con la lesión (Fig. 10). El vendaje se deja cerrado durante 3 a 5 días. Cuando se abre el apósito, se puede observar si se ha logrado o no el resultado esperado (Fig. 11.), como revascularización o signos de epitelización, por lo que podemos repetir el método si es necesario.
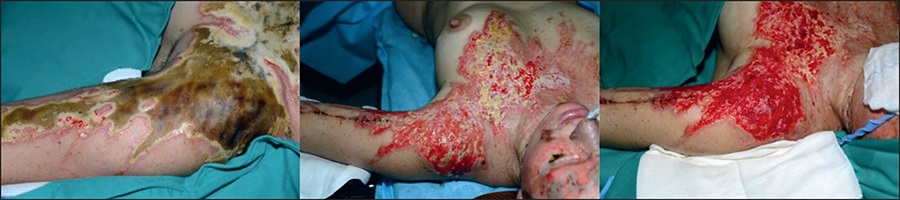
Figura 9. Revascularización en quemaduras químicas profundas 6 días después de 2 aplicaciones de grasa

Figura 10. Tipo de gasa sintética utilizada. Aplicación de la grasa sobre gasa sintéticade forma similar a como aplicaríamos mermelada en una tostada; eversión de la gasa colocando la grasa en contacto con la herida

Figura 11. Mismo paciente: aspecto a los 5 días del tratamiento y a los 3 años. Obsérvese la buena calidad de la curación, incluso después de cubrir con un injerto en malla en la cara medial del muslo
Una de las características más importantes observadas en los injertos de grasa en quemaduras agudas es la excelente apariencia de los injertos de piel a medio y largo plazo, incluso en áreas más propensas a la hipertrofia cicatricial (Fig. 12).
Injertos adiposos en cicatrices hipertróficas
El injerto de tejido adiposo bajo una fibrosis o cicatriz antiestética ha demostrado ser una herramienta útil en el tratamiento de estas deformidades. La técnica para aplicar el injerto adiposo es la misma que se usa para las quemaduras agudas, pero en este caso debe aplicarse debajo de la cicatriz, que puede ser reciente o no. En las hipertrofias recientes (Fig. 13), hasta 4 meses de su inicio, los resultados son mejores y se producen más rápidamente, pudiendo resolver la hipertrofia en una sola aplicación (Fig. 14 y 15). Para las hipertrofias más antiguas, a partir de 5 meses, puede ser necesario volver a aplicar cada 30 a 60 días, dependiendo de los resultados. Los resultados esperados son la mejora de los síntomas de incomodidad de las cicatrices referidos por los pacientes, que ocurre desde los primeros días, y la mejora de la apariencia de estas cicatrices, que ocurrirá de 2 a 3 meses después de la aplicación (Fig. 16).

Figura 13. Evolución de una quemadura en cara los días 1, 5, 10, 15, 30 y 45, con retracción del párpado inferior y de la comisura de los labios en el lado izquierdo

Figura 14. Disminución del cuadro inflamatorio con un injerto de grasa y 3 infiltraciones de triancinolona (9 meses de evolución)
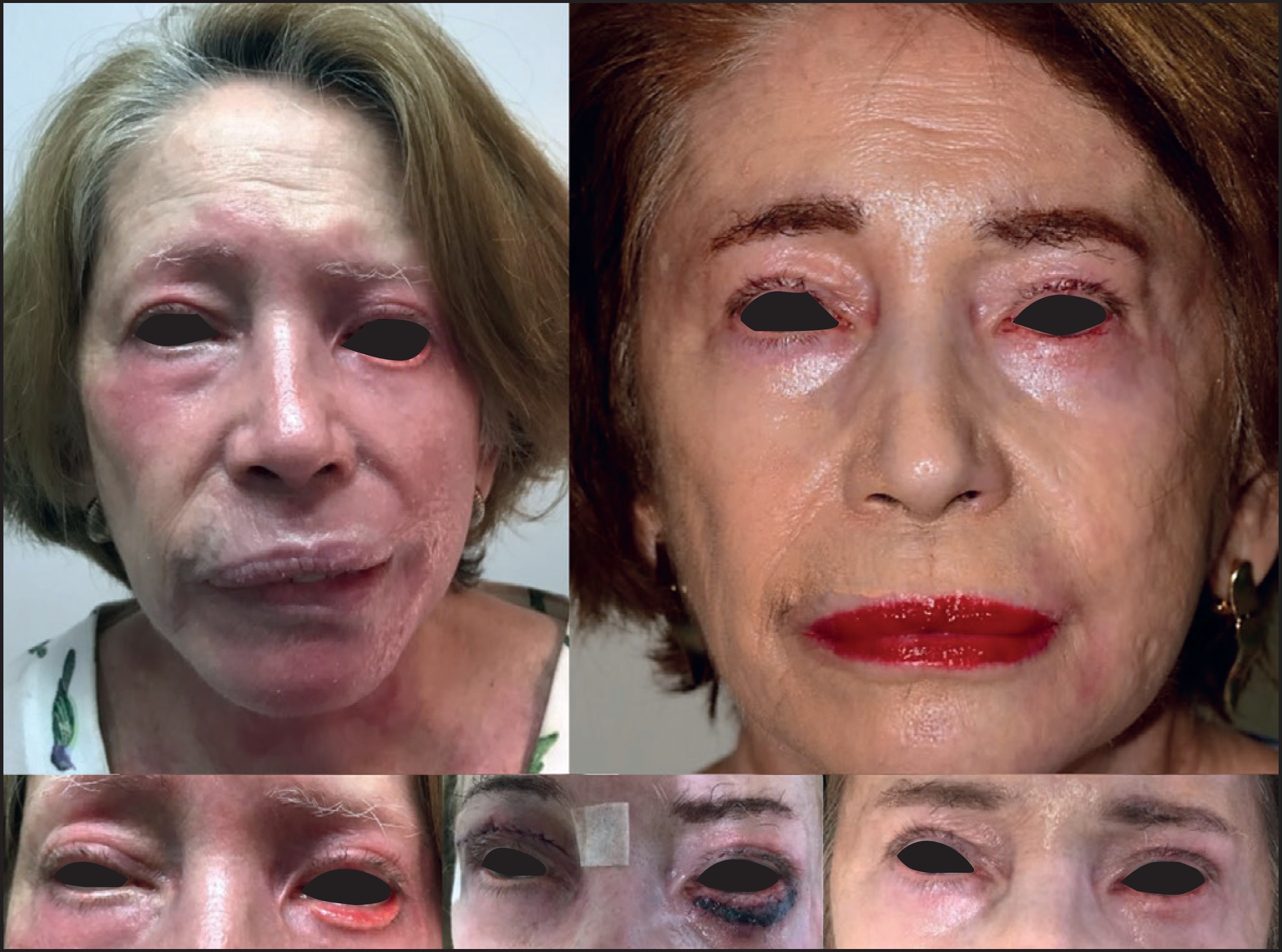
Figura 15. Corrección de la desviación del labio con un solo injerto de grasa. Corrección del ectropión del párpado y reposicionamiento del punto lagrimal inferior con injerto de piel extraído del párpado superior contralateral. Nótese la casi ausencia de cicatrices en el injerto
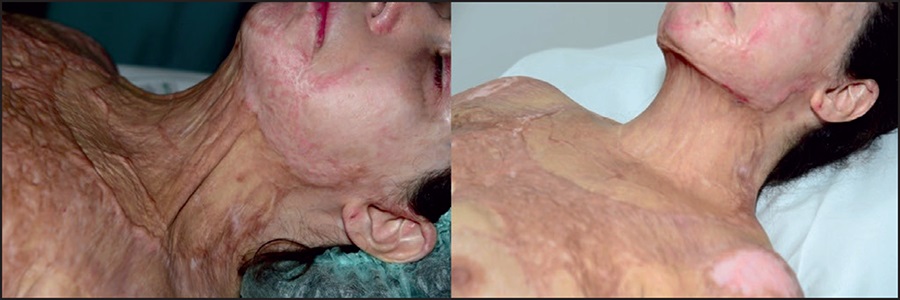
Figura 16. Retracción cervical antes y después de 3 injertos adiposos (imagen a los 8 meses de tratamiento). El paciente usó un collar compresivo y una placa de silicona durante este período
En casos de fibrosis cicatricial severa, cuando es necesario reemplazar la cubierta de la piel, el uso de injerto de grasa causa una disminución de la fibrosis y una mejora en la elasticidad del injerto de piel a medio y largo plazo, haciendo posible la recuperación funcional y estética del área comprometida (Fig. 17 y 18).

Figura 17. Secuelas severas de quemaduras en la mano izquierda que presentan fibrosis extensa. Se realizó injerto de grasa y varios injertos de piel. Aspecto final al año del tratamiento
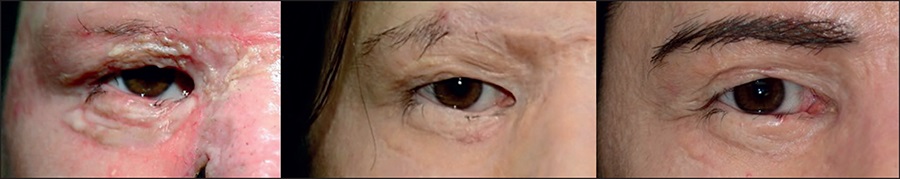
Figura 18. Recuperación funcional y estética de toda la región periorbitaria y de la hendidura palpebral mediante diversas cirugías e injertos de piel ayudados por injerto de grasa. Imagen 2 años después del tratamiento. Nótese la importante disminución en la reacción inflamatoria y en la fibrosis cicatricial. Se realizó implante capilar de cejas
En el caso de cicatrices por quemaduras en cuero cabelludo podemos usar injertos de grasa para separar la cicatriz del periostio, mejorar la elasticidad y movilidad de la cicatriz y crear espacio para los injertos foliculares (Fig. 19 y 20) o facilitar la rotación de un colgajo.
Discusión
Se han empleado diferentes formas de preparar el aspirado después de obtener el tejido adiposo por liposucción a fin de usarlo como un injerto, tales como la centrifugación, la decantación, la filtración y la emulsificación.
Los métodos utilizados para aislar los adipocitos o las llamadas células madre, como la decantación, el lavado por aspiración o la centrifugación, son efectivos cuando solo se desea el efecto volumétrico del tejido injertado, ya que desperdician las citocinas y otros factores producidos por estas células en su fase más activa, que es el momento exacto en que fueron retirados de su lecho natural. En el momento de la liposucción, las células del tejido adiposo aumentan la expresión de exosomas, factores angiogénicos, antiinflamatorios y tróficos. Por lo tanto, la porción líquida de la liposucción es rica en estas moléculas y no debe desperdiciarse.
Los adipocitos adultos y algunas células de la porción del estroma vascular, a diferencia de las células madre del tejido adiposo (ADSC), son más sensibles y no resisten a las manipulaciones traumáticas, como la centrifugación, que debe evitarse cuando queremos obtener el efecto metabólico del tejido en su plenitud.
Tras el descubrimiento de células madre en el tejido adiposo ha surgido mucha especulación sobre sus propiedades y la idea errónea de que estas células se convierten en otras para regenerar el tejido, ha impulsado la mayor parte de la investigación socavando los hallazgos clínicos. De hecho, la función de las ADSC es interactuar con otras células y gestionar los mecanismos metabólicos necesarios para mantener la homeostasis y la regeneración de los tejidos, como la angiogénesis y la mitosis celular, por nombrar algunas. En nuestra investigación, basada en los resultados obtenidos en la reparación de lesiones humanas, no hay necesidad de aislar las células madre de la grasa; más bien, debemos mantener la estructura molecular mientras preservamos la interconectividad para que las células perciban la nanotopografía del tejido donde fueron injertadas. La sensibilidad topográfica es un fenómeno en el que la célula percibe el entorno circundante y afecta a múltiples propiedades celulares, como la morfología, la capacidad migratoria, el perfil de expresión génica y, finalmente, la diferenciación celular y el destino.
Conclusiones
El tejido adiposo participa activamente en la regeneración de la piel produciendo moléculas con acción trófica, antifibrótica, antinflamatoria e inmunomoduladora. El uso de injertos de tejido adiposo en quemaduras agudas y en sus secuelas, demostró ser muy eficaz para resolver estas lesiones, reducir el cuadro inflamatorio, acelerar el proceso de curación y mejorar la calidad de las cicatrices. La supervivencia de las células injertadas (o transferidas) no es un factor primario cuando queremos el efecto regenerativo del tejido adiposo. Cuando queremos lograr un efecto regenerador metabólico (no un efecto de relleno o volumen), los factores secretados por estas células presentes en la porción líquida de la grasa aspirada son muy importantes. Por lo tanto, nuestro objetivo debería ser la manipulación mínima y la utilización de esta grasa en el menor tiempo posible entre la obtención y la transferencia. Lo más importante es la activación celular disparada por el sufrimiento infligido en el momento de la remoción y manipulación de la grasa.