Introducción
Envejecer es un proceso biológico, progresivo e irreversible, condicionado por determinantes genéticos e individuales, factores nutricionales y acumulación de diversas agresiones ambientales, muchos de ellos influenciados por la actividad laboral y los diferentes estilos de vida. Comprende dos procesos clínico-biológicos independientes: el envejecimiento cronológico intrínseco y el fotoenvejecimiento.(1,2) Con el transcurrir de los años y en especial a partir de los 25 años de edad, comienzan a manifestarse los primeros signos de envejecimiento en la superficie de la piel. De entrada, aparecen finas líneas y en el trascurso del tiempo llegan a percibirse arrugas, pérdida de volumen y pérdida de densidad.(1,2)
Existen 3 manifestaciones principales de envejecimiento de la piel en general, cada una de ellas afecta al aspecto de la cara de un modo diferente: las arrugas, la pérdida de volumen y la pérdida de densidad.(2,3)
La búsqueda de la belleza es universal y la cara es una de las estructuras más representativas de la anatomía humana. Los cambios anatómicos que aparecen como consecuencia del envejecimiento producto de los diferentes agentes ambientales y de la gravedad se producen por la disminución progresiva del colágeno, ocasionando flacidez y pérdida de la tonicidad y marcando de esta manera las líneas de expresión y los depósitos de grasa.(3,4)
El avance del conocimiento científico y tecnológico ha provisto de una nueva perspectiva en el rejuvenecimiento facial con la utilización de materiales autólogos, de fácil aplicación y obtención. El plasma rico en plaquetas (PRP) es una fracción de sangre separada por centrifugación en la que se concentra la mayor cantidad de plaquetas, y el fundamento en su utilización es la bioestimulación cutánea y/o el tratamiento antienvejecimieto.(3)
Los signos del envejecimiento varían según las capas de la piel. En la epidermis se produce un adelgazamiento generalizado de un 10-50% entre los 30 y los 80 años de edad. Las alteraciones epidérmicas más importantes recaen sobre el estrato basal o germinativo, afectando principalmente a las células madre y sobre la unión dermoepidérmica, que sufre un aplanamiento progresivo. Este último cambio reduce la superficie de contacto entre la epidermis y la dermis, con lo que se incrementa la fragilidad cutánea.
Los queratinocitos llegan a su límite replicativo y entran en senescencia, permaneciendo en la fase de reposo del ciclo celular. Las células senescentes son más resistentes a la apoptosis, persisten largo tiempo sin replicar o morir, pero debido al curso biológico, sus mecanismos reparadores del metabolismo oxidativo tienen una menor eficacia. Por estos motivos, durante el período de senescencia acumulan lesiones sobre las proteínas, los lípidos y el ADN a causa del estrés oxidativo, aumentando la inestabilidad genética y la presencia de mutaciones. Los melanocitos, que son las células que dan pigmento a la piel, disminuyen un 8-20% por década después de los 30 años de edad y desarrollan heterogeneidad morfológica y funcional. Con la exposición solar se forman focos de melanocitos activados que forman lentigos, junto con áreas de menor densidad celular con células inactivadas.(2-4).
Por otra parte, en la dermis también ocurren cambios como consecuencia del envejecimiento. Su principal componente es el colágeno; con la edad y la exposición solar las fibrillas normales de colágeno son sustituidas por un material amorfo, homogéneo y sin función que recuerda a la elastina. Este fenómeno se conoce con el nombre de elastosis solar, que es más abundante en las áreas fotoexpuestas, como la cara. Hay también otros cambios secundarios, como la dilatación de los vasos, la presencia de un infiltrado inflamatorio variable, disminución de la cantidad y capacidad de los fibroblastos, dando lugar a una desorganización del tejido cutáneo.(3,4)
Con la piel envejecida se produce la degradación del colágeno, lo cual se explica por la expresión de metalatrioproteinasas (MMPs) y el aumento de los niveles de especies reactivas de oxígeno (ROS); a su vez, los restos de colágeno fragmentado estimulan la síntesis de MMPs y ROS, creando un círculo vicioso que perpetúa las lesiones de la matriz extracelular.
El envejecimiento y el culto cada vez más marcado por la belleza han hecho que en los últimos años la ciencia médica haya avanzado en el refinamiento de técnicas quirúrgicas y procedimientos complementarios y auxiliares con el objeto de obtener mejores resultados en el rejuvenecimiento facial. El tratamiento pretende restablecer a la normalidad el metabolismo y las funciones cutáneas deteriorados por el paso del tiempo a través de la activación biológica de las células de la piel (bioestimulación).(5-6).
En los últimos 10 años los avances en la Medicina Regenerativa han abierto las puertas a nuevas estrategias diseñadas para conseguir, a partir de tejidos autólogos, una apariencia natural, mejorar la textura y alcanzar resultados estéticos favorables, empleando para ello métodos con grasa y PRP, entre otros.(4,5)
El PRP es una fuente fiable de obtención de células para regenerar tejidos, con una fácil disponibilidad a corto plazo; es un material inocuo, 100% biocompatible, con mínima posibilidad de rechazo. Actúa como bioestimulador y mediador biológico contra el envejecimiento celular, restaura y repara tejidos con propiedades indistinguibles al tejido original, es de fácil aplicación a través de métodos mínimamente invasivos y permite conservar la armonía y fisiología de la estructura tisular propia del paciente, lo cual nunca podrá ser superado por sustancias sintéticas ni métodos quirúrgicos invasivos.(5) Estas plaquetas ricas en factores de crecimiento están altamente concentradas y suspendidas en un pequeño volumen de plasma. El producto final se aplica localmente, ya sea en forma de gel o como solución.(6)
Estudios in vitro han demostrado que el uso seriado de preparaciones plaquetarias proporciona una reparación de heridas más eficiente que con la aplicación de dosis única y sus efectos se mantienen hasta 5 días después.(7) Sus beneficios y usos han sido publicados en múltiples estudios, pero en la mayoría la información se basa más en datos de carácter descriptivo que en un análisis profundo de lo acontecido, sobre todo en cuanto a la constatación histopatológica de evidencia clínica.(8)
En Italia, Rigoti y col. comunicaron el beneficio de agregar PRP a los injertos de grasa autóloga para lograr mejores resultados en el rejuvenecimiento facial.(9,10)
Otros estudios han evaluado la efectividad terapéutica del uso de materiales autólogos en la piel con fines cosméticos y señalan las propiedades beneficiosas del PRP.(8-11)
Entre los tantos efectos que produce el PRP están: aumento de la proliferación fibroblástica, aumento del colágeno no cicatricial (tipos III y IV), aumento del ácido hialurónico (sustancia fundamental) a partir de la estimulación del metabolismo del fibroblasto y recupera la dermis original.(12)
Además de diversas metodologías para la obtención del PRP,(13-19) existen 3 protocolos establecidos de aplicación del PRP: el protocolo Italiano propuesto por Ceccareli, en el cual se realiza una estimulación 7 días antes con vitaminas (vitamina C por ejemplo), una primera aplicación de PRP, 8 horas después una segunda aplicación y una tercera aplicación a los 30 días; el protocolo Argentino, basado en la clasificación Glogau, en el que partiendo del grado de envejecimiento leve-moderado se utiliza una primera dosis, una segunda a los 3 meses y un refuerzo a los 6 meses y para los pacientes con grado severo-avanzado, una dosis de PRP cada 30 días con un refuerzo a los 6 meses; finalmente el esquema creado por Anitua o protocolo Americano, con una primera sesión, una segunda a los 7 días y una tercera a los 14 días.(20-23)
Considerando que el PRP actúa en la reparación y regeneración de los tejidos, es un método autólogo y sencillo, ¿podría utilizarse un tratamiento seriado con PRP en el rejuvenecimiento facial y demostrar su efectividad?, ¿se podría investigar cuáles son los cambios histopatológicos ocurridos en la piel facial con la aplicación del PRP?, ¿es posible determinar la permanencia en el tiempo de los efectos del PRP en la piel de la región facial?, ¿se podría establecer un protocolo de tratamiento con PRP para el rejuvenecimiento facial?. Con tal motivo realizamos un estudio que investigó si aplicando un tratamiento seriado con PRP en los pacientes con ritidosis se producen resultados eficaces que apoyen su utilidad como tratamiento en el rejuvenecimiento facial. Pretendemos así determinar los cambios histopatológicos y clínicos que se producen con la aplicación del PRP en el tratamiento del rejuvenecimiento facial.
Material y método
Presentamos un estudio prospectivo, comparativo de tipo autocontrol, realizado en el Servicio de Cirugía Plástica y Reconstructiva del Hospital General del Este Dr. Domingo Luciani de Caracas, Venezuela, en el período comprendido entre febrero y octubre de 2017.
La muestra estuvo representada por 17 pacientes con diagnóstico de ritidosis facial que acudieron a la consulta de Cirugía Plástica por presentar arrugas faciales, flacidez facial y fotoenvejecimieto, que cumplieron con el consentimiento informado y con los criterios de inclusión exclusión.
Criterios de inclusión: pacientes con ritidosis grado I, II, III, IV y envejecimiento cutáneo según escala Glogau.
Criterios de exclusión: pacientes con riesgo quirúrgico o riesgo anestésico III, IV y V según la Asociación Americana de Anestesiólogos (ASA), diabetes mellitus, enfermedades hematológicas, coagulopatías, dislipidemias, colagenopatías, antecedentes de hábito tabáquico o tabaquismo actual o pacientes con materiales de relleno facial.
De los 17 pacientes de estudio se pudo concluir con 14 ya que 3 de los casos abandonaron la investigación.
Como variables estudiamos la aplicación seriada del PRP a través de inyecciones intradérmicas, en total 3 sesiones con intervalos de 1 mes, con la finalidad de activar la bioestimulación celular continua y así conseguir mayor efectividad y un efecto estético menos perecedero. Otra variable estudiada fue el fototipo de piel con el cual categorizamos la piel en base a la clasificación de Fitzpatrick para evaluar si la respuesta al tratamiento con PRP es mejor o peor según el fototipo de piel. Asimismo, el envejecimiento facial se incluye como principal variable de nuestro estudio, para lo cual evaluamos clínica e histopatológicamente cada caso antes y después del tratamiento seriado con PRP.
Para la evaluación clínica empleamos la escala de Glogau y clasificamos a los pacientes según el grado de envejecimiento.
Para la evaluación histopatológica realizamos un estudio microscópico del grosor de las capas de la piel en milímetros y el porcentaje de incremento o no de fibras de colágeno, así como el contaje de fibroblastos por mm2 y la relación colágeno/fibroblastos.
Recogimos los datos en una ficha de recolección en la que se reflejan datos personales, datos de laboratorio y procedimiento aplicado (Anexo 1).
Anexo 1. Ficha de recolección de datos
Fuente: Instituto Venezolano de los Seguros Sociales. Hospital General del Este Dr. Domingo Luciani, Postgrado de Cirugía Plástica y Reconstructiva
A cada paciente se le realizó el siguiente protocolo de tratamiento:
-
Primera toma de biopsia de piel (momento 0): antes de iniciar el tratamiento a cada paciente se le tomó una muestra de piel de 5 x 3 mm de la región preauricular (Fig. 1), la cual fue procesada por Anatomía Patológica con la finalidad de describir las características histológicas presentes. Estas biopsias fueron fijadas rápidamente por al menos 4 horas a temperatura ambiente con 10% formaldehido en PBS (phosphate buffer saline) y embebidas en parafina. Luego se procedió a realizar cortes longitudinales de 4 a 5 micras de espesor utilizando microtomo; los cortes obtenidos fueron colocados en portaobjetos, desparafinados en xilol e hidratados con etanol. Luego del examen histopatológico (tinción H&E) se evaluaron los siguientes parámetros: espesor de la epidermis, espesor de la dermis, espesor de la hipodermis medida en mm, contaje de fibroblastos, contaje de fibras de colágeno, relación colágeno/fibroblastos. Para la identificación de los haces o paquetes de colágeno, todas las biopsias fueron teñidas siguiendo el protocolo de la coloración con tricrómico de Masson.
-
Aplicación del PRP: una vez tomada la muestra para biopsia de piel, realizamos 3 sesiones de aplicación en la región facial (Fig. 2), aplicadas según unidades estéticas tal y como describimos en la Fig. 3. Estas sesiones se aplicaron con intervalos de 1 mes entre una y otra hasta completarse las 3 (Tabla I).

Figura 2. Preparación y aplicación del PRP. A. Tubos Vacutainer con la muestra centrifugada para preparación del PRP. B. Mujer de 52 años en la que se muestra el procedimiento de microinyecciones de PRP.

Figura 3. Esquema para la aplicación del PRP siguiendo las subunidades estéticas faciales, según el protocolo seguido en la investigación.
Tabla I. Cuadro que representa las diferentes dosis de aplicación de PRP por subunidades estéticas seguidas en el protocolo aplicado en la investigación.
UNIDADES ESTÉTICAS
FACIALESCANTIDAD DE PRP Frontal 200 Unidades Orbitaria 100 Unidades Temporal 100 Unidades Mejilla 300 Unidades Mentón 100 Unidades -
Para el procesamiento del PRP practicamos a través de venopunción la extracción de 20 cc de sangre en frascos Vacutainer citratados (citrato de Na al 3.2%); la muestra se centrifugó a 1500 revoluciones por minuto durante 10 minutos, con método de una sola centrifugación. Del plasma obtenido tomamos la porción rica en plaquetas y a este PRP se le aplicó Gluconato de Calcio en cantidad equivalente al 10% del total de PRP para la activación del mismo. Una vez preparado el PRP, lo aplicamos en la región facial a través de microinyecciones intradémicas, distribuyéndolo por unidades estéticas (Fig. 4).

Figura 4. Fracciones del PRP. Separación por centrifugación de los compo nentes de la muestra tomada para preparar el PRP; los 2 tubos Vacutainer a la izquierda muestran la fracción de plasma (en color amarillo) donde se encuentran las plaquetas y la fracción o franja inferior de sangre completa (en color rojo oscuro) donde se encuentran los hematies. Inmediatamente entre la fracción superior y la inferior se encuentra una franja representa da por los leucocitos. Los 2 tubos Vacutainer a la derecha, muestran las 3 fracciones o tercios en los que se divide el plasma; un tercio superior o fracción 1, pobre en plaquetas, un tercio medio o fracción 2 que es media no en plaquetas, y un tercio inferior o fracción 3 que viene a ser la fracción de rica en plaquetas o PRP.
Efectuadas las tres sesiones de PRP, una semana después tomamos biopsia de piel de la región preauricular izquierda (momento 1), con el objeto de comparar los hallazgos obtenidos con la biopsia tomada antes de iniciar el protocolo de tratamiento. Para la identificación de los haces o paquetes de colágeno, todas las biospsias fueron teñidas siguiendo el protocolo de la coloración tricrómico de Masson.
Ritidectomía: transcurridos 6 meses desde la primera aplicación de PRP realizamos tratamiento quirúrgico facial según grado de ritidosis presente en cada paciente, desde una ritidectomía clásica cérvico-facial, hasta técnica de Macs lift(24).
Tercera toma de biopsia de piel (momento 2): al tiempo de efectuar el tratamiento quirúrgico de la ritidosis facial realizamos una tercera toma de muestra de piel obtenida del excedente de la ritidectomía, de iguales dimensiones y características que la tomada en las biopsias previas y que fue procesada por el mismo anatomopatólogo. En esta muestra se evaluaron los mismos parámetros ya descritos, buscando establecer la permanencia o no en el tiempo de los efectos del PRP en la piel de la región facial. Para la identificación de los haces o paquetes de colágeno, todas las biopsias fueron teñidas siguiendo el protocolo de la coloración tricrómico de Masson.
Asimismo realizamos registro fotográfico de cada caso clínico de la siguiente manera: previo a la aplicación del PRP (momento 0), cumplidas las 3 sesiones de PRP (momento 1) y a los 6 meses (momento 2).
-
De igual forma practicamos evaluación clínica, efectuada por un médico a los 3 y a los 6 meses (Anexo 2) y aplicamos a los pacientes un test de apreciación personal sobre su opinión acerca del resultado del tratamiento con PRP a los los 3 meses de tratamiento (momento 1) y transcurridos los 6 meses (momento 2). En dicho test evaluamos la perspectiva individual en cuanto a los aspectos que esperaban mejorar con el tratamiento (manchas, sequedad de la piel, tono, luminosidad, arrugas y flacidez), indagamos acerca de la mejoría o no con la terapia con PRP, la mejoría alcanzada en los aspectos citados y la opinión en relación al resultado final en la escala de malo, igual, bueno o excelente (Anexo 3).
Análisis estadístico
Los datos estadísticos se presentaron en cuadros y gráficos; las variables cuantitativas, como la edad, se resumieron en promedio, desviación estándar y rango; la variable sexo se resumió en porcentajes. El grosor de las capas de la piel se evaluó en promedio y desviación estándar. El contaje de colágeno y fibroblastos se evaluó en promedio y desviación estándar y su relación en porcentajes. La diferencia de estos valores entre la aplicación de PRP antes y después del tratamiento se constató con la prueba t de Student para muestras relacionadas con un nivel de significación p < de 0.05.
Resultados
El grupo de estudio estuvo integrado por 12 mujeres (85.7%) y 2 hombres (14%). El promedio de edad fue de 57.3 años, con una desviación estándar de 5.9 (máximo de 48 años y mínimo de 67 años).
Con respecto al fototipo de piel de acuerdo a la clasificación de Fitzpatrick, observamos una mayor prevalencia (42.9%) de pacientes con fototipo tipo IV (n=6), seguido del fototipo tipo II con un 35.7% (n=5) y del fototipo de piel tipo III presente en 2 pacientes (14,3%) y solo 1 paciente se incluyó dentro del fototipo tipo V (7.1%).
En relación a la escala de envejecimiento según Glogau, de los 14 pacientes 5 (35.7%) pertenecieron al tipo II y 9 (64.2%) al tipo III.
Resultados histopatológicos
La tinción con H&E y muy especialmente el tricrómico de Masson permitieron la identificación de los haces o paquetes de colágeno en las biopsias tomadas en el momento 0, es decir antes del tratamiento, momento 1 a los 3 meses del tratamiento y momento 2 a los 6 meses (M0, M1, M2). En el momento 0 esta tinción reveló la presencia de fibroblastos y paquetes de colágeno focalmente fragmentados distribuidos en todo el espesor de la dermis, mientras que el momento 2 mostró la presencia de haces de colágeno localizados principalmente en la dermis papilar (Fig. 5-7). Asimismo, el tricrómico de Masson permitió observar infiltrado inflamatorio y proliferación de vasos sanguíneos (M1, M2).

Figura 5. Biopsia de piel facial con tinción con hematoxilina/eosina de 2 biopsias de piel de una misma paciente tomadas al momento 0, y 2 (M= 0, y M=2), mostrando fibras de colágeno focalmente fragmentadas y haces o paquetes finos de colágeno en la dermis papilar (DP) y dermis reticular (DR) (M=0), así como también haces gruesos de colágeno (M=2) de dis posición más organizada. E, epidermis. Aumento original: 100X. A mayor aumento se observan fibroblastos (flechas). Aumento original: 400X.
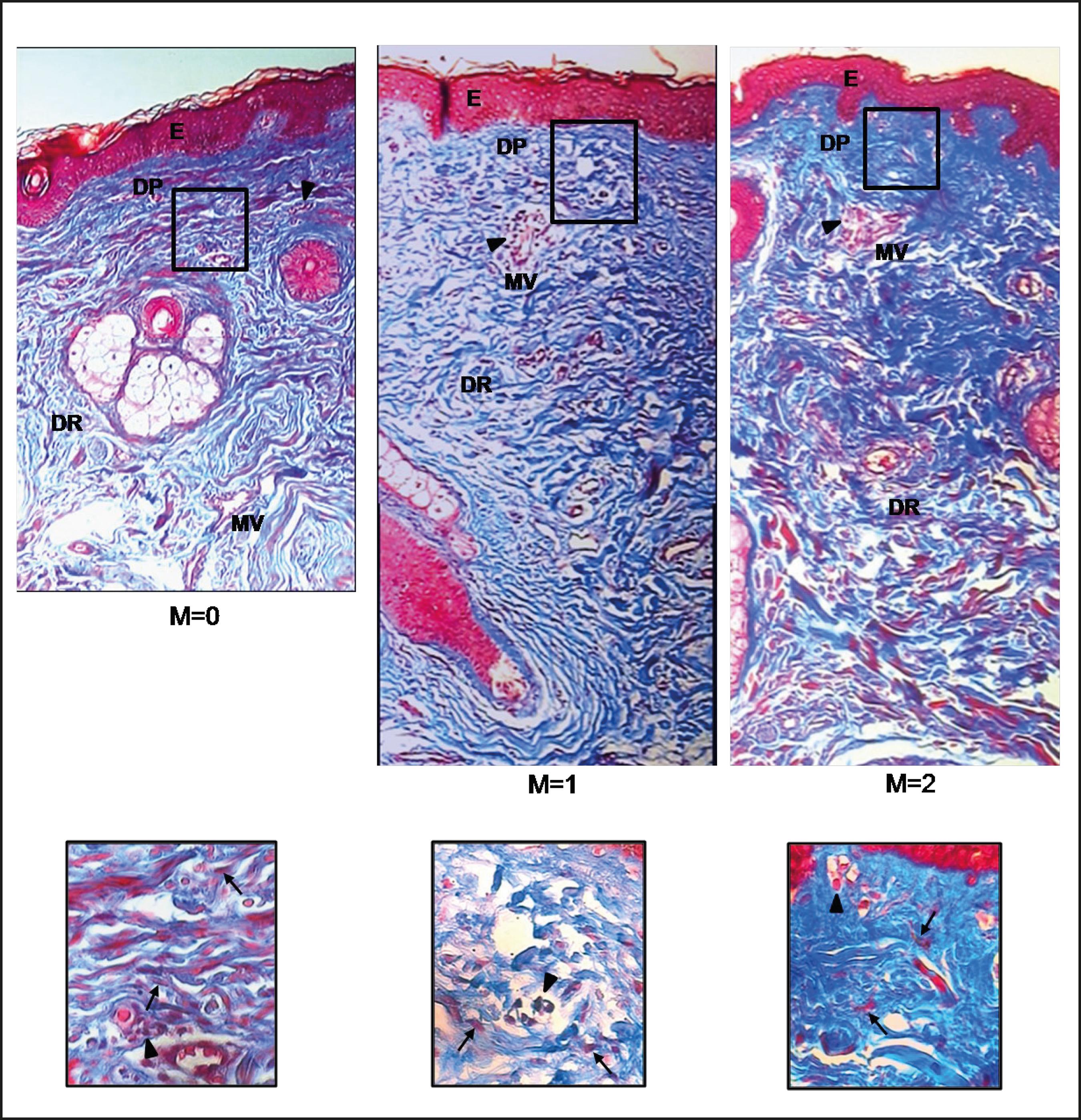
Figura 6. Biopsia de piel facial con tinción con tricrómico de Masson de 3 biopsias de piel de una misma paciente tomadas al momento 0, 1 y 2 (M= 0, M=1 y M=2), mostrando paquetes de colágeno focalmente fragmentados y haces o paquetes finos de colágeno en la dermis papilar (DP) y dermis reticular (DR) (M=0), así como también haces gruesos de colágeno (M=2). Nótese la presencia de algunos microvasos (MV) y de algunos infiltrados inflamatorios (cabeza de flechas). E, epidermis. Aumento original: 100X. A mayor aumento se observan fibroblastos (flechas) e infiltrados inflamato rios (cabeza de flecha). Aumento original: 400X.

Figura 7. Biopsia de piel facial con Tinción tricrómico de Masson de 2 biop sias de piel de una misma paciente tomadas al momento 0 y 2 (M= 0, y M=2), mostrando paquetes de colágeno focalmente fragmentados y haces o paquetes finos de colágeno en la dermis papilar (DP) y dermis reticular (DR) (M=0), así como también haces gruesos de colágeno (M=2). E, epider mis. Aumento original: 100X. A mayor aumento se observan fibroblastos (flechas). Aumento original: 400X.
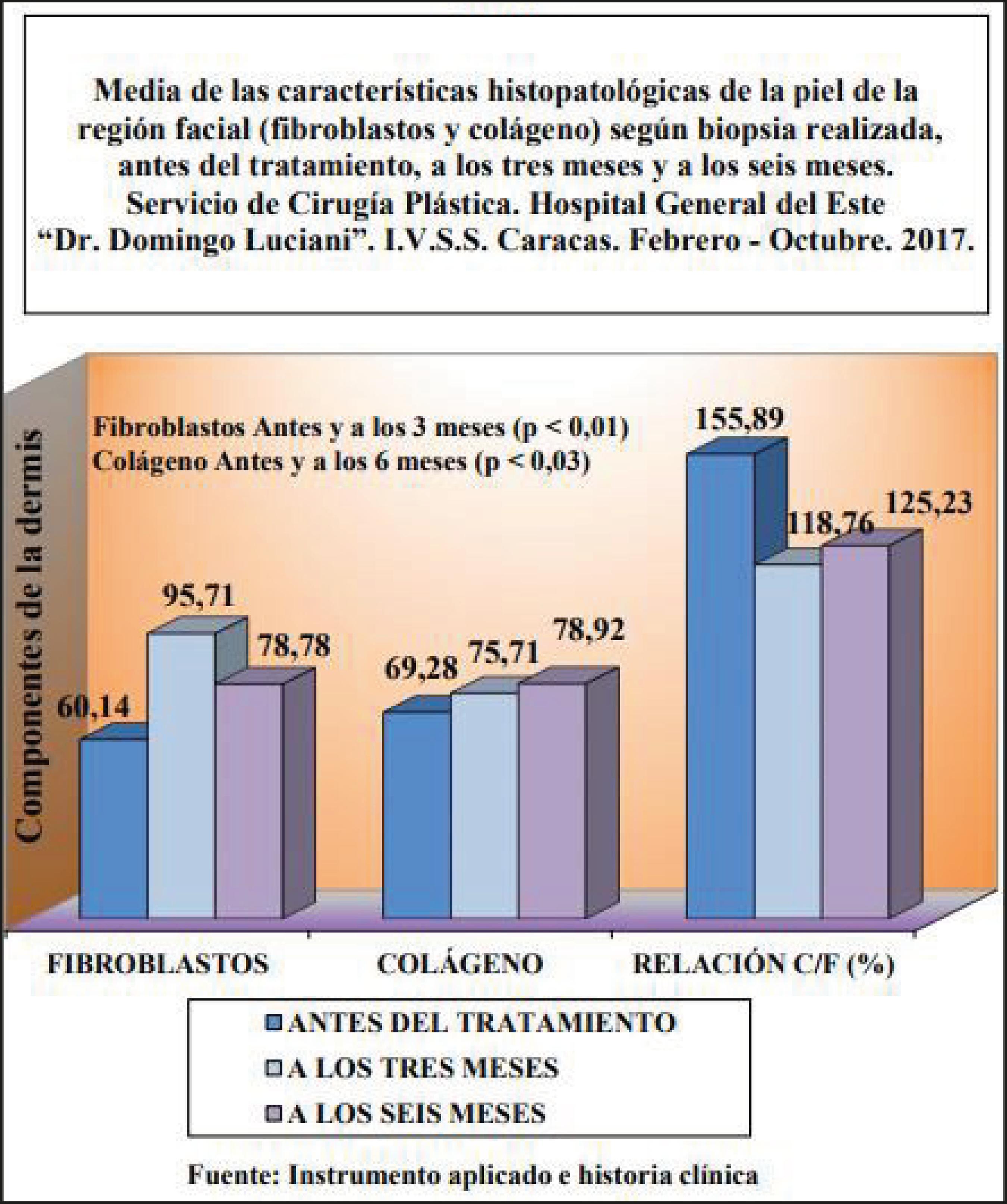
En la tabla II (Gráficos 1 y 2) se observan los resultados de la biopsias antes y a los 3 meses del tratamiento, donde hubo una diferencia significativa (p <0.01), evidenciando un incremento de los fibroblastos en el momento 1 donde la media pasó de 60,14 x mm2 a 95,71x mm2, siendo este un valor significativo. De igual manera hubo un incremento estadísticamente significativo de los valores medios de la hipodermis de 0.62 mm a 1.10 mm y de las cifras de colágeno pasando de 69.28% en promedio a 75.71% a los 3 meses del tratamiento. En la dermis no se evidenció variación significativa y en las restantes características no hubo incremento a considerar.
Tabla II. Media (x) y desviación estándar (s) de las características histopatológicas de la piel de la región facial de los pacientes en estudio según biopsias realizadas antes y a los 3 meses del tratamiento.
| Características histológicas de la piel |
Antes del tratamiento (M0)
x ± s |
A los 3 meses del tratamiento (M1)
x ± s |
Significación estadística (unilateral) |
|---|---|---|---|
| Epidermis (mm) | 0.0182 ± 0.03 | 0.01 ± 0.0 | N = 14; t =-1.00; g.l.= 13; p < 0.17 |
| Dermis (mm) | 0.928 ± 0.73 | 0.875 ± 0.55 | N = 14; t =-0.34; g.l.= 13; p < 0.37 |
| Hipodermis (mm) | 0.62 ± 0.76 | 1.10 ± 1.00 | N = 10; t =+1.28; g.l.= 9; p < 0.16 |
| Fibroblastos | 60.14 ± 28.91 | 95.71 ± 59.37 | N = 14; t =+2.64; g.l.= 13; p < 0.01 |
| Colágeno | 69.28 ± 15.42 | 75.71 ± 10.16 | N = 14; t =+1.19; g.l.= 13; p < 0.12 |
| R C/F (%) | 155.89 ± 85.56 | 118.76 ± 51.84 | N = 14; t =-1.48; g.l.= 13; p < 0.08 |
Fuente: Instrumento aplicado e historia clínica
M0= Momento 0, M1= Momento 1; R C/F = Relación colágeno/fibroblastos expresada en porcentaje
En la tabla III (Gráfico 2), comparando los resultados obtenidos a los 3 meses de tratamiento con los observados 6 meses después (M1 con M2), se mostraron diferencias significativas de incremento en los valores medios de la dermis al pasar de 0.87 mm a 1.23 mm y en las medias de la hipodermis de 1.04 mm a 1.90 mm. Del mismo modo pudimos observar un incremento, aunque sin significación estadística (p > 0.05), del colágeno de 75.71% a 79.92% y la R C/F (relación colágeno/fibroblasto) de 118.76% a 125.23% en término de sus valores medios (Gráfico 1).
Tabla III. Media (x) y desviación estándar (s) de las características histopatológicas de la piel de la región facial de los pacientes en estudio según biopsias realizadas a los 3 y 6 meses del tratamiento
| Características histológicas de la piel |
A los 3 meses del tratamiento (M1)
x ± s |
A los 6 meses del tratamiento (M2)
x ± s |
Significación estadística (unilateral) |
|---|---|---|---|
| Epidermis (mm) | 0.01 ± 0.0 | 0.01 ± 0.0 | N = 14 |
| Dermis (mm) | 0.875 ± 0.55 | 1.23 ± 0.59 | N = 14; t =+1.85; g.l.= 13; p < 0.04 |
| Hipodermis (mm) | 1.04 ± 0.97 | 1.90 ± 1.30 | N = 10; t =+2.11; g.l.= 9; p < 0.03 |
| Fibroblastos | 95.71 ± 59.37 | 78.78 ± 41.51 | N = 14; t =-0.89; g.l.= 13; p < 0.19 |
| Colágeno | 75.71 ± 10.16 | 78.92 ± 10.77 | N = 14; t =+1.00; g.l.= 13; p < 0.16 |
| R C/F (%) | 118.76 ± 51.84 | 125.23 ± 69.78 | N = 14; t =+0.31; g.l.= 13; p < 0.38 |
Fuente: Instrumento aplicado e historia clínica
M1= Momento 1, M2= momento 2; R C/F = Relación Colágeno/fibroblastos expresada en porcentaje
La tabla IV (Gráfico 1) denota el incremento en los valores medios de colágeno comparando los valores antes del tratamiento (M0) con los resultados a los 6 meses (M2), demostrando aumento significativo en los valores promedios del colágeno que pasan de 69.28% a 78.92% (p < 0.03). En la dermis, hipodermis, así como en los fibroblastos, se produjeron incrementos de los valores medios sin significación estadística p > 0.05.
Tabla IV. Media (x) y desviación estándar (s) de las características histopatológicas de la piel de la región facial de los pacientes en estudio según biopsias realizadas antes y a los 6 meses del tratamiento
| Características histológicas de la piel |
Antes del tratamiento(M0)
x ± s |
A los 6 meses del tratamiento (M1)
x ± s |
Significación estadística (unilateral) |
|---|---|---|---|
| Epidermis (mm) | 0.0182 ± 0.03 | 0.01 ± 0.0 | N = 14; t =-1.00; g.l.= 13; p < 0.17 |
| Dermis (mm) | 0.928 ± 0.73 | 1.23 ± 0.59 | N = 14; t =+1.41; g.l.= 13; p < 0.09 |
| Hipodermis (mm) | 0.56 ± 0.70 | 1.87 ± 1.24 | N = 12; t =+2.82; g.l.= 11; p < 0.08 |
| Fibroblastos | 60.14 ± 28.91 | 78.78 ± 41.51 | N = 14; t =+1.21; g.l.= 13; p < 0.12 |
| Colágeno | 69.28 ± 15.42 | 78.92 ± 10.77 | N = 14; t =+2.00; g.l.= 13; p < 0.03 |
| R C/F (%) | 155.89 ± 85.56 | 125.23 ± 69.78 | N = 14; t =-0.81; g.l.= 13; p < 0.21 |
Fuente: Instrumento aplicado e historia clínica
M0= Momento 0, M2= Momento 2; R C/F = Relación colágeno/fibroblastos expresada en porcentaje
En cuanto a la variación de los fibroblastos en el tercer mes de tratamiento, encontramos que hubo incremento de los fibroblastos en 10 pacientes (71,4%), categorizados como Fitzpatrick II, III y IV. Por su parte, en 3 pacientes hubo disminución (21.4%), categorizados como Fitzpatrick II, IV y V. Solamente en 1 paciente (7.1%) no se evidenció variación (Tabla V).
Tabla V. Distribución de los pacientes de estudio según fototipo de piel de acuerdo a la Clasificación de Fitzpatrick y resultados de biopsia en relación a la variación de fibroblastos a los 3 meses del tratamiento
| Fibroblastos | ||||
|---|---|---|---|---|
| Fototipo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 4 (80) | 1 (20) | 0 (0) | 5 (35.7) |
| III | 2 (100) | 0 (0) | 0 (0) | 2 (14.3) |
| IV | 4 (66.7) | 2 (33.3) | 1 (16.7) | 6 (42.9) |
| V | 0 (0) | 1 (100) | 0 (0) | 1 ( 7.1) |
| TOTAL | 10 (71.4) | 3 (21.4) | 1 (7.1) | 14(100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla VI, al examinar los resultados de variación en los fibroblastos 6 meses después según categorización de los pacientes de acuerdo a Fitzpatrick, encontramos que en 8 pacientes (57.1%) con fototipo II, III y IV, se incrementaron los fibroblastos, en contraposición con 5 pacientes (35.7%) con fototipo II, III y IV en los que disminuyó el número de fibroblastos.
Tabla VI. Distribución de los pacientes de estudio según fototipo de piel de acuerdo a la Clasificación de Fitzpatrick y resultados de biopsia en relación a la variación del fibroblastos a los 6 meses del tratamiento
| Fibroblastos | ||||
|---|---|---|---|---|
| Fototipo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 3 (60) | 2 (40) | 0 (0) | 5 (35.7) |
| III | 2 (100) | 0 (0) | 0 (0) | 2 (14.3) |
| IV | 3 (50) | 2 (33.3) | 1 (16.7) | 6 (42.9) |
| V | 0 ( 0) | 1 (100) | 0 (0) | 1 ( 7.1) |
| TOTAL | 8 (57,1) | 5 (35,7) | 1 ( 7,1) | 14(100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla VII mostramos la relación entre las variaciones del colágeno y el fotoenvejecimiento (Fitzpatrick) a los 3 meses de tratamiento; se observa que hubo igual número de aumento y sin cambios, es decir, 6 pacientes (42.9%) fototipo II, IV y V y 6 pacientes (42,9%) fototipo II, III y IV en cada caso. En sólo 2 casos fototipo II se manifestó la disminución del colágeno.
Tabla VII. Distribución de los pacientes de estudio según fototipo de piel de acuerdo a la Clasificación de Fitzpatrick y resultados de biopsia en relación a la variación del colágeno a los 3 meses del tratamiento
| Colágeno | ||||
|---|---|---|---|---|
| Fototipo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 2 (40) | 2 (40) | 1 (20) | 5 (35.7) |
| III | 0 (0) | 0 (0) | 2(100) | 2 (14.3) |
| IV | 3 (50) | 0 (0) | 3 (50) | 6 (42.9) |
| V | 1 (100) | 0 (0) | 0 (0) | 1 (7.1) |
| TOTAL | 6 (42.9) | 2 (14.2) | 6 (42.9) | 14(100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla VIII se observa que transcurridos los 6 meses, 7 pacientes (50%) presentaron aumento del colágeno, habiendo representación en todos los fototipos. Por su parte en 3 (21,4%) hubo disminución del colágeno, siendo estos pacientes fototipo II y III. En 4 (28.6%) permaneció igual. No evidenciamos relación entre estas variables.
Tabla VIII. Distribución de los pacientes de estudio según fototipo de piel de acuerdo a la Clasificación de Fitzpatrick y resultados de biopsia en relación a la variación del colágeno a los 6 meses del tratamiento
| Colágeno | ||||
|---|---|---|---|---|
| Fototipo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 2 (40) | 2 (40) | 1 (20) | 5 (35.7) |
| III | 1 (50) | 1 (50) | 0 (0) | 2 (14.3) |
| IV | 3 (50) | 0 (0) | 3 (50) | 6 (42.9) |
| V | 1 (100) | 0 (0) | 0 (0) | 1 (7.1) |
| TOTAL | 7 (50) | 3 (21.4) | 4 (28.6) | 14(100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla IX se relacionan las variables envejecimiento y variación en el número de fibroblastos a los 3 meses, donde se muestra que 5 pacientes (35.7%) pertenecían a la categoría II y 9 (64.3%) a la categoría III. El incremento en el número de fibroblastos a los 3 meses de tratamiento se evidenció principalmente en la categoría III con un 77.7%.
Tabla IX. Distribución de los pacientes de estudio de acuerdo a la Clasificación de Envejecimiento según Glogau y resultados de biopsia en relación a la variación del fibroblastos a los tres meses del tratamiento
| Fibroblastos | ||||
|---|---|---|---|---|
| Envejecimiento | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 3 (60) | 1 (20) | 1 (20) | 5 (35.7) |
| III | 7 (77.7) | 2 (22.2) | 0 (0) | 9 (64.3) |
| TOTAL | 10 (71.4) | 3(21.4) | 1 (7.1) | 14 (100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla X se relacionan las variables envejecimiento facial (Glogau) y variación en el número de fibroblastos a los 6 meses, evidenciando aumento de los fibroblastos en 5 pacientes (55.5%), perteneciendo dichos pacientes al grado de envejecimiento tipo III. De igual forma, hubo disminución de los fibroblastos en 5 pacientes con grado de envejecimiento tipo II y III, además de un incremento en 3 pacientes (60%) categorizados en el tipo II. No evidenciamos relación entre estas variables.
Tabla X. Distribución de los pacientes de estudio de acuerdo a la Clasificación de Envejecimiento según Glogau y resultados de biopsia en relación a la variación del fibroblastos a los 6 meses del tratamiento
| Fibroblastos | ||||
|---|---|---|---|---|
| Envejecimiento | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 3 (60) | 2 (40) | 0 (0) | 5 (35.7) |
| III | 5 (55.5) | 3 (33.3) | 1 (11.1) | 9 (64.3) |
| TOTAL | 8 (57.1) | 5 (35.7) | 1 (7.1) | 14 (100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla XI examinamos las variaciones de las fibras de colágeno a los 3 meses de tratamiento relacionadas con la escala de envejecimiento Glogau. El colágeno presentó igual número de pacientes en los que aumentó o se mantuvo igual en la categoría III de envejecimiento (44.4%), mientras que en los tipo II no hubo variación.
Tabla XI. Distribución de los pacientes de estudio de acuerdo a la Clasificación de Envejecimiento según Glogau y resultados de biopsia en relación a la variación del colágeno a los 3 meses del tratamiento
| Colágeno | ||||
|---|---|---|---|---|
| Envejecimiento | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 2 (40) | 1 (20) | 2 (20) | 5 (35.7) |
| III | 4 (44.4) | 1 (11.1) | 4 (44.4) | 9 (64.3) |
| TOTAL | 6(42.8) | 2 (14.3) | 6 (42.8) | 14 (100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla XII se pueden apreciar los cambios en el número de fibras de colágeno a los 6 meses de tratamiento relacionados con el envejecimiento según Glogau, donde predominó el aumento tanto en la categoría II (6%), como en la categoría III (44.4%). Sin embargo no fue posible establecer una correlación.
Tabla XII. Distribución de los pacientes de estudio de acuerdo a la Clasificación de Envejecimiento según Glogau y resultados de biopsia en relación a la variación del colágeno a los 6 meses del tratamiento
| Colágeno | ||||
|---|---|---|---|---|
| Envejecimiento | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| II | 3 (60) | 3 (60) | 1 (20) | 5 (35.7) |
| III | 4 (44.4) | 4 (44.4) | 3 (33.3) | 9 (64.3) |
| TOTAL | 7 (50) | 7 (50) | 4 (28,5) | 14(100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En la tabla XIII (Gráfico 3) se puede evidenciar que relacionando las variables sexo con las variaciones de los fibroblastos, en el sexo femenino se presentó un aumento de los fibroblastos en 12 mujeres (100%), en contra de lo exhibido en el sexo masculino donde sólo en 1 caso (50%) hubo incremento y en 1 (50%) hubo disminución.
Tabla XIII. Distribución de los pacientes de estudio según sexo y resultados de biopsia en relación a la variación de fibroblastos a los 3 meses del tratamiento
| Fibroblastos | ||||
|---|---|---|---|---|
| Sexo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL (%) |
| Femenino | 9 (75) | 2 (16.7) | 1 (8.3) | 12 (85.7) |
| Masculino | 1 (50) | 1 (50) | 0 (0) | 2 (14.3) |
| TOTAL | 10 (71.4) | 3 (21.4) | 1 (7.1) | 14(100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
En lo concerniente a lo observado en la tabla XIV (Gráfico 3), a los 6 meses de tratamiento se mantuvo el incremento de los fibroblastos en el sexo femenino (58.3%), no encontrando variabilidad en el sexo masculino.
Tabla XIV. Distribución de los pacientes de estudio según sexo y resultados de biopsia en relación a la variación del fibroblastos a los 6 meses del tratamiento
| Fibroblastos | ||||
|---|---|---|---|---|
| Sexo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL(%) |
| Femenino | 7 (58.3) | 4 (33.3) | 1 (8.3) | 12 (85.7) |
| Masculino | 1 (50) | 1 (50) | 0 (0) | 2 (14.3) |
| TOTAL | 8 (57.1) | 5 (35.7) | 1 (7.1) | 14 (100) |
*Porcentaje en base a subtotales horizontales
En las tablas XV y XVI (Gráfico 4) se establece la relación entre los cambios en el contaje de fibras colágeno con la edad a los 3 meses, donde se exhibe un aumento de las mismas en el sexo femenino (50%), mientras que en el sexo masculino no hubo ni aumento ni disminución. De igual forma, transcurridos los 6 meses, se mantuvo el incremento de las fibras de colágeno en el sexo femenino (50%). Por su parte, en el sexo masculino, en 1 paciente aumentó y en 1 paciente disminuyó.
Tabla XV. Distribución de los pacientes de estudio según sexo y resultados de biopsia en relación a la variación del colágeno a los 3 meses del tratamiento
| Colágeno | ||||
|---|---|---|---|---|
| Sexo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL(%) |
| Femenino | 6 (50) | 2 (16.7) | 4(33.3) | 12 (85.7) |
| Masculino | 0 (0) | 0 (0) | 2(100) | 2 (14.3) |
| TOTAL | 6 (42.9) | 2 (14.2) | 6 (42.9) | 14 (100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
Tabla XVI. Distribución de los pacientes de estudio según sexo y resultados de biopsia en relación a la variación del colágeno a los 6 meses del tratamiento
| Colágeno | ||||
|---|---|---|---|---|
| Sexo | Aumentó F (%)* |
Disminuyó F (%)* |
Igual F (%)* |
TOTAL(%) |
| Femenino | 6 (50) | 3 (25) | 3 (25) | 12 (85.7) |
| Masculino | 1 (0) | 0 (0) | 1 (50) | 2 (14.3) |
| TOTAL | 7 (42.9) | 3 (14.2) | 4(42.9) | 14 (100) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
Resultados clínicos
En la tabla XVII se muestran los resultados de la evaluación clínica de mejoría efectuada por el médico a los 3 y 6 meses, donde se atenuaron las arrugas en reposo a los 6 meses en el 64.3% (n=9) de los casos; tanto al tercer mes como a los 6 meses se evidenció una mayor luminosidad en el 100% de los pacientes y la flacidez cutánea facial presentó cambios de mejoría en un 100% de los casos a los 6 meses (Fig. 8-11).
Tabla XVII. Distribución de los pacientes en estudio según resultados de la mejoría de los aspectos clínicos evaluados a los 3 y 6 meses del tratamiento con PRP
| Aspectos clínicos Evaluados con mejoría |
Tres meses F (%)* |
Seis meses F (%)* |
|---|---|---|
| Arrugas en reposo | 0 ( 0.0) | 9 (64.3) |
| Arrugas en movimiento | 1 ( 7.1) | 0 ( 0.0) |
| Léntigos solares | 6 (42.9) | 4 (28.6) |
| Discromías y telangiectasias | 2 (14.3) | 1 (7.1) |
| Luminosidad | 14 (100.0) | 14 (100.0) |
| Flacidez | 0 ( 0.0) | 14 (100.0) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base catorce pacientes

Figura 8. Mujer de 52 años. A-D. Imágenes previas a la aplicación de la terapia con PRP (momento 0). E-H. La paciente a los 3 meses de tratamiento con microinyecciones de PRP (momento 2). I-L. Resultado a los 6 meses de iniciado el protocolo (momento 3).

Figura 9. Varón de 60 años. A-D. Imágenes previas a la aplicación de la terapia con PRP (momento 0). E-H. A los 3 meses de tratamiento con microinyec ciones de PRP (momento 2). I-L- Resultado a los 6 meses de iniciado el protocolo (momento 3).

Figura 10. Mujer de 48 años. A-D. Imágenes previas a la aplicación de la terapia con PRP (momento 0). E-H. La misma paciente a los 3 meses de tratamiento con microinyecciones de PRP (momento 2). I-L. Resultado a los 6 meses de iniciado el protocolo (momento 3).

Figura 11. Mujer de 55 años. A-D. Imágenes previas a la aplicación de la terapia con PRP (momento 0). E-H. La paciente a los 3 meses de tratamiento con microinyecciones de PRP (momento 2). I-L. Resultado a los 6 meses de iniciado el protocolo (momento 3).
En las tablas XVIII, XIX y XX (Gráfico 5) observamos los resultados del test de apreciación personal aplicado a los pacientes después de 3 meses de tratamiento con PRP; el 100% (14 pacientes) manifestaron cambios de mejoría en la región facial con el tratamiento con PRP. Seis pacientes (75%) catalogaron los resultados como buenos a los 3 meses y 6 pacientes (75%) a los 6 meses catalogaron los resultados como excelentes. Por otro lado, de los 14 pacientes, 9 (64.3%) deseaban mejorar todos los aspectos mencionados en el test (manchas, sequedad, tono, luminosidad, arrugas, flacidez), alcanzando mejoría en la mitad de los aspectos 6 pacientes (43%) y 4 pacientes (28.6%) en todos los aspectos mencionados en el test, manteniéndose esta misma apreciación a los 6 meses del estudio (Gráfico 6).
Tabla XVIII. Distribución de los pacientes de estudio según resultados del Test de Apreciación Personal sobre la mejoría esperada a los 3 y 6 meses de tratamiento con PRP
| Seis meses | |||||
|---|---|---|---|---|---|
| Tres meses | Menos de la mitad F (%)* |
Más de la mitad F (%)* |
Mitad F (%)* |
Todo F (%)* |
TOTAL(%) |
| Menos de la mitad | 1 (50.0) | 0 ( 0.0) | 1 (50.0) | 0 (0.0) | 2 (14.3) |
| Más de la mitad | 2 (100.0) | 0 ( 0.0) | 0 (0.0) | 0 (0.0) | 2 (14.3) |
| Mitad | 0 (0.0) | 0 (0,0) | 1 (100.0) | 0 (0.0) | 1 (7.1) |
| Todo | 4 (44.4) | 1 (11.1) | 1 (11,1) | 3 (33.3) | 9 (64.3) |
| TOTAL | 7 (50.0) | 1 (7.1) | 3 (21.4) | 3 (21.4) | 14 (100.0) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
Tabla XIX. Distribución de los pacientes de estudio según resultados del Test de Apreciación Personal sobre la mejoría alcanzada a los 3 y 6 meses de tratamiento con PRP
| Seis meses | ||||
|---|---|---|---|---|
| Tres meses | Menos de la mitad F (%)* |
Más de la mitad F (%)* |
Mitad F (%)* |
TOTAL (%) |
| Menos de la mitad | 1 (50.0) | 0 (0.0) | 1 (50.0) | 2 (14.3) |
| Más de la mitad | 0 (0.0) | 1 (50.0) | 1 (50.0) | 2 (14.3) |
| Mitad | 1 (16.7) | 3 (50.0) | 2 (33.3) | 6 (42.9) |
| Todo | 2 (50.0) | 0 (0.0) | 2 (50.0) | 4(28.6) |
| TOTAL | 4 (28.6) | 4 (28.6) | 6 (42.9) | 14 (100.0) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
Tabla XX. Distribución de los pacientes de estudio según sus opiniones acerca de los resultado obtenidos a los 3 y 6 meses de tratamiento con PRP
| Seis meses | |||
|---|---|---|---|
| Tres meses | Bueno F (%)* |
Excelente F (%)* |
TOTAL (%) |
| Bueno | 6 (75.0) | 2 (25.0) | 8 (57.1) |
| Excelente | 0 (0.0) | 6 (100.0) | 6 (42.9) |
| TOTAL | 6 (42.9) | 8 (57.1) | 14 (100.0) |
Fuente: Instrumento aplicado e historia clínica
*Porcentaje en base a subtotales horizontales
Discusión
Los resultados arrojados en esta investigación comprueban los efectos del PRP en la piel de la región facial y su efectividad como terapia seriada en el rejuvenecimiento facial, logrando activar las células y elementos responsables de dar a la cara un aspecto más joven, como son los fibroblastos y las fibras de colágeno. Estos efectos fueron demostrados clínicamente en los pacientes de nuestro estudio a través de la constatación de mayor luminosidad y menor flacidez, e histológicamente a través del aumento del contaje de fibroblastos y fibras de colágeno, así como del incremento del grosor de la dermis e hipodermis, alcanzando de esta manera el objetivo general de nuestra investigación.
El PRP ha sido ampliamente utilizado en la regeneración y remodelación tisular y diversos estudios afirman que el tratamiento con inyección intradérmica de PRP proporciona concentraciones suprafisiológicas de factores de crecimiento, jugando un papel clave en la migración celular, proliferación, diferenciación y remodelación de la matriz extracelular.(17-19)
Se han realizado múltiples investigaciones en relación al tema del envejecimiento cutáneo, y de éstos García M. y col. demostraron en su estudio que con la edad hay una disminución progresiva de las fibras de colágeno dérmico y de su espesor, permaneciendo constante esta densidad en la dermis papilar durante la infancia y la juventud y con una disminución progresiva con el paso del tiempo; además en su revisión bibliográfica, explican que producto de la degradación del colágeno se inhibe la síntesis de procolágeno I, factor de crecimiento del tejido conectivo (CTGF), inducen una morfología fibroblástica senescente y estimulan la expresión de MPPs y ROS, originando un círculo vicioso que perpetúa las lesiones de la matriz extracelular.(4)
En el rejuvenecimiento facial, los puntos clave son: la activación de los fibroblastos dérmicos, la estimulación de la síntesis de colágeno y de los componentes de la matriz extracelular.(19) En el presente estudio determinamos los cambios en el espesor de las capas de la piel y en el número de fibroblastos y fibras de colágeno producto de un tratamiento seriado con PRP, cuyos resultados arrojaron significancia estadística con un aumento importante del número de fibroblastos transcurridos los 3 meses de tratamiento, un incremento significativo del espesor de la dermis entre el tercer mes y los 6 meses y un incremento significativo desde el punto de vista estadístico de las fibras de colágeno a los 6 meses. Asimismo, pudo demostrarse a través del tricrómico de Masson que efectivamente se logró un cambio en cuanto al espesor de las fibras de colágeno, obteniendo una mayor expresión y organización del mismo en la dermis papilar que se hace más evidente en el momento 2 del estudio (6 meses), con lo cual se consiguió una reparación de la dermis papilar al punto de lograr una semejanza con la dermis papilar en la juventud. Adicionalmente evidenciamos un aumento estadísticamente significativo en el espesor de la hipodermis con la aplicación de PRP durante 3 meses, hallazgo que pudiera reforzar lo propuesto por Kakudo y col. quienes, aunque su estudio no cumple con las mismas características de la presente investigación y sus determinaciones fueron realizadas en cultivo, concluyen que el PRP puede mejorar la proliferación de células madre derivadas del adipocito; estos mismos autores evidenciaron proliferación de fibroblastos en cultivo con la preparación de PRP.(8) Por otro lado Rigoti y col. partiendo del principio de proliferación de células madre liberadas del adipocito, comunicaron el beneficio de agregar PRP a los injertos de grasa autóloga; con estos resultados reportados en nuestro estudio en relación al aumento del espesor de la hipodermis es posible fortalecer la premisa de estimulación de células madre liberadas del adipocito con la terapia con PRP.(13)
En la literatura revisada, Cameli y col. realizaron un estudio aplicando 3 sesiones de PRP con intervalos de 1 mes, donde evidenciaron una mejoría clínica en cuanto a textura, elasticidad y suavidad de la piel facial, mediante la medición con corneometría y cutómetro;(25) estos resultados, relacionados con los cambios clínicos logrados en la presente investigación donde el 100% de los pacientes manifestaron haber evidenciado mejoría clínica después de la aplicación del tratamiento, denotan que ciertamente si se produce un efecto de mejoría en la piel de la región facial y los pacientes lo confirman catalogando los resultados como buenos (75%) y excelentes (100%) a los 3 y a los 6 meses respectivamente. Adicionalmente es importante destacar que las manchas, luminosidad y flacidez de la piel facial evaluadas en nuestro estudio mejoraron en un 46% a los 3 y 6 meses. Yuksel y col., mediante la aplicación de PRP con intervalos de 2 semanas, también evidenciaron que hubo una diferencia clínica con respecto a la apariencia general, logrando mayor firmeza de la piel y mejoría de las arrugas.(18) Por su parte, Elnehrawy y col. evaluaron la seguridad y eficacia del PRP en la piel de la región facial a través de una única inyección intradérmica, logrando una mejoría clínica de la apariencia en un 25%(19) y demostrando que la tendencia con la aplicación de este tratamiento, al igual que en el presente estudio, es hacia la mejoría y hacia el cambio. Serra Renón y col. encontraron a través de la valoración cualitativa en la calidad de piel una mejoría del brillo, textura y elasticidad de la piel facial mediante el uso de PRP, tanto en terapia única como en combinación con injertos grasos,(25) trabajo que complementa nuestro estudio y nuestros resultados. Mercedes Acosta y col. reportan que el uso de PRP en cicatrices de abdominoplastia produce un aumento en la cantidad de fibras de colágeno, de predominio delgadas, en la dermis papilar a los 21 días y a los 3 meses también un aumento de las mismas pero esta vez más gruesas y más organizadas, semejante a lo encontrado en nuestro estudio, donde las fibras de colágeno se incrementaron en la dermis papilar, siendo más densas y más organizadas.(23) Con estos hallazgos se puede argumentar que el PRP produce una estimulación de la dermis papilar tal y como afirman Rossani y col. en su investigación.(26)
En base a los resultados de nuestra investigación, proponemos un protocolo de aplicación seriada de PRP como tratamiento en el rejuvenecimiento facial, que presentamos en el Anexo 4.
Conclusiones
Teniendo en cuenta los resultados de nuestro estudio, consideramos que la terapia con PRP es un procedimiento de bioestimulación con el que se activan los factores de crecimiento, induciendo cambios clínicos importantes como consecuencia de los efectos histopatológicos en la piel de la región facial y cuyo principal protagonista es el colágeno.
El análisis histopatológico de nuestra investigación presentó que el PRP produce un incremento significativo de los fibroblastos tras un tratamiento seriado de 6 meses. De igual forma comprobamos que tras la bioestimulación con PRP durante 3 meses se produce un aumento en el espesor de la dermis y en especial en la dermis papilar. Tras un tratamiento con PRP mensual durante 3 meses se produce un incremento de las fibras de colágeno pasados los 6 meses, evidenciando características de la dermis papilar en consonancia con la dermis papilar evidenciada en la juventud.
La estimulación biológica con PRP induce el aumento del espesor de la hipodermis, lo que puede ser el resultado de la estimulación de las células madre liberadas del adipocito. Teniendo en cuenta otros estudios al respecto, se propone iniciar una línea de investigación sobre los efectos del PRP en el tejido adiposo y de esta manera lograr mayores contribuciones tanto en la estética facial como en Cirugía Reconstructiva.
Comprobamos también que el PRP ocasiona cambios clínicos mejorando manchas, sequedad, tono, luminosidad, arrugas y flacidez, que contribuyen también al rejuvenecimiento de la piel de la región facial.
En base a todo lo anterior, proponemos en el presente artículo un protocolo de aplicación de PRP como tratamiento en el rejuvenecimiento facial y realizar la aplicación por subunidades estéticas faciales.